扩展功能
文章信息
- 程蓓蓓, 陈舜, 汪铭书, 程安春
- CHENG Beibei, CHEN Shun, WANG Mingshu, CHENG Anchun
- 四川白鹅CD4基因胞外去信号肽区的可溶性表达及纯化
- Soluble Expression and Purification of Extracellular Region without Signal Peptide of Sichuan White Goose CD4 Gene
- 四川动物, 2015, 34(6): 875-879
- Sichuan Journal of Zoology, 2015, 34(6): 875-879
- 10.11984/j.issn.1000-7083.20150121
-
文章历史
- 收稿日期: 2015-04-02
- 接受日期: 2015-06-23
2. 四川农业大学动物医学院, 禽病防治与研究中心, 成都611130;
3. 四川农业大学动物医学院, 动物疫病与人类健康四川省重点实验室, 成都611130
2. Avian Disease Research Center, College of Veterinary Medicine of Sichuan Agricultural University, Chengdu 611130, China;
3. Key Laboratory of Animal Disease and Human Health of Sichuan Province, Sichuan Agricultural University, Chengdu 611130, China
T淋巴细胞根据其表面标志和分化抗原不同大致可分为CD4+T细胞和CD8+T细胞,其中CD4分子由含4个免疫球蛋白的胞外区、跨膜区以及较长的胞浆区构成,与MHCⅡ类分子的非多肽区结合,参与T淋巴细胞的信号识别并促进T细胞的活化,是T细胞表面非常重要的分子标志(Veillette et al.,1988)。
禽类作为许多重要病原的天然储存库(如禽流感病毒AIV),在病原的传播、携带与进化演变中扮演了重要的角色。目前完成了包括鸡(Koskinen et al.,1996)、火鸡(Powell et al.,2009)、鸭(Kothlow et al.,2005)等在内的多种禽类 CD4 基因的克隆并得到了相关体外蛋白和抗体。与鸡相比,鹅免疫学研究起步较晚。2013年,Yan等(2013)首次对四川白鹅(Sichuan white goose,Anser cygnoides)的 CD4 基因(JX902315)进行分子克隆并获得其cDNA全长。鹅 CD4 基因的cDNA序列全长为1940 bp,包含一个编码480个氨基酸残基的开放阅读框。与其他物种CD4分子一样,成熟的鹅CD4分子为一跨膜糖蛋白,由胞外区、跨膜区以及胞质尾区构成。张雪莲等(2014)克隆表达了东北白鹅的 CD4 基因,但蛋白以包涵体形式存在,未对其可溶性表达进行探究。然而,简单快速地获得大量目的蛋白对于后续蛋白的结构和功能研究具有重要意义。
本研究通过对表达菌和培养基进行优化,选择最适合表达的温度,改变了诱导剂浓度,最终成功构建了能够稳定表达四川白鹅CD4胞外区基因的重组质粒,并获得其可溶性表达产物,为原核表达的可溶性表达提供一种参考,为该蛋白结构和功能的进一步研究打下基础。
1 材料与方法 1.1 实验动物和主要试剂成年四川白鹅购自四川农业大学水禽养殖场。大肠杆菌Esherichia coli菌株 JM109,E. coli DH5α,E. coli BL21(DE3)和Rosetta(DE3)pLysS 由四川农业大学禽病防治与研究中心提供。表达载体pET-32a(+)载体购自Novagen公司;DNA Marker、T4 DNA连接酶、NcoⅠ、HindⅢ限制性内切酶购自宝生物公司;胶回收试剂盒、质粒抽提试剂盒购自天根生物有限公司;鼠抗His-tag抗体,Western-blot检测用HRP标记山羊抗鼠IgG购自上海生工生物工程公司;ECL高灵敏化学发光试剂盒,蛋白Marker购自Thermo公司;NI+填料购自Novagen公司;其他试剂均为商业公司购买的分析纯。
1.2 方法 1.2.1 引物设计CD4 胞外去信号肽区,全长1194 bp,采用Primer 5.0软件设计引物序列,引物goCD4-F: 5’-CATGCCATGG (NcoⅠ酶切位点)ATCAACAACAGATTGGGGTTGAG-3’和goCD4-R: 5’-CCC AAGCTT(HindⅢ 酶切位点)TCCAATTACTGTATAGCTAATCC-3’由北京六合华大基因科技有限公司合成。
1.2.2 重组表达载体的构建与鉴定取成年四川白鹅胸腺组织,按Trizol使用说明提取总RNA,反转录合成cDNA第一链并以此为模板进行PCR扩增,扩增产物经琼脂糖凝胶电泳回收片段。
DNA片段由限制性内切酶NcoⅠ和HindⅢ双酶切,电泳,回收目的片段,同时将pET-32a(+)空质粒经NcoⅠ和HindⅢ双酶切回收。在T4 DNA连接酶的作用下,将目的片段定向克隆至双酶切的pET-32a(+)空质粒中,将其转化到DH5α感受态细胞中,并在含氨苄青霉素(AMP)抗性(工作浓度为100 μg·mL-1)的LB固体培养基中37 ℃培养过夜。从平板中随机挑取单个阳性菌落,接种于10 mL LB液体培养基(工作浓度为100 μg·mL-1)中,37 ℃培养6 h至对数生长期,然后按照质粒抽提试剂盒说明书所述步骤提取重组质粒。阳性重组质粒经PCR扩增与限制性内切酶NcoⅠ和HindⅢ双酶切确认。将抽提重组质粒 送上海美吉公司进行DNA序列测定。测序结果在NCBI上进行比对,结果正确则进行下一步试验。
1.2.3 目的蛋白的表达为了使重组蛋白成功表达,本实验分别对表达系统的培养基、表达菌种、诱导温度、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)浓度、诱导时间以及抗性浓度进行了优化(表 1)。选取经测序验证无误的阳性克隆,提取重组质粒并转入表达菌,接种于相应培养基中,37 ℃培养过夜,取菌液按1∶ 100的比例加入到新鲜培养基中快速培养至菌液OD600为0.6~1.0时,加入IPTG进行诱导,以获得目的蛋白。吸取1 mL诱导后菌液于EP管中,12 000 r/min离心2 min,弃上清,磷酸盐缓冲液(PBS)洗涤3次并重悬,取200 μL诱导菌液加入适量蛋白电泳上样缓冲液,混匀并沸水中裂解10 min备用。余下菌液加入溶菌酶至终浓度为1 mg·mL-1,0.1%的脱氧核糖核酸酶Ⅰ(DNaseⅠ),混匀至冰上反应30 min,并反复冻融3次,12 000 r/min离心5 min。分别取上清和沉淀加入适量SDS上样缓冲液,混匀并沸水中裂解10 min,经上述方法处理后进行SDS-PAGE电泳分析。
| 菌株Strains | 培养基Medium | 诱导温度Induction temperature/℃ | 诱导时间Induction time/h |
| Esherichia coli BL21(DE3) | TB | 16、25、30、37 | 2、4、8、16、24 |
| E. coli BL21(DE3) | LB | 16、25、30、37 | 2、4、8、16、24 |
| E. coli JM109 | TB | 16、25、30、37 | 2、4、8、16、24 |
| E. coli JM109 | LB | 16、25、30、37 | 2、4、8、16、24 |
| RosettaTM(DE3)pLysS | TB | 16、25、30、37 | 2、4、8、16、24 |
| RosettaTM(DE3)pLysS | LB | 16、25、30、37 | 2、4、8、16、24 |
为了使目的蛋白以可溶形式存在于细胞裂解液上清中,在成功表达目的蛋白条件下本实验对IPTG、AMP浓度进行进一步优化。取过夜培养的表达菌按1∶ 100加入到新鲜培养基中(AMP浓度分别为50 mg·L-1,80 mg·L-1,100 mg·L-1,150 mg·L-1,200 mg·L-1),快速培养至OD600为0.6~0.8时,加入IPTG(浓度分别为1 mM,0.8 mM,0.6 mM,0.4 mM,0.2 mM,0.1 mM)诱导。取经不同处理的菌体,裂解后分别取全菌、上清、沉淀进行SDS-PAGE电泳分析。
按照最佳条件大量诱导后,经NI+亲和层析纯化重组蛋白,并由SDS-PAGE分析纯化结果。
1.2.5 重组蛋白的Western-blot分析纯化蛋白经SDS-PAGE后,转到聚偏二氟乙烯(PVDF)膜上。经5%脱脂奶-TBS,4 ℃封闭过夜。0.5% Tween-TBS洗涤3次后加入鼠抗His-tag抗体作为一抗(1∶ 5000稀释),37 ℃孵育2 h。二抗为HRP标记的山羊抗鼠IgG(1∶ 5000稀释),37 ℃孵育1 h。经0.5% Tween-TBS洗涤3次,ECL显色。
2 结果 2.1 四川白鹅CD 4 胞外区原核表达载体的构建以胸腺组织总RNA反转录产物为模板,PCR扩增出特异性目的条带,与预期条带(1194 bp)大小相符(图 1:A)。将扩增片段经双酶切后连接到表达载体pET-32a(+)上,构建的重组质粒经酶切后得到的片段与预期结果相符(图 1:B),质粒序列测序验证为目的基因。

|
|
图 1 鹅CD4胞外去信号肽段基因扩增以及
重组质粒goCD4-pET-32a(+)的双酶切鉴定
Fig. 1 The amplicon of extracellular domain of goose CD4 and
restriction enzyme analysis of goCD4-pET-32a(+)
A: M. DNA分子质量标准, 1. 鹅CD 4 基因胞外去信号肽段扩增结果; B: M. DNA分子质量标准, 1. 重组质粒goCD4-pET-32a(+)的双酶切(NcoⅠ与HindⅢ酶)产物。
A: M. DNA maker, 1. PCR product of go-CD4; B: M. DNA marker, 1. Digested products of goCD4-pET-32a(+) by NcoⅠ and HindⅢ. |
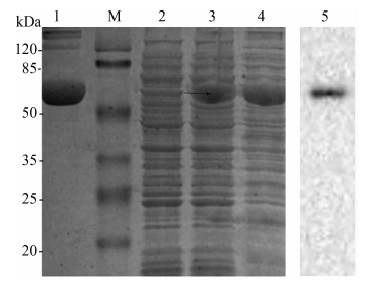
表达菌在不同条件下诱导,产物经SDS-PAGE分析显示只有在Rosetta表达菌中,以TB培养基于16 ℃培养过夜条件下,可在64 kDa处出现1条特异性的蛋白条带,与预计的蛋白质相对分子质量大小相符,且蛋白以不可溶的包涵体形式存在于细菌裂解沉淀中(图 2),其他条件下均未见目的条带(图片未展示)。
|
|
图 2 重组蛋白his-goCD4表达产物的SDS-PAGE分析
Fig. 2 SDS-PAGE analysis of the expression products of
recombinant his-goCD4 protein
M. 蛋白质相对分子质量标准, 1. 经纯化的重组蛋白, 2. 未诱导goCD4-pET-32a(+), 3. 诱导的goCD4-pET-32a(+), 4. 诱导的goCD4-pET-32a(+)上清, 5. Western-blot结果(鼠抗-his-tag为一抗)。
M. Protein marker, 1. Protein purification products, 2. goCD4-pET-32a(+) without IPTG, 3. goCD4-pET-32a (+) with IPTG, 4. Proteins in the supernatant, 5. Result of Western-blot (Mouse anti-his-tag). |
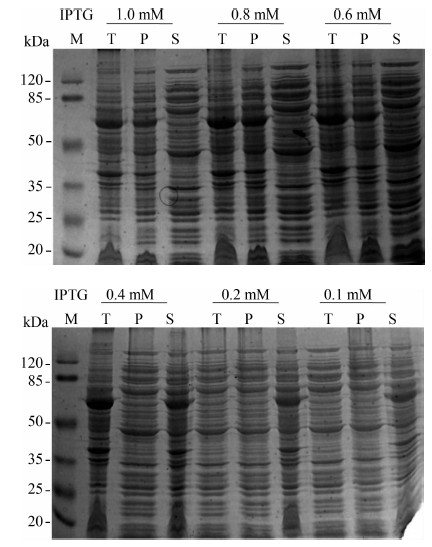
为使重组蛋白大量存在于细菌裂解上清中,以不同的IPTG诱导过夜,SDS-PAGE结果表明在0.4 mM IPTG诱导条件下,蛋白多以可溶形式存在,增加IPTG浓度蛋白量无明显增加且包涵体成分增多,降低IPTG浓度蛋白表达量有一定程度的下降(图 3)。在不同AMP浓度下,蛋白表达情况无明显变化。
|
|
图 3 在不同IPTG浓度下的 his-goCD4蛋白表达情况
Fig. 3 Expression of his-goCD4 under different IPTG concentrations
T. 全菌蛋白, P. 菌体裂解沉淀, S. 菌体裂解上清。
T. Total protein of bacteria, P. Precipitation of bacterial lysates, S. Supernatant of bacterial lysates. |
成功表达的重组蛋白加上融合标签大小约为64 kDa,N-端和C-端各带有His-tag,采用NI+亲和层析纯化重组蛋白,洗脱液经SDS-PAGE分析,结果显示在64 kDa处出现单一明显的目标条带(图 2:第2泳道)。用鼠抗his-tag抗体作为一抗进行Western blot检测,出现明显单一的杂交条带(图 2:第5泳道),表明该蛋白为目的蛋白。
3 讨论本实验对四川白鹅CD 4 胞外去信号肽区蛋白进行了可溶性的原核表达,获得了较纯的重组蛋白。在我们前期研究中,曾以胸腺cDNA为模板,扩增CD 4 整个ORF区域(包含信号肽、胞外区、跨膜区及胞质区)并与pET-32a(+)连接进行诱导表达,但经多个条件优化始终未见目的蛋白的表达。分析原因如下:首先,CD4作为T淋巴细胞表面跨膜蛋白,不同区域之间亲水性与疏水性差别较大,由于原核表达系统常无法对表达外源蛋白进行正确折叠,故影响蛋白的表达;其次,跨膜蛋白膜结构的亲和性对细菌膜蛋白及其蛋白转运系统具有一定毒性,同样不利于外源蛋白在细菌细胞内的表达(Bannwarth & Schulz,2003;Renesto & Raoult,2003;Savage et al.,2005)。通过对鹅以及其他物种CD4分子进行比对分析发现,其氨基酸差异主要存在于胞外区,而其他区域相对保守(张雪莲等,2014),且胞外区富含亲水性氨基酸利于原核表达系统的正常运行。在这种情况下,本研究选取鹅T细胞表面分子CD4的胞外区进行体外原核重组表达。为获得目的基因的表达,本研究进行了多个条件的摸索,其中包括不同培养基、不同表达菌、不同诱导浓度与温度等。最终,确定重组蛋白his-goCD4只有在Rosetta(DE3)pLysS感受态细胞中,在TB培养基内,16 ℃温度条件下才能成功表达。重组蛋白在IPTG浓度为1 mM时多以不可溶形式存在,当IPTG降低至0.4 mM时多以可溶性形式存在。
大肠杆菌Rosetta是由 BL21 发展而来的一种蛋白酶缺失的宿主菌,能够防止对目的蛋白的降解。与 BL21 相比,Rosetta降低了大肠杆菌对稀有密码子的要求,更加有利于真核蛋白的表达(Dubendorff & Studier,1991)。改变培养基成分也是促进原核表达的常用策略之一(Vincentelli et al.,2011)。本文采取的TB培养基配方中酵母提取物比例较高且含有甘油。张姝等(2009)发现,酵母提取物中的一些诱导因子对原核表达系统具有促进作用,而TB培养基中的甘油具有产酸量小且密度较大的优点,为细菌提供碳源能量的同时而不影响菌体生长(刘爽,胡宝成,2005)。除此之外,蛋白的存在形式与培养环境有关,如温度(朱红裕,李强,2006)及pH等。有报道表明:降低诱导剂浓度能够减缓蛋白合成速率,从而促进其正常折叠形成可溶性蛋白(Correa & Oppezzo,2011)。本研究结果显示:IPTG浓度对其可溶性表达具有一定影响,随着IPTG浓度降低,可溶性表达增加。除了降低诱导剂浓度外,降低温度被认为是蛋白可溶性表达最常用的方法(Bessette et al.,1999)。降低温度一方面减缓细菌生长速度,蛋白合成较慢从而有充分的时间和空间正确折叠(Shaw & Ingraham,1999),另一方面,低温能够在一定程度上抑制蛋白降解提高其稳定性。
此外,我们发现被诱导的菌体浓度对蛋白表达具有一定影响。本研究中,被诱导宿主菌的OD范围在0.4~0.8时,可见目标蛋白的表达。但当菌体浓度过高时(OD大于1.0),蛋白表达明显减少。Malakhov等(2004)认为,低菌体浓度较有利于蛋白表达,因为在低浓度的对数生长期,菌体活性较高,生长活跃,有利于蛋白表达。另一方面,浓度较高的菌液中含有较多的β-内酰胺酶以及其他酸性代谢产物,当其达到一定浓度时会破坏培养基内的氨苄青霉素,从而破坏环境的选择压力,不利于蛋白表达( Sφrensen &Mortensen,2005)。
综上所述,我们通过对原核表达系统各个条件进行摸索,成功得到了四川白鹅CD 4 胞外去信号肽区重组蛋白。这为进一步制备抗体,建立特异性检测鹅CD4+淋巴细胞的方法等提供了材料依据,且本研究对各种优化条件的探索与分析为利用原核表达系统成功表达跨膜的外源真核基因提供了重要参考。
| 刘爽, 胡宝成. 2005. 原核系统可溶性表达策略[J]. 生物技术通讯, 16(2): 172-175. |
| 张姝, 王敏, 韩梅琳, 等. 2009. 酵母提取物诱导重组大肠杆菌合成HrpNEcc蛋白的研究[J]. 中国农业科学, 42(11): 3380-3387. |
| 张雪莲, 魏双施, 邵建伟. 2014. 东北白鹅CD4基因的克隆及其胞外区的表达与抗血清的制备[J]. 畜牧兽医学报, 45(4): 639-646. |
| 朱红裕, 李强. 2006. 外源蛋白在大肠杆菌中的可溶性表达策略[J]. 过程工程学报, 6(1): 150-155. |
| Bannwarth M, Schulz GE. 2003. The expression of outer membrane proteins for crystallization[J]. Biochim Biophys Acta, 1610: 37-45. |
| Bessette PH, Aslund F, Eckwith J, et al. 1999. Efficient folding of proteins with multiple disulfide bonds in the Escherichia coli cytoplasm[J]. Proc Natl Acad Sci USA, 96(24): 13703-13708. |
| Correa A, Oppezzo P. 2011. Tuning different expression parameters to achieve soluble recombinant proteins in E. coli: advantages of high-throughput screening[J]. Biotechnol J, 6(6): 715-730. |
| Dubendorff JW, Studier FW. 1991. Controlling basal expression in an inducible T7 expression system by blocking the target T7 promoter with lac repressor[J]. Mol J Bio, 219(1): 45-59. |
| Koskinen R, Lamminmäki U, Tregaskes CA, et al. 1996. Cloning and modeling of the first nonmammalian CD4[J]. J Immunol, 162(7): 4115-4121. |
| Kothlow S, Mannes NK, Schaerer B, et al. 2005. Characterization of duck leucocytes by monoclonal antibodies[J]. Dev Comp Immunol, 29: 733-748. |
| Malakhov MP, Mattern MR, Malakhova OA, et al. 2004. SUMO fusion and SUMO-specific proteases for efficient expression and purification of proteins[J]. Funct Genom, 5: 75-86. |
| Powell F, Lawson M, Rothwell L, et al. 2009. Development of reagents to study the turkey's immune response: identification and molecular cloning of turkey CD4, CD8α and CD28[J]. Dev Comp Immunol, 33(4): 540-546. |
| Renesto P, Raoult D. 2003. From genes to proteins: in vitro expression of rickettsial proteins[J]. Ann NY Acad Sci, 990: 642-652. |
| Savage DF, Anderson CL, Robles-Colmenares Y, et al. 2005. Cell-free complements in vivo expression of the E. coli membrane proteome[J]. Protein Sci, 16: 966-976. |
| Shaw MK, Ingraham JL. 1999. Synthesis of macromolecules by Escherichia coli near the minimal temperature for growth[J]. Bacteriology, 94: 157-164. |
| Sφrensen HP, Mortensen KK. 2005. Advanced genetic strategies for recombinant protein expression in Escherichia coli[J]. Journal of Biotechnology, 115: 113-128. |
| Veillette A, Bookman MA, Horak EM, et al. 1988. The CD4 and CD8 T cell surface antigens are associated with the internal membrane tyrosine-protein kinase p56lck[J]. Cell, 55(2): 301-308. |
| Vincentelli R, Cimino A, Geerlof A, et al. 2011. High-throughput protein expression screening and purification in Escherichia coli[J]. Methods, 55(1): 65-72. |
| Yan XL, Liu F, Chen S, et al. 2013. Molecular cloning, characterization and tissue expression of CD4 in Chinese goose[J]. Gene, 519(2): 298-304. |
 2015, Vol.34
2015, Vol.34 




