扩展功能
文章信息
- 黄思邈, 黄龙, 莫春横, 李娟, 王亚军
- HUANG Simiao, HUANG Long, MO Chunheng, LI Juan, WANG Yajun
- 家鸡G蛋白偶联受体139基因的结构、序列及表达特征分析
- Characterization of the Structure and Tissue Expression of Chicken G Protein-coupled Receptor (GPR139) Gene
- 四川动物, 2015, 34(6): 869-874
- Sichuan Journal of Zoology, 2015, 34(6): 869-874
- 10.11984/j.issn.1000-7083.20150177
-
文章历史
- 收稿日期: 2015-04-12
- 接受日期: 2015-09-14
G蛋白偶联受体(GPCRs)家族是最大的细胞表面受体家族,广泛表达于各种组织中,将细胞外环境中的胺类、多肽类、脂质、光子、离子等信号转换并传递至细胞内(Melvin et al.,1991;Joel & Jean,1999;David et al.,2005;Ute et al.,2006),从而参与众多生理过程调节(Kristen et al.,2002;Kavita & Kaiser,2014;Raise et al.,2015),如有丝分裂的发生、肌肉收缩、离子通道调控、基因转录等(Ayako et al.,2005)。
G蛋白偶联受体都具有7次跨膜结构(Joel & Jean,1999)。G蛋白偶联受体具有α、β和γ 3个亚基,其中,Gα亚基有4种类型:Gαs、Gαi/o、Gαq和Gα12/13(Ayako et al.,2005;Liaoyuan et al.,2009)。Gαs刺激腺苷酸环化酶的活性,增加胞内cAMP的含量;而Gαi则抑制cAMP的产生;Gαq刺激甘油二酯和磷酸肌醇的生成,进而促进胞内Ca2+的释放;Gα12/13调控小G蛋白RhoA的活性(Kristen et al.,2002; Kavita &Kaiser,2014)。根据G蛋白偶联受体初级结构,以及它们与配体的相互作用的不同,G蛋白偶联受体被分成不同的亚家族,其中包括A类(视紫红质样家族)、B类(分泌素样家族)和C类(代谢型谷氨酸样家族)3个主要亚家族(Ulrik,2000;Robert et al.,2003a,2003b;Kavita & Kaiser,2014;Raise et al.,2015)。
G蛋白偶联受体虽然仅构成人类基因组的小部分,但其可作为近半数市场现有药物的靶点(Jurgen,2000;Robert et al.,2003a;Thóra et al.,2006;Davide & Maria,2008;Liaoyuan et al.,2009)。人类基因组计划显示人体内含有超过800个G蛋白偶联受体,仍有大约140个G蛋白偶联受体为孤儿受体(Robert et al.,2003a;David et al.,2005;Chung et al.,2008)。截止目前,研究人员已为超过100个受体寻找到其对应的内源性配体,并且证实这些受体可以作为许多人类疾病治疗的药物靶点(Olivier et al.,2006;Davide & Maria,2008;Kavita & Kaiser,2014)。因此,寻找新的G蛋白偶联受体及其对应配体仍是研究的热点。研究人员在人和小鼠的基因组数据库中发现了新型的G蛋白偶联受体,并将其命名为GPR139(又名GPRg1)(Robert et al.,2003b;Ayako et al.,2005;David et al.,2005;Feng et al.,2011;Vignir et al.,2014)。人的GPR139与小鼠的GPR139具有94%的相似度(Ayako et al.,2005;Ute et al.,2006),说明了GPR139在进化过程中高度保守(Ute et al.,2006)。GPR139第三跨膜区域末端包含一个天冬氨酸-精氨酸-酪氨酸(D-R-Y)基序,属于G蛋白偶联受体家族视紫红质亚家族(Andrew & Colin,2002;Robert et al.,2003a;Ayako et al.,2005;Ute et al.,2006)。然而,GPR139与G蛋白偶联受体家族视紫红质亚家族的其他成员仅有20%左右的相似度,却与另一孤儿受体GPR142具有较高的相似度(50%)(Ayako et al.,2005;Liaoyuan et al.,2009),因此,GPR139与GPR142形成视紫红质亚家族的一个新分支(Ayako et al.,2005)。
组织表达图谱研究发现,小鼠GPR139几乎全部分布在小鼠的中枢神经系统中,主要分布在纹状体腹侧外部和缰核中央,说明GPR139参与调节大脑功能(Andrew & Colin,2002;Ayako et al.,2005;Ute et al.,2006;Liaoyuan et al.,2009;Feng et al.,2011)。然而,小鼠GPR139在胚胎时期脑组织中的分布较成熟中枢神经系统更为广泛,预示着GPR139可能在大脑不同区域的发育中发挥重要功能(Ute et al.,2006)。人GPR139具有2种不同大小的剪接变体,hGPR139和hGPR139b。人GPR139主要分布在中枢神经系统中,在尾状壳核及下丘脑中具有极高表达量;而人GPR139b广泛分布于不同组织中,在甲状腺、胼胝体、小脑、脾、小肠、胰腺等组织中均有表达(Ayako et al.,2005;Ute et al.,2006)。目前,已有研究结果显示GPR139在调控个体自主活动和情感行为方面具有重要作用(Ayako et al.,2005;Ute et al.,2006)。
黄思邈等:家鸡G蛋白偶联受体139基因的结构、序列及表达特征分析进一步研究发现,在表达GPR139的细胞中,小鼠脑组织提取物可以剂量依赖性地提升胞内钙离子水平,说明在小鼠脑组织中可能存在GPR139的内源性配体(Ute et al.,2006)。在CHO细胞中,报告基因转录分析结果首次证实GPR139可偶联Gq发挥其生理功能(Ayako et al.,2005;Feng et al.,2011;Vignir et al.,2014;Raise et al.,2015);随后有研究发现GPR139可偶联Gi亚基(Ute et al.,2006;Raise et al.,2015);此外也有研究发现过表达GPR139的HEK293F细胞内cAMP含量增加,表明GPR139可以偶联Gαs亚基激活下游信号通路(Liaoyuan et al.,2009)。
家鸡是重要的经济动物,也是重要的模式生物。本次研究以家鸡为对象,从其脑组织中克隆得到家鸡GPR 139基因的cDNA序列,并探究了GPR139 在家鸡组织及脑中的表达情况,为寻找家鸡GPR139的内源性配体、胞内信号通路,及其在家鸡组织中的生理作用奠定基础。
1 材料与方法 1.1 材料感受态大肠杆菌Eschericha coli菌株DH5α由本实验室制备保存;pTA2载体、聚合酶链式反应(PCR)中所使用KOD-Fx高保真聚合酶均购自TOYOBO公司;总RNA提取所用RNAzol购自Molecular Research Center公司;限制性内切酶、逆转录酶MMLV、T4连接酶、dNTP均购自TaKaRa公司;引物合成由Invitrogen公司完成,测序由北京华大六和股份公司完成。
1.2 方法 1.2.1 家鸡总RNA提取取家鸡心脏、肝脏、脾脏、肺、肾脏、小肠、肌肉、胰腺、精巢、卵巢、垂体,以及脑各功能区域(大脑、中脑、小脑、后脑、下丘脑)约600 mg,于液氮中充分研磨,并与600 μL RNAzol混合均匀,加入240 μL DEPC-H2O混匀,4 ℃12 000 r/min冷冻离心15 min;取上清,加入3 μL的阿司咪唑(BAN),漩涡后于4 ℃ 12 000 r/min离心 10 min;取上清,加入等体积异丙醇,4 ℃12 000 r/min冷冻离心15 min;弃上清,加入70%的乙醇漂洗2次,4 ℃ 12 000 r/min冷冻离心3 min;弃上清,用DEPC-H2O溶解沉淀,-80 ℃保存。
1.2.2 反转录以各组织总RNA为模板,反转录合成cDNA序列。反转录体系:1 μL Oligo-dT,2 μg RNA,加入DEPC-H2O补足5 μL,70 ℃反应10 min后冰上放置2 min;再加入2 μL 5×Buffer(+DTT),0.5 μL dNTP,0.5 μL MMLV-RT,2 μL DEPC-H2O混合均匀,42 ℃反应1.5 h,70 ℃反应10 min。将反转录产物加入50 μL MiliQ-H2O稀释作为cDNA模板,-20 ℃保存。
1.2.3 引物设计根据NCBI中家鸡GPR 139 预测序列(Accession No:XM_428970),设计了家鸡GPR 139 基因cDNA全长的扩增引物(rU1+rL1)及组织表达检测引物(rU2+rL2)(表 1)。
| 基因 | 引物序列 | 片段大小/bp |
| 基因克隆引物 | ||
| GPR139 | rU1: 5’-CCCAAGCTTAGAGCAGGTCCATGGAGCACAA-3’
rL1: 5’-CCGGAATTCAGAACTTTCACCCACCAACTCCA-3’ | 1121 |
| 组织表达引物 | ||
| GPR139 | rU2: 5’-ATCGCTATGGCTGTGGCTTG-3’
rL2: 5’-CGAGCAGGGTAGGAGACTGTAT-3’ | 376 |
| β-actin | U1: 5’-TGTGCTACGTCGCACTGGAT-3’
L1: 5’-GCTGATCCACATCTGCTGGA-3’ | 401 |
以大脑cDNA为模板,采用PCR方法对家鸡GPR 139 基因的开放阅读框(open reading frame,ORF)区域进行扩增。PCR体系:5 μL 2×KOD Buffer,2 μL cDNA模板,2 μL 2 mM dNTP,0.1 μL rU1引物,0.1 μL rL1引物,0.2 μL KOD-Fx,加水补足10 μL。将PCR体系混合均匀后,94 ℃预变性2 min;98 ℃变性10 s,60 ℃退火30 s,68 ℃延伸90 s,变性-退火-延伸35个循环;68 ℃最终延伸20 min。反应完成后,取3 μL PCR产物用1%的琼脂糖凝胶进行电泳检测。
取4.5 μL PCR产物与0.5 μL 10×A-attachment Mix混合,60 ℃反应30 min,产物3’-末端加A;取1.5 μL加A产物,2.5 μL 2×Ligation Buffer,0.5 μL pTA2载体,0.5 μL T4 DNA连接酶,混匀后4 ℃过夜连接;转化后用通用引物进行菌落PCR筛选,提取重组质粒并进行酶切检测,将选取的质粒进行测序。
1.2.5 家鸡GPR 139 基因组织表达图谱研究以家鸡各组织cDNA为模板,根据表 1中引物rU2+rL2进行PCR扩增,检测家鸡GPR 139 基因在不同组织中的表达情况。PCR体系:1 μL 10×Taq Buffer,2 μL cDNA模板,0.2 μL dNTP,0.1 μL rU2引物,0.1 μL rL2引物,0.1 μL Taq酶,加水补足10 μL。将PCR体系混合均匀后,于94 ℃预变性2 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸40 s,变性-退火-延伸共29个循环,72 ℃最终延伸5 min。反应完成后,取3 μL PCR产物用2%的琼脂糖凝胶进行电泳检测。
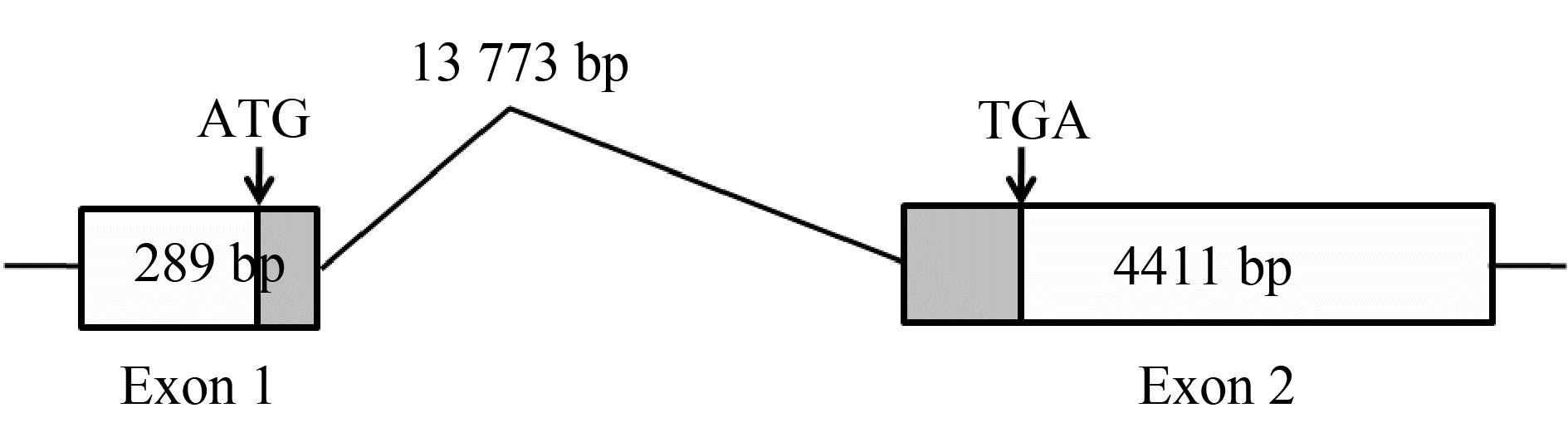
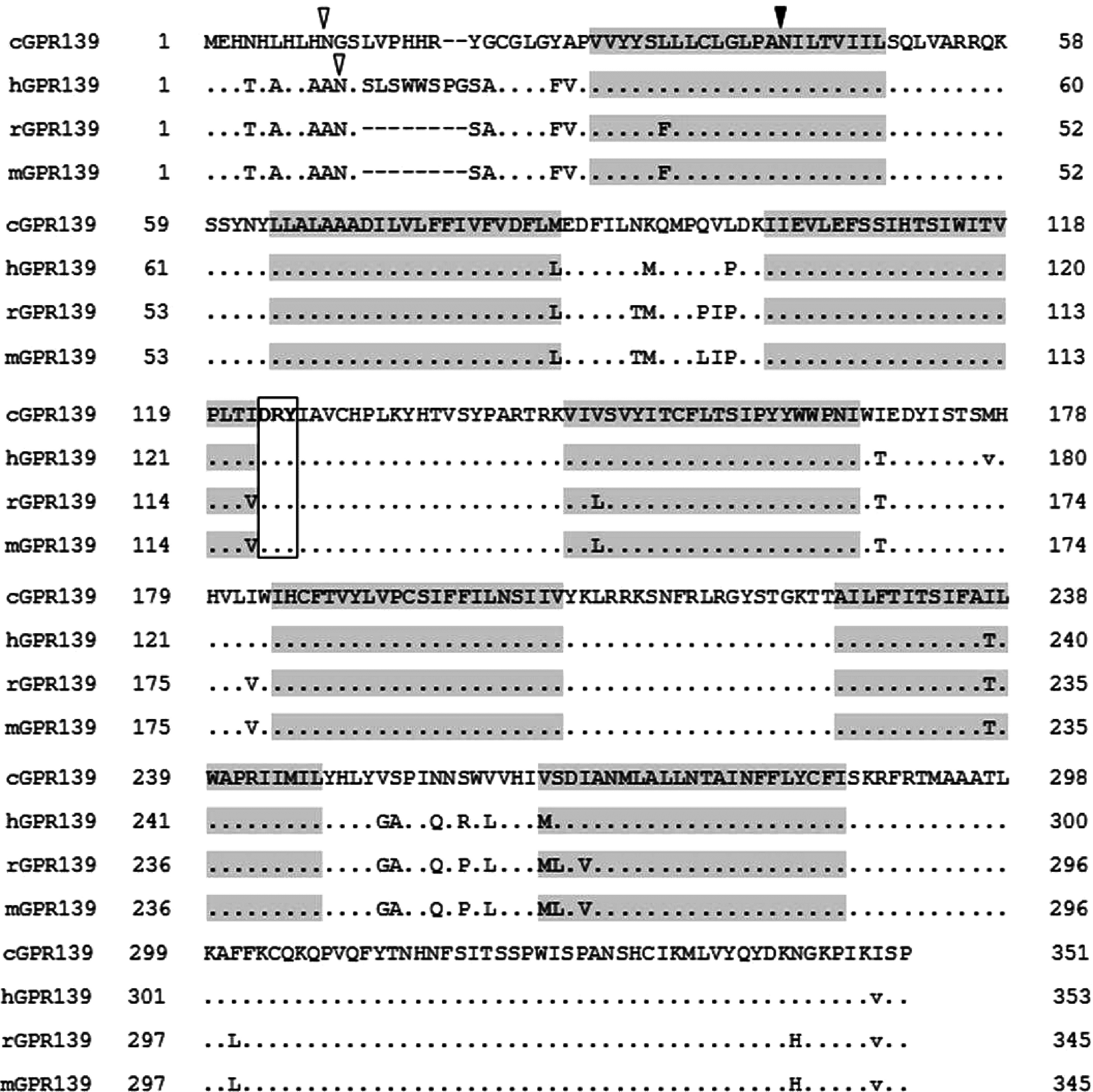
2 结果 2.1 家鸡GPR 139 基因cDNA ORF区域克隆及序列分析以家鸡大脑cDNA为模板,进行PCR扩增,得到GPR 139 基因cDNA ORF区域全长,与预测基因片段大小相同(图 1)。测序结果显示,家鸡GPR 139 基因ORF区域全长1056 bp,编码351个氨基酸的前体蛋白。GPR 139 的第三跨膜区末端有1个D-R-Y基序,属于G蛋白偶联受体家族视紫红质亚家族。我们将家鸡GPR 139 基因ORF区域序列进行基因组序列比对,显示该基因位于家鸡第14号染色体上,由2个外显子组成。家鸡GPR139前体蛋白与人(91.78%)、大鼠(89.17%)、小鼠(89.17%)的GPR139前体蛋白具有较高的同源性(图 2,图 3)。
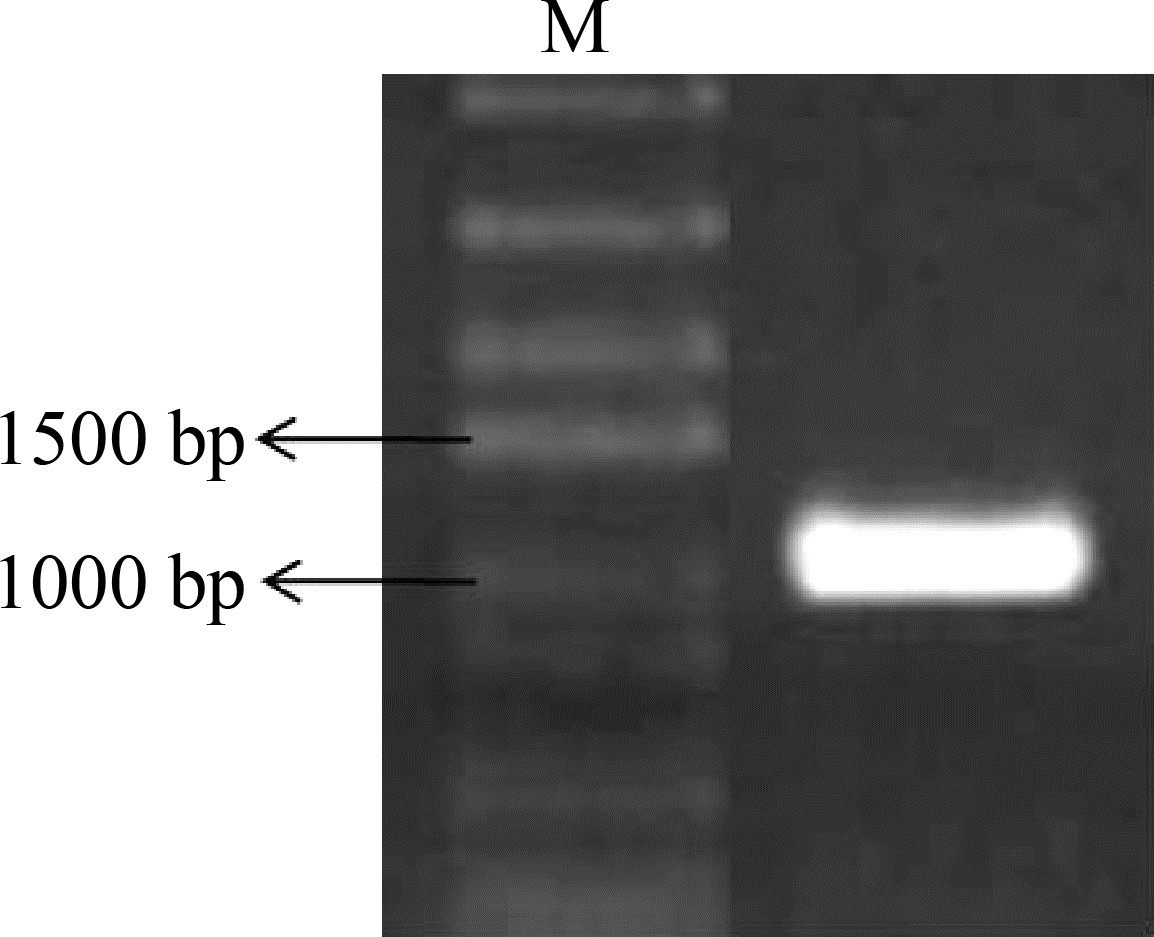
|
| 图 1 家鸡GPR 139 基因cDNA ORF区域扩增 Fig. 1 Amplification of the open reading frame (ORF) of chicken GPR 139 M. DNA marker. |
|
|
图 2 家鸡GPR 139 基因结构
Fig. 2 Genomic organization of chicken GPR 139
注: 家鸡GPR 139 基因有2个外显子, 阴影部分为ORF区域。
Note: Chicken GPR 139 consisted of two exons (exon 1 and exon 2), ORF region was shaded. |
|
|
图 3 家鸡GPR139(cGPR139)与人(hGPR139)、大鼠(rGPR139)、小鼠(mGPR139)的GPR139的氨基酸序列比对图
Fig. 3 Amino acid sequence alignment of chicken GPR139 with that of human (hGPR139), rat (rGPR139), and mouse (mGPR139)
阴影部分显示7次跨膜区; 方框显示视紫红质亚家族的“D-R-Y”基序; 黑色三角表示剪切位点; 空心三角表示糖基化位点; 圆点表示与家鸡cGPR139相同的氨基酸残基; 破折号表示氨基酸残基的缺失。
The seven putative transmembrane domains were shaded. The “D-R-Y” motif was boxed. Splice site and N-glycosylation site were marked by filled and open triangles, respectively. Dots indicate that amino acids were identical to cGPR139 and dashes represented gaps in the sequence. |
采用RT-PCR方法对GPR 139 在成体家鸡组织和脑各功能区的表达情况进行检测。结果显示:家鸡GPR 139在大脑、中脑、小脑、后脑、下丘脑、垂体、肺、卵巢、精巢、肌肉和肾脏等组织中有表达。其中,GPR139在脑各功能区域和垂体中的表达量最高;在肺、卵巢、精巢、肌肉和肾脏组织中仅有微弱表达。而在其余多种外周组织中,基本检测不到GPR139 的表达(图 4)。

|
|
图 4 家鸡GPR 139 基因的组织表达图谱分析
Fig. 4 Tissue expression of GPR 139 in chicken tissues
Br. 全脑, He. 心脏, Li. 肝脏, Sp. 脾脏, Lu. 肺, Ki. 肾脏, In. 小肠, Te. 精巢, Ov. 卵巢, Pi. 垂体, Mu. 肌肉, Pa. 胰腺, Tc. 大脑, Mb.中脑, Cb. 小脑, Hb. 后脑, Hp. 下丘脑。 “+” 指RT反应中添加了反转录酶, “-” 指RT反应中未添加反转录酶。
Br. brain, He. heart, Li, liver, Sp. spleen, Lu. lung, Ki. kidney, In. small intestine, Te. testis, Ov. ovary, Pi. pituitary, Mu. muscle, Pa. pancreas, Tc. telencephalon, Mb. midbrain, Cb. cerebellum, Hb. hindbrain, Hp. hypothalamus. “+” represented RT with reverse transcriptase, “-” represented RT without reverse transcriptase. |
GPR139属于G蛋白偶联受体家族视紫红质亚家族,目前仍未发现其内源性配体。孤儿受体被证实可作为药物靶点,因此,GPR139也一直是研究热点,但其在非哺乳类脊椎动物中的信息尚属空白。本次实验首次以家鸡为研究对象,成功从家鸡大脑中克隆得到了 GPR139基因的完整ORF区域。基因序列比对结果显示,GPR139 基因位于家鸡第14条染色体上,由2个外显子组成,在其第三跨膜区域末端含有1个D-R-Y基序(图 3)。其中,ORF区长1056 bp,编码351个氨基酸(图 1~图 3)。不同物种间氨基酸序列比对显示,GPR 139 基因编码的前体蛋白与人、大鼠、小鼠GPR139前体蛋白具有较高的同源性(图 3),说明GPR 139 在进化过程中十分保守,也表明GPR 139 可能具有重要生理学功能,而该功能在脊椎动物进化过程中高度保守。
通过对家鸡GPR 139基因组织表达图谱研究表明,GPR139基因的高表达主要局限于家鸡中枢神经系统及垂体中,暗示GPR 139 主要在家鸡脑组织及垂体中发挥作用。家鸡GPR139基因表达模式与小鼠GPR139基因和人GPR139 基因的表达模式一样,主要在中枢神经系统中表达(Andrew & Colin,2002;Ayako et al.,2005;Ute et al.,2006;Liaoyuan et al.,2009;Feng et al.,2011),也暗示GPR 139 在物种进化过程中发挥相同或相似的生理学作用,包括参与动物自主活动、行为的调控(Ute et al.,2006)。此外,与小鼠GPR 139基因和人GPR139基因不同的是,家鸡GPR139基因高表达于垂体,还被检测到在肺、卵巢、精巢、肌肉中有微弱表达。GPR139基因在家鸡组织中的表达图谱结果,表明GPR139在下丘脑-垂体轴及少数外周组织中发挥作用。本研究为探讨GPR139基因在家鸡中的生理功能奠定了一些基础。
| Andrew LH, Colin RG. 2002. The druggable genome[J]. Drug Discovery, 1(9): 727-730. |
| Ayako M, Shun-ichiro M, Mamoru N, et al. 2005. Molecular cloning and characterization of a novel Gq-coupled orphan receptor GPRg1 exclusively expressed in the central nervous system[J]. Biochemical and Biophysical Research Communications, 331(1): 363-369. |
| Chung S, Funakoshi T, Civelli O. 2008. Orphan GPCR research[J]. British Journal of Pharmacology, 153 suppl 1(S1): S339-S346. |
| David EIG, Helgi BS, Robert F. 2005. Nine new human Rhodopsin family G-protein coupled receptors: identification, sequence characterisation and evolutionary relationship[J]. Biochimica et Biophysica Acta, 1722(3): 235-246. |
| Davide L, Maria PA. 2008. Deorphanisation of G protein-coupled receptors: a tool to provide new insights in nervous system pathophysiology and new targets for psycho-active drugs[J]. Neurochemistry International, 52(3): 339-351. |
| Feng S, Jing KS, Danqi C, et al. 2011. Discovery and SAR of a series of agonists at orphan G protein-coupled receptor 139[J]. ACS Medicinal Chemistry Letters, 2(4): 303-306. |
| Joel B, Jean PP. 1999. Molecular tinkering of G protein-coupled receptors: an evolutionary success[J]. The EMBO Journal, 18: 1723-1729. |
| Jurgen D. 2000. Drug fiscovery: a historical perspective[J]. Science, 287(5460): 1960-1964. |
| Kavita KK, Kaiser J. 2014. Sequence-structure based phylogeny of GPCR class A rhodopsin receptors[J]. Molecular Phylogenetics and Evolution, 74: 66-96. |
| Kristen LP, Richard TP, Robert JL. 2002. Seven-transmembrane receptors[J]. Molecular Cell Biology, 3(9): 639-650. |
| Liaoyuan AH, Pauline MT, Nima KE, et al. 2009. Identification of surrogate agonists and antagonists for orphan G-protein-coupled receptor GPR139[J]. Journal of Biomolecular Screening, 14(7): 789-797. |
| Melvin IS, Michael PS, Narasimhan G. 1991. Diversity of G proteins in signal transduction[J]. Science, 252(5007): 802-808. |
| Olivier C, Yumiko S, Zhiwei W, et al. 2006. Orphan GPCRs and their ligands[J]. Pharmacology & Therapeutics, 110: 525-532. |
| Raise A, Stefanie W, Ralf J. 2015. Hunting for the function of orphan GPCRs-beyond the search for the endogenous ligand[J]. British Journal of Pharmacology, 172(13): 3218-3228. |
| Robert F, Malin CL, Lars-gustav L, et al. 2003a. The G-protein-coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints[J]. Molecular Pharmacology, 63(6): 1256-1272. |
| Robert F, Par JH, David EIG, et al. 2003b. Seven evolutionarily conserved human rhodopsin G protein-coupled receptors lacking close relatives[J]. Febs Letters, 554(3): 381-388. |
| Thóra KB, David EG, Sofia HH, et al. 2006. Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse[J]. Genomics, 88(3): 263-273. |
| Ulrik G. 2000. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors[J]. Endorine Reviews, 21(1): 137-166. |
| Ute S, Irm HB, Jens U, et al. 2006. Characterisation and differential expression of two very closely related G-protein-coupled receptors, GPR139 and GPR142, in mouse tissue and during mouse development[J]. Neuropharmacology, 50(4): 512-520. |
| Vignir I, Kirsten BA, Christoph B, et al. 2014. Computer-aided discovery of aromatic L-α-amino acids as agonists of the orphan G protein-coupled receptor GPR139[J]. Journal of Chemical Information & Modeling, 54(6): 1553-1557. |
 2015, Vol.34
2015, Vol.34 




