扩展功能
文章信息
- 徐峰, 廖灏泓, 杨维康
- XU Feng, LIAO Haohong, YANG Weikang
- 旱地沙蜥的两性异形
- Sexual Dimorphism of Phrynocephalus helioscopus
- 四川动物, 2015, 34(6): 859-862
- Sichuan Journal of Zoology, 2015, 34(6): 859-862
- 10.11984/j.issn.1000-7083.20150175
-
文章历史
- 收稿日期: 2015-05-12
- 接受日期: 2015-07-24
动物的两性异形(sexual dimorphism)是指同一物种的雌、雄两性个体在身体大小、颜色和局部形态特征等方面存在差异的现象,它普遍存在于整个动 物界中(Darwin,1871;Shine,1989;Andersson,1994)。 两性异形产生的原因复杂多样,目前还没有统一的规律解释这一现象。有研究表明性选择是导致一些动物类群中雄性个体体形偏大的两性异形现象产生的主要原因,因为体形大的雄性在性选择中有优势,能够获得更多的繁殖和交配机会;但也有研究表明在某些动物类群中,体形大的雌性能够繁殖更多后代,具有更高的繁殖力,因此导致产生雌性个体体形更大的两性异形现象,这也被称为两性异形的生育力选择压力假说;还有研究表明两性异形现象是自然选择压力作用下两性间的生态位分离机制导致的。因此,目前认为两性异形现象是由性选择压力、生育力选择压力以及自然选择等因素综合作用的结果(Shine,1989;Andersson,1994)。
自从达尔文提出两性异形现象以来,它在许多不同物种中得到了验证,比如兽类中一般雄性个体的体形大于雌性,而在鸟类中,雄性个体一般要比雌性个体色彩鲜艳,这些都体现出了两性异形在动物中的普遍性(Andersson,1994)。相比于兽类和鸟类,爬行动物中的两性异形则要复杂得多,没有统一的规律(廖灏泓等,2013a)。爬行动物尤其是有鳞类爬行动物物种多样性高、分布广,是研究两性异形的理想类群,而针对生活在荒漠地区的沙蜥开展的两性异形研究则相对较少,因此本文选择在我国仅分布于新疆北部地区的旱地沙蜥Phrynocephalus helioscopus为研究对象,检验该物种是否存在两性异形现象。旱地沙蜥主要分布在中亚荒漠干旱地区,在我国旱地沙蜥仅分布于新疆天山以北的塔城和阿勒泰地区,在新疆东北部的木垒县也有分布,它们生活于荒漠草原环境中的戈壁和沙砾中,以昆虫为食(赵尔宓等,1999)。旱地沙蜥的相关研究非常有限,除了分类和分布区外,仅见其核型分析的相关研究(吴敏,马英梅,1994),关于旱地沙蜥两性异形的研究尚未见报道,鉴于此,本文通过测量旱地沙蜥两性各形态学特征,研究旱地沙蜥的两性异形模式,同时也为进一步探讨旱地沙蜥两性异形的产生机制提供更多基础资料。
徐峰等:旱地沙蜥的两性异形 1 材料与方法 1.1 实验材料本研究用成年旱地沙蜥51只(其中,雌性23只,雄性28只)于2013年7月捕自新疆塔城地区托里县城北。样本带回实验室,用数显游标卡尺(精确到0.1 mm)测量相关形态特征。体长(snout-vent length,SVL)为吻端至泄殖腔孔前缘间距,口宽(mouth width,MW)为左右口角点间距,头宽(head width,HW)为左右颌关节间距,头高(head height,HH)为头顶骨到下颌骨之间的距离,头长(head length,HL)为吻端至外耳道前缘间距,眼间距(interorbital distance,ID)为左右上眼睑内缘之间最窄距离,腹部长(abdomen length,AL)为前肢腋窝到后肢腋窝间距,尾长(tail length,TL)为泄殖腔孔至尾末端间距(何南等,2011;廖灏泓等,2013b)。通过蜥蜴尾基部半阴茎鉴定性别和性成熟,并通过测量和参考《中国动物志爬行纲第二卷有鳞目蜥蜴亚目》(赵尔宓等,1999),将SVL≥42 mm的个体划为成体。
1.2 数据处理所有数据首先用Kolmogorov-Smironov和Levene检验分别检验数据的正态性和方差同质性。经检验除口宽外(P=0.02),其他所有数据符合正态性和方差齐性。用以性别为因子的单因素方差分析(One-Way ANOVA)比较旱地沙蜥两性成体的体长差异,用Pearson相关性检验分析雌、雄性体长与其他形态学特征的相关性。对与体长有显著相关性的形态学特征,以体长为协变量,性别为因变量做单因素协方差分析(One-Way ANCOVA)以控制体长因素,分析各形态特征的两性差异。口宽的雌雄两性差异则用非参数检验分析。数据以平均值±标准误(Mean±SE)表示。所有统计分析用SPSS 17.0软件进行,显著性水平设为0.05。
2 结果旱地沙蜥的体长、口宽、头宽、头高、头长、眼间距、腹部长和尾长数据见表 1。雌性和雄性成体体长与其他7项身体特征均显著正相关(雄性:MW=0.660,P < 0.01,HW=0.648,P < 0.01,HH=0.530,P < 0.01,HL=0.827,P < 0.01,ID=0.822,P < 0.01,AL=0.501,P < 0.01,TL=0.409,P < 0.05;雌性:MW=0.771,P < 0.01,HW=0.730,P < 0.01,HH=0.729,P < 0.01,HL=0.836,P < 0.01,ID=0.487,P < 0.05,AL=0.810,P < 0.01,TL=0.438,P < 0.05)。One-Way ANOVA结果显示雌雄个体平均体长间的差异无统计学意义。协方差分析显示:在控制体长的情况下,雌雄个体的头高、头长、腹部长和尾长间的差异有统计学意义,而头宽和眼间距间的差异无统计学意义。其中,雄性个体在头高、头长和尾长显著高于或长于雌性,而雌性个体的腹部明显长于雄性。Mann-Whitney U检验结果显示雌雄个体口宽间的差异无统计学意义。一元线性回归分析表明,雌雄个体的口宽、头宽、头高、头长、眼间距、腹部长和尾长都与体长有明显的线性关系(图 1),并且两性的腹部长呈现明显的异速生长,即雌性生长快于雄性。
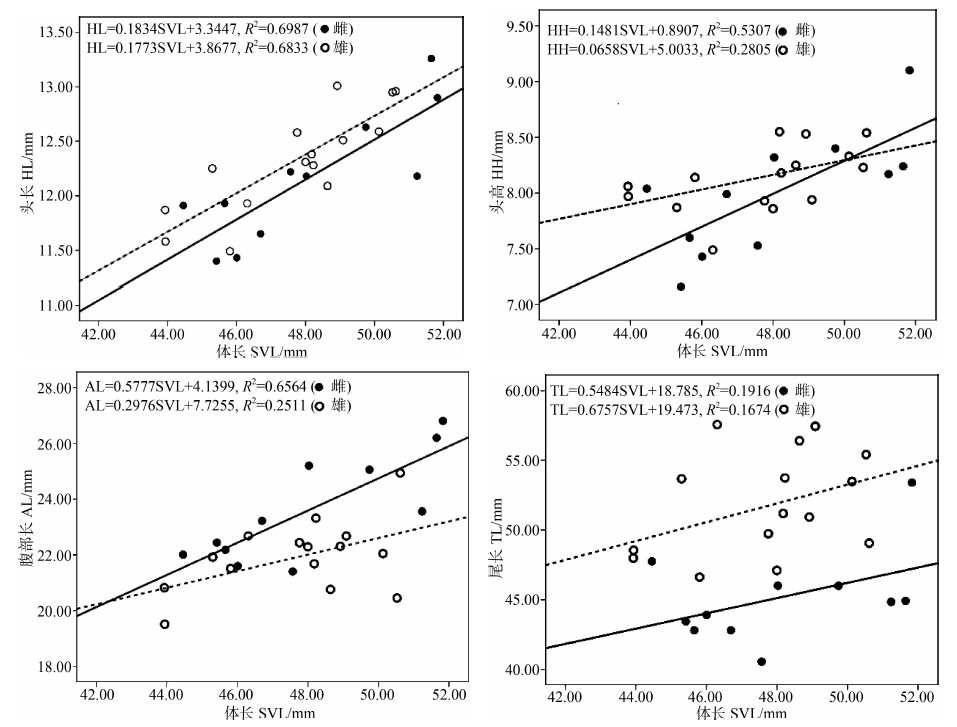
|
| 图 1 旱地沙蜥成体头长、头高、腹部长和尾长与体长之间的关系 Fig. 1 Linear regression between head length, head height, abdomen length, tail length and snout-vent length of adult Phrynocephalus helioscopus |
| 指标 | 雄性(n=28) 平均值±标准误(范围)/mm | 雌性(n=23) 平均值±标准误(范围)/mm | One-Way ANOVA | One-Way ANCOVA | Mann-Whitney U test |
| 体长SVL | 47.7±0.4(46.9~48.6) | 48.1±0.6(46.9~49.2) | F1,49=0.19, P=0.67>0.05 | ||
| 口宽MW | 11.4±0.3(10.8~12.1) | 10.9±0.1(10.8~11.2) | U=-1.05, P=0.30>0.05 | ||
| 头宽HW | 12.1±0.1(12.0~12.3) | 12.3±0.1(12.1~12.5) | F1,48=2.41, P=0.13>0.05 | ||
| 头高HH | 8.1±0.1(8.0~8.2) | 8.0±0.1(7.8~8.2) | F1,48=4.10, P < 0.05 | ||
| 头长HL | 12.3±0.1(12.2~12.5) | 12.2±0.1(11.9~12.4) | F1,48=7.92, P < 0.01 | ||
| 眼间距ID | 7.6±0.1(7.5~7.8) | 7.7±0.1(7.5~7.9) | F1,48=0.01, P=0.97>0.05 | ||
| 腹部长AL | 21.9±0.2(21.4~22.4) | 23.6±0.4(22.8~24.4) | F1,48=21.87, P < 0.01 | ||
| 尾长TL | 51.7±0.7(50.4~53.1) | 45.1±0.7(43.7~46.6) | F1,48=56.90, P < 0.01 |
个体大小即体长是动物两性异形中最重要的指标,一般而言一种动物具有雌性偏大或雄性偏大的两性异形模式,均是雌雄个体体长之间比较的结果(Shine,1988)。本次研究结果显示雌雄旱地沙蜥体长间的差异无统计学意义,表明其属于蜥蜴中两性异形不显著的种类。以往研究结果显示蜥蜴并无统一的两性异形规律,有些种类雄性偏大,如蓝尾石龙子Eumeces elegans(杜卫国,计翔,2001)和中国石龙子E. chinensis(林植华,计翔,2000)等;有些种类雌性偏大,如蝘蜓Sphenomorphus indicus(计翔,杜卫国,2000);还有许多种类和本次研究的旱地沙蜥类似,两性异性不显著,如新疆沙虎Teratoscincus przewalskii(廖灏泓等,2013b)、鳄蜥Shinisaurus crocodilurus(何南等,2011)、山地麻蜥Eremias brenchleyi)(许雪峰,计翔,2003)和宁波滑蜥Scincella modesta(罗来高等,2012)。动物的两性异形受多种因素和选择压力的影响,这种差异无统计学意义的两性异形模式可能是性选择压力、生育力选择压力和自然选择压力综合作用的结果。
本次研究还显示旱地沙蜥虽然在体长上无两性异形,但雄性头高、头长和尾长显著大于雌性;而雌性的腹部明显长于雄性,并且两性腹部长呈现明显的异速生长。蜥蜴头部大小的两性异形较为常见,且几乎均为雄性大于雌性(廖灏泓等,2013a),如以往研究显示北草蜥Takydromus septentrionalis(张永普,计翔,2000)、蓝尾石龙子(张永普,计翔,2004)、中国石龙子(马小梅,计翔,2001)和青海沙蜥P. vlangalii(Zhang et al.,2005)等蜥蜴的雄性头长、头宽均大于雌性,本次研究显示旱地沙蜥头宽两性间的差异无统计学意义,但是头长和头高间的差异有统计学意义。这种头部大小方面的差异很可能是性选择压力作用的结果。蜥蜴的头部大小一般与其咬合力大小有关,蜥蜴的头部越大,其咬合力越大,因此头部大的雄性蜥蜴在性选择中具有优势,这种性选择压力可能是驱使雄性蜥蜴头部较大的主要原因(Shine,1989;廖灏泓等,2013a)。
卷尾行为是雄性蜥蜴间进行交流的主要行为方式之一,研究表明蜥蜴的卷尾可能与警戒以及性选择中的雄性竞争等多种行为有关,而相对较长的尾部有利于增大尾部空间以容纳较大的半阴茎和牵缩肌肌肉,使雄性在性选择中具有较大的优势(廖灏泓等,2013a)。本次研究表明雄性旱地沙蜥具有较长的尾部,这与性选择压力假说相符,说明旱地沙蜥具有较长的尾部可能是性选择压力作用的结果。这一结果也与青海沙蜥(Zhang et al.,2005)、变色沙蜥P. versicolor、草原沙蜥P. frontalis(Qu et al.,2011)和东方叶趾虎Hemidactylus bowringii(Xu & Ji,2007)等研究结果一致。
除了上述结果显示的性选择压力可能对两性异形产生影响外,影响两性异形的另一大因素是生育力选择(Shine,1988;廖灏泓等,2013a)。生育力选择往往作用于雌性,体长较大或者腹部较长的雌性个体具有更大的空间和繁育更多后代的可能性,因此在生育力选择压力的作用下,雌性在两性异形中往往具有更大的体长或者更长的腹部(Shine,1988,1989;廖灏泓等,2013a)。本次研究结果表明雌性旱地沙蜥腹部更长,符合生育力选择压力假说,表明生育力选择压力是促使雌性旱地沙蜥腹部更长的主要原因。
综上所述,旱地沙蜥体长无明显的两性异形,但是头长、头高、尾长和腹部长具有明显的两性异形。雄性具有更大、更长的头和更长的尾,这可能是性选择压力作用的结果;而雌性个体具有更长的腹部,这可能是生育力选择压力作用的结果。
| 杜卫国, 计翔. 2001. 蓝尾石龙子的生长、两性异形及雌性繁殖[J]. 动物学研究, 22(4): 279-286. |
| 何南, 武正军, 蔡凤金, 等. 2011. 鳄蜥的两性异形[J]. 生态学杂志, 30(1): 7-11. |
| 计翔, 杜卫国. 2000. 蝘蜓头、体大小的两性异形和雌体繁殖[J]. 动物学研究, 21(5): 349-354. |
| 廖灏泓, 徐峰, 杨维康. 2013a. 两栖爬行动物两性大小异形研究进展[J]. 生态学杂志, 32(11): 3082-3093. |
| 廖灏泓, 徐峰, 杨维康. 2013b. 新疆沙虎的两性异形[J]. 四川动物, 32(6): 808-813. |
| 林植华, 计翔. 2000. 浙江丽水中国石龙子的食性、两性异形和雌性繁殖[J]. 生态学报, 20(2): 304-310. |
| 罗来高, 吴义莲, 田贤玉, 等. 2012. 宁波滑蜥两性异形和雌性繁殖[J]. 动物学杂志, 47(2): 23-30. |
| 马小梅, 计翔. 2001. 中国石龙子个体发育过程中头部两性异型和食性的变化[J]. 生态学杂志, 20(3): 12-16. |
| 吴敏, 马英梅. 1994. 旱地沙蜥的核型和Ag-NORs研究[J]. 新疆师范大学学报, 13(1): 45-48. |
| 许雪峰, 计翔. 2003. 山地麻蜥个体发育过程中头部两性异形和食性的变化[J]. 应用生态学报, 14(4): 557-561. |
| 张永普, 计翔. 2000. 北草蜥个体发育过程中头部两性异形及食性的变化[J]. 动物学研究, 21(3): 181-186. |
| 张永普, 计翔. 2004. 蓝尾石龙子的头部两性异形和食性[J]. 动物学报, 50(5): 745-752. |
| 赵尔宓, 赵肯堂, 周开亚, 等. 1999. 中国动物志爬行纲:第二卷 有鳞目 蜥蜴亚目[M]. 北京: 科学出版社. |
| Andersson M. 1994. Sexual selection[M]. Princeton: Princeton University Press. |
| Darwin C. 1871. The descent of man, and selection in relation to sex[M]. London: John Murray. |
| Qu Y, Gao J, Mao L, et al. 2011. Sexual dimorphism and female reproduction in two sympatric toad-headed lizards, Phrynocephalus frontalis and P. versicolor (Agamidae)[J]. Animal Biology, 61: 139-151. |
| Shine R. 1988. The evolution of large body size in females: a critique of Darwin's fecundity advantage model[J]. American Naturalist, 131: 124-131. |
| Shine R. 1989. Ecological causes for the evolution of sexual dimorphism: a review of the evidence[J]. Quarterly Review of Biology, 64: 419-461. |
| Xu D, Ji X. 2007. Sexual dimorphism, female reproduction and egg incubation in the oriental leaf-toed gecko (Hemidactylus bowringii) from southern China[J]. Zoology, 110: 20-27. |
| Zhang X, Ji X, Luo L, et al. 2005. Sexual dimorphism and female reproduction in the Qinghai toad headed lizard Phrynocephalus vlangalii[J]. Acta Zoologica Sinica, 51: 1006-1012. |
 2015, Vol.34
2015, Vol.34 




