扩展功能
文章信息
- 柴连琴, 苗迎春, 王乐
- CHAI Lianqin, MIAO Yingchun, WANG Le
- 20-羟基蜕皮酮对棉铃虫免疫系统的影响
- The Effects of 20-hydroxyecdysone on Cotton Bollworm Immune System
- 四川动物, 2015, 34(5): 739-747
- Sichuan Journal of Zoology, 2015, 34(5): 739-747
- 10.11984/j.issn.1000-7083.20150036
-
文章历史
- 收稿日期:2015-1-24
- 接受日期:2015-05-08
2. 河南大学棉花生物学重点实验室, 河南开封 475004;
3. 河南大学生物工程研究所, 河南开封 475004
2. State Key Laboratory of Cotton Biology, Henan University, Kaifeng, Henan Province 475004, China;
3. Institute of Bioengineer, Henan University, Kaifeng, Henan Province 475004, China
昆虫生长发育过程中受到保幼激素(juvenile hormone,JH)和蜕皮激素(ecdysone)的联合调控(Riddiford et al.,2003)。JH维持幼虫形态阻止成虫的出现,20-羟基蜕皮酮(20-hydroxyecdysone,20E)为羟基化后具有生物活性的蜕皮激素,能够指导幼虫周期性的蜕皮,同时调控幼虫到蛹和蛹到成虫的转换。20E类似物RH2485作为杀虫剂,正是利用该类化合物能够模拟昆虫体内蜕皮激素(Wing,1988),引起虫体提前致死性蜕皮的原理(李照民等,2002)。昆虫生长过程中时刻受到外界微生物的威胁,免疫系统对昆虫的存活至关重要,然而20E对昆虫免疫系统的影响和调控我们至今了解较少。
作为无脊椎动物,昆虫仅有先天免疫系统(Aggarwal & Silverman,2007),其由体液免疫反应和细胞免疫反应组成。体液免疫主要包括抗菌肽(antimicrobial peptide,AMPs)的产生和酚氧化酶触发的黑化反应等。在病原体入侵昆虫后,昆虫可通过模式识别受体识别病原体并通过Toll和Imd等信号途径启动昆虫的体液及细胞免疫反应。昆虫中发现的模式识别受体(pattern recognition receptor,PRRs)常分为7种类型(Christophides et al.,2002;Hultmark,2003):肽聚糖识别蛋白(peptidoglycan recognition proteins,PGRPs)、含硫酯蛋白(thioester-containing proteins,TEPs)、革兰氏阴性菌结合蛋白(Gram-negative binding proteins,GNBPs)、清道夫受体(scavenger receptors,SCRs)、C型凝集素(C type lectin)、硫依赖型凝集素(galectins)和Toll受体。其中GNBPs和β-1,3-葡聚糖识别蛋白是同一类模式识别蛋白的2种不同名称。抗菌肽作为昆虫体液免疫的重要组成部分,主要由脂肪体细胞分泌(Zasloff,2002;Lemaitre & Hoffmann,2007)。果蝇中发现的抗菌肽分为7个家族(Lemaitre & Hoffmann,2007),Defensins主要针对革兰氏阳性菌,Attacin,Diptericin,Drosocin高效杀灭革兰氏阴性菌,Cecropin A1既能抵抗细菌又能抵抗一些真菌,其中Drosomycin和Metchnikowin是抗真菌肽,后两种为果蝇科Drosophilidae特有。体液免疫还包括黑化反应,导致黑色素的形成,消除入侵微生物对机体的损伤。酚氧化酶(phenoloxidase,PO)是黑色素形成的关键酶。昆虫血细胞作为先天免疫系统的另一重要组成,通过吞噬(phagocytosis)、结节(nodulation)和包囊(encapsulation)等作用快速杀灭入侵微生物。其中具有吞噬能力的是浆血细胞和粒血细胞(Lavine & Str and ,2002)。
研究表明体液免疫基因的表达受到20E的调控(Flatt et al.,2008;Tian et al.,2010;Rus et al.,2013)。棉铃虫Helicoverpa armijera用20E短期处理6 h,不同C型凝集素基因表达既有上调也有下调(Wang et al.,2012)。20E处理果蝇幼虫能够增强抗菌肽基因diptericin的表达(Meister & Richards,1996)。当沉默果蝇S2细胞中蜕皮激素受体(EcR)或ultraspiracle(USP)基因,20E诱导的免疫效应就不能发生(Flatt et al.,2008)。但是,有研究表明20E抑制EcR依赖性的抗菌肽基因的表达(Beckstead et al.,2005),包括defensin、cecropin C、attacin A、drosocin和drosomycin。在家蚕中20E的处理也能降低抗菌肽mRNA表达(Tian et al.,2010)。以上实验结论不同甚至相反,因而对于20E的调控作用目前仍没有确切结论。本试验通过半定量RT-PCR检测了20E处理24 h后,24个体液免疫基因分别在脂肪体和血淋巴中的诱导变化;同时检测了20E对血细胞吞噬能力、凋亡状况、细胞间距、细胞浓度及类型的影响。通过研究20E对棉铃虫体液免疫和细胞免疫的影响,为深入理解20E对昆虫免疫系统的调节提供更多资源,也为害虫的防治提供参考。
1 材料与方法1.1 材料供试昆虫:棉铃虫由本实验室保种,在26 ℃±1 ℃、L∶D=14 h∶10 h、湿度为80%条件下人工饲料喂养。人工饲料购自河南济源白云实业。
供试菌:苏云金芽孢杆菌Bacillus thuringiensis(Bt)为实验室保存。
试剂:20E购自上海一基实业有限公司;Trizol RNA提取试剂购自北京博迈德科技发展有限公司;反转录试剂盒购自大连宝生物;2×Taq Master Mix购自novoprotein公司;2×SYBR Green Realtime PCR试剂盒购自日本ToYoBo公司;吖啶橙(Acridine orange,AO)、碘化丙啶(propidium iodide,PI)和4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)购自美国Sigma公司。
仪器:荧光显微镜LeicaDM6000德国徕卡;PCR仪2720 Thermal Cycler美国ABI;高速冷冻离心机德国Sigma。
1.2 方法1.2.1 引物的设计与合成根据NCBI核酸数据库中棉铃虫免疫相关基因序列,应用DNAMAN软件设计引物(表 1);经NCBI-BLAST比对分析,选取与棉铃虫其他序列具有较低相似性的区域,由生工生物工程(中国上海)股份有限公司合成。
| Gene序列号 | 正向引物Forward primer (5’-3’) | 反向引物Reverse primer (5’-3’) | 长度Length/bp |
| Attacin (AAX51192) | GCGGTGGTCTTGATTATAT | GGAACAGGTTGAGATTGC | 163 |
| Cecropin 1 (ADR51154) | TGTTCGCGTGTTTGGTAG | TTCACCGAGGACTGCTAT | 143 |
| Cecropin 2 (ADR51147) | TGTCTTCGCTTGTTTTGTG | ATCACGAATGTGCTGACCA | 101 |
| Cobatoxin (ADR51150) | CAATGGATGACCTGCTAA | CGTATAGAGCCTGATTGG | 103 |
| Gallerimycin (ADR51151) | GGCTGCTGAAGTTGAATC | TATCCGCCAGACTTGTATC | 138 |
| Galiomicin (ADR51145) | CGTGACATTCCTGGTGAT | CAGTCGGAGGTGTAGTTG | 102 |
| Gloverin (ADR51146) | TCATTATTCGGTCGTGGAG | GCCTTCGCATTATCATTGT | 155 |
| Lysozyme (ABF51015) | GGCAGAGTGAACAAGAAC | CGCAAGTGACATTACAGT | 122 |
| Moricin (ADR51149) | CATTACTGGTGCCATCTGA | CGTGCTCGCTATGTTGAT | 110 |
| *PRP-A (ADR51143) | TGACTTCCACTTGTACCA | ATCTCCTGTTGTAGCCATA | 186 |
| *PPO-2 (AAZ52554) | CCGCTTCACTCATCTTAAC | ACGAATCTGTCCATCTCAA | 174 |
| *GRP-1 (ACI32825) | GTGCGATACTGAACCTTAC | GTGGCTGTCTTGTAGAAC | 180 |
| *GRP-2a (ACI32826) | GCACAGGACAGTTGAGTA | GACTTCCACCTTGCCATA | 128 |
| *GRP-2b (ACI32827) | GATATGTGGCGGTCAAGT | CTGGTAGTTGTCGTCATCT | 103 |
| *GRP-3 (ACI32828) | TACCTGATGTGACCATACG | GGAACACGAAGAGACTGA | 87 |
| *G-BP (ACB54952) | CGTATCCGAACTGTCAATT | TGCCGTAGGTGTTGTAAG | 124 |
| *HaCTL-1 (ABF83203) | AAGAGGCTGGTTACGATAA | TGGCAGATAGGTGGATAC | 163 |
| *HaCTL-2 (ACI32834) | GTGCTGACCAATAAGTGT | AGTTCTCTGATGACCTGA | 133 |
| *HaCTL-3 (AFI47448) | GGAGCAGAGCCAATGGTCCC | GTTCCTCAGCAGAATCATGG | 182 |
| *HaCTL-4 (AFI47449) | AAGACTGCGTAGTGAAGAT | CCAGGTTGAGCACATAATC | 147 |
| *HaCTL-5 (AFI47450) | ACGATAGACCGCAATTACA | CAGTATTCCGCCTTCCATA | 117 |
| *HaCTL-6 (AFI47451) | TTAGATGCGACTACCAATATC | ACAGCACCTTGAAGAGTA | 109 |
| *HaCTL-7 (AFI47452) | CTCTGCAAGCCGCAGTACT | GTGGAGACGCTAACACTGC | 127 |
| *HaCTL-8 (AFI47453) | AAGCCTTCCTCAGATGTC | GAGTGCGAGTTATGTGTTC | 139 |
| β-actin (EU527017) | CGCCAAGTGTGACTATTC | ACGATACCTTACAGCCTAT | 122 |
| 注:*缩写PRP, PPO-2, GRP, G-BP, PRP和Ha-lectin分别表示肽聚糖结合蛋白, 酚氧化酶原亚基2, β-1, 3葡聚糖结合蛋白, 革兰氏阴性菌结合蛋白和棉铃虫C型凝集素。 Notes: The abbreviations of PRP, PPO-2, GRP, G-BP, PRP and Ha-lectin are peptidoglycan recognition-like protein A, prophenoloxidase subunit 2, beta-1, 3-glucan recognition protein, Gram-negative bacteria-binding protein and cotton bollworm C type lectin. |
|||
1 mg 20E先用8.9 μL无水乙醇溶解,后用磷酸盐缓冲液(phosphate buffered saline,PBS)稀释至5.6 g·L-1作为母液避光保存。使用时PBS稀释100倍。选取6龄取食期棉铃虫,实验组棉铃虫100只,每只注射5 μL 20E(56 mg·L-1)。对照组100只,注射等量含0.05%乙醇的PBS。
1.2.3 半定量RT-PCR检测免疫基因的表达6龄取食期棉铃虫20E处理24 h后,选取实验组和对照组幼虫各12只,用Trizol法提取血淋巴和脂肪体总RNA,1%琼脂糖凝胶检测。取总RNA 4 μg,根据反转录试剂盒说明书,合成cDNA,并以此为模板,半定量RT-PCR分析棉铃虫24个免疫基因表达水平变化。实验独立重复3次。
1.2.4 血细胞密度和类型的统计6龄取食期棉铃虫20E处理24 h后,选取5只实验组棉铃虫,酒精擦拭腹足,冰上收集血淋巴混匀。用细胞计数板在显微镜下观察统计粒细胞、浆血细胞、类绛色细胞、珠血细胞和原血细胞5类细胞的数目。用75%乙醇和三蒸水清洗计数板。选取5只对照组棉铃虫,用同样的方法统计总细胞和各类型细胞数,独立重复3次。
1.2.5 血细胞粘连6龄取食期棉铃虫20E处理24 h后,选取5只实验组幼虫,酒精擦拭腹足,冰上收集血淋巴混匀。吸取20 μL滴在干净的载玻片上制片,在显微镜下观察照相。取5只对照组棉铃虫,用同样的方法制片显微镜下观察照相,独立重复3次。
1.2.6 血细胞吞噬能力的检测方法取实验室保存Bt菌种2 μL加入4 mL LB培养基中,恒温30 ℃摇床中220 r·min-1过夜。16 h后取2 mL菌液,6000 r·min-1离心5 min,沉淀用500 μL PBS悬浮,再加入5 μL AO(0.1 mg·mL-1),室温染色5 min,6000 r·min-1离心5 min,沉淀用PBS 6000 r·min-1离心10 min,洗涤3次,加PBS 500 μL得到Bt菌液(1×106个·mL-1)。处理24 h后,取实验组棉铃虫和对照组棉铃虫各5只,冰冻麻醉。每只注射5 μL Bt菌液。4 h后酒精擦拭腹足,冰上收集血淋巴混匀。分别取20 μL制片,在荧光显微镜下观察照相。记录视野中血细胞总数,并在荧光下记录带有荧光信号即发生吞噬的血细胞数。独立重复3次。
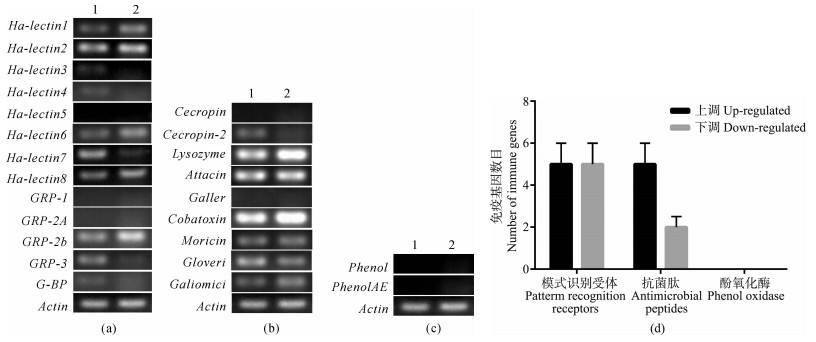
2 结果与分析2.1 20E对免疫基因表达的影响6龄取食期棉铃虫注射20E后,RT-PCR结果显示在脂肪体中模式识别受体中的Ha-lectin1、Ha-lectin2、Ha-lectin6、Ha-lectin8、GRP-2b表达上调,Ha-lectin3、Ha-lectin4、Ha-lectin7、GRP-3表达下调(图 1:a),抗菌肽中的Lysozyme、Attacin、Cobatoxin、Moricin、Galiomicin表达上调,Cecropin-2、Gloverin表达下调(图 1:b),酚氧化酶Phenol、PhenolAE没变化(图 1:c),脂肪体中模式识别受体基因上调和下调的基因数基本相同,抗菌肽中上调基因多于下调基因(图 1:d)。在血淋巴中模式识别受体Ha-lectin6表达上调,Ha-lectin1、Ha-lectin2、Ha-lectin7、Ha-lectin8、GRP-2b、GRP-2b表达下调(图 2:a),抗菌肽Cecropin-2、Attacin、Moricin、Gloverin、Galiomicin表达上调(图 2:b),酚氧化酶中Phenol表达下调(图 2:c),PhenolAE上调,在血淋巴中模式识别受体下调的明显多于上调的,抗菌肽上调的多于下调的基因(图 2:d)。
|
|
图 1 注射20E后6龄取食期棉铃虫脂肪体中免疫基因表达变化
Fig. 1 The changes of immune gene expression in fat body of the 6th instar feeding Helicoverpa armigera larvea after injected with 20E
a. 模式识别受体, b. 抗菌肽, c. 酚氧化酶, d. 免疫基因表达上调或下调数目; 1. 对照组, 2. 实验组; 下图同。 a. Pattern recognition receptor, b. Antimicrobial peptides, c. Polyphenol oxidase, d. The numbers of immune genes upregulated or downregulated; 1. Control group, 2. 20E treatmentgroup; the same below. |

|
| 图 2 注射20E后6龄取食期棉铃虫血淋巴中免疫基因表达变化 Fig. 2 The changes of immune gene expression in haemolymph of the 6th instar feeding Helicoverpa armigera larvea after injected with 20E |
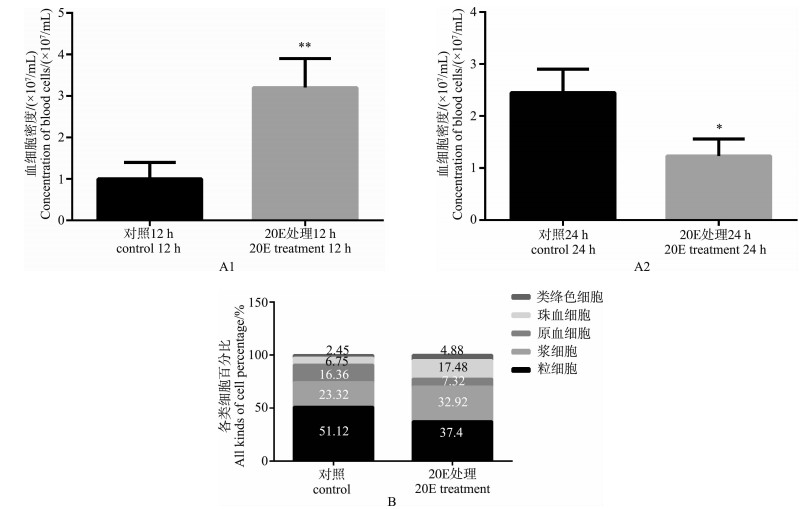
6龄取食期棉铃虫注射20E 12 h、24 h后,与对照组相比血细胞密度发生变化(图 3:A1,A2)。12 h时对照组密度为1.0×107个·mL-1,试验组密度为3.20×107个·mL-1,增加近2倍(图 3:A1);24 h时对照组血细胞密度为2.45×107个·mL-1,实验组密度为1.23×107个·mL-1,减少1/2(图 3:A2)。24 h时每种细胞类型占总数的百分比发生变化,对照组中粒细胞51.12%,浆细胞23.32%,原血细胞16.36%,珠血细胞6.75%,类绛色细胞2.45%;注射20E后:粒细胞37.40%,浆细胞32.92%,珠血细胞17.48%,原血细胞7.32%,类绛色细胞4.88%。注射20E后浆细胞、珠血细胞和类绛色细胞所占百分比增加,其中浆细胞增加较多(图 3:B)。
|
|
图 3 注射20E后6龄取食期棉铃虫血细胞密度和每种细胞类型相对丰度的改变
Fig. 3 The changes of the haemocyte density and the relative abundance of each type in the 6th instar feeding Helicoverpa armigera larvea after injected with 20E
A1. 20E处理12 h, **P<0.01; A2. 20E处理24 h, *P<0.05; B. 每种细胞类型所占百分比。 A1. 20E treat for 12 h, **P<0.01; A2. 20E treat for 24 h, *P<0.05; B. The percentage of each haemocyte type. |
6龄取食期棉铃虫注射20E 24 h后,与对照组相比血细胞发生聚集,间距变小(图 4)。而聚集对于增强血细胞的吞噬、结节、包囊等细胞免疫反应发挥重要作用。

|
| 图 4 注射20E后6龄取食期棉铃虫血细胞间距的改变 Fig. 4 The spacing changes of the haemocytes in the 6th instar feeding Helicoverpa armigera larvea after injection 20E a. 对照组Control group, b. 实验组 20E treatment group. |
在荧光显微镜下观察到6龄取食期棉铃虫血细胞能够吞噬荧光标记的Bt(图 5:A),吞噬率约40%(图5:B)。经20E处理24 h后,观察到荧光信号增强(图5:A),血细胞吞噬率达到55%(图5:B),吞噬能力提高了约15%(图5:A,B)。

|
|
图 5 注射20E后6龄取食期棉铃虫血细胞吞噬能力的改变
Fig. 5 Changes in phagocytic capacity of the 6th instar feeding Helicoverpa armigera larvea after injected with 20E
A. 吞噬能力, B. 细胞吞噬率; a. 对照组, b. 实验组; 1. 自然光, 2. 荧光; *P<0.05。 A. Phagocytic capacity, B. Phagocytic rate; a. Control group, b. 20E treatment group; 1. Natural light, 2. Fluorescence; *P<0.05. |
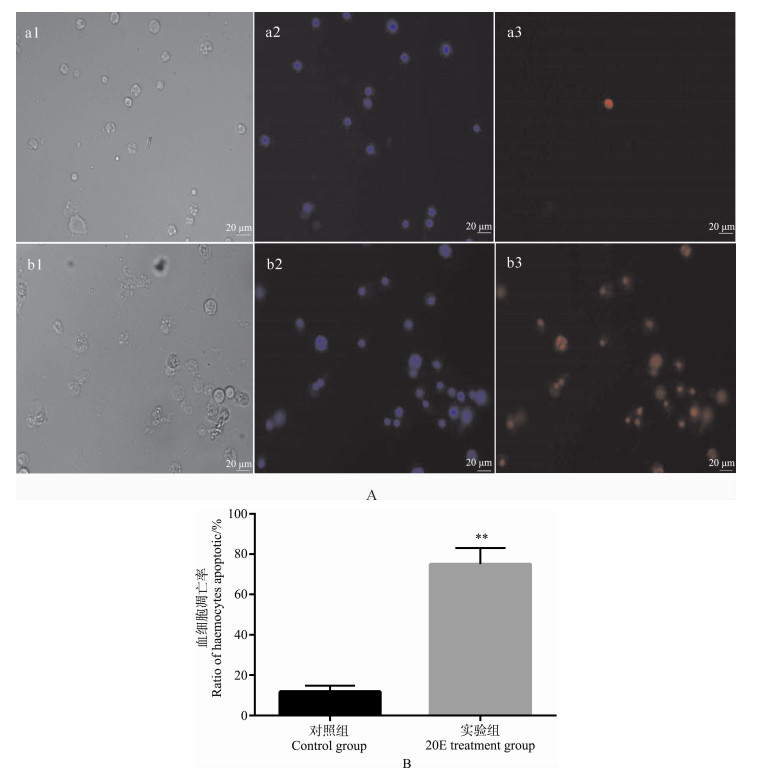
6龄棉铃虫注射20E后细胞的凋亡率发生改变,对照组凋亡率为11.76%,实验组凋亡率近75%,凋亡率显著升高(图 6:B)。
|
|
图 6 注射20E后6龄取食期棉铃虫细胞凋亡率的改变
Fig. 6 Changes of cell apoptosis rate in the 6th instar feeding Helicoverpa armigera larvea after injected with 20E
A. 血细胞凋亡对比: a. 对照组, b. 实验组; 1. 自然光, 2. DAPI染色, 3. PI染色; B. 细胞凋亡率; **P<0.01。 A. Comparison of haemocytes apoptosis: a. Control group, b. 20E treatment group; 1. Natural light, 2. DAPI staining, 3. PI staining; B. Apoptotic rate; **P<0.01. |
蜕皮激素20E处理24 h后,棉铃虫体液免疫发生复杂的变化。所选取的13个模式识别受体、9个抗菌肽和2个酚氧化酶相关基因在脂肪体和血淋巴中的表达(图 1,图 2)差别较大。说明同一组织不同免疫基因对20E的响应不同,且同一免疫基因在不同组织内对20E的响应也不同。有研究显示20E处理取食期棉铃虫,脂肪体中CTL5在处理3 h和6 h时表达降低,12 h表达明显升高(Wang et al.,2014)。本实验中处理24 h CTL5表达与对照相比没有发生明显变化(图 1:a)。表明CTL5对20E的响应持续时间较短,同时表明模式识别受体的表达变化与20E的处理时间密切相关。Wang等(2014)用20E处理取食期棉铃虫3 h时,脂肪体中Attacin、Gloverin 和Cecropin-2表达下调,至6 h和12 h表达显著上调。本实验中20E 处理24 h 时(图 1:b),Attacin仍上调表达,说明Attacin对20E的响应持续时间较长;而Cecropin-2和Gloverin表达已经下调,显然Cecropin-2和Gloverin对20E的响应持续的时间较短。综上所述,20E对棉铃虫体液免疫的影响比较复杂。
本研究同时检测了20E对细胞免疫的影响。注射20E 12 h 时血细胞密度增加2倍(图 3:A1),24 h血细胞密度减少近1/2且浆血细胞数相对增多(图 3:A2,B)。细胞间距减小(图 4),细胞的吞噬能力增强近15%(图 5)。结果说明20E的处理对棉铃虫血细胞产生了全面而深刻的影响,20E影响了细胞的增殖和分化。王成龙等(2009)研究了20E对体外培养的家蚕造血器官的造血功能的调节作用,结果表明20E对家蚕的造血器官的造血功能起促进作用。本实验中在20E处理的12 h细胞密度增加,24 h密度减少(图 3:A),说明此浓度的20E对血细胞增殖的促进作用维持在12 h以内。Franssens等(2005)在对麻蝇Neobellieria bullata 3龄幼虫注射昆布多糖前,分别用20-羟基蜕皮甾酮和保幼激素处理,结果显示20-羟基蜕皮甾酮促进昆布多糖引起的集结反应,保幼激素降低了血细胞集结作用的能力,这与本研究结果基本一致。吞噬作用是用于清除入侵的病原体和细胞凋亡残体的机制,包括识别、吞噬、对入侵病原体的破坏和细胞本身的衰竭死亡等,在免疫反应中扮演了重要的角色(Blandin & Levashina,2007;Williams,2007)。本实验中20E处理后血细胞的吞噬率提高,证实了20E能够增强昆虫的免疫能力。20E处理后细胞凋亡率升高(图 6:B)。细胞凋亡是免疫应答和免疫调控的重要形式之一。细胞凋亡有特殊的意义,细胞通过自身的凋亡来抵抗外来微生物和病毒的感染。昆虫在发育的过程中,血细胞的一个主要任务就是扫除和吞噬死细胞(Franc et al.,1996)。Regan等(2013)在对果蝇的研究中也证明了昆虫体内产生的蜕皮激素能迅速增强血细胞的活力,不仅能够提高血细胞的运动能力,还能增强对体内凋亡细胞和外来微生物的吞噬作用。结果表明20E能够提高昆虫的细胞免疫。
棉铃虫是重要的农业害虫,它极大地损害作物,造成世界范围内的经济损失。虽然通过转基因苏云金芽孢杆菌(Bt)棉花品种能有效地控制棉铃虫,但是非靶害虫如蟓已取代棉铃虫成为病虫害(Lu et al.,2010)。同时棉铃虫已经开始抗Bt作物,这可能导致棉铃虫病虫害重新发生(Tabashnik et al.,2009,2011;Downes et al.,2010;Wan et al.,2012)。蜕皮激素20E 可以调节昆虫的羽化、变态、生殖和细胞凋亡,对20E调控棉铃虫免疫系统的研究将有利于寻找新的方法控制棉铃虫。本研究表明昆虫不同组织中的不同免疫基因对20E的响应不同,20E对体液免疫的影响是复杂的,但是对细胞免疫的增强作用是明显的。蜕皮甾酮的潜在价值吸引了众多科学家,许多植物分子生物学、植物生化及医学领域的科学家开始加入到蜕皮甾酮的研究队伍,研究内容也从基础性理论研究迅速向其在害虫防治和医学应用等其他应用领域扩展。
| 李照民, 赵小凡, 李斐雪, 等. 2002. RH-2485对棉铃虫的室内药效试验[J]. 植物保护学报, 29(1):78-82. |
| 王成龙, 曹平生, 吴姗, 等. 2009. 外源激素对体外培养家蚕造血器官造血功能的影响[J]. 蚕业科学, 35(3):562-568. |
| Aggrawal K, Silverman N. 2007. Peptidoglycan recognition in Drosophila[J]. Biochemical Society Transactions, 35(Pt6):1496-1500. |
| Beckstead RB, Lam G, Thummel CS. 2005. The genomic response to 20-hydroxyecdysone at the onset of Drosophila metamorphosis[J]. Genome Biology, 6(12):R99. |
| Blandin SA, Levashina EA. 2007. Phagocytosis in mosquito immune responses[J]. Immunological Reviews, 219(1):8-16. |
| Christophides GK, Zdobnov E, Barillas-Mury C, et al. 2002. Immunity-related genes and gene families in Anopheles gambiae[J]. Science, 298(5591):159-165. |
| Downes S, Parker T, Mahon R. 2010. Incipient resistance of Helicoverpa punctigera to the Cry2Ab Bt toxin in Bollgard II® cotton[J]. PLoS ONE, 5(9):e12567. |
| Flatt T, Heyland A, Rus F, et al. 2008. Hormonal regulation of the humoral innate immune response in Drosophila melanogaster[J]. Journal of Experimental Biology, 211(16):2712-2724. |
| Franc NC, Dimarcq JL, Lagueux M, et al. 1996. Croquemort, a novel Drosophila hemocyte/macrophage receptor that recognizes apoptotic cells[J]. Immunity, 4(5):431-443. |
| Franssens V, Simonet G, Bronckaers A, et al. 2005. Eicosanoids mediate the laminarin-induced nodulation response in larvae of the flesh fly, Neobellieria bullata[J]. Archives of Insect Biochemistry and Physiology, 59(1):32-41. |
| Hultmark D. 2003. Drosophila immunity:paths and patterns[J]. Current Opinion in Immunology, 15(1):12-19. |
| Lavine MD, Strand MR. 2002. Insect hemocytes and their role in immunity[J]. Insect Biochemistry and Molecular Biology, 32(10):1295-1309. |
| Lemaitre B, Hoffmann J. 2007. The host defense of Drosophila melanogaster[J]. Annu Rev Immunol, 25:697-743. |
| Lu Y, Wu K, Jiang Y, et al. 2010. Mirid bug outbreaks in multiple crops correlated with wide-scale adoption of Bt cotton in China[J]. Science, 328(5982):1151-1154. |
| Meister M, Richards G. 1996. Ecdysone and insect immunity:the maturation of the inducibility of the diptericin gene in Drosophila larvae[J]. Insect Biochemistry and Molecular Biology, 26(2):155-160. |
| Regan JC, Brandão AS, Leitão AB, et al. 2013. Steroid hormone signaling is essential to regulate innate immune cells and fight bacterial infection in Drosophila[J]. PLoS Pathogens, 9(10):e1003720. |
| Riddiford LM, Hiruma K, Zhou X, et al. 2003. Insights into the molecular basis of the hormonal control of molting and metamorphosis from Manduca sexta and Drosophila melanogaster[J]. Insect Biochemistry and Molecular Biology, 33(12):1327-1338. |
| Rus F, Flatt T, Tong M, et al. 2013. Ecdysone triggered PGRP-LC expression controls Drosophila innate immunity[J]. The EMBO Journal, 32(11):1626-1638. |
| Tabashnik BE, Huang F, Ghimire MN, et al. 2011. Efficacy of genetically modified Bt toxins against insects with different genetic mechanisms of resistance[J]. Nature Biotechnology, 29(12):1128-1131. |
| Tabashnik BE, Van Rensburg JBJ, Carrière Y. 2009. Field-evolved insect resistance to Bt crops:definition, theory, and data[J]. Journal of Economic Entomology, 102(6):2011-2025. |
| Tian L, Guo E, Diao Y, et al. 2010. Genome-wide regulation of innate immunity by juvenile hormone and 20-hydroxyecdysone in the Bombyx fat body[J]. BMC Genomics, 11(1):549. |
| Wan P, Huang Y, Wu H, et al. 2012. Increased frequency of pink bollworm resistance to Bt toxin Cry1Ac in China[J]. PLoS ONE, 7(1):e29975. |
| Wang JL, Chen L, Tang L, et al. 2014. 20-hydroxyecdysone transcriptionally regulates humoral immunity in the fat body of Helicoverpa armigera[J]. Insect Molecular Biology, 23(6):842-856. |
| Wang JL, Liu XS, Zhang Q, et al. 2012. Expression profiles of six novel C-type lectins in response to bacterial and 20E injection in the cotton bollworm (Helicoverpa armigera)[J]. Developmental & Comparative Immunology, 37(2):221-232. |
| Williams MJ. 2007. Drosophila hemopoiesis and cellular immunity[J]. The Journal of Immunology, 178(8):4711-4716. |
| Zasloff M. 2002. Antimicrobial peptides of multicellular organisms[J]. Nature, 415(6870):389-395. |
 2015, Vol. 34(5)
2015, Vol. 34(5)




