扩展功能
文章信息
- 李小雪, 邵鑫, 霍永旭, 苏小娟, 王思洋, 杨春蕾
- LI Xiaoxue, SHAO Xin, HUO Yongxu, SU Xiaojuan, WANG Siyang, YANG Chunlei
- MTHF对C57BL/6鼠Lewis肺癌细胞生长的影响
- Effect of MTHF on the Growth of Lewis Lung Cancer Cells in C57BL/6 Mice
- 四川动物, 2015, 34(5): 729-733
- Sichuan Journal of Zoology, 2015, 34(5): 729-733
- 10.11984/j.issn.1000-7083.20150009
-
文章历史
- 收稿日期:2015-01-09
- 接受日期:2015-04-08
3’-甲氧基-3,4’,5,7-四羟基黄酮(3’-Methoxy-3,4’,5,7-tetrahydfoxyflavone,MTHF)是O-甲基化黄酮醇,广泛存在于蓼科植物中,也是哺乳动物和植物中槲皮素的中间代谢物(Lee et al., 2008)。黄酮类化合物具有广泛的生物活性,如抗癌和抗氧化作用。研究表明黄酮类化合物能够通过抑制细胞周期,诱导凋亡进而抑制肿瘤细胞。黄酮类化合物为潜在的抗癌治疗药物(Maqqioni et al., 2014)。MTHF作为黄酮类化合物,在体内对肿瘤细胞的抑制作用很少被报道(Lee et al., 2006)。本实验通过建立C57BL/6鼠Lewis肺癌移植瘤模型,从动物水平进一步探讨其抗肿瘤作用的机理。 1 材料与方法 1.1 细胞培养及细胞悬液的制备
将鼠Lewis肺癌LL2细胞株(本实验室提供)复苏,加入含10%已灭活的小牛血清(成都哈里生物有限工程公司)的DMEM(GIBCO)培养基,置于含5%CO2,37 ℃恒温细胞培养箱中培养,传代收集对数生长期细胞后制备细胞悬液,调节浓度为1×107/mL。 1.2 鼠Lewis肺癌LL2细胞移植瘤的建立
受体鼠为6周龄C57BL/6鼠(购自四川省抗生素研究所,合格证号:0005),体质量20~23 g,接种部位为右前肢腋窝皮下,微量注射器注射细胞悬液0.2 mL/只(细胞数为2×106个),接种约15 d后形成明显的移植瘤。将荷瘤鼠随机分成3组,每组14只,雌雄各半:对照组注射生理盐水0.1 mL/只,每日1次,共7 d;MTHF处理组,瘤体注射MTHF50 mg/(kg·d),共7 d;顺铂组,瘤体注射顺铂25 mg/(kg·d),共7 d。 1.3 抑瘤率观察
每隔1 d测量肿瘤体积(a×b2)/2(a、b分别是肿瘤的长和宽),并绘制移植瘤生长曲线;药物注射7 d后,断髓法处死小鼠,完整切取肿瘤,测量瘤重,计算各组药物的抑瘤率。抑瘤率=[(对照组平均瘤重-实验组平均瘤重/对照组平均瘤重)]×100%。 李小雪等:MTHF对C57BL/6鼠Lewis肺癌细胞生长的影响 1.4 组织学观察
光镜观察:4%多聚甲醛固定肿瘤组织,常规包埋石蜡切片,切片进行苏木精-伊红(HE)染色,光镜下观察肿瘤细胞坏死程度,并计算坏死斑面积。
电镜观察:将肿瘤组织块投入2%冷戊二醛中固定,洗涤液漂洗2 h后在4 ℃下用1%饿酸固定2 h。而后组织经逐级脱水,浸透包埋,超薄切片,电子染色后在H-600IV型透射电镜下观察肿瘤组织。 1.5 PCNA、Bcl-2、Bax表达的检测
免疫组化SP法:常规包埋石蜡切片脱蜡,封闭内源性过氧化酶,柠檬酸用于抗原修复,一抗封闭过夜,加二抗辅助试剂,孵二抗后经DAB显色,再将组织切片进行苏木素染色,置于氨水中以便充分返蓝,晾干后封片进行显微镜观察。PCNA以细胞胞核出现棕黄色或褐色颗粒为阳性标准。Bcl-2和Bax以细胞胞质被染成棕黄色颗粒为阳性。按下述标准进行结果判定:光镜下观察100个肿瘤细胞中阳性细胞的百分比,其阳性率<10%为-,阳性率10%~25%为+,阳性率25%~50%为++,阳性率>50%为+++。阴性对照组均用PBS代替第一抗体。其中PCNA、Bcl-2、Bax抗体及相关试剂盒购自北京中山生物技术有限公司。 1.6 统计学分析
实验结果进行方差分析,P<0.05表示结果具有统计学意义。 2 结果 2.1 药物对Lewis肺癌移植瘤的抑制作用
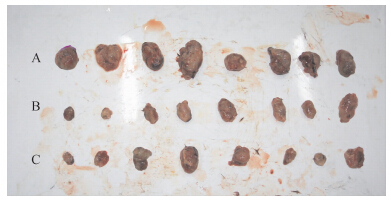
C57BL/6鼠接种Lewis肺癌细胞后,15 d左右形成明显的移植瘤,用药期间未发现鼠死亡(图 1)。计算MTHF组、顺铂组的抑瘤率分别为46.2%、54.5%(表 1),MTHF组、顺铂组移植瘤体积较对照组减小(图 2,图 3),结果显示移植瘤对MTHF和顺铂治疗均敏感。

|
| 图 1 C57BL/6鼠移植瘤 Fig. 1 C57BL/6 mice transplantation tumor A. 对照组Control group,B. MTHF组 MTHF treatment group,C. 顺铂组Cisplatin treatment group; 下同the same below. |

|
| 图 2 移植瘤生长曲线 Fig. 2 Growth curve of transplantation tumor |
| 组别
Groups | 平均瘤体大小
Average weight/g | 抑瘤率
Inhibition rate/% |
| 对照组 | 2.66 | |
| MTHF组 | 1.08* | 46.2 |
| 顺铂组 | 1.41* | 54.5 |
| 注: 与对照组相比,*P<0.05。 Note: compared with control group,*P<0.05. | ||
|
| 图 3 各实验组C57BL/6鼠肿瘤大小 Fig. 3 C57BL/6 mice transplantation tumor of each group |
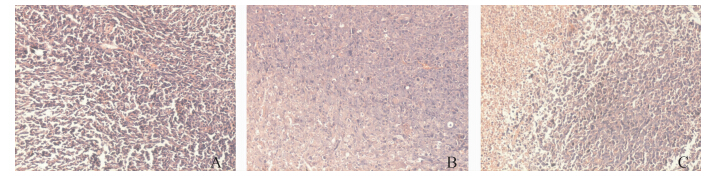
光镜下观察肿瘤组织,对照组细胞仍保持着培养状态下原有的异质性,呈不规则形态,核异型深染,出现异常的核分裂组(图 4:A)。MTHF组细胞较对照组呈现不同程度的退行性变化,细胞体积减小,部分肿瘤组织明显坏死(图 4:B,C)。
|
| 图 4 各实验组HE染色比较(×100) Fig. 4 Comparison of each group after HE staining(×100) |
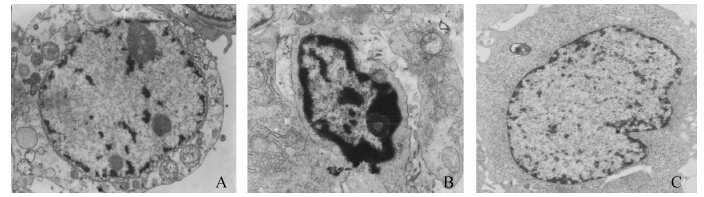
电镜下观察对照组细胞胞膜结构完整,胞核大而圆,核膜光滑无褶皱,核仁清晰可见。MTHF组可见典型的凋亡细胞形态:细胞膜完整,胞体皱缩并形成突起,胞浆内密度加深,核质浓缩,核膜、核仁破裂,异染色质趋边聚集,排列在核膜内侧。顺铂组细胞膜完整,核膜出现褶皱(图 5)。
|
| 图 5 透射电镜观察各实验组超微结构(×12 000) Fig. 5 Observation of the ultrastructure of each group by transmission electron microscope(×12 000) |
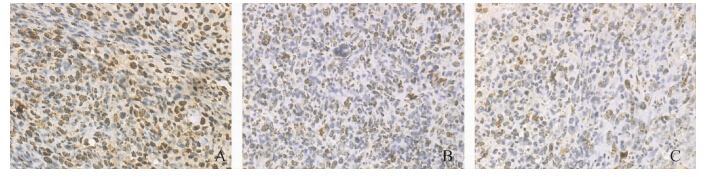
PCNA免疫组化结果显示:PCNA蛋白表达于Lewis肺癌细胞核内,阳性细胞呈棕褐色。对照组PCNA阳性率明显高于MTHF组、顺铂组(图 6:A~C),药物处理后的PCNA指数明显下降,与对照组相比差异具有高度统计学意义(P<0.01)(表 2)。表明MTHF对肿瘤细胞增殖有抑制作用。
|
| 图 6 免疫组化法检测各实验组肿瘤组织PCNA表达(×100) Fig. 6 Positive immunohistochemical expression of PCNA in cancer tissue(×100) |
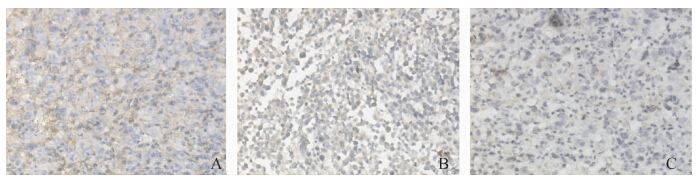
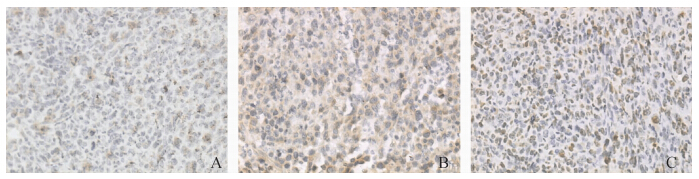
免疫组化结果显示MTHF组、顺铂组Bcl-2表达明显低于对照组(P<0.05)(图 7,表 3),而Bax的表达却高于对照组(图 8,表 4)。表明MTHF可抑制Bcl-2蛋白的表达并促进Bax蛋白的表达。
| 组别Groups | PCNA-LI/% |
| 对照组 | 66.05±2.46 |
| MTHF组 | 45.58±3.12** |
| 顺铂组 | 37.67±2.24** |
| 注: 与对照组相比,**P<0.01。
Note: compared with control group,**P<0.01. | |
|
| 图 7 免疫组化法检测各实验组肿瘤组织Bcl-2表达(×100) Fig. 7 Positive immunohistochemical expression of Bcl-2 in cancer tissue(×100) |
|
| 图 8 免疫组化法检测各实验组肿瘤组织Bax表达(×100) Fig. 8 Positive immunohistochemical expression of Bax in cancer tissue(×100) |
| 组别Groups | Bcl-2标记指数Expression of Bcl-2 | |||
| - | + | ++ | +++ | |
| 对照组 | 1 | 2 | 3 | |
| MTHF组 | 1 | 5 | ||
| 顺铂组 | 2 | 4 | ||
| 注: -. 阳性率<10%,+. 阳性率10%~25%,++. 阳性率25%~50%,+++. 阳性率>50%; 阿拉伯数字表示组织切片数; 下表同。 Notes: -. positive rate was lower than 10%,+. positive rate was between 10% and 25%,++. positive rate was between 25% and 50%,+++. positive rate was more than 50%; number represented the section number of tissue; the same below. | ||||
| 组别Groups | Bax标记指数Expression of Bax | |||
| - | + | ++ | +++ | |
黄酮类化合物是最常见的多酚类植物化合物,分离出的化合物常为山奈酚、槲皮素的衍生物。黄酮类化合物是苯丙烷类代谢途径产生的次生代谢产物,由15个C原子和1个共同的C6-C3-C6骨架,2个苯环通过吡喃杂环或者1个吡喃酮环连接在一起(Carletti et al., 2014)。已报道的黄酮类化合物对多种肿瘤细胞系均有抑制增殖的作用,包括肝癌、结肠癌、胶质瘤、食道癌等(Tsai et al., 2010;Yan et al., 2014)。Tsui等(2014)发现黄酮类化合物能够阻断H460与A549细胞周期。本研究发现,MTHF能够抑制Lewis肺癌细胞的生长、增殖而发挥抗肿瘤的作用。
PCNA在细胞分裂过程中发挥着至关重要的作用,在调控细胞周期、染色体代谢和DNA复制过程中起着重要的作用。在真核细胞和古细菌中发现PCNA是在进化上十分保守的蛋白质。PCNA是DNA聚合酶的聚合因子,可作为细胞增殖的指标(Strzalkaet & Ziemienowicz,2011)。本实验中发现MTHF组PCNA的表达量显著低于对照组,表明MTHF能够抑制细胞的增殖。Bcl-2家族是在细胞凋亡中有重要作用的一类蛋白质。Bcl-2家族的表达和调控是影响细胞凋亡的关键因素之一,在细胞凋亡信号转导途径中发挥重要作用。研究表明Bcl-2缺陷小鼠能诱发淋巴细胞凋亡,Bax缺陷小鼠的淋巴细胞却增生(McDonnell et al., 1989)。说明Bcl-2是抗凋亡因子,而Bax的作用等同于凋亡因子。Bcl-2蛋白与Bax相竞争。当Bax过量时,Bax自身形成的同源二聚体占优势,细胞执行死亡的命令;当Bcl-2占优势时,Bcl-2和Bax形成异源二聚体,凋亡被抑制细胞存活(Korsmeyer,1999)。Bcl-2和Bax的比值可以作为测定凋亡的指标。C57BL/6鼠Lewis肺癌移植瘤细胞经MTHF处理后Bcl-2的表达明显低于对照组,表明MTHF可能能够诱导Bax的表达,从而抑制Bcl-2基因,进而诱导细胞凋亡。
通过上述实验可见,MTHF能抑制C57BL/6鼠Lewis肺癌移植瘤的增殖,这是MTHF在体内具有抗肿瘤作用的实验依据,为抗癌药物的筛选提供一条可能的途径。
| Carletti G, Nervo G, Cattivelli L. 2014. Flavonoids and Melanins:a common strategy across two kingdoms[J]. Biological Sciences, 10(10):1159-1170. |
| Korsmeyer SJ. 1999. Bcl-2 gene family and the regulation of programmed cell death[J]. Cancer Reseach, 59(7):1693-1700. |
| Lee HJ, Lee EO, Ko SG, et al. 2008. Mitochondria-cytochrome C-caspase-9 cascade mediates isorhamnetin-induced apoptosis[J]. Cancer Letters, 270(2):342-353. |
| Lee SK, Baek NI, Lee JS, et al. 2006. Antiproliferation effects of isorhamnetin isolated from Persicaria thunbergii on cancer cell lines[J]. Natural Product Sciences, 12(4):214-216. |
| Maqqioni D, Biffi L, Nicolini G, et al. 2014. Flavonoids in oral cancer prevention and therapy[J]. European Cancer Prevention, 23(4):157-162. |
| McDonnell TJ, Deane N, Platt FM, et al. 1989. Bcl-2-immunoglobulin transgenic mice demonstrate extended B cell survival and follicular lymphoproliferation[J]. Cell, 57(1):79-88. |
| Strzalka W, Ziemienowicz A. 2011. Prolifetating cell nuclear antigen (PCNA):a key factor in DNA replication and cell cycle regulation[J]. Annals of Botany, 107(7):1127-1140. |
| Tsai YC, Lin CL, Chen BH. 2010. Preparative chromatography of flavonoids and saponins in Gynostemma pentaphyllum and their antiproliferation effect on hepatoma cell[J]. Phytomedicine, 18(1):2-10. |
| Tsui KC, Chiang TH, Wang JS, et al. 2014. Flavonoids from Gynostemma pentaphyllum exhibit differential induction of cell cycle arrest in H460 and A549 cancer cells[J]. Molecules, 19(11):17663-17681. |
| Yan H, Wang Y, Wang P, et al. 2014. Antiproliferation and anti-migration induced by gypenosides in human colon cancer SW620 and esophageal cancer Eca-109 cells[J]. Human & Experimental Toxicology, 33(5):522-533." |
 2015, Vol. 34(5)
2015, Vol. 34(5)




