扩展功能
文章信息
- 刘雪清, 李莎, 肖衎, 赵珣, 郭柏福, 陈磊, 杜合军
- LIU Xueqing, LI Sha, XIAO Kan, ZHAO Xun, GUO Baifu, CHEN Lei, DU Hejun
- 中华鲟性别相关的扩增片段长度多态性分子标记筛选
- Screening of Sex-specific Markers in Acipenser sinensis Using AFLP
- 四川动物, 2015, 34(5): 714-718
- Sichuan Journal of Zoology, 2015, 34(5): 714-718
- 10.11984/j.issn.1000-7083.20140563
-
文章历史
- 收稿日期:2014-12-18
- 接受日期:2015-04-08
2. 三峡工程鱼类资源保护湖北省重点实验室, 湖北宜昌 443100
2. Hubei Key Laboratory of Three Gorges Project for Conservation of Fishes, Institute of Chinese Sturgeon, China Three Gorges Corporation, Yichang, Hubei Province 443100, China
中华鲟Acipenser sinensis是一种古老的大型海河回游性鱼类,在我国近海大陆架生长育肥,在江河上游产卵。中华鲟曾广泛分布于长江、珠江等河流中,近年来,水利工程建设、过度捕捞和环境污染等人类活动造成其数量急剧下降。进入20世纪以来,中华鲟仅见于长江,已成为极度濒危物种。2013年和2014年中华鲟研究所、中国水产科学研究院长江水产研究所等多家科研单位共同开展的中华鲟自然繁殖监测,均未监测到中华鲟产卵繁殖,中华鲟的保护因此更加备受关注。2009年中华鲟全人工繁殖的成功使建立中华鲟人工繁殖种群的长期繁衍成为可能(郭柏福等,2011)。而性别比例平衡是迁地群体中的重要管理原则(季维智,宿兵,1999),因此,性别鉴定成为迁地保护研究中的常规技术。中华鲟性成熟时间较长,性腺发育到达Ⅱ期至少需要2年,而达到Ⅲ期,雄性至少需要9年,雌性至少需要14年(四川省长江水产资源调查组,1988;郭柏福等,2011),且中华鲟不具备第二性征,因此,在性成熟之前难以通过外部形态进行性别区分。虽然基于穿刺组织检查、内窥镜检查、B超检查和激素分析等鉴定技术可以在一定程度上对性别加以区分,但需要发育到一定的阶段才能进行(性腺发育至Ⅱ期甚至Ⅲ期),易继舫等(1999)认为这通常需要3年以上的时间,这显然不利于迁地人工种群的有效管理。因此越早对中华鲟进行性别鉴定,越有利于性比平衡管理,以较小种群保存较大的繁殖能力和保持较大的进化潜力,进而有利于以最少的投入发挥较大的保护效益。分子标记技术以其准确率高、重复性好、样品需求少和对个体伤害小,成为临床医学、畜牧、水产、物种保护等方面常用的性别鉴定手段(Devlin & Nagahama,2002)。 刘雪清等:中华鲟性别相关的扩增片段长度多态性分子标记筛选
中华鲟自然种群及养殖子一代群体性比接近1∶1(四川省长江水产资源调查组,1988),表明其性别决定机制可能主要是由遗传决定(van Eenennaam et al., 1999),这为利用分子手段进行其性别鉴定提供了可能。扩增片段长度多态性(amplified fragment length polymorphism,AFLP)结合了限制性酶切片段多样性(RFLP)和PCR的优点,具有全基因组范围检测、多态性丰富、信息量大、灵敏度高等优点,在鱼类性别相关分子标记筛选及优良性状筛选等方面得到了广泛应用(Waugh et al., 1997;Liu & Cordes,2004)。但目前尚无利用AFLP来筛选中华鲟性别分子标记的报道。
本研究尝试通过构建中华鲟AFLP反应体系来筛选与中华鲟性别密切相关的分子标记,为中华鲟发育早期阶段的性别鉴定提供技术支撑。 1 材料与方法 1.1 样品
实验鱼来自中国长江三峡集团公司中华鲟研究所10龄以上的中华鲟子一代。通过性腺穿刺取样和解剖观察方法鉴定性别。分别采集雌鱼15尾,雄鱼9尾,剪少量鳍条,用无水乙醇固定。 1.2 基因组DNA的提取及纯度检测
将无水乙醇固定保存的鳍条样品剪碎,70 ℃烘干,使乙醇完全挥发。用Qiagen基因组DNA抽提试剂盒依据其说明书进行基因组DNA抽提(德国)。1.0%琼脂糖凝胶电泳检测后,用SCANdrop 200(德国)检测其浓度和纯度。然后,将DNA浓度调整至 200 ng·μL-1,-20 ℃保存备用。 1.3 接头和引物的合成
单链寡核苷酸接头(adapter)及引物由上海生物工程技术服务有限公司合成(表 1)。
| 接头及引物
Adapters and primers | 序列5’-3’
Sequence 5’-3’ | 接头及引物
Adapters and primers | 序列5’-3’
Sequence 5’-3’ |
| EcoR I adapters | CTCGTAGACTGCGTACC | Mse I adapters | GACGATGAGTCCTGAG |
| AATTGGTACGCAGTCTAC | TACTCAGGACTCAT | ||
| EcoR I 预扩增 | GTAGACTGCGTACCAATTCA | Mse I预扩增 | GACGATGAGTCCTGAGTAAC |
| E1 | FAM-GACTGCGTACCAATTC-ATC | M1 | GATGAGTCCTGAGTAA-CGT |
| E2 | FAM-GACTGCGTACCAATTC-AGA | M2 | GATGAGTCCTGAGTAA-CCA |
| E3 | FAM-GACTGCGTACCAATTC-AGG | M3 | GATGAGTCCTGAGTAA-CTG |
| E4 | FAM-GACTGCGTACCAATTC-ATG | M4 | GATGAGTCCTGAGTAA-CGA |
| E5 | FAM-GACTGCGTACCAATTC-AAG | M5 | GATGAGTCCTGAGTAA-CAA |
| E6 | FAM-GACTGCGTACCAATTC-AAC | M6 | GATGAGTCCTGAGTAA-CTC |
| E7 | FAM-GACTGCGTACCAATTC-AGC | M7 | GATGAGTCCTGAGTAA-CAC |
| E8 | FAM-GACTGCGTACCAATTC-ACC | M8 | GATGAGTCCTGAGTAA-CAT |
| E9 | FAM-GACTGCGTACCAATTC-ACA | ||
| E10 | FAM-GACTGCGTACCAATTC-AGT |
AFLP分析过程参考Yarmohammadi等(2011)的方法并稍作修改。酶切采用EcoR I/Mse I组合,预扩增采用无选择碱基的引物对,选择性扩增采用含3个选择性碱基的引物组合,并对E-NNN5’端进行FAM荧光标记。利用E-NNN和M-NNN自由组合共80对选择性扩增引物对24尾中华鲟个体进行PCR扩增。 1.5 毛细管电泳检测以及数据分析
将荧光标记后的PCR产物在ABI 3730XL毛细管测序仪进行测序分型,用GeneMapper 4.0软件对 其检测。检测后的数据使用GeneMarker 1.6软件进行分析,根据各毛细管电泳的泳道内分子量内标的位置与各样品峰值的位置做比较分析,得到不同片段的大小。假定凝胶上所有迁移位置相同条带均来自同一位点上的同一等位基因,按毛细管测序电泳图上带的有无,将24个中华鲟样品,80对引物所得数据转化为0-1矩阵(1表示出现扩增条带,0表示未出现扩增条带),统计位点总数和多态性位点比例(匡友谊等,2007)。利用Phylip 3.6软件进行个体遗传距离和遗传相似系数计算并进行聚类分析(Felsenstein,2005)。 2 结果 2.1 AFLP扩增结果及多态性分析
80对AFLP引物组合分别对24尾中华鲟个体(9尾雄性、15尾雌性)进行扩增,共得到846个位点(在100~500 bp区间内,峰值低的条带不纳入统计)。其中,多态性位点411个,多态性位点比例为48.58%。每对引物组合产生的扩增位点数为5~28,扩增出的多态性条带为1~26条,多态性位点比例为8.33%~96.15%。但在411个多态性位点中,并未发现雌雄特异位点。 2.2 雌雄个体差异
27对引物组合扩增结果中,有33个位点在雌雄个体中分布存在较大差异(表 2)。其中E2-M3、E2-M6引物对扩增结果中的2个位点只在雌性个体中随机出现,而在雄性个体中并未出现;E11-M5组合扩增结果中的1个位点在雄鱼个体中随机出现,但是并未在所有的雌鱼个体中出现;E4-M1、E5-M8、E5-M9、E6-M7、E6-M8、E7-M2、E9-M7、E11-M4、E11-M8、E12-M4引物对扩增结果中则各有1个位点在雄鱼个体中都存在,但是在雌性个体中随机出现(如E6-M7引物对扩增的232 bp位点在9尾雄性个体中都有出现,而在15尾雌性个体中仅在5尾个体中出现);而E9-M7、E11-M7引物对扩增的位点中有1个位点在雄鱼群体中随机出现,而在所有雌鱼中全部出现;其他扩增位点在雌雄个体中扩增的位点相差在40%以上,表明这些位点可能与中华鲟性别具有一定的相关性。
| 引物组合
Primer pairs | 位点分 子质量
Length of marker | 雄性个体
Males
(出现个数/ 样本总数) (presence/ total sample) | 雌性个体
Females
(出现个数/ 样本总数) (presence/ total sample) | 雌雄分布 比例差值
Distribution of gender differences/% |
| E2-M1 | 322 | 7/9 | 4/15 | 44.4 |
| 386 | 7/9 | 2/15 | 64.4 | |
| E2-M3 | 411 | 0/9 | 3/15 | 20.0 |
| E2-M6 | 182 | 0/9 | 2/15 | 13.3 |
| E3-M4 | 153 | 9/9 | 11/15 | 26.7 |
| E3-M5 | 182 | 3/9 | 0/15 | 33.3 |
| E3-M7 | 140 | 6/9 | 4/15 | 40.0 |
| 356 | 7/9 | 15/15 | 22.2 | |
| E3-M8 | 311 | 9/9 | 13/15 | 13.3 |
| E4-M1 | 154 | 9/9 | 13/15 | 13.3 |
| 310 | 3/9 | 14/15 | 60.0 | |
| E4-M3 | 205 | 2/9 | 11/15 | 51.1 |
| E4-M8 | 342 | 6/9 | 2/15 | 53.3 |
| E5-M8 | 158 | 9/9 | 11/15 | 26.7 |
| 361 | 9/9 | 9/15 | 40.0 | |
| E6-M1 | 169 | 1/9 | 10/15 | 55.6 |
| 259 | 2/9 | 11/15 | 51.1 | |
| E6-M2 | 192 | 6/9 | 2/15 | 53.3 |
| E6-M7 | 232 | 9/9 | 5/15 | 66.7 |
| E6-M8 | 169 | 9/9 | 10/15 | 33.3 |
| E7-M2 | 170 | 2/9 | 12/15 | 57.8 |
| 204 | 9/9 | 13/15 | 13.3 | |
| E7-M4 | 274 | 5/9 | 1/15 | 48.9 |
| E8-M1 | 160 | 3/9 | 13/15 | 53.3 |
| 179 | 4/9 | 14/15 | 48.9 | |
| E8-M4 | 172 | 7/9 | 2/15 | 64.4 |
| E9-M1 | 310 | 5/9 | 2/15 | 42.2 |
| E9-M4 | 274 | 6/9 | 4/15 | 40.0 |
| E9-M7 | 156 | 9/9 | 12/15 | 20.0 |
| 225 | 5/9 | 15/15 | 44.4 | |
| E9-M8 | 150 | 7/9 | 5/15 | 44.4 |
| E10-M4 | 194 | 9/9 | 11/15 | 26.7 |
| E10-M7 | 179 | 7/9 | 2/15 | 64.4 |
|
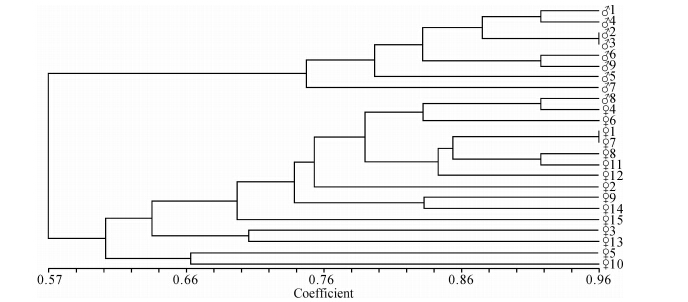
| 图 1 中华鲟雌雄个体聚类图 Fig. 1 Individuals dendrogram of male and female Acipenser sinensis |
利用Phylip 3.6软件计算24尾中华鲟个体之间的遗传距离,运用UPGMA统计分析方法对24尾个体进行聚类分析。从图 1可以看出,中华鲟雌雄群体聚为2支,雌鱼聚为一支,雄鱼一支,这表明优选的33个位点在相同性别之间的鱼的遗传距离较近,优先聚为一支,而与不同性别之间的鱼的遗传距离较远。由此可以推断,这33个多态性位点与中华鲟性别之间存在较大的相关性。 3 讨论与结论
鱼类在脊椎动物中属于比较低等的动物,其性别染色体分化程度较低,90%的鱼类中未观察到性别相关的异型染色体存在(Devlin & Nagahama,2002; Volff,2004)。能找到性别特异的DNA片段无论是在鱼类育种上还是在性别决定与性别分化研究及物种保护上都具有重要意义。
目前也确实通过不同分子标记技术筛选到鱼类性别特异或紧密连锁的DNA片段,如利用随机扩增多态性DNA技术(r and om amplified polymorphism DNA,RAPD)和荧光原位杂交技术(fluorescence in situ hybridization,FISH)筛选出虹鳟鱼Oncorhynchus mykiss的性别相关标记(Ittura et al., 1997)。利用AFLP标记技术对刺鱼Gasterosteus aculeatus进行性别鉴定(Griffith et al., 2000),以及Cui等(2006)利用cDNA-AFLP技术从虎河鲀Takifugu rubripes筛选性别相关标记。李静等(2007)利用AFLP技术检测雌雄半滑舌鳎Cynoglossus semilaevis基因组DNA间的差异,筛选出半滑舌鳎雌性特异的AFLP标记,并将其中1个AFLP标记成功转化为特征性片段扩增区域(sequence characterized amplification region,SCAR),从而建立了半滑舌鳎遗传性别鉴定的PCR技术。
截止目前,通常采用2种策略进行性别特异分子标记筛选:一种是直接分析性别决定及性别分化密切相关的候选基因;另一种是对2种性别基因组差异比较。无论采用哪种策略并结合多种分子技术手段均未能从其他鲟鱼,如西伯利亚鲟A. baerii、纳氏鲟A. naccarii、小体鲟A. ruthenus、欧洲鳇Huso huso、湖鲟A. fluvescens、俄罗斯鲟A. gueldenstaedtii、欧洲大西洋鲟A. sturio、高首鲟A. transmontanus、波斯鲟A. persicus、意大利鲟A. naccarii中找到与性别密切连锁的DNA序列(van Eenennaam et al., 1999;Flynn et al., 2006;Wuertz et al., 2006;Keyvanshokooh et al., 2007;McCormick et al.,2008;Hale et al., 2010;Keyvanshokooh & Gharaei,2010;Yarmohammadi et al., 2011)。
本研究通过构建中华鲟AFLP反应体系,用80对引物共扩增出846条片段,多态性片段411条,但是从多态性位点中并未分离到与雌雄相关的特异性DNA片段,这与在其他鲟鱼中的研究结果一致。本实验以及其他研究未能发现鲟鱼性别紧密连锁的基因或DNA片段,可能与多种因素有关,例如基因组大小、筛查位点的密度、决定性别的同源染色体在鲟鱼中差异程度及检测手段的敏感性等(Wuertz et al., 2006;Keyvanshokooh & Gharaei,2010;Yarmohammadi et al., 2011),并且鱼类的性别不仅与遗传因素有关,还与环境有一定的关联,从而造成遗传性别与生理性别的不一致,也增加了性别相关基因分离的难度(Devlin & Nagahama,2002)。
然而本研究中,411个多态性位点中有33个在中华鲟雌雄个体中分布比例具有很大差异。进一步对9尾雄性、15尾雌性中华鲟个体中的这33个位点进行UPMGA聚类分析,结果表明雌雄个体具有一定的遗传分化,性别相同的个体优先聚为一支,说明这些位点可能与中华鲟性别决定基因存在密切相关性。但结果中个别个体存在雌雄个体穿插现象,如雄性第8号个体与15尾雌性个体聚为一支。作者认为这可能一方面由相关座位选择上的差异造成,另一方面也不排除中华鲟存在生理性别与遗传性别的不一致(李静等,2006)。这些差异位点的多态性可能是由个体间遗传变异造成的(Gao et al., 2010),也不排除是一种偶然的巧合,需要扩大种群进一步验证。
本研究尝试在中华鲟基因组中寻找性别相关的特异AFLP分子标记,虽然未筛选到与性别紧密连锁的特异位点,但是得到了拥有大量个体遗传特征的AFLP数据,可为人工种群的遗传管理提供基础资料。
致谢:本研究采样得到中国长江三峡集团公司中华鲟研究所万建义、田家元、舒德斌、张建明、郑成黔、姜华、朱欣、王京树、胡亚平、文志豪、饶军、唐大明等的协助,在此一并致谢。| 郭柏福, 常剑波, 肖慧, 等. 2011. 中华鲟初次全人工繁殖的特性研究[J]. 水生生物学报, 35(6):940-945. |
| 季维智, 宿兵. 1999. 遗传多样性研究的原理与方法[M]. 杭州:浙江科学技术出版社. |
| 匡友谊, 佟广香, 尹家胜, 等. 2007. 呼玛河哲罗鱼遗传多样性的AFLP分析[J]. 中国水产科学, 14(4):615-621. |
| 李静, 陈松林, 邓思平, 等. 2007. 半滑舌鳎雌性特异扩增片段长度多态性标记的筛选与应用[J]. 水产学报, 31(5):591-597. |
| 李静, 陈松林, 温海深. 2006. 鱼类性别相关基因及性别特异标记的研究进展[J]. 海洋水产研究, 27(4):90-95. |
| 四川省长江水产资源调查组. 1988. 长江鲟鱼类生物学及人工繁殖研究[M]. 成都:四川科学技术出版社. |
| 易继舫, 刘灯红, 唐大明, 等. 1999. 蓄养中华鲟的性腺发育与人工繁殖初报[J]. 水生生物学报, 23(1):85-86. |
| Cui JZ, Shen XY, Gang QL, et al. 2006. Identification of sex markers by cDNA-AFLP in Takifugu rubripes[J]. Aquaculture, 257(1):30-36. |
| Devlin RH, Nagahama Y. 2002. Sex determination and sex differentiation in fish:an overview of genetic, physiological, and environmental influences[J]. Aquaculture, 208(3):191-364. |
| Felsenstein J. 2005. PHYLIP:Phylogenetic inference program, version 3.6[S]. Seattle:University of Washington. |
| Flynn SR, Matsuoka M, Martin-Robichaud DJ, et al. 2006. Gynogenesis and sex determination in shortnose, Acipenser brevirostrum LeSuere[J]. Aquaculture, 253:721-727. |
| Gao ZX, Wang HP, Yao H, et al. 2010. No sex-specific markers detected in bluegill sunfish Lepomis macrochirus by AFLP[J]. Journal of Fish Biology, 76(2):408-414. |
| Griffith R, Orr KJ, Adam A, Barber I. 2000. DNA sex identification in the three-spined stickleback[J]. Journal of Fish Biology, 57(5):1331-1334. |
| Hale MC, Jackson JR, DeWoody JA. 2010. Discovery and evaluation of candidate sex-determining genes and xenobiotics in the gonads of lake sturgeon (Acipenser fulvescens)[J]. Genetica, 138(7):745-756. |
| Iturra P, Medrano JF, Bagley M, et al.1997. Identification of sex chromosome molecular markers using RAPDs and fluorescent in situ hybridization in rainbow trout[J]. Genetica, 101(3):209-213. |
| Keyvanshokooh S, Gharaei A. 2010. A review of sex determination and searches for sex-specific markers in sturgeon[J]. Aquaculture Research, 41(9):1-7. |
| Keyvanshokooh S, Pourkazemi M, Kalbasi MR. 2007. The RAPD technique failed to identify sex-specific sequences in beluga (Huso huso)[J]. Journal of Applied Ichthyology, 23(1):1-2. |
| Liu ZJ, Cordes JF. 2004. DNA marker technologies and their applications in aquaculture genetics[J]. Aquaculture, 238(1):1-37. |
| McCormick CR, Bos DH, DeWoody JA. 2008. Multiple molecular approaches yield no evidence for sex-determining genes in Lake Sturgeon (Acipenser fulvescens)[J]. Journal of Applied Ichthyology, 24(6):643-645. |
| van Eenennaam AL, van Eenennaam JP, Medrano JF, et al. 1999. Evidence of female heterogametic genetic sex determination in white sturgeon[J]. Journal of Heredity, 90(1):231-233. |
| Volff JN. 2004. Genome evolution and biodiversity in teleost fish[J]. Heredity, 94(3):280-294. |
| Waugh R, Bonar N, Baird E, et al. 1997. Homology of AFLP products in three mapping populations of barley[J]. Molecular and General Genetics, 255(3):311-321. |
| Wuertz S, Gaillard S, Barbisan F, et al. 2006. Extensive screening of sturgeon genomes by random screening techniques revealed no sex-specific marker[J]. Aquaculture, 258(1):685-688. |
| Yarmohammadi M, Pourkazemi M, Chakmehdouz F, et al. 2011. Comparative study of male and female gonads in Persian sturgeon (Acipenser persicus) employing DNA-AFLP and cDNA-AFLP analysis[J]. Journal of Applied Ichthyology, 27(2):510-513. |
 2015, Vol. 34(5)
2015, Vol. 34(5)




