扩展功能
文章信息
- 李继荣, 杨乐, 曹建, 王文娟, 李来兴
- LI Jirong, YANG Le, CAO Jian, WANG Wenjuan, LI Laixing
- 青藏高原3种常见鸟类卵壳膜稳定碳、氮同位素组成特征
- Stable Carbon and Nitrogen Isotope Compositions of Egg Membrane from Three Bird Species in Qinghai-Tibet Plateau
- 四川动物, 2015, 34(5): 683-687,694
- Sichuan Journal of Zoology, 2015, 34(5): 683-687,694
- 10.11984/j.issn.1000-7083.20140523
-
文章历史
- 收稿日期:2014-11-20
- 接受日期:2015-04-08
2. 中国科学院大学, 北京 100049;
3. 西藏自治区高原生物研究所, 拉萨 850001
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Tibetan plateau Institute of Biology, Lhasa 850001, China
目前,稳定同位素分析技术在动物生态学研究方面得到广泛应用,由于光照(Boon et al., 2001)、温度(McKinnon et al., 2012)等气候条件的不同,导致不同地区具有特定的稳定同位素比值,生活在该地区的生物体的特定组织必能反映当地的同位素特征值(Pearson et al., 2003)。利用该特征值可以进行动物迁徙(Hobson et al., 2001;Hobson et al., 2010)、营养级关系(Muoz-Gil et al., 2012)、生活史(Phillips et al., 2009)、食性(Denadai et al., 2008)等方面研究。
目前国内有关动物稳定同位素应用已有多年研究,稳定同位素组成特征分析的采样部位包括鱼类的全身、肌肉(蔡德陵等,2003;马冬红等,2012)、角质鄂(金岳等,2014)、耳石(高永文等,2004);两栖类的肌肉、内脏和皮肤(王微,2011;郑传伟等,2014);哺乳类的毛发(刘晓玲,2012)、肌肉(刘泽鑫,2008)等;鸟类的羽毛(丛日杰,2013)和肌肉(易现峰等,2004;宋大伟等,2007;杨月琴等,2009)。但有关野生鸟类卵壳膜的稳定同位素信息未见相关报道。
李继荣等:青藏高原3种常见鸟类卵壳膜稳定碳、氮同位素组成特征 在国外的研究中,卵壳、爪、羽毛、血液、肌肉等组织已经成为最常见的测量样品(Barquete et al., 2013)。卵壳、羽毛、血液、爪相对于其他组织来说是无损伤取样,大部分水禽和一些陆禽在卵孵化后将卵壳留在巢中,卵壳膜可以在不影响鸟类孵化的前提下进行收集(Mabee,1997;Oppel et al., 2009),这对于研究濒危物种有很重要的意义。卵壳膜在输卵管的峡部,产卵前20 h形成。卵壳膜形成过程所需要的营养物质来自鸟类当前的食物(Oppel et al., 2009),其稳定同位素δ13C、δ15N反映的是产卵前3~5天的食物稳定同位素信息(Giardina et al., 2014),产地信息具有确定性。而对于羽毛来说,一些水鸟常常迁徙到人迹罕至的地方换羽,其换羽地存在一定程度的不确定性。在利用稳定同位素研究鸟类迁徙时,使用鸟卵作为繁殖地本底值,建立鸟卵与不同组织同位素值间的联系是日后研究鸟类迁徙,追溯其繁殖地、中途停歇地与越冬地的重要方法(Hobson,1999)。
本文以青藏高原常见的3种鸟类——普通鸬鹚Phalacrocorax carbo、渔鸥Larus ichthyaetus和小云雀Alauda gulgula为例,通过测试其卵壳膜中碳、氮稳定同位素的组成特征,分析其中所蕴含的生活史信息和地理信息,探究卵壳膜能否代替肌肉作为稳定同位素技术研究载体,同时确定卵壳膜能否作为鸟类迁徙繁殖地信息载体,为稳定同位素分析技术在鸟类生态学方面的推广积累数据。
1 材料与方法 1.1 研究区域概况
青海湖国家级自然保护区位于青海省刚察县境内,介于36°32′~37°25′N,99°36′~100°46′E之间,海拔约3200 m,是中亚-印度迁徙路线上众多水鸟的重要繁殖地和中途停歇地(张国钢等,2008),该地区属于高原大陆性气候。鸬鹚岛和三块石位于保护区内,生境类型为岩石湖岸湿地(侯元生等,2009),鸬鹚岛的东北边缘有断层陡崖紧靠湖边,陡崖外有一近似圆柱形的岩石屹立于青海湖中,是普通鸬鹚的繁殖场所,三块石位于青海湖的西南方位,是由7块密集在一起的石灰石、礁石构成,是渔鸥和普通鸬鹚的集中繁殖地。普通鸬鹚和渔鸥在该地区的种群数量较大,小样本采样不会对其种群造成太大的伤害,且2个物种为青藏高原繁殖期优势水鸟,其卵壳膜的同位素组成一定程度上反应了该地区繁殖水鸟的同位素特征,由于三块石四面环水,样品采集相对较难,加之采样时间上的局限性,仅采集到渔鸥样品。
海北高寒草甸生态系统定位站地处青藏高原东北隅的青海海北藏族自治州门源县境内,祁连山北支冷龙岭东段南麓坡地的大通河河谷西段,介于37°29′~37°45′N,101°12′~101°23′E之间,海拔3200~3600 m。该地区位于亚洲大陆腹地,具有明显的高原大陆性气候,东南季风及西南季风微弱,该区为矮嵩草草甸、金露梅灌丛草甸、小嵩草草甸为主要建群种的不同植被类型(李英年等,2004)。小云雀为该地区常见的雀形目鸟类之一,其巢大多数建立在植被高度和覆盖度比较高的草甸地面上,营巢类型为开放型地面巢,一般在迎风面都有一簇小草遮挡用以伪装,巢内结构简单、无垫铺(赵亮等,2002)。 1.2 取样方法
经相关部门批准,于2007年在青海湖国家级自然保护区的三块石采集渔鸥卵10枚,2012年3—4月在鸬鹚岛采集鸬鹚卵10枚,2014年5月在海北高寒草甸生态系统定位站采集小云雀卵12枚。每天上午对产有1枚卵的鸟巢进行观察,待亲鸟离巢觅食后,标记鸟巢及卵顺序,待亲鸟产下第2枚卵时取出第1枚卵并标记第2枚卵。标记时先用附近泥土搓洗双手,避免人为因素造成弃巢,每窝中取1枚卵用于稳定同位素测定。 1.3 样品处理及稳定同位素测定 1.3.1 主要仪器及试剂
稳定同位素比值质谱仪:MAT253型,美国Thermo Fisher公司;元素分析仪:Flash EA2000 型,美国Thermo Fisher公司;万分之一天秤;标准物:IAEA-600。 1.3.2 仪器条件
O2、CO2、N2和He压力均为0.4 MPa,反应管温度为960 ℃,载气流速为90 mL/min,氧气流速250 mL/min,参考气体流速200 mL/min,仪器精度δ13C、δ15N均为0.01‰。 1.3.3 样品处理及制备
卵破壳后用不锈钢镊子将卵壳与壳膜分离开,去离子水冲洗去除壳膜附带的卵黄和卵清,60 ℃恒温干燥箱48 h烘干至恒重,放入研钵中充分研磨,过100目筛备用(Polito et al., 2009;Herzka et al., 2013)。由于小云雀的壳膜量相对较少,我们将2枚卵的壳膜合为一份样品。称量0.5 mg放入锡杯中包好,每折叠一次锡杯时尽量压平,将锡杯中的空气挤出,防止空气中的CO2、N2的影响,以Flash EA2000元素分析仪联MAT253同位素比值质谱仪进行测样,每份样品测3次,求平均值,标准品使用IAEA-600。稳定同位素丰度表示为样品与标准品之间偏差的千分数(Hobson & Clark,1992;Hobson et al., 1994;Tsahar et al., 2008):
δX=[(R样品/R标准-1)]×1000‰
其中:X指15N或13C;R=15N/14N或13C/12C;R样品为被测样品的同位素比值;R标准为标准品的同位素比值。
δ13C样品=[(13C/12C样品)/(13C/12C标准)-1]×1000‰
δ15N样品=[(15N/14N样品)/(15N/14N标准)-1]×1000‰
1.4 稳定同位素数据分析使用Excel 2007对数据进行整理,OriginPro 8.5作图,不同物种卵壳膜稳定同位素数据分析使用软件SPSS 20进行单因素方差分析,统计检验前,用Kolmogorov-Smirnov和Levene统计量分别检验所有数据的正态性和方差同质性,满足方差齐性时采用LSD多重比较法进行分析。 2 结果 2.1 卵壳膜稳定同位素碳组成
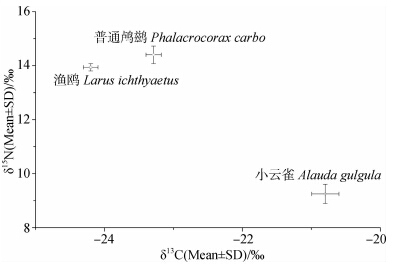
由表 1和图 1可以看出3个物种的δ13C值标准差较小,表明其种间波动性较小,小云雀卵壳膜的δ13C值相对于普通鸬鹚卵壳膜的偏正,普通鸬鹚卵壳膜的相对渔鸥卵壳膜的偏正,3种鸟卵壳膜δ13C平均值分别为-20.80‰、-23.29‰、-24.20‰。
|
物种 Species |
样本量 n |
平均数±标准差 Mean±SD |
最小值 Min |
最大值 Max |
|
普通鸬鹚 Phalacrocorax carbo | 10 | -23.29±0.35B | -24.03 | -22.78 |
|
渔鸥 Larus ichthyaetus | 10 | -24.20±0.33C | -24.91 | -23.70 |
|
小云雀 Alauda gulgula | 6 | -20.80±0.48A | -21.54 | -20.30 |
| 注: 上标字母表示LSD多重比较结果,不同上标字母表示两物种间差异有高度统计学意义(P<0.01); 下同。 Notes:Superscripts mean the results of LSD multiple comparison,different superscripts indicate extremely significant difference(P<0.01); the same below. | ||||
单因素方差分析结果显示(表 2),3种鸟卵壳膜的δ13C值差异有高度统计学意义(F(2,23)=155.982,P<0.01)。LSD多重比较结果表明(表 1)普通鸬鹚、渔鸥和小云雀的卵壳膜δ13C值之间差异有高度统计学意义,δ13C值为小云雀相对普通鸬鹚偏正,普通鸬鹚相对渔鸥偏正。
|
变异来源 Source of variation | df | SS | MS | F |
| 组间 Between groups | 2 | 44.207 | 22.104 | 155.982** |
| 组内 Within group | 23 | 3.259 | 0.142 | |
| 总变异 Total | 25 | 47.467 | ||
| 注: **表示差异有高度统计学意义,F(2,23,0.01)=5.66;下同。 Note: **the difference was extremely significant,F(2,23,0.01)=5.66; the same below. | ||||
由表 3和图 1可以看出,3个物种δ15N值的标准差较大,表明其种间波动相差较大,渔鸥相对普通鸬鹚的和小云雀卵壳膜的方差较小,其δ15N值相对较稳定。小云雀的δ15N值相对普通鸬鹚的和渔鸥的较贫乏,3种鸟卵壳膜δ15N值分别为9.25‰、14.40‰、13.94‰。
|
| 图 1 3种鸟卵壳膜稳定同位素碳(δ13C)和氮(δ15N) Fig. 1 Stable carbon(δ13C) and nitrogen(δ15N)isotope of three species’ shell membrane |
|
物种 Species |
样本量 n |
平均数±标准差 Mean±SD |
最小值 Min |
最大值 Max |
|
普通鸬鹚 Phalacrocorax carbo | 10 | 14.40±1.03A | 12.22 | 15.73 |
|
渔鸥 Larus ichthyaetus | 10 | 13.94±0.43A | 13.31 | 14.41 |
|
小云雀 Alauda gulgula | 6 | 9.25±0.87B | 8.33 | 10.50 |
单因素方差分析结果显示(表 4),3种鸟δ15N值之间的差异有高度统计学意义(F(2,23)=86.738),P<0.01)。LSD多重比较结果表明(表 3)普通鸬鹚和渔鸥卵壳膜δ15N值差异无统计学意义,但普通鸬鹚与小云雀之间,渔鸥与小云雀卵壳膜之间δ15N值差异有高度统计学意义,普通鸬鹚和渔鸥卵壳膜δ15N值较小云雀卵壳膜δ15N值偏正。
|
变异来源 Source of variation | df | SS | MS | F |
| 组间 Between groups | 2 | 112.718 | 56.359 | 86.738** |
| 组内 Within group | 23 | 14.944 | 0.650 | |
| 总变异 Total | 25 | 127.662 |
易现峰等(2004)研究中5月采集测得小云雀胸肌的δ13C值(-23.76‰±0.32‰)与本文小云雀卵壳膜的δ13C值相差2.94‰,7月采集测得小云雀胸肌的δ13C值(-26.52‰±0.07‰)与本文小云雀卵壳膜的δ13C值相差5.72‰。对比2种样品的采样时间可以得出,卵壳膜与胸肌之间δ13C值的差异是由于采样时间的不同所造成的,小云雀卵壳膜的δ13C值更接近于5月采集胸肌样品的δ13C值,卵壳膜与肌肉的采样时间相近。
组织中稳定同位素值反应其所食食物的同位素标签,不同的组织具有不同的稳定性同位素组成特征,具有较快周转率的组织反映最近几天所食的食物信息,而较慢周转率的组织反映的是长时间段所食食物的平均值(Pearson et al., 2003)。对比杨月琴等(2009)的研究结果得出,普通鸬鹚和渔鸥的卵壳膜稳定同位素值δ13C、δ15N相差不大,普通鸬鹚卵壳膜相对于胸肌的稳定同位素值(δ13C:-23.19‰±0.18‰,δ15N:14.45‰±0.43‰),δ13C值仅有0.1‰的相差,而δ15N值仅相差0.05‰;渔鸥卵壳膜相对胸肌的稳定同位素值(δ13C:-23.97‰±0.35‰,δ15N:14.27‰±0.18‰),δ13C值相差0.23‰,δ15N值相差0.13‰。相对于肌肉,卵壳膜取材方便,且不会对研究对象造成伤害,因此在一些问题的研究中卵壳膜更具优势。 3.2 不同物种卵壳膜δ13C、δ15N差异来源 3.2.1 卵壳膜δ13C差异来源
动物组织中稳定同位素组成反映其所食食物中的同位素特征(Pearson et al., 2003)。小云雀卵壳膜的δ13C相对普通鸬鹚和渔鸥较富集,主要是由于3个物种的食性不同所致,小云雀成鸟为杂食性(易现峰等,2004),所食植物比例略大,多以杂草种子为食(吴毅等,1989),而普通鸬鹚和渔鸥以鱼类为主要食物。有文献报道,由于动物体内含有较高比例的脂肪,而脂肪中的δ13C相对贫乏,导致食肉动物相对食草动物的δ13C相对贫乏(Hobson,1995);食草动物在消耗糖类的过程中呼出较轻的12CO2,导致其体内δ13C富集(Schaffner & Swart,1991),进而其所产子代卵中的δ13C富集。因此,食肉动物相对食草动物卵壳膜的δ13C较贫乏。
不同栖息环境下的个体δ13C值不同,有关红尾鸲的研究结果显示,生活在潮湿森林的个体相对于湿度较低环境下的个体δ13C较贫乏(Hobson,1999)。根据生活在质量较高的栖息环境相对于质量较低的栖息环境的生物体的δ13C较贫乏,可以得出普通鸬鹚和渔鸥的栖息环境较小云雀栖息环境好(Marra et al., 1998;Norris et al., 2005)。
处于不同食物链类型中的消费者δ13C值不同,有关肉食性鸟类在不同食物链类型中的研究结果显示,处于C3植物食物链中的鸟类组织δ13C取值范围为-28.1‰~-17.4‰,而海洋食物链中鸟类组织δ13C取值范围为-21.0‰~-13.7‰(Kelly,2000),根据同位素混合原理可推测出,普通鸬鹚和渔鸥处于C3植物食物链中。这与李明财等(2004)利用δ13C对青藏高原高寒地区20科38属62种植物光合类型的确定,得出的光合类型均属于C3植物,没有C4植物或CAM植物的结果相一致。卵壳膜稳定同位素特征是物种对环境长期适应的结果,其同位素值可以反映特定的环境值。 3.2.2 卵壳膜δ15N差异来源
在食物网中,消费者δ15N值相对其食物富集3‰~5‰(Post,2002;Griffith,2004)。渔鸥与普通鸬鹚卵壳膜δ15N之间差异无统计学意义,表明青海湖的渔鸥与普通鸬鹚处在同一营养级。这与青海湖湖区普通鸬鹚、棕头鸥Larus brunnicephalus、渔鸥和凤头Podiceps cristatus处在最高的营养级群体的结论相一致(杨月琴等,2009)。这也可能与青海湖区渔鸥和普通鸬鹚的活动范围存在大量重叠有关(张国钢等,2008)。稳定同位素δ15N、δ13C的变化间接地指示物种的生态位宽度(Herzka et al., 2013),而普通鸬鹚与渔鸥卵壳膜之间δ15N值差异无统计学意义,说明它们在青海湖区域存在一定的生态位重叠。小云雀卵壳膜的δ15N值相对渔鸥和普通鸬鹚偏负4.69‰,5.15‰,说明小云雀与普通鸬鹚和渔鸥之间相差至少一个营养级。同一物种不同个体间的稳定同位素δ13C、δ15N存在一定波动性,可能与母体产卵过程中取食的主要食物不同有关(Oppel et al., 2009),不同个体间存在一定的取食偏好(Ito et al., 2012)。
致谢:感谢青海省林业厅、西藏自治区林业厅、青海湖国家级自然保护区管理局对本研究在样品采集过程中的支持。| "蔡德陵, 张淑芳, 唐启升, 等. 2003. 鲈鱼新陈代谢过程中的碳氮稳定同位素分馏作用[J]. 海洋科学进展, (3):308-317. |
| 丛日杰. 2013. 利用稳定性同位素氘建立斑背大尾莺的迁徙连接(migration connectivity)[D]. 哈尔滨:东北林业大学. |
| 高永文, 鲁安怀, 宋玉国. 2004. 鱼耳石的碳、氧稳定同位素成分研究[J]. 自然科学进展, 14(3):30-34. |
| 侯元生, 何玉邦, 星智, 等. 2009. 青海湖国家级自然保护区水鸟的多样性及分布[J]. 动物分类学报, 34(1):184-187. |
| 金岳, 陈新军, 李云凯, 等. 2014. 基于稳定同位素技术的北太平洋柔鱼角质颚信息[J]. 生态学杂志, (8):2101-2107. |
| 李明财, 易现峰, 李来兴, 等. 2004. 基于稳定碳同位素技术研究青藏高原东部高寒区植被的光合型[J]. 西北植物学报, 24(6):1052-1056. |
| 李英年, 赵新全, 曹广民, 等. 2004. 海北高寒草甸生态系统定位站气候、植被生产力背景的分析[J]. 高原气象, 23(4):558-567. |
| 刘晓玲. 2012. 牛尾毛稳定同位素分析在牛肉产地溯源中的应用研究[D]. 陕西杨凌:西北农林科技大学. |
| 刘泽鑫. 2008. 关中地区牛肉产地同位素溯源技术的研究[D]. 江苏无锡:江南大学. |
| 马冬红, 王锡昌, 刘利平, 等. 2012. 稳定氢同位素在出口罗非鱼产地溯源中的应用[J]. 食品与机械, 28(1):5-7. |
| 宋大伟, 李明财, 李来兴, 等. 2007. 高寒草甸消费者种群稳定碳、氮同位素组成的海拔分异[J]. 生态学杂志, 26(1):40-45. |
| 王微. 2011. 基于稳定同位素方法的中国林蛙陆生食物链研究[D]. 长春:东北师范大学. |
| 吴毅, 袁重桂, 张世学. 1989. 小云雀的食性[J]. 四川动物, 8(2):36. |
| 杨月琴, 易现峰, 李宁. 2009. 利用稳定同位素技术分析青海湖优势水鸟的营养级结构[J]. 动物学研究, 30(4):418-422. |
| 易现峰, 张晓爱, 李来兴, 等. 2004. 高寒草甸生态系统食物链结构分析——来自稳定性碳同位素的证据[J]. 动物学研究, 25(1):1-6. |
| 张国钢, 刘冬平, 江红星, 等. 2008. 青海湖四种繁殖水鸟活动区域的研究[J]. 生物多样性, 16(3):279-287. |
| 赵亮, 张晓爱, 李来兴, 等. 2002. 角百灵和小云雀的孵化行为[J]. 动物学报, 48(5):695-699. |
| 郑传伟, 徐承香, 黎道洪, 等. 2014. 贵州黑洞内红点齿蟾组织和器官的碳氮稳定同位素分析[J]. 四川动物, 33(4):498-504. |
| Barquete V, Strauss V, Ryan PG. 2013. Stable isotope turnover in blood and claws:a case study in captive African penguins[J]. Journal of Experimental Marine Biology and Ecology, 448:121-127. |
| Boon P, Watt PW, Smith K, et al. 2001. Day length has a major effect on the response of protein synthesis rates to feeding in growing Japanese quail[J]. Journal of Nutrition, 131(2):268-275. |
| Denadai JC, Ducatti C, Sartori JR, et al. 2008. The traceability of animal meals in layer diets as detected by stable carbon and nitrogen isotope analyses of eggs[J]. Braz J Poultry Sci, 10(3):189-194. |
| Giardina MA, Neme GA, Gil AF. 2014. Rheidae egg human exploitation and stable isotopes:trends from west central Argentina[J]. International Journal of Osteoarchaeology, 24(2):166-186. |
| Griffith GW. 2004. The use of stable isotopes in fungal ecology[J]. Mycologist, 18(Part 4):177-183. |
| Herzka SZ, Mellink E, Talley DM, et al. 2013. Stable isotope ratios of egg albumen of three waterbird species nesting in the colorado river delta indicate differences in foraging ground and isotopic niche breadth[J]. Aquatic Conservation-Marine and Freshwater Ecosystems, 23(4):546-563. |
| Hobson KA. 1995. Reconstructing avian diets using stable-carbon and nitrogen isotope analysis of egg components-patterns of isotopic fractionation and turnover[J]. The Condor, 97(3):752-762. |
| Hobson KA. 1999. Tracing origins and migration of wildlife using stable isotopes:a review[J]. Oecologia, 120(3):314-326. |
| Hobson KA, Clark RG. 1992. Assessing avian diets using stable isotopes Ⅰ:turnover of 13C in tissues[J]. The Condor, 94(1):181-188. |
| Hobson KA, Barnett-Johnson R, Cerling T. 2010. Using isoscapes to track animal migration[M]. Heidelberg:Springer Netherlands:273-298. |
| Hobson KA, McFarl KP, Wassenaar LI, et al. 2001. Linking breeding and wintering grounds of bicknell's thrushes using stable isotope analyses of feathers[J]. Auk, 118(1):16-23. |
| Hobson KA, Piatt JF, Pitocchelli J. 1994. Using stable isotopes to determine seabird trophic relationships[J]. J Anim Ecol, 63(4):786-798. |
| Ito M, Kazama K, Niizuma Y, et al. 2012. Prey resources used for producing egg yolks in four species of seabirds:insight from stable-isotope ratios[J]. Ornithological Science, 11(2):113-119. |
| Kelly JF. 2000. Stable isotopes of carbon and nitrogen in the study of avian and mammalian trophic ecology[J]. Canadian Journal of Zoology-Revue Canadienne De Zoologie, 78(1):1-27. |
| Mabee TJ. 1997. Using eggshell evidence to determine nest fate of shorebirds[J]. Wilson Bulletin, 109(2):307-313. |
| Marra PP, Hobson KA, Holmes RT. 1998. Linking winter and summer events in a migratory bird by using stable-carbon isotopes[J]. Science, 282(5395):1884-1886. |
| McKinnon EA, Fraser KC, Diamond AW, et al. 2012. Stable-hydrogen isotope turnover in red blood cells of two migratory thrushes:application to studies of connectivity and carry-over effects[J]. Journal of Field Ornithology, 83(3):306-314. |
| Muñoz-Gil J, Marín-Espinoza G, Andrade-Vigo J, et al. 2012. Trophic position of the neotropic cormorant (Phalacrocorax brasilianus):integrating diet and stable isotope analysis[J]. Journal of Ornithology, 154(1):13-18. |
| Norris DR, Marra PP, Kyser T, et al. 2005. Tracking habitat use of a long-distance migratory bird, the American redstart Setophaga ruticilla, using stable-carbon isotopes in cellular blood[J]. Journal of Avian Biology, 36(2):164-170. |
| Oppel S, Powell AN, O'Brien DM. 2009. Using eggshell membranes as a non-invasive tool to investigate the source of nutrients in avian eggs[J]. J Ornithol, 150(1):109-115. |
| Pearson SF, Levey DJ, Greenberg CH, et al. 2003. Effects of elemental composition on the incorporation of dietary nitrogen and carbon isotopic signatures in an omnivorous songbird[J]. Oecologia, 135(4):516-523. |
| Phillips RA, Bearhop S, McGill RA, et al. 2009. Stable isotopes reveal individual variation in migration strategies and habitat preferences in a suite of seabirds during the nonbreeding period[J]. Oecologia, 160(4):795-806. |
| Polito MJ, Fisher S, Tobias CR, et al. 2009. Tissue-specific isotopic discrimination factors in gentoo penguin (Pygoscelis papua) egg components:implications for dietary reconstruction using stable isotopes[J]. J Exp Mar Biol Ecol, 372(1-2):106-112. |
| Post DM. 2002. Using stable isotopes to estimate trophic position:models, methods, and assumptions[J]. Ecology, 83(3):703-718. |
| Schaffner FC, Swart PK. 1991. Influence of diet and environmental water on the carbon and oxygen isotopic signatures of seabird eggshell carbonate[J]. Bulletin of Marine Science, 48(1):23-38. |
| Tsahar E, Wolf N, Izhaki I, et al. 2008. Dietary protein influences the rate of n-15 incorporation in blood cells and plasma of yellow-vented bulbuls (Pycnonotus xanthopygos)[J]. Journal of Experimental Biology, 211(3):459-465." |
 2015, Vol. 34(5)
2015, Vol. 34(5)




