扩展功能
文章信息
- 章迪, 王政昆, 姜文秀, 朱万龙
- ZHANG Di, WANG Zhengkun, JIANG Wenxiu, ZHU Wanlong
- 横断山区高山姬鼠臼齿特征的研究
- Characteristics of the Molars of Apodemus chevrieri from Hengduan Mountain Region
- 四川动物, 2015, 34(5): 656-662
- Sichuan Journal of Zoology, 2015, 34(5): 656-662
- 10.11984/j.issn.1000-7083.20140375
-
文章历史
- 收稿日期:2014-08-27
- 接受日期:2015-04-08
2. 云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室, 昆明 650500
2. Key Laboratory of Colleges and Universities on Ecosystems of Southwestern Mountain and Ecological Adaptive Evolution and Protection of Animals-plants in Yunnan Province, Kunming 650500, China
近年来,几何形态测量技术不断地发展和完善,已经成为研究种间、种内形态分化的重要手段。其基本步骤是选定研究的几何形态结构,按一定规则进行测量,将测量结果转换成数字信息,并对所得到的数字信息进行统计分析(Sabrina et al., 2002)。该技术的优点是对生物形态特征进行定量比较分析研究,并且仅需要考虑样本的形态变化,而不需要考虑标本实际大小,已经在啮齿动物中得到了广泛的应用(Figueirido et al., 2009; Heidi et al., 2009;Nagorsenl & Cardini,2009)。
生物通过自然选择适应环境,对形态和功能关系的检测将有利于解释适应和行为之间的相互关系,臼齿因其是生物体和环境相互作用的直接契合点,所以在研究生物对环境的适应上有重要的意义。通过对现存动物类群牙形态的研究,有利于进一步了解形态和环境之间的相互关系(Jess,2009)。臼齿形态反映的是动物食性问题,对臼齿形态的研究可以深入地了解动物与其生活环境、食性之间的关系。目前已有很多研究显示臼齿在研究动物与其生活环境的适应关系及其分类和演化方面有重要的意义(Piras et al., 2009),对臼齿的研究也有较多的报道(Julia et al., 2008)。
在横断山从北到南的地理区域内,植被、温度等生态因子发生了变化,小型哺乳动物头骨的形态也发生了较明显的变异,臼齿是头骨中重要的部分,但目前对高山姬鼠Apodemus chevrieri臼齿的研究较少,故本文采用几何形态测量技术对其第一、第二、第三上臼齿和第一、第二、第三下臼齿进行了研究,以探讨高山姬鼠臼齿和生活环境之间的关系。姬鼠属Apodemus是分布于欧亚大陆温带最常见的小型啮齿动物,是研究生物地理分布特征和适应模式最好的材料之一。高山姬鼠属于姬鼠属,起源于古北界,为我国特有种,主要分布于云南、四川、贵州、湖北、甘肃、陕西的一些地区;云南省主要分布于昭通、昆明、丽江、大理、澜沧江和怒江流域地区。一般栖息于灌丛、农田和次生林,穴居,夜行性动物,为纯植物食性鼠类,喜食稻谷、玉米、草籽、树种子等,是农业和林业主要害鼠。横断山地处青藏高原东南部,山脉南北走向,地势西高东低,高山深谷相对,海拔变化较大,形成明显的气候过渡地带,为动物的生存提供了多种多样的立体栖息环境。广泛分布于此的高山姬鼠,其臼齿形态可能随环境的变化而变化,这种变化可能反映了该地区特殊的地理和气候特征。 章迪等:横断山区高山姬鼠臼齿特征的研究 1 材料与方法 1.1 样品材料
高山姬鼠的头骨样本来自中国科学院昆明动物研究所馆藏标本,均为成年个体,共96个(云南中甸:1089,1094,1093,1092,810478,810479,810481,810482,810483,810484,810485,810486,810488,810489,810477,810476,810475,810464,810462,810444,810443,810433,810432,810429;云南景东:811672,811643,811646,811647,811614,811616,811671,811659,811655,811652,811654,811644,811641,811640,811639,811633,811615,811625,811626,811627,811628;云南宁蒗:810757,810771,810769,810768,810767,810756,810758,810759,810760,810762,810764,810765,810766,810743,810742,810741,810725,810724,810723,810721,810722,810719;四川巴塘:810371,810370,810368,810360,810359,810333,810332,810331,810322,810314,810372,810377,810378,810379,810381,8103782,810383,810384,810386,810387,810388,810389,810390,810391,1069,1070,1071,1072,1068),分别来自四川巴塘29个(98°58′~99°45′E,28°46′~30°38′N,海拔2600 m)、云南景东21个(100°22′~101°15′E,23°56′~24°29′N,海拔2100 m)、云南中甸24个(99°20′~100°19′E,26°52′~28°52′N,海拔2470 m)、云南宁蒗22个(100°21′~101°16′E,26°35′~27°56′N,海拔2650 m)(图 1)。四川巴塘地处横断山脉东北边缘,是丘原向山原的过渡地带,属青藏高原的一部分,高山寒温带气候,冬长夏短,日照长,辐射强,年日照时数2453 h,年平均气温5.6 ℃,年平均降水量485 mm,无霜期183 d;云南景东位于横断山南端,属于亚热带季风性气候,夏无酷暑,雨量集中,干湿分明,雨热同季,年平均气温18.3 ℃,年平均降水量1086.7 mm,年日照时数2131.6 h,无霜期355 d;云南中甸地处青藏高原南缘、横断山脉中段,立体气候明显,年平均气温6.7 ℃,年平均降水量618.4 mm,年日照时数2180.3 h,无霜期121 d;云南宁蒗地处滇西北横断山脉中段,属典型山原地貌,气候属低纬高原季风区,干湿季分明,受高原和高山峡谷地形的影响,立体气候明显,年均降雨量920 mm,年日照时数2298 h,年均无霜期190 d,年均气温12.7 ℃。4个地区的植被类型:巴塘是针叶林,中甸和宁蒗是温带落叶阔叶林,景东是常绿阔叶林。气候和植被类型的差异可能会导致4个地区的食物条件有所不同。
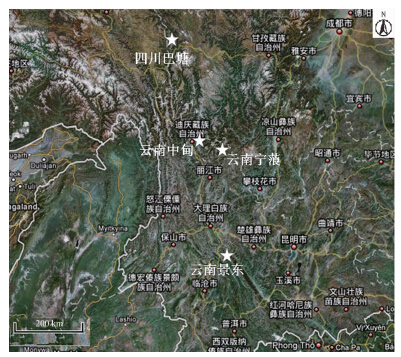
|
| 图 1 高山姬鼠采样点分布 Fig. 1 The location of Apodemus chevrieri samples |
Cardini等(2005)提出性二型在考虑样本大小时表现出极大的影响,而在研究样本形态时可以被忽略。本文仅研究样本形态的差异,所以忽略样本性别,统一计数。 1.2 方法
用Cannon A720IS数码相机距离头骨10 cm以微距拍摄臼齿。用TPSDIG 2软件对获得的图片进行数字化(Rohlf,1990)处理。根据相关兽类下颌和臼齿的标记方法(Caumul & Poll,2005;Cardini et al., 2005)并结合高山姬鼠臼齿的实际形态,对相应的照片进行打点标记(图 2,图 3)。界标点被数字化处理后获得相应的坐标数据。为避免重复数据的产生,本文仅对样本的右面结构进行标记。为保证界标的准确性,每个标记均由同一人重复标记6次以上,所得到的均值坐标数据用于后面的统计分析。采用广义普鲁克分析(generalized procrustes analysis,GPA)对界标点布局进行叠印,去除非形态变异对分析的干扰。用薄片样条法(thin plate spline,TPS)描述形态变形。
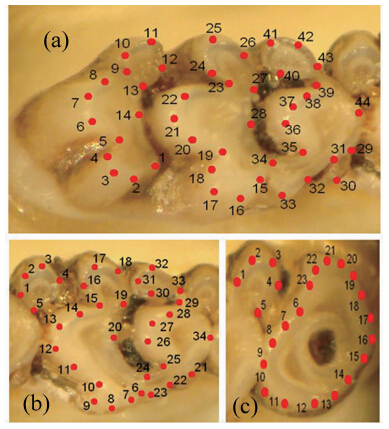
|
| 图 2 高山姬鼠的第一上臼齿(a)、第二上臼齿(b)、第三上臼齿(c)界标点图 Fig. 2 L and mark configurations on the crown of the upper first molar (a),the upper second molar(b) and the upper third molar(c)of Apodemus chevrieri |

|
| 图 3 高山姬鼠的第一下臼齿(a)、第二下臼齿(b)和第三下臼齿(c)界标点标记图 Fig. 3 L and mark configurations on the crown of the lower first molar(a),the lower second molar(b) and the lower third molar(c)of Apodemus chevrieri |
用SPSS 15.0将下颌侧面和3个上臼齿分析所得到的前3个主成分值各自做主成分分析,将第一、第二、第三上臼齿数据信息组合起来可以代表整个头骨的形态特征,3组数据组合后所得矩阵进行多维尺度分析。下臼齿也分别作相应的分析。 2 结果 2.1 第一上臼齿分析
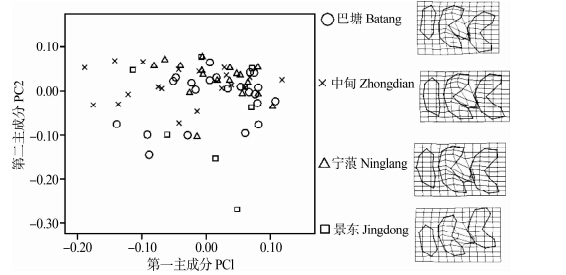
以横断山由北到南的巴塘、宁蒗、景东3个地区高山姬鼠的第一上臼齿做主成分分析,对第一主成分和第二主成分作图(图 4),结果显示巴塘地区高山姬鼠的第一上臼齿样本与宁蒗和景东2个地区的重叠相对较少,宁蒗和景东重叠较多,即巴塘种群第一上臼齿发生了一定的变异;TPS显示3个地区的第一上臼齿形变主要发生在第二、第三横嵴的中间齿突。
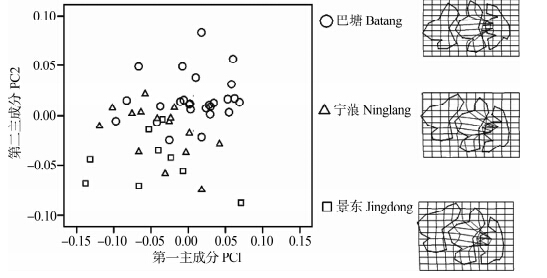
|
| 图 4 高山姬鼠第一上臼齿第一主成分和第二主成分散点图及薄片样条分析 Fig. 4 Plots of principal component factors 1 and 2 for upper first molar and TPS of Apodemus chevrieri |
对巴塘、宁蒗、景东3个地区高山姬鼠的第二上臼齿的第一主成分和第二主成分作图(图 5),结果显示巴塘地区高山姬鼠第二上臼齿样本与宁蒗和景东2个地区的重叠相对较少,宁蒗和景东重叠相对较多,即巴塘种群第二上臼齿发生了一定的变异;TPS显示3个地区的第二上臼齿形变主要发生在第二、第三横嵴的齿突间。
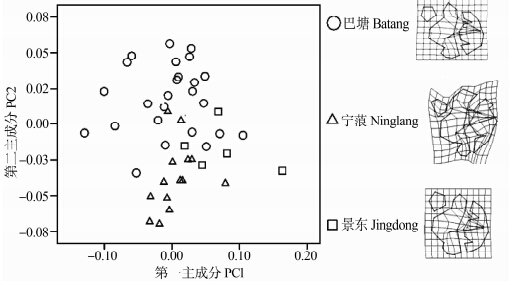
|
| 图 5 高山姬鼠第二上臼齿第一主成分和第二主成分散点图及薄片样条分析 Fig. 5 Plots of principal component factors 1 and 2 for upper second molar and TPS of Apodemus chevrieri |
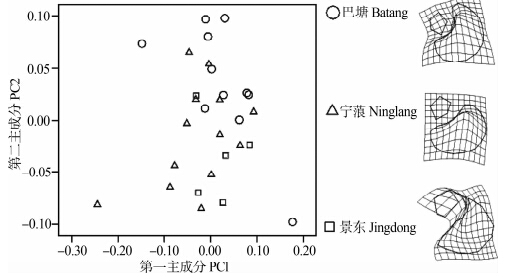
对巴塘、宁蒗、景东3个地区高山姬鼠的第三上臼齿的第一主成分和第二主成分作图(图 6),结果显示3个地区的第三上臼齿样本都有部分交互重叠,即3个地区第三上臼齿变异较小;TPS显示3个地区的第三上臼齿形变主要发生在第二横嵴的齿突间。
|
| 图 6 高山姬鼠第三上臼齿第一主成分和第二主成分散点图及薄片样条分析 Fig. 6 Plots of principal component factors 1 and 2 for upper third molar and TPS of Apodemus chevrieri |
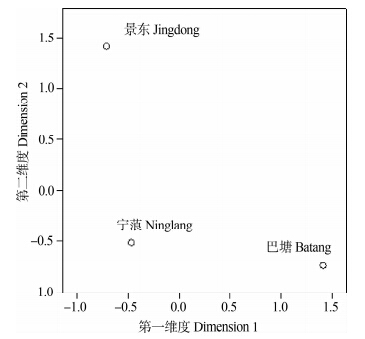
将相同采集地臼齿样本的第一上臼齿、第二上臼齿、第三上臼齿的数据整合得到代表巴塘、宁蒗和景东样本的数据,经多维尺度分析可以看出(图 7):3个地区的高山姬鼠有明显差异。将图 7与4个地区的地理位置比较:在第一维度方向上,巴塘、宁蒗和景东的相对位置与3个地区的经度相关,故估计高山姬鼠上臼齿的变异可能受到经度变化的影响;在第二维度方向上,巴塘、宁蒗和景东的相对位置与3个地区的纬度相关,故估计3个地区上臼齿的差异可能受到纬度变化的影响。
|
| 图 7 高山姬鼠各采样点上臼齿组合数据的多维尺度分布图 Fig. 7 Diagram of MDS for combined datasets of upper molars of Apodemus chevrieri in different regions |
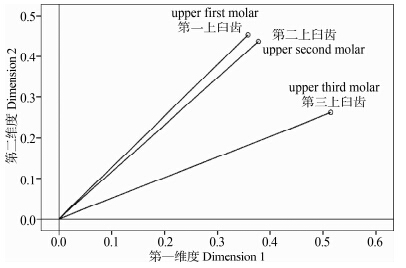
从个体权重空间分布图(图 8)可以看出,第一臼齿(0.358,0.453)和第二臼齿(0.378,0.437)的评分对第二维度的贡献较大;第三臼齿(0.514,0.262)的评分对第一维度的贡献较大。
|
| 图 8 高山姬鼠第一、第二和第三上臼齿个体权重空间分布图 Fig. 8 Dimension weights for upper first molar,upper second molar and upper third molar of Apodemus chevrieri |
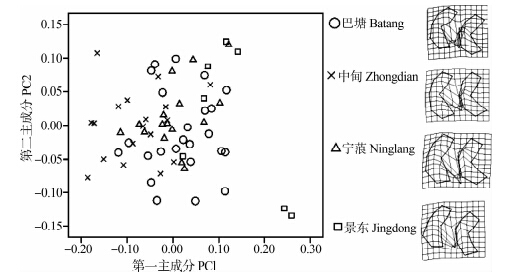
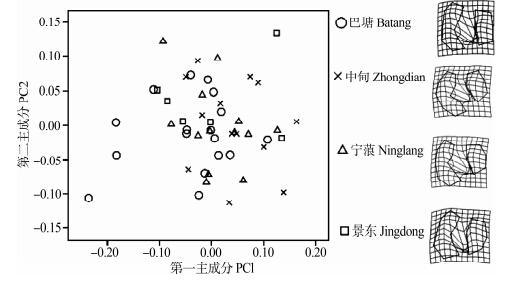
分别对4个地区高山姬鼠的第一、第二、第三下臼齿的第一主成分和第二主成分分别作图,结果显示4个地区的第一、第二、第三下臼齿样本的重叠均较高,即4个地理种群的下臼齿变异较小(图 9~图 11),TPS显示各臼齿齿叶间有少量的形态变异。
|
| 图 9 高山姬鼠第一下臼齿第一主成分和第二主成分散点图及薄片样条分析 Fig. 9 Plots of principal component factors 1 and 2 for lower first molar and TPS of Apodemus chevrieri |
|
| 图 10 高山姬鼠第二下臼齿第一主成分和第二主成分散点图及薄片样条分析 Fig. 10 Plots of principal component factors 1 and 2 for lower second molar and TPS of Apodemus chevrieri |
|
| 图 11 高山姬鼠第三下臼齿第一主成分和第二主成分散点图及薄片样条分析 Fig. 11 Plots of principal component factors 1 and 2 for lower third molar and TPS of Apodemus chevrieri |
目前已有在不同水平层次对臼齿的大量研究报道,其中有对研究方法的探讨,也有对环境适应和功能动力学的研究(Ungar,1998;Teaford,2000)。如在寻找适合用于臼齿功能研究的方法中发现,Microwear法适用于研究动物的取食行为(Ungar et al., 2003;Godfrey et al., 2004;Semprebon et al., 2004),比较定性法适合用于寻找对牙齿(特别是臼齿)功能起决定作用的因子(Ungar et al., 2003,2004);对牙齿功能的研究主要集中在探讨咀嚼的动力来源和模式上(Hiiemae,1984;Evans & Sanson,2003;Evans,2005)。利用上臼齿的14个标记研究了A. agrarius,A. epimelas,A. flavicollis,A. sylvaticus,A. uralensis和A. alpicola,发现A. agrarius与其他物种之间的差异较大,其臼齿更加细长。因为早先A. atavus、 A. orientalis、A. dominans的臼齿宽且坚固,推测A. agrarius可能由这方面起源。在Sylvaemus亚属中,A. epimelas与其他4种不同,其拥有更加坚固且更长的第二臼齿。最终得出结论发现物种间的臼齿形状有异速增长关系,臼齿的坚固程度与臼齿大小呈负相关(Renaud & Michaux,2007)。
在对动物形态变异的研究中发现,纬度可能是一个重要的因子(Yom-Tov et al., 1999)。在对臼齿的研究中发现,在种群水平上,虽然其和身体大小没有密切的关系,但是和取食密切相关。在对小林姬鼠A. sylvaticus的研究中发现,下颌和臼齿在种群水平上的变异和取食行为有关,且与咀嚼过程直接相关。纬度改变了下颌的宽度,冠状突和角状突也有了极大的发展。Renaud和Michaux(2003)的研究认为这和日摄食量的变化有关。在对小林姬鼠的研究中也发现第一下臼齿有变宽的趋势,这主要与小林姬鼠取食植物有关,加宽的臼齿面增大了食物的咀嚼面,也增大含纤维较大食物的摩擦力(Renaud & Michaux,2004;Renaud,2005),而且这种规律在许多亲缘较近的姬鼠属物种中也有发现。但在对旱獭Marmota baibacina的研究中发现臼齿与食物之间的关系密切,但是食物对臼齿的生态表型变异影响较小,有两个主要原因:其一,当牙齿从牙龈中长出之前,它表层的釉质就不能再生长和改变了;其二,臼齿受环境选择压力的影响较低,特别是对一系列差异不大的食物,臼齿的功能是相同的(Caumul & Poll,2005)。本研究结果表明横断山地区高山姬鼠的上臼齿形态变异较大,下臼齿变异较小。
综上所述,横断山各地区间高山姬鼠臼齿形态发生了一定的变异,这可能与其取食的食物和生存的环境有关。但究竟是受食物数量还是质量的影响,有待进一步研究。
| "Cardini A, Hoffmann RS, Thorington RW. 2005. Morphological evolution in marmots (Rodentia, Sciuridae):size and shape of the dorsal and lateral surfaces of the cranium[J]. Journal Zool Syst Evolutionary Res, 43(3):258-268. |
| Caumul R, Poll PD. 2005. Phylogenetic and environmental components of morphological variation:skull, mandible and molar shape in marmots (Marmota, Rodentia)[J]. Evolution, 59(11):2460-2472. |
| Evans AR, Sanson GD. 2003. The tooth of perfection:functional and spatial constraints on mammalian tooth shape[J]. Biol J Linn Soc Lond, 78:173-191. |
| Evans AR. 2005. Connecting morphology, function, and tooth wear in microchiroperans[J]. Biol J Linn Soc Lond, 85:81-96. |
| Figueirido B, Palmqvist P, Perez-Claros JA. 2009. Ecomorphological correlates of craniodental variation in bears and paleobiological implications for extinct taxa:an approach based on geometric morphometrics[J]. Journal of Zoology, 277:70-80. |
| Godfrey LR, Semprebon GM, Jungers WL, et al. 2004. Dental use wear in extinct lemurs:evidence of diet and niche differentiation[J]. J Hum Evol, 47:145-169. |
| Heidi S, Polly PD, Jonathan DK, et al. 2009. Differential sexual dimorphism:size and shape in the cranium and pelvis of grey foxes (Urocyon)[J]. Biological Journal of the Linnean Society, 96:339-353. |
| Hiiemae KM. 1984. Functional aspects of primate jaw morphology[M]. New York:Plenum Press:257-281. |
| Jess W. 2009. Geometric morphometric investigation of molar shape diversity in modern lemurs and lorises[J]. The Anatomical Record, 292:701-719. |
| Julia C, Boughner M, Christopher D. 2008. Mandibular shape, ontogeny and dental development in Bonobos (Pan paniscus) and chimpanzees (Pan troglodytes)[J]. Evol Biol, 35:296-308. |
| Nagorsen DW, Cardini A. 2009. Tempo and mode of evolutionary divergence in modern and Holocene Vancouver Island marmots (Marmota vancouverensis) (Mammalia, Rodentia)[J]. Journal Zool Syst Evolutionary Res, 47(3):1-10. |
| Piras P, Marcolini F, Raia P, et al. 2009. Testing evolutionary stasis and trends in first lower molar shape of extinct Italian populations of Terricola savii (Arvicolidae, Rodentia) by means of geometric morphometrics[J]. Journal Evolutionary Biology, 22:179-191. |
| Rohlf FJ. 1990. Tpspline:a program to compare two shapes using a thin-plate spline, department of ecology and evolution[M]. New York:State University of New York at Stony Brook:11794. |
| Renaud S. 2005. First upper molar and mandible shape of wood mice (Apodemus sylvaticus) from northern Germany:ageing, habitat and insularity[J]. Mammalian Biology, 3:157-170. |
| Renaud S, Michaux JR. 2003. Adaptive latitudinal trends in the mandible shape of Apodemus wood mice[J]. Journal of Biogeography, 30:1617-1628. |
| Renaud S, Michaux JR. 2004. Parallel evolution in molar outline of murine rodents:the case of the extinct Malpaisomys insularis (Eastern Canary Islands)[J]. Zoological Journal of the Linnean Society, 142:555-572. |
| Renaud S, Michaux JR. 2007. Mandibles and molars of the wood mouse, Apodemus sylvaticus (L.):integrated latitudinal pattern and mosaic insular evolution[J]. Journal of Biogeography, 34:339-355. |
| Sabrina V, Ombretta S, Lei Y. 2002. Regulation of endothelial cell branching morphogenesis by endogenous chemokine stromal-derived factor-1[J]. Blood, 99:2703-2711. |
| Semprebon GM, Godfrey LR, Solounias N, et al. 2004. Can low-magnification stereomicroscopy reveal diet?[J]. J Hum Evol, 40(47):115-144. |
| Teaford MF. 2000. Primate dental functional morphology revisited[M]. Cambridge:Cambridge University Press:290-304. |
| Ungar P. 1998. Dental allometry, morphology, and wear as evidence for diet in fossil primates[J]. Evol Anthropol, 6:205-217. |
| Ungar P, Brown CA, Bergstrom TS, et al. 2003. Quantification of dental microwear by tandem scanning confocal microscopy and scale-sensitive fractal analysis[J]. Scanning, 25:185-193. |
| Ungar P, Teaford M, Kay R. 2004. Molar microwear and shearing crest development in Miocene catarrhines[J]. Anthropologie, 42:21-35. |
| Yom-Tov Y, Yom-Tov S, Moller H. 1999.Competition, coexistence, and adaptation amongst rodent invaders to Pacific and New Zealand islands[J]. Journal of Biogeography, 26(5):947-958." |
 2015, Vol. 34(5)
2015, Vol. 34(5)




