扩展功能
文章信息
- 张婧, 杨承忠, 赵元莙
- ZHANG Jing, YANG Chengzhong, ZHAO Yuanjun
- 碘泡科(粘体门:粘孢子纲:双壳目)动物的系统分类学研究
- Advances in Systematics of Myxobolidae (Myxozoa: Myxosporea: Bivalvulida)
- 四川动物, 2015, 34: 474-480
- Sichuan Journal of Zoology, 2015, 34: 474-480
- 10.3969/j.issn.1000-7083.2015.03.030
-
文章历史
- 收稿日期:2015-01-09
- 接受日期:2015-02-10
粘孢子虫Myxosporidia是一类种类繁多分布广泛的后生动物寄生虫,其主要寄主为鱼类(Kent et al.,2001;Canning & Okamura,2004;Lom & Dyková,2006),也有少数寄生于环节动物、昆虫、两栖动物、爬行动物和哺乳动物等(赵元莙,宋微波,2003a;Canning et al.,2004;索栋,赵元莙,2010)。粘孢子虫可寄生于鱼体几乎所有部位:寄生在鱼体表和鳍条上,可形成许多灰白色点状或瘤状孢囊;寄生在鱼鳃上,也可形成孢囊,致鳃组织受损,呼吸困难;寄生在肠道,可形成大量的孢囊,破坏肠粘膜组织,肠壁糜烂成白色;寄生在神经系统和感觉器官上,可形成白色孢囊,病鱼尾部上翘,狂游乱窜。粘孢子虫病是鱼类养殖生产中危害较大的一类疾病,爆发时会造成大面积的养殖鱼类死亡,给渔业带来损失,从而引起了人们的广泛关注。
自1825年Jurine从莱芒湖白鲑Coregonus fera的肌肉中发现粘孢子虫以来,相关研究已有190年的历史,其中绝大多数为分类学。迄今,全世界已记述的粘孢子虫约62属2200多种(Lom & Dyková,2006;李媛,2009;赵元莙,宋微波,2009),我国记载有600余种(陈启鎏,马成伦,1998)。这些种类的分类鉴定依据主要为成熟孢子的形态学特征。由于粘孢子虫个体微小、结构简单、多样性丰富、种间相似性高,常常给鉴定带来较大的困难,致使很多种类和类群的分类学问题一直存在争议和混乱,学者们曾经也依据不同的标准提出了多个分类系统(Levine et al.,1980;Lom & Dykova,1992;陈启鎏,马成伦,1998;Kent et al.,2001;赵元莙,宋微波,2003b)。
广义的碘泡虫是泛指孢质内包含有嗜碘泡的一类粘孢子虫,狭义的则指碘泡科的种类。碘泡科Myxobolidae Thélohan,1892是粘孢子虫纲最大的一科,该科动物及其相关类群在属和种阶元的归属问题上一直备受争议。本文对广义碘泡虫相关类群的分类学问题进行综述,以期为该科动物的系统发生、分类进化和鱼类粘孢子虫病的防治提供基础资料。1 碘泡科属级阶元分类争议
碘泡科动物形态各异、种类繁多,在粘孢子虫分类系统中占据非常重要的地位。但该科下面的种和属阶元的分类学问题一直比较混乱。依据Levine等(1980)提出的原生动物分类系统,碘泡科包含碘泡虫属Myxobolus、侧尾虫属Leterocaudata、霍氏虫属Hoferellus、尾孢虫属Henneguya、足孢虫属Podopspora、单尾虫属Unicauda和三角孢子虫属Trigonosporous。而在陈启鎏等于1981年提出的分类系统中,把碘泡虫属Myxobolus、霍氏虫属Hoferellus、三角孢子虫属Trigonosporous、尾孢虫属Henneguya、单尾虫属Unicauda、旋缝虫属Spirosuturia、侧尾虫属Leterocaudata和足孢虫属Podopspora归到碘泡科Myxobolidae中。Lom和Dyková(1992)则认为碘泡虫属Myxobolus、旋缝虫属Spirosuturia、单尾虫属Unicauda、双尾虫属Dicauda、焰孢虫属Phlogospora、侧尾虫属Leterocaudata、尾孢虫属Henneguya、似尾孢虫属Hennegoides、四尾虫属Tetrauronema、单极虫属Thelohanellus、新单极虫属Neothelohanellus、新尾孢虫属Neohenneguya和三角孢子虫属Trigonosporus属于碘泡科。陈启鎏和马成伦(1998)认为碘泡科Myxobolidae仅包含3个属,碘泡虫属Myxobolus、霍氏虫属Hoferellus和足孢虫属Podopspora,而把侧尾虫属Leterocaudata、尾孢虫属Henneguya和单尾虫属Unicauda归到尾孢虫科Caudasporidae中,四尾虫属Tetrauronema归到四尾虫科Tetrauronematidae,旋缝虫属Spirosuturia归到旋缝科Spirosuturidae,三角孢子虫属Trigonosporus归到三角孢子科Trigonosporidae,单极虫属Thelohanellus归到单级科Thelohanellidae。1.1 粘体虫属的归属问题
碘泡科种类的孢子由2壳瓣组成,2个极囊集中排列于孢子前端,变形虫状胚质含嗜碘泡,大部分种类是多孢子型的孢囊和多核型的营养体(Levine et al.,1980)。由于碘泡虫的胞质中含有明显嗜碘泡,可以有效地区分粘体虫属和碘泡虫属的种类(图版Ⅰ:A,B)。但随着粘孢子虫超微结构的深入研究,一些学者对嗜碘泡作为区分粘体虫属和碘泡虫属种类鉴别依据的有效性提出了质疑(Walliker,1968;吴英松,汪建国,2001)。有学者主张不采用嗜碘泡这一结构作为分类依据,除了碘泡科虫体的胞质中含有嗜碘泡而粘体科种类不含外,孢子的其他结构均相同,应将粘体虫属和碘泡虫属合并为单一的碘泡虫科和属(Walliker,1968)。另有学者在观察圆形碘泡虫孢子发生时发现嗜碘泡并不是碘泡科动物的固定结构,能否在碘泡虫中观察到明显的嗜碘泡可能是由能量的贮存量决定的,嗜碘泡不能作为一个稳定的分类依据(吴英松,汪建国,2001)。国际上现已取消了粘体科和粘体虫属,不再把嗜碘泡作为区分碘泡虫和粘体虫的基本特征,同时将粘体虫属下的种类也并入了碘泡虫属,这2个属合并后出现的同物异名现象也已经被修改(Land sberg & Lom,1991;Eiras et al.,2005)。
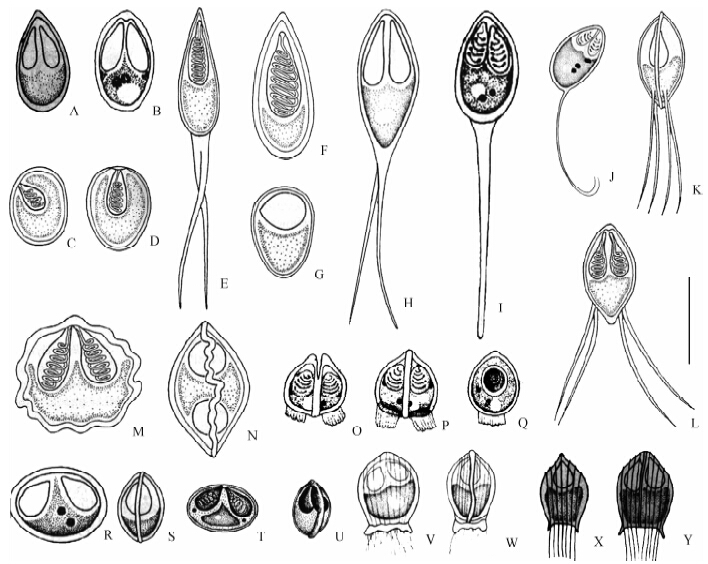
|
|
图版Ⅰ 碘泡科各属代表种形态
Plate Ⅰ The representative species of different genera of Myxobolidae
注: A. 粘体虫属代表种杜氏粘体虫Myxosoma dujardini壳面观(仿赵元莙,马成伦,1994); B. 碘泡虫属代表种穆勒碘泡虫Myxobolus müelleri壳面观(仿李连祥,倪达书,1973); C,D. Myxobolus irinae孢子壳面观单个极囊倾斜排列和位于孢子顶端(仿Shulman,1984); E. 焰孢虫属代表种Phlogospora mysti壳面观(仿Quadri,1962); F. 单极虫属代表种Thelohanellus jiroveci壳面观(仿 Kundu &Haldar,1981); G. 新单极虫属代表种Neothelohanellus indicus壳面观(仿Gupta & Khera,1988); H. 尾孢虫属代表种鲈尾孢虫Henneguya psorospermica壳面观(仿赵元莙,马成伦,1994); I. 单尾虫属代表种黄颡单尾虫Unicauda pelteobagrus壳面观(仿陈启鎏,马成伦,1998); J. 侧尾虫属代表种刺鳅侧尾虫Laterocaudata mastacembelus壳面观(仿陈启鎏,马成伦,1998); K. 四尾虫属代表种斗鱼四尾虫孢子缝面观,L. 孢子壳面观(仿吴宝华等,1988); M,N. 旋缝虫属代表种鲢旋缝虫孢子壳面观和缝面观(仿陈启鎏,谢杏人,1987); O,P,Q. 足孢虫属代表种斜颌鲴足孢虫Podospora plagiognathopis),O,P. 孢子缝面观,Q. 孢子壳面观(仿陈启鎏,谢杏人,1984); R,S. 宜宾碘泡虫壳面观和缝面观,T,U. 饼形碘泡虫孢子壳面观和缝面观(仿陈启鎏,马成伦,1998); V,W. 霍氏虫属代表种湖北霍氏虫壳面观和缝面观; X,Y. 冠孢虫代表种鲤冠孢虫壳面观和缝面观(仿陈启鎏,马成伦,1998)。标尺=10 μm。
Notes: A. Myxosoma dujardini in frontal view(after Zhao & Ma,1994); B. Myxobolus müelleri in frontal view(after Li & Ni,1973); C,D. Myxobolus irinae in frontal view,a single polar capsule apically or laterally located(after Shulman,1984); E. Phlogospora mysti in frontal view(after Quadri,1962); F. Thelohanellus jiroveci in frontal view(after Kundu & Haldar,1981); G. Neothelohanellus indicus in frontal view(after Gupta & Khera,1988); H. Henneguya psorospermica in frontal view(after Zhao & Ma,1994); I. Unicauda pelteobagrus in frontal view(after Chen & Ma,1998); J. Laterocaudata mastacembelus in frontal view(after Chen & Ma,1998); K,L. Tetrauronema macropodos in sutural view(K) and frontal view(L)(after Wu et al.,1988); M,N. Spirosuturia hypophihalmichthydis in frontal view(M) and sutural view(N)(after Chen & Xie,1987); O,P,Q. Podospora plagiognathopis in sutural view(O,P),in frontal view(Q)(after Chen & Xie,1984); R,S. Myxobolus yibinensis in frontal view(R) and sutural view(S); T,U. Myxobolus artus in frontal view(T) and sutural view(U)(after Chen & Ma,1998); V,W. Hoferellus hupehensis in frontal view(V) and sutural view(W)(after Chen & Ma,1998); X,Y. Mitraspora cyprini in frontal view(X) and sutural view(Y)(after Chen & Ma,1998). Bar=10 μm. |
新单极虫属由Das和Haldar(1986)建立,包括2个寄生于不同宿主的物种N. catlae和N. krishnagarensis。Lom和Dyková(1992)将其归到碘泡虫科中,但随后Sarkar和Misra(1996)通过对新单极虫属物种的形态特征详细研究后认为,这2个物种与另1个属Lomosporus的物种L. indicus(Gupta & Khera,1988),其极囊与缝面垂直或呈一定角度,且其极丝开口均不在孢子顶点,这与碘泡虫科的其他物种有明显差别,故将这2个属从碘泡虫科中分出来,新建一新单极虫科Neothelohanellidae。Lom和Dyková(1992)则认为Lomosporus是新单极虫属的同物异名。而M. irinae Daniyarov,1975(图版Ⅰ:C,D)的孢子含有单个极囊,极囊有时位于孢子顶端,有时稍微靠后倾斜,这可能代表了碘泡虫属和新单极虫属之间的转变(Lom & Dyková,1992)。
单极虫科由Tripathi于1948年建立,其孢子梨形,只含1个极囊,位于孢子前端,其下仅含一属,即单极虫属(Tripathi,1948)。陈启鎏与马成伦(1998)也将单极虫属单独归在了单极虫科中。继而,基于形态学特征的聚类分析结果,赵元莙和宋微波将双壳目Bivalvulida分类系统做了进一步调整,重新厘定的分类系统中,将焰孢虫属,新单极虫属和单极虫属都归到了单极虫科中(赵元莙,2000;赵元莙,宋微波,2003b)。1.3 旋缝虫属的归属问题
陈启鎏和谢杏人检获旋缝虫属一新种,命名为鲢旋缝虫Spirosuturia hypophihalmichthydis(图版Ⅰ:M,N)。此属原被列入碘泡科中,但碘泡科的孢子缝线基本是均直的,而旋缝虫则具有波浪形扭曲的缝线,而缝线又是粘孢子虫孢子的重要结构,故考虑建立旋缝科,并简述了新科与旋缝虫属的鉴别特征,旋缝科动物在淡水鱼组织中寄生,孢子具2壳瓣,2个极囊位于孢子一端,具嗜碘泡,缝脊呈波浪形扭曲(陈启鎏,谢杏人,1987)。1.4 足孢虫属的归属问题
足孢虫属由陈启鎏和谢杏人于1984年建立。该属种类寄生于淡水鱼组织或器官腔内,孢子钟状或球状,前端稍尖,后端圆钝,两侧各有一片薄膜状突出物,缝脊直,2个圆形极囊位于孢子前端缝脊两侧,具明显嗜碘泡。通过此特征,建立了足孢虫属,他们认为此属极囊位于孢子前端,并具有嗜碘泡,应归于碘泡科中。并与此科已知属中的霍氏虫属最相近,但其极囊所在位置和孢子后端突出物可将其区分开(陈启鎏,谢杏人,1984)。在之后的分类研究中,一些学者也因该属种类具有嗜碘泡而将其归到了碘泡科中(陈启鎏,马成伦,1998;赵元莙,宋微波,2003b)。而Lom(2006)则以极囊所在位置将其列为球孢虫属Sphaerospora的同物异名。1.5 四尾虫属的归属问题
1984年,吴宝华等在斗鱼鳃丝上检获一罕见粘孢子虫,虽与碘泡虫科孢子一样均具嗜碘泡,但其形态比较特殊。与碘泡科的孢子不同,其孢子宽厚基本相等,顶面观呈圆形,极丝粗且末端圆钝,孢子体的后端有4条由壳片突伸相互对称的尾巴,孢子末端有小突。与其他各科相比,差别也很大,难以归纳到现有粘孢子虫分类系统的科内,根据其孢子形态的独特性,应另立新科。故建四尾虫科,四尾虫属,并将此虫种命为斗鱼四尾虫Tetrauronema macropodos(图版Ⅰ:K,L),归在此新属新科中(吴宝华等,1988)。但随后,又有学者将四尾虫属归入碘泡科(Lom & Dykova,1992;Lom & Dykova,2006),而陈启鎏和马成伦(1998)还是接受吴宝华等的观点,将其单立一科,归属于四尾虫科,在赵元莙和宋微波(2003b)双壳目的分类系统中,也将该属归入四尾虫科。1.6 尾孢虫属和单尾虫属的有效性
尾孢虫属种类的孢子壳瓣向后端延伸成2根等长的尾突,成为与碘泡虫属种类相区别的鉴别性特征。但是,有学者利用分子标记对粘孢子虫系统发育展开研究时发现,碘泡虫属和尾孢虫属的种类总是相互交叉聚在一起,并不能形成独立的分支,甚至这两者还经常出现与单尾虫属交叉聚类的现象(Fiala,2006;Bartošova et al.,2009;董江丽等,2011;李楠楠等,2012)。其实,即使从形态学上的尾突的存在与否来判断尾孢虫属和碘泡虫属也不一定完全能将其完全区分开。早有学者发现,薄鳅碘泡虫M. leptobotiae和斗鱼粘体虫M. macropodusi部分成熟的孢子基部存在与尾孢虫相似的尾突结构,认为这种带有尾突的碘泡虫是其异常孢子(陈启鎏,马成伦,1998)。最近Bahri(2008)在研究中也发现M. bizerti和M. mülleri的部分孢子基部存在类似结构。后来又有学者在M. turpisrotundus的孢子中观察到尾突,通过对碘泡虫属和尾孢虫属的分子系统学研究,也认为带尾突的孢子是碘泡虫的一种异形形态(Liu et al.,2010a,2010b)。因此,尾突作为粘孢子虫的分类依据受到了广泛的质疑。尾孢虫的尾突可能是碘泡虫壳瓣褶皱的一种延伸和特化,并不是有效的分类依据(Andree et al.,1999)。
以18S rDNA为分子标记对单尾虫属进行系统学研究时发现,黄颡单尾虫U. pelteobagrus和尾单尾虫U. caudatus分别聚支,且尾突特征在碘泡虫属、尾孢虫属、似尾孢虫属、单尾虫属和拟尾孢虫属类群支系的分类中是混杂的,表明尾突不足以作为分类依据(李楠楠等,2012)。因此,单尾虫属的有效性应受到质疑。同样以28S rDNA建立系统树和遗传距离分析也证实了这几个属间模糊的系统关系,尾突的特征并不能将它们分开(董江丽等,2011)。
尽管如此,也有学者认为尾突在粘孢子虫的分类中仍起到重要作用。鲁义善和聂品(2006)在研究我国淡水鱼类粘孢子虫的支序分类学时,认为粘孢子虫的尾突可能是一种特化的结构以适应寄生生活,而且它决定了尾孢虫、单尾虫、侧尾虫(图版Ⅰ:H~J)等一大类粘孢子虫的分类地位。所以,尽管这个形态学特征被分子系统学和部分形态学证明是有争议的,但尾突对于界定粘孢子虫的类群是不可缺少的。
赵元莙和马成伦(1998)认为,碘泡科的特征已经不足以包含尾孢科各属的特征,所以应该建立一新科——尾孢科,同时将尾孢虫属、单尾虫属、侧尾虫属、扁尾虫属和新尾孢虫属归于其中(陈启鎏,马成伦,1998)。该观点得到了赵元莙和宋微波(2003b)的支持。1.7 霍氏虫属的争议
霍氏虫属最先由Doflein(1898)建立并命名为Hoferia,后由Berg(1898)改名为Hoferellus。根据Doflein(1898)的描述,霍氏虫属种类的孢子2个极囊均位于缝面,与碘泡虫属的种类缝面与极囊所在平面的关系是一样的。1985年,Lom用电子显微镜观察鲤霍氏虫H. cyprini的早期发生后,指出以前报道的鲤霍氏虫应该是肾居球孢虫Sphaerospora renicola生活史中的一种不完全发育阶段的形态,鲤霍氏虫并不是一个有效的分类阶元;前人所描述的这个种类的孢子(Doflein,1898;Mercier,1908)可能是之后所描述的鲤冠孢虫Mitraspora cyprinid (Fujita,1912)。之前所得到的所有类似形态的虫种都与Doflein对霍氏虫属的原始描述不同,他认为如果不能证明有其他种类属于霍氏虫属,那么霍氏虫属的有效性是值得怀疑的(Lom,1985)。之后,有学者在对所谓的鲤霍氏虫和鲤冠孢虫生活史进行深入研究后认为鲤冠孢虫是鲤霍氏虫的同物异名(Molnár et al.,1986)。Lom(1986)认为没有发现1种粘孢子虫与Doflein(1898)所描述的霍氏虫一致,且接受冠孢虫属与霍氏虫属为同物异名,他将1种冠状的虫种归在了霍氏虫属中,确定了鲫霍氏虫H. carassii的分类地位,且作为该属的模式物种。随后有学者证实了肾居球孢虫和鲤冠孢虫为2个不同的种(Dykova & Lom,1982),即鲤冠孢虫为有效的。Lom和Dyková(2006)认为霍氏虫属种类的极囊排列方式应该归到球孢科Sphaerosporidae中。后来又有学者发现了与Doflein描述一致的霍氏虫属种类,如湖北霍氏虫H. hupehensis、武昌霍氏虫H. wuchangensis等,并与其他霍氏虫均归到碘泡科内,而将以前命名的极囊与缝线垂直的霍氏虫和冠孢虫都归到冠孢虫属,即冠孢虫属不是霍氏虫属的同物异名,且属于球孢虫科(马成伦,陈启鎏,1998)。霍氏虫属和冠孢虫属的孢子表面比较相似,都具条纹,后端有或无丝状条饰。但霍氏虫属的粘孢子虫2个极囊与孢子缝面呈平行排列,即其缝面观只能观察到1个极囊,而冠孢虫属的种类2个极囊与孢子缝面呈垂直排列,其缝面可观察到2个极囊(图版Ⅰ:V~Y),极囊的排列方式能有效区分霍氏虫属和冠孢虫属。2 物种阶元的分类及其方法学
碘泡科动物种类众多,其中具有相同宿主、形态相似性较大的种类的区分较为困难。早期粘孢子虫的分类主要依据其形态学特征,但由于其局限性,碘泡科动物在种的界定上易出现混淆。将应用如免疫学(吴英松,汪建国,2000)、分子标记(Andree,1999;Kent,2001;Milyutina et al.,2001;Fiala,2006;Zhao et al.,2008;Bartošova et al.,2009;鄢彦杰,赵元莙,2010;董江丽等,2011)、遗传距离(董江丽等,2011;Zhao et al.,2013;冉佼等,2014)、组织病理学(Molnár et al.,2008;Molnár et al.,2009;Molnár et al.,2011)、电子显微镜(Longshaw et al.,2003;张全中等,2009)及流式细胞术(唐发辉等,2009)等运用到粘孢子虫分类中,使得其在物种阶元的归属问题上更加准确。
在物种的阶元上,关于碘泡虫属的分类学研究较多。陈启鎏等(1998)对碘泡虫属进行了系统的描述,其后Eiras等(2005)在前人工作的基础上,对碘泡虫进行了清理性研究。大多数碘泡虫寄生于鳃与内脏器官中,Molnár(2002)曾对寄生于鳃部不同位置的碘泡虫进行过详细的研究,确定了碘泡虫具有寄生部位专一性的特点。结合寄生组织专一性的特点,碘泡虫孢子的形态与不同发育阶段孢子的大小可以为碘泡虫的系统分类学研究提供有价值的信息(Lom & Arthur,1989;Molnár,1994)。由于孢子的形态特征与寄生组织专一性易受到寄生宿主种类和环境差异的影响(Lom,1987;Mitchell,1989;Hedrick,1999;Baldwin & Myklebust,2002),过去仅从形态学方面对碘泡虫的分类学研究并不十分准确,因此运用多种技术方法综合考虑成为必要。2.1 免疫学方法的分类鉴定
吴英松和汪建国(2000)提取圆形碘泡虫M. rotundus可溶性抗原对其免疫原性进行研究时发现粘孢子虫可能存在属特异性的抗原。但兔抗圆形碘泡虫的抗体能与同为碘泡虫属的关桥碘泡虫M. guanqiaoensis及野鲤碘泡虫M. koi的孢子起交叉反应,但不与此属的饼形碘泡虫M. artus的孢子发生反应,因此他们对饼形碘泡虫所处分类位置的合理性产生了怀疑。2.2 电子显微镜与形态分类
粘孢子虫结构较为简单,对其形态学上的鉴定通常是通过对其成熟孢子的观察描述,如孢子形态、大小,极囊形态、大小,极丝圈数,缝线形状等。传统的形态分类学方法可以对一些形态相似性不是特别高的物种进行区分,如宜宾碘泡虫M. yibinenis与饼形碘泡虫M. artus在形态上比较相似(图版Ⅰ:R~U),很多报道中都将这2种碘泡虫混淆(黄琪琰,2005)。基于两者在孢子的长、宽、厚等,寄主与寄生部位上的差异,赵元莙和马成伦(1994)对其进行了区分并重新描述了种类特征。但是有很多种类之间的差异或共同点在光学显微镜中无法展示出来,因而对其鉴定存在一定的局限,而电子显微镜的利用,解决了诸如此类的问题。1997年,Lom利用电镜对放射孢子虫和粘孢子虫的超微结构作了详细的对照,发现了它们之间的许多共同点,提出放射孢子虫和粘孢子虫应该分别作为粘孢子虫生活史中的2个阶段,其中放射孢子虫是粘孢子虫在中间宿主的发育阶段,而粘孢子虫则是终宿主的成熟孢子期阶段(Dyková & Lom,1997; Lom et al.,1997a,1997b)。感染异育银鲫的M. turpisrotundus Zhang,2009与M. rotundus Nemeczek,1911的孢子外部形态十分相似,利用普通的形态学方法很难区分,自1995年M. turpisrotundus首次在中国报道以来,一直被当作M. rotundus的同物异名种,很多报道对它的研究都没有足够的证据证明它们属于2个种(吴英松,汪建国,2000;鲁义善,聂品,2004;Molnár et al.,2009)。Molnár等(2009)指出M. rotundus孢子表面光滑,而Liu等(2010a)通过扫描电镜发现M. turpisrotundus超微结构孢子表面凹凸不平,为确定M. turpisrotundus为寄生于异育银鲫体表的一新种提供了有利证据。2.3 分子生物学与物种鉴定
近年来,分子生物学的迅猛发展使得有关粘孢子虫的分类学研究取得了更大的进步。有学者通过核糖体小亚基对脑粘体虫M. cerebralis和放射孢子虫及其他一些粘孢子虫进行序列分析时发现,脑粘体虫与其相应的放射孢子虫18S rDNA序列相似度远远高于其他2种碘泡虫,并提出这2种生物体为同一物种的不同发育阶段(Andree et al.,1997)。其后又有学者利用分子生物学方法对圆形碘泡虫M. rotundus和放射孢子虫的18S rDNA片段进行了分析,发现圆形碘泡虫与其相应的放射孢子虫的18S rDNA的基因序列的相似率极高,达到了99.9%,同样证明了该碘泡虫与其相应的放射孢子虫实为同一物种的不同发育阶段的结论(Székely et al.,2009)。
Zhang等(2010)通过形态学及分子手段的研究表明吴李碘泡虫M. wulii、关桥碘泡虫和寄生于日本金鱼鳃丝的一种未命名碘泡虫M. sp.不仅形态十分相似,而且三者的18S rDNA序列一致,指出三者实为同一种碘泡虫。Zhao等(2013)基于瓶囊碘泡虫M. ampullicapsulatus和洪湖碘泡虫M. honghuensis的鉴别研究结果表明,两者的基因序列相似度达99%,通过对其基因序列变异点、遗传距离、系统发生、寄生部位差异等的细致研究,有效地区分了鲫鳃寄生的的瓶囊碘泡虫和异育银鲫咽部寄生的洪湖碘泡虫,同时指出即使基因序列相似度达99%以上,也可能是2个不同的物种。分子生物学的应用给粘孢子虫的分类带来了新的思路,为该领域的发展注入了活力。3 展望
碘泡科种类繁多,是粘孢子虫中非常重要的一个类群,其分类学问题一直倍受关注。碘泡科的属和种阶元的归属问题随着粘孢子虫研究的深入发生着变化,目前已经纠正了先前许多错误的鉴定结果,但仍有很多问题有待解决,其分类系统仍然模糊不清,如碘泡虫属、尾孢虫属、单尾虫属、拟尾孢虫属、足孢虫属、霍氏虫属、三角孢子虫属等到底哪几个属应该归为碘泡科?碘泡虫属、单尾虫属、尾孢虫属这3个属的分类关系究竟怎样?碘泡虫属种类众多,对于具有相同宿主、寄生部位相同并且形态相似性较大的种类的分类鉴定依据是什么?虽然分子生物学的迅速发展帮助学者们在粘孢子虫分类学领域取得了很多成果,但碘泡科分类学依然存在一些问题。而重建碘泡科系统,厘清碘泡科各类群的归属、亲缘关系、分化和进化模式等是非常重要而意义深远的。今后的研究中结合形态特征、遗传、免疫、生物地理、组织向性、宿主特异性、协同进化等多种因素,综合考虑包括碘泡虫科在内的粘孢子虫的系统分类将成为必然趋势,同时,碘泡虫科关键类群的鉴定和相应基础数据的积累也是解决碘泡虫科动物系统分类学问题必不可少的工作。
| 陈启鎏, 马成伦. 1998. 中国动物志: 粘体门·粘孢子纲(淡水)[M]. 北京: 科学出版社. |
| 陈启鎏, 谢杏人. 1984. 中国淡水鱼类寄生粘孢子虫碘泡科一新属及二新种[J]. 动物分类学报, 9(2): 113-117. |
| 陈启鎏, 谢杏人. 1987. 粘孢子纲一新科的代表——鳞旋缝虫, 新种[J]. 动物分类学报, 12(1): 1-4. |
| 董江丽, 赵元莙, 唐发辉, 等. 2011. 黄颡单尾虫(粘体门,双壳目)的重描述及基于28S rDNA和ITS-5.8S序列的系统地位分析[J]. 动物分类学报, 36(1): 84-92. |
| 黄琪琰. 2005. 淡水鱼病防治实用技术大全[M]. 北京: 中国农业出版社. |
| 李连祥, 倪达书. 1973. 湖北省鱼病病原区系图志: 粘孢子目[M]. 北京: 科学出版社. |
| 李楠楠, 赵元莙, 唐发辉, 等. 2012. 基于18S rDNA序列对单尾虫属(粘体门, 双壳目)的系统学研究[J]. 内江师范学院学报, 27(12): 38-42. |
| 李媛. 2009. 11种粘孢子虫基于rDNA的系统分类学研究及中华球孢虫的亚显微结构描述[D]. 重庆: 重庆师范大学. |
| 鲁义善, 聂品. 2006. 我国淡水鱼类粘孢子虫的支序分类学研究[J]. 动物分类学报, 31(1): 63-68. |
| 冉佼, 杨承忠, 赵元莙. 2014. 基于遗传距离的粘孢子虫分类研究[J]. 重庆师范大学学报, 31(3): 31-34. |
| 索栋, 赵元莙. 2010. 尼氏单极虫(粘体门,双壳目)的重描述及基于18S rDNA的系统地位分析[J]. 动物分类学报, 35(1): 90-95. |
| 唐发辉, 赵元莙, 唐安科. 2009. 流式细胞术用于粘孢子虫分类学的探讨[J]. 动物分类学报, 34(3): 675-680. |
| 吴宝华, 玉淑霞, 姜乃澄. 1988. 中国淡水鱼类寄生粘孢子虫——斗鱼四尾虫新种(新属、新科)(粘抱子虫纲: 单极亚目)[J]. 动物分类学报, 13(4): 313-316. |
| 吴英松, 汪建国. 2000. 圆形碘泡虫免疫原性的研究[J]. 水生生物学报, 24(3): 246-251. |
| 吴英松, 汪建国. 2001. 圆形碘泡虫孢子发生的超微结构研究[J]. 水生生物学报, 25(1): 61-69. |
| 鄢彦杰, 赵元莙. 2010. HSP70研究进展及其在粘孢子虫分类学与病害学中的应用[J]. 河北农业科学, 14(10): 68-72. |
| 张全中, 赵元莙, 何根林. 2009. 瓶囊碘泡虫成熟孢子的显微及亚显微结构研究[J]. 动物分类学报, 34(3): 531-539. |
| 赵元莙, 马成伦. 1994. 中国西部淡水鱼类寄生粘孢子虫的记述(粘孢子纲: 双壳目)[J]. 动物分类学报, 19(3): 261-262. |
| 赵元莙, 宋微波. 2003a. 世界海洋鱼类粘孢子虫原生动物的种类与分布[M].// 宋微波, 赵元莙, 徐奎栋, 等(主编). 海水养殖中的危害性原生动物. 北京: 科学出版社: 315-428. |
| 赵元莙, 宋微波. 2003b. 双壳目粘孢子虫的属级阶元修订[M].// 宋微波, 赵元莙, 徐奎栋, 等(主编). 海水养殖中的危害性原生动物. 北京: 科学出版社: 265-289. |
| 赵元莙, 宋微波. 2009. 青岛近岸海洋鱼类4种寄生薄壳虫属粘孢子虫, 包括1新种的研究(粘体门, 双壳目)[J]. 水生生物学报, 33(1): 61-66. |
| 赵元莙. 2000. 黄渤海山东沿岸海洋鱼类寄生粘孢子虫[D]. 青岛: 青岛海洋大学. |
| Andree KB, El-Matbouli M, Hoffman RW, et al. 1999. Comparison of 18S and ITS-1 rDNA sequences of selected geographic isolates of Myxobolus cerebralis[J]. International Journal for Parasitology, 29(5): 771-775. |
| Andree KB, Gresoviac SJ, Hedrick RP. 1997. Small subunit ribosomal RNA sequence unties altemate actinosporean and myxosporean stage of Myxobolus cerebralis the causative agent of whirling diseases[J]. Journal of Eukaryotic Microbiology, 44(3): 208-215. |
| Bahri S. 2008. Abnormal forms of Myxobolus bizerti and Myxobolus mülleri (Myxosporea: Bivalvulida) spores with caudal appendages[J]. Fish Pathology, 28(6): 252-255. |
| Baldwin TJ, Myklebust KA. 2002. Validation of a single round polymerase chain reaction assay for identification of Myxobolus cerehralis myxospores[J]. Diseases of Aquatic Organisms, 49(3): 185-190. |
| Bartoova P, Fiala I, Hypa V. 2009. Concatenated SSU and LSU rDNA data confirm the main evolutionary trends within myxosporeans (Myxozoa: Myxosporea) and provide an effective tool for their molecular phylogenetics[J]. Molecular Phylogenetics and Evolution, 53(1): 81-93. |
| Berg. 1898. Communicat. Mus. Nac[J]. Buenos, 41. |
| Canning EU, Okamura B. 2004. Biodiversity and evolution of the myxozoa[J]. Advances in Parasitology, 56: 44-131. |
| Das MK, Haldar DP. 1986. Studies on protozoan parasites from fishes: two species of the genus Neothelohanellus n. gen. (Myxosporidia)[J]. Archiv für Protistenkunde, 132(1): 125-130. |
| Doflein F. 1898. Studien zur Naturgeschichte der Protozozen. Ⅲ. Vber Myxosporidien[J]. Zoologische Jahrbücher, 2: 281-350. |
| Dyková I, Lom J. 1982. Sphaerospora renicola n. sp., a myxosporean from carp kidney, and its pathogenicity[J]. Zeitschrift für Parasitenkunde, 68(3): 259-268. |
| Dyková I, Lom J. 1997. Ultrastructural features of the actinosporean phase of myxosporean (phylum: Myxozoa): a comparative study[J].. Acta Protozoologica, 36(2): 83-103. |
| Eiras JC, Molnár K, Lu YS. 2005. Synopsis of the species of Myxobolus Butschli, 1882 (Myxozoa: Myxusporea: Myxobolidae) [J]. Systematic Parasitology, 61(1): 1-46. |
| Fiala I. 2006. The phylogeny of Myxosporea (Myxozoa) based on small subunit ribosomal RNA gene analysis[J]. International Journal for Parasitology, 36(14): 1521-1534. |
| Fujita T. 1912. Notes on new sporozoan parasites of fishes[J]. Zoologischer Anzeiger, 37: 251-261. |
| Gupta S, Khera S. 1988. On a new myxosporean parasite (Myxozoa), Lomosporus indicus gen. et sp. n. from the freshwater fish, Labeo calbasu (Hamilton)[J]. Acta Protozoologica, 27(2): 171-176. |
| Hedrick RP, McDowell TS, Mukkatirra K, et al. 1999. Susceptibility of selected inland salmonids to experimentally induced infections with Myxobolus cerebralis, the causative agent of whirling disease[J]. Journal of Aquatic Animal Health, 11(14): 330-339. |
| Kent ML, Andree KB, Bartholomew JL, et al. 2001. Recent advances in our knowledge of the Myxozoa[J]. The Journal of General and Applied Microbiology, 48(4): 395-413. |
| Kovács-Gayer é, Rátz F, Baska F, et al. 1988. Light and electron microscopic studies on various developmental stages of Hoferellus cyprini (Doflein, 1898)[J]. European Journal of Protistology, 23(2): 185-192. |
| Kundu TK, Haldar DP. 1981. Studies on Thelohanellus jiroveci sp. n., a new myxosporidian parasitic in a common teleost fish[J]. Věstník Ceskoslovenské Spolecnosti Zoologické, 45: 94-101. |
| Landsberg JH, Lom J. 1991. Taxonomy of the genera of the Myxobolus/Myxosoma group (Myxobolidae: Myxosporea), current listing of species and revision of synonyms[J]. Systematic Parasitology, 18(3): 165-186. |
| Levine ND, Corliss JO, Cox FE, et al. 1980. A newly revised classification of the Protozoa[J]. The Journal of Protozoology, 27(1): 37-58. |
| Liu Y, Gu ZM, Luo YL. 2010a. Some additional data to the occurrence, morphology and validity of Myxobolus turpisrotundus Zhang, 2009 (Myxozoa: Myxosporea)[J]. Parasitology Research, 107(1): 67-73. |
| Liu Y, Whipps CM, Gu ZM, et al. 2010b. Myxobolus turpisrotundus (Myxosporea: Bivalvulida) spores with caudal appendages: investigating the validity of the genus Henneguya with morphological and molecular evidence[J]. Parasitology Research, 107(3): 699-706. |
| Lom J, Arthur JR. 1989. A guideline for the preparation of species descriptions in Myxosporea[J]. Journal of Fish Diseases, 12(2): 151-156. |
| Lom J, Dyková I. 1992. Protozoan parasites of fishes[M]. New York: Elsevier Amsterdam: 204-235. |
| Lom J, Dyková I. 2006. Myxozoan genera: definition and notes on taxonomy, life-cycle terminology and pathogenic species[J]. Folia Parasitologica, 53(1): 1-36. |
| Lom J, McGeorge J, Feist SW, et al. 1997a. Guidelines for the uniform characterisation of the actinosporean stages of parasites of the phylum Myxozoa[J]. Diseases of Aquatic Organisms, 30(1): 1-9. |
| Lom J, Yokoyama H, Dyková I. 1997b. Comparative ultrastructure of Aurantiactinomyxon and Raabeia: actinosporean stages of Myxozoa life cycles[J]. Archiv für Protistenkunde, 148(1): 173-189. |
| Lom J. 1985. Hoferellus cyprini Doflein, 1898 from carp kidney:a well established Myxosporean species or a sequence in the developmental cycle of Sphaerospora renicola Dykova and Lom, 1982[J]. Protistologica, 21(2): 195-206. |
| Lom J. 1986. Hoferellus cyprini (Doflein, 1898) Berg, 1898(syn: Mitraspora cyprini Fujita,1912), Myxobilatus nostalgicus sp. n. and related species: partial revision of two Myxosporean genera[J]. Folia Parasitologica, 33(4): 289-296. |
| Lom J. 1987. Myxosporea: a new look at long-known parasites of fish[J]. Parasitology Today, 3(11): 327-332. |
| Longshaw M, Frear P, Stephen WF. 2003. Myxobolus buckei sp. n. (Myxozoa), a new pathogenic parasite from the spinal column of three cyprinid fishes from the United Kingdom[J]. Folia Parasitologica, 50(4): 251-262. |
| Mercier L. 1908. Notes sur los Myxosporidies[J]. Arch. Zool. Exp. Gén., 8: 53-62. |
| Milyutina IA, Aleshin VV, Mikrjukov KA, et al. 2001. The unusually long small subunit ribosomal RNA gene found in amitochondriate amoeboflagellate Pelomyxa palustris: its rRNA predicted secondary structure and phylogenetic implication[J]. Gene, 272(1): 131-139. |
| Mitchell LG. 1989. Myxobolid parasites (Myxozoa: Myxobolidae) infecting fishes of western Montana, with notes on histophathology, seasonality, and intraspecific variation[J]. Canadian Journal of Zoology, 67(8): 1915-1922. |
| Molnár K, Cech G, Székely C. 2008. Infection of the heart of the common bream, Abramis brama (L.), with Myxobolus dogieli (Myxozoa, Myxobolidae)[J]. Journal of Fish Diseases, 31(8): 613-620. |
| Molnár K, Cech G, Székely C. 2011. Histological and molecular studies of species of Myxobolus Bütschli, 1882 (Myxozoa: Myxosporea) in the gills of Abramis, Blicca and Vimba spp. (Cyprinidae), with the redescription of M. macrocapsularis Reuss, 1906 and M. bliccae Donec & Tozyyakova, 1984[J]. Systematic Parasitology, 79(2): 109-121. |
| Molnár K, Csaba G, éva KG. 1986. Study of the postulated identity of Hofferellus cyprini (Doflein,1898) and Mitraspora cyprini Fujita, 1912[J]. Acta Veterinaria Hungarica, 34(3-4): 175-181. |
| Molnár K, Székely C, Sascha L, et al. 2009. Some remarks on the occurrence, host-specificity and validity of Myxobolus rotundus Nemeczek, 1911 (Myxozoa: Myxospore)[J]. Systematic Parasitology, 72(1): 71-79. |
| Molnár K. 1994. Comments on the host, organ and tissue specificity of fish in myxosporeans and on the types of their intrapiscine development[J]. Parasitol Hung, 27: 5-20. |
| Molnár K. 2002. Differences between the European carp (Cyprinus carpio carpio) and the coloured carp (Cyprinus carpio haematopterus) in susceptibility to Thelohanellus nikolskii (Myxosporea) infection[J]. Acta Veterinaria Hungarica, 50(1): 51-57. |
| Quadri SS. 1962. On a new myxosporidian parasite, Phlogospora mysti gen. n., sp. n., form Indian freshwater fish Mystus bleekeri[J]. Arch Protistenkd, 106: 211-217. |
| Sarkar NK, Misra KK. 1996. Neothelohanellidae fam. n. and taxonomic consideration on the genera Neothelohanellus and Lomosporus (Myxozoa: Myxosporea)[J]. Acta Protozoologica, 35(2): 157-160. |
| Shulman SS. 1984. Parasitic protozoa. Key to parasitic of freshwater fishes of the USSR (Ed. ON Bauer in the Russian)[J]. Nauka, Leningrad, USSR, 1: 426. |
| Székely C, Hallett SL, Atkinson SD, et al. 2009. Complete life cycle of Myxobolus rotundus (Myxosporea: Myxobolidae), a gill myxozoan of common bream Abramis brama[J]. Diseases of Aquatic Organisms, 85(2): 147-155. |
| Tripathi YR. 1948. Some new myxosporidia form Plymouth with a proposed new classification of the order[J]. Parasitology, 39: 110-118. |
| Walliker D. 1968. The nature of the iodinophilous vacuole of Myxosporidan spores, and a proposal to synonymize the genus Myxosoma Thelohan, 1892 with the genus Myxobolus Butschli, 1882[J]. The Journal of Protozoology, 15(3): 571-575. |
| Zhang JY, Yokoyama H, Wang JG, et al. 2010. Utilization of tissue habitats by Myxobolus wulii Landsberg & Lom, 1991 in different carp hosts and disease resistance in allogynogenetic gibel carp: redescription of M. wulii from China and Japan[J]. Journal of Fish Diseases, 33(1): 57-68. |
| Zhao YJ, Li NN, Tang FH, et al. 2013. Remarks on the validity of Myxobolus ampullicapsulatus and Myxobolus honghuensis (Myxozoa: Myxosporea) based on SSU rDNA sequences[J]. Parasitology Research, 112(11): 3817-3823. |
| Zhao YJ, Zhou Y, Kent ML, et al. 2008. Replacement of the preoccupied name Davisia Laird 1953 and description of a new myxozoan species (Myxosporea: Sinuolineidae) from Sebastiscus marmoratus (Cuvier, 1829) in the East China Sea[J]. The Journal of Parasitology, 94(1): 269-279. |
 2015, Vol. 34
2015, Vol. 34




