扩展功能
文章信息
- 张力, 刘超, 周昕, 谢英, 刘树锋
- ZHANG Li, LIU Chao, ZHOU Xin, XIE Ying, LIU Shufeng
- 应用2A肽策略构建双基因共表达转基因斑马鱼的研究
- The Study on Application of Bicistronic Vector in Transgenic Zebrafish Based on 2A Peptide
- 四川动物, 2015, 34: 338-344
- Sichuan Journal of Zoology, 2015, 34: 338-344
- 10.3969/j.issn.1000-7083.2015.03.003
-
文章历史
- 收稿日期:2014-09-19
- 接受日期:2014-12-26
2. 华中科技大学同济医学院遗传学系, 武汉430032
2. Department of Medical Genetics, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430032, China
斑马鱼已成为后基因组时代生命科学研究中重要的模式脊椎动物之一,转基因斑马鱼在生物医学研究、疾病模型构建、药物筛选等领域中发挥着越来越重要的作用(Zon,1999;Schartl,2014)。在转基因斑马鱼的构建过程中,为方便目标基因的检测,常需要以绿色荧光蛋白(GFP)、Cherry等作为示踪基因与目标基因同时分别表达,这就需要一个质粒介导多个基因同时成功表达的质粒构建技术。基于这一目的,一些研究策略已得到应用:(1)多启动子分别单独启动多个基因表达;(2)单一启动子启动多个基因以融合蛋白形式表达;(3)在不同基因之间插入内部核糖体结合位点(internal ribosomal entry sites,IRES);(4)在不同基因开放阅读框中间插入蛋白酶剪切位点。在此类构建策略中,IRES因其优点而被广泛应用:(1)可确保IRES序列前后基因的共同表达;(2)可在IRES序列后的基因增加亚细胞定位序列;(3)拥有包含IRES序列的商品化表达质粒。但IRES存在2个主要缺点:(1)IRES序列长度通常超过500个核苷酸序列,使得在构建大片段插入IRES病毒载体时限制了载体的容载量,而在构建多顺反子(polycistronicm RNA)共表达质粒时也会出现这个问题;(2)IRES序列后的蛋白翻译效率要远低于位于IRES序列前的基因蛋白翻译(Chan et al.,2011)。
2A肽(2A peptide)是一种可"自我剪切"的短小肽链,最初在手足口病毒(foot- and -mouth disease virus,FMDV)中发现,平均长度为18~22个氨基酸,2A肽可在蛋白翻译时通过核糖体跳跃从自身最后2个氨基酸C末端断裂(de Felipe et al.,2003)。甘氨酸和脯氨酸之间的肽链结合群在2A位点是受损的,能引发核糖体跳跃而从第2个密码子开始翻译,从而使1个转录单元里2个蛋白独立表达。这种2A介导的剪切广泛存在于所有的真核动物细胞当中。因此,2A肽序列短小且前后基因表达均一的优点可成功解决IRES功能上的局限性。利用2A肽较高的剪切效率及促使上下游基因平衡表达的能力,可以改进异源多聚蛋白(如细胞表面受体、细胞因子、免疫球蛋白等)的表达效率。然而,通过2A肽介导多顺反子载体获得稳定转基因动物后代的研究只在转基因猪与转基因羊上得到了验证(Deng et al.,2011;Tian et al.,2013;Yen & Scheerlinck,2013)。
B细胞活化因子(BAFF)蛋白为Ⅱ型跨膜蛋白,相对分子质量约32 kDa,胞内有46个氨基酸,疏水跨膜区有27个氨基酸,胞外区有212个氨基酸。通常,在某些特定蛋白酶作用下可发生水解,形成可溶性功能片段。以融合蛋白形式研究此类跨膜蛋白往往不能正确反映蛋白功能的正常发挥,因此研究以BAFF为候选基因,探索2A肽序列在此类跨膜蛋白表达上所起到的积极作用。
该研究通过InFusion法将2A序列融合GFP与Cherry蛋白序列构建于Tol2转座子质粒上,转染细胞并联合转座酶注射斑马鱼1-细胞受精卵,观察GFP与Cherry蛋白的表达,Western blot法检测质粒转染HeLa细胞后不同时间点GFP与Cherry融合蛋白的表达与剪切情况。 以Ⅱ型跨膜蛋白BAFF为对象,分别构建Tol2-GFP-2A-BAFF与Tol2-BAFF-2A-Cherry质粒制备转基因斑马鱼,Western blot法检测BAFF的表达与剪切情况,分析位置效应对2A剪切的影响。结果表明,基于2A肽构建策略的单启动子双基因共表达载体可成功应用于转基因斑马鱼制备,且表达量呈等比例表达。发现功能基因位于2A序列的前后位置会直接影响蛋白的剪切效率。 1 材料方法 1.1 材料 1.1.1 实验动物
性成熟Tuebingen品系斑马鱼引自清华大学生命科学学院,实验室斑马鱼繁育系统饲养,水温28 ℃±0.5 ℃,pH7.0±0.5,光周期控制14 L∶10 D,以孵化的丰年虫(Artemia)喂养(谢英等,2013)。 1.1.2 试剂
质粒测序工作由生工生物工程(上海)股份有限公司完成;DM5000 marker(北京康为世纪公司);凝胶回收试剂盒、限制性内切酶(TaKaRa公司),Phusion聚合酶(NEB),DNA连接试剂盒,InFusion kit(clontech),质粒小提试剂盒(北京天根生化科技有限公司)。大肠杆菌Trans1-T1 Phage Resistant Chemically competent cells(全式金公司),体外转录试剂盒mMESSAGEmMACHINE Kit(applied biosystems),鼠抗GFP单克隆抗体(AG281,碧云天),鼠抗Cherry单克隆抗体(Abbkine),β-actin一抗(碧云天),辣根过氧化物酶标记二抗(碧云天),DAB试剂盒(武汉博士德公司)。 1.2 PTol2-GFP-2A-Cherry表达载体的构建
如下2A序列送Invitrogen公司测序:T2ABAS:CCGGAGGAAGCGGAGCTACTAACTTCAGCCTGCTGAAGCAGGCTGGAGACGTGGAGGAGAACCCTGGA-CCTG;T2ABAAS2:AATTCAGGTCCAGGGTTCTCCT-CCACGTCTCCAGCCTGCTTCAGCAGGCTGAAGTTA-GTAGCTCCGCTTCCT。
分别于5’与3’端引入BspEⅠ与EcoRⅠ粘末端酶切位点序列(下划线加粗),退火并回收退火片段。pEGFP-C1质粒经BspEⅠ与EcoRⅠ酶切回收骨架片段后与2A退火片段通过T4 DNA 连接酶16 ℃连接过夜后转化大肠杆菌,次日取单克隆菌落后摇菌扩增,提取质粒并酶切鉴定,将酶切鉴定正确质粒命名为pEGFP-C1-2A并送测序公司测序。PCR法克隆Cherry片段,引物如下:
CherryS:5’-GCGAATTCATGGTGAGCAAGGGCGAG -3’;
CherryAS:5’-GCGGATCCCTACTTGTACAGCT-CGTCCATGC-3’。
引入酶切位点为EcoRⅠ与BamHⅠ,经双酶切后胶回收711 bp Cherry片段。EcoRⅠ与BamHⅠ酶切pEGFP-C1-2A后胶回收载体片段,并将其与Cherry片段连接,构建pEGFP-C1-2A-Cherry质粒。以pEGFP-C1-2A-Cherry质粒为模板扩增获得GFP-2A-Cherry片段,通过InFusion法将其构建于Tol2质粒,最终获得pTol2-GFP-2A-Cherry质粒。 1.3 细胞转染
将HeLa细胞接种于12孔板,传代后24 h细胞汇合度达90%时进行脂质体转染。转染方法按照lipofectamine 2000(Invitrogen)操作,每孔质粒2 μg,脂质体5 μL。转染后选取8 h、12 h、24 h、72 h,每孔加入100 μL蛋白裂解液提取蛋白,-80 ℃保存。 1.4 蛋白提取与Western blot
提取瞬时转染有pTol2-GFP-2A-Cherry细胞总蛋白,方法如下:使用含苯甲基磺酰氟(PMSF)和蛋白酶抑制剂的1×SDS裂解液冰上裂解细胞,煮沸10 min,裂解液冰上超声3 s,15次。离心后吸取上清,-20 ℃保存。所得蛋白进行SDS-PAGE 凝胶电泳,将蛋白转移到0.45 μm孔径硝酸纤维素膜上,置于5%脱脂奶粉封闭液中,室温孵育1 h,分别加入3%BSA稀释的鼠抗GFP单克隆抗体(1∶1000)和鼠抗Cherry单克隆抗体(1∶1000),4 ℃孵育过夜,用TBST洗膜3次,每次10 min。然后加入1∶1000辣根过氧化物酶标记二抗,TBST 洗膜3次,每次5 min,弃去二抗,室温孵育1 h。采用β-actin作为内参,DAB法显色。 1.5 转座酶的体外转录
按照体外转录试剂盒mMESSAGEmMACHINE Kit说明书操作,体外转录获得转座酶用于胚胎注射,转座酶注射终浓度为100 ng·μL-1。1.6 斑马鱼胚胎注射转座酶注射终浓度100ng·μL-1。 1.6 斑马鱼胚胎注射
性成熟的雌雄亲鱼分开饲喂1 d 后按1∶1~2 比例放入产卵盒中交配,收集受精卵,无菌水清洗,转移至有琼脂糖的表面皿中,注射浓度为50 ng·μL-1 pTol2-GFP-2A-Cherry质粒与转座酶,体积约2 nL。选取1-细胞期受精卵注射,注射针经卵黄穿入注射至动物极,注射完毕后,缓慢抽出注射针。注射后的受精卵放入装有系统水的培养皿,置28 ℃±0.5 ℃恒温箱培养,分别在1~11 dpf(days post fertilization)倒置荧光显微镜下观察并筛选具有荧光蛋白表达的胚胎(谢英等,2013)。 2 实验结果 2.1 pTol2-GFP-2A-Cherry载体构建
pTol2-GFP-2A-Cherry通过PCR与InFusion法构建得到(图 1)。

|
| 图 1 pTol2-GFP-2A-Cherry质粒构建过程 Fig. 1 The construction of pTol2-GFP-2A-Cherry recombinant plasmid |
pTol2-GFP-2A-Cherry质粒转染HeLa细胞24 h后于倒置荧光镜下观察,GFP与Cherry均有强表达且呈现位置、强度一致性(图 2)。
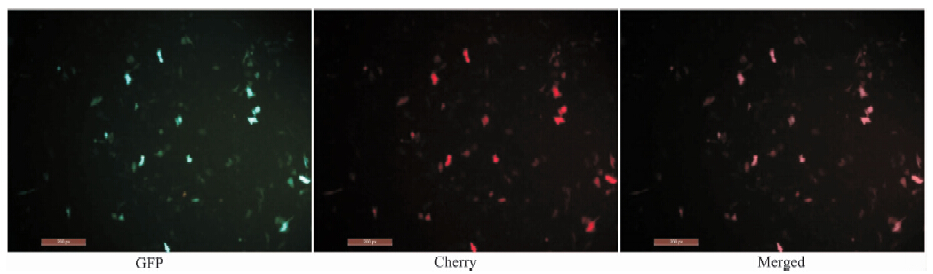
|
| 图 2 pTol2-GFP-2A-Cherry转染HeLa细胞24 h后荧光表达情况 Fig. 2 The fluorescence expression of HeLa cell 24 h after transfection with pTol2-GFP-2A-Cherry |
pTol2-GFP-2A-Cherry质粒转染HeLa细胞后,分别选取8 h、12 h、24 h、72 h 4个时间点细胞进行Western blot检测。结果表明:从12 h到72 h随着时间的延长,GFP-Cherry融合蛋白表达量呈逐渐增加趋势,被剪切获得的GFP与Cherry蛋白也分别呈现上升表达情况,剪切效率于12 h最高(图 3)。
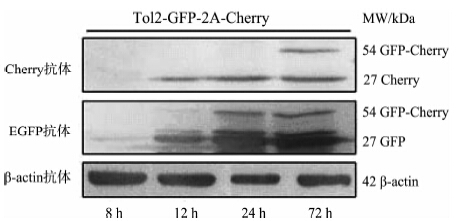
|
|
图 3 pTol2-GFP-2A-Cherry瞬时转染HeLa细胞后不同时间点GFP与Cherry蛋白剪切情况
Fig. 3 The Western blot results of GFP and Cherry expression in HeLa cells transiently transfected with pTol2-GFP-2A-Cherry at different time points |
pTol2-GFP-2A-Cherry质粒注射1-细胞期斑马鱼受精卵,48 h后荧光倒置显微镜观察GFP与Cherry蛋白在斑马鱼体内表达情况。结果表明,与质粒转染HeLa细胞结果一致,斑马鱼体内GFP与Cherry蛋白均有表达,且呈现空间、位置与强度一致性(图 4)。
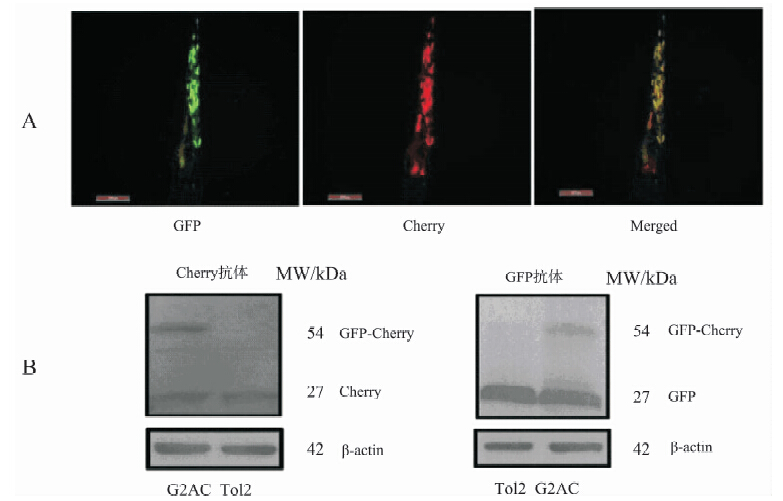
|
|
图 4 pTol2-GFP-2A-Cherry质粒注射斑马鱼胚胎48 h后荧光表达
Fig. 4 The protein expression of 1-cell stage fertilized embryos after injection with pTol2-GFP-2A-Cherry for 48 h
A. pTol2-GFP-2A-Cherry质粒注射1-细胞受精卵后48 h荧光表达;B. Western blot检测pTol2-GFP-2A-Cherry质粒(G2AC)注射1-细胞受精卵48 h后GFP与Cherry蛋白表达。 A. The fluorescence expression of 1-cell stage fertilized embryos after injection with pTol2-GFP-2A-Cherry for 48 h; B. The Western blot results of 1-cell stage fertilized embryos after injection with pTol2-GFP-2A-Cherry(G2AC)for 48 h. |
以pTol2-GFP-2A-Cherry为骨架,通过InFusion法将BAFF分别构建到2A序列的前后,获得BAFF位于2A序列3’端质粒pTol2-GFP-2A-BAFF与位于2A序列5’端质粒pTol2-BAFF-2A-Cherry。2种质粒注射斑马鱼1-细胞受精卵后48 h,Western blot法检测BAFF蛋白表达情况。结果表明,构建于2A序列下游的BAFF序列可成功表达GFP-2A-BAFF融合蛋白和BAFF蛋白,而构建于2A序列上游的BAFF序列则大部分以BAFF-2A-Cherry融合蛋白的形式存在(图 5)。
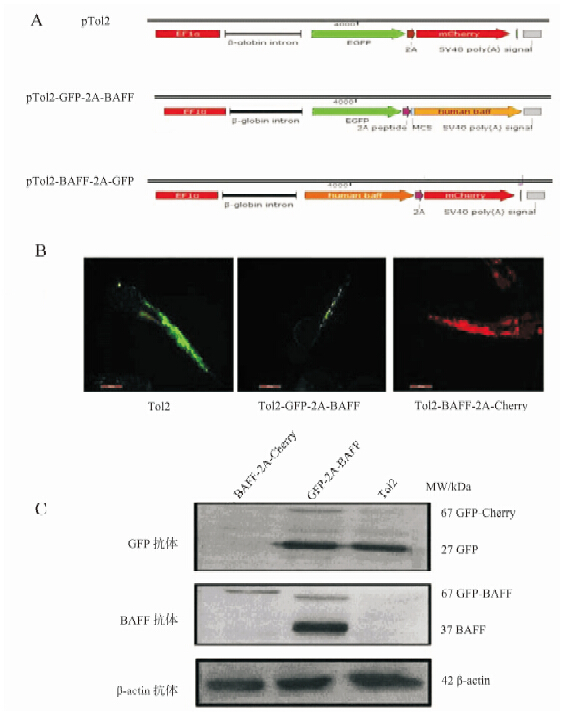
|
|
图 5 相对位置对BAFF蛋白表达的影响
Fig. 5 The position effect of 2A peptide on protein expression
A. pTol2,pTol2-GFP-2A-BAFF与pTol2-BAFF-2A-Cherry质粒元件组成;B. 3种质粒注射斑马鱼1-细胞受精卵第7天荧光表达情况;C. 3种质粒注射1-细胞受精卵后第7天蛋白表达情况。 A. The components of pTol2,pTol2-GFP-2A-BAFF and pTol2-BAFF-2A-Cherry; B. The fluorescence expression of early embryos injected with three plasmids at 7 d pf; C. The Western blots results of GFP and BAFF expression in 7 d pf embryos injected with pTol2,pTol2-GFP-2A-BAFF and pTol2-BAFF-2A-Cherry. |
转基因作为新兴的技术被广泛应用于动物体内的基因功能研究(Ward,1991)。斑马鱼具有繁殖能力强、体外受精和发育、胚胎透明、性成熟周期短、个体小易养殖,可针对治疗药物进行高通量筛选等诸多特点,使其成为后基因组时代生命科学研究中重要的模式脊椎动物之一。由于转基因效率高、制作成本低,常利用荧光报告基因在斑马鱼胚胎或体内实现目标基因的实时跟踪(Berghmans et al.,2005)。基于此种目的,斑马鱼转基因策略中经常利用荧光蛋白融合目的基因的表达方式进行载体构建,但这种融合蛋白的表达往往会导致目的基因细胞定位或基因功能的改变。
在哺乳动物系统中,通过在IRES序列前后分别放置目的基因可以实现2种或多种基因的同时表达(de Felipe,2002)。但是已有大量文献报道了此类载体中IRES序列后基因的表达效率显著低于IRES序列前基因的表达,且已有实验表明IRES在斑马鱼中的表达活性较低(张力等,2013)。因此,当需要相同表达效率的2种或多种基因表达时,基于IRES序列构建策略不适于转基因斑马鱼的构建。
与IRES相比,2A肽具有以下优点:(1)2A序列短,能够有效地实现连接基因之间的共表达;(2)位于2A下游的基因同样可以获得很高的表达水平;(3)已有实验表明,与其他3种不同来源2A序列(T2A,E2A 或AGCAGGCTGGAGACGTACGTGGAGGAGAACCCTG-GACCTA,在斑马鱼当中剪切效率最高(Ibrahmi et al.,2009;Kim et al.,2011;Lin et al.,2013)。2A序列上游的蛋白经翻译后剪切会残余来自2A序列碳端的19个氨基酸,下游蛋白则残余来自氮端的2~5个氨基酸。已有实验表明GFP与Cherry等报告基因蛋白的剪切不受2A肽的具体位置影响,但一些分泌蛋白如TGF-β,当位于2A序列上游时易受位置效应影响而不能发挥正常基因功能(Rothwell et al.,2010)。实验发现,外源基因与2A序列的相对位置可以影响该外源基因蛋白的正常剪切。以pTol2-GFP-2A-Cherry为骨架分别构建pTol2-GFP-2A-BAFF和pTol2-BAFF-2A-Cherry,发现编码跨膜蛋白的功能基因BAFF位于2A序列的不同位置会直接影响蛋白的剪切效率,功能基因位于2A序列后易于跨膜蛋白的剪切。表明当应用2A序列进行分泌蛋白双顺反子的表达时应考虑外源蛋白转录后修饰作用影响蛋白剪切。
Tol2转座子是hAT转座子家族中的一员,是目前发现的唯一一个可以编码具有完整转座酶功能的自主性转座子,在斑马鱼、鼠、人等多种动物细胞中都具有转座活性,常用于转基因斑马鱼系统的转座载体,Tol2能够高效地整合于斑马鱼基因组,可在F0代转基因斑马鱼获得很高的嵌合效率,在初代转基因品系中即可对基因表达进行分析(Kawakami,2005)。
实验发现,以2A肽与Tol2转座载体结合构建质粒,可不因融合蛋白而对蛋白功能造成影响,利用适宜的荧光报告基因可在活体水平通过荧光观察跟踪并确认外源基因的表达。因此,2A系统为斑马鱼提供了一种可同时平衡表达多蛋白的应用体系。
研究结果表明,以Tol2为启动子,利用2A肽策略构建单一载体、单一启动子质粒,可在斑马鱼体内实现不影响蛋白功能的分别表达,编码跨膜蛋白的功能基因位于2A序列的前后位置会直接影响蛋白的剪切。
| 谢英, 梁卫华, 王冀, 等. 2013. 一种低成本实验室用斑马鱼饲养繁育设备[J]. 科学技术与工程, 13(14): 150-155. |
| Berghmans S, Jette C, Langenau D, et al. 2005. Making waves in cancer research: new models in the zebrafish[J]. Biotechniques, 39(2): 227-237. |
| Chan HY, Sivakamasundari V, Xing X, et al. 2011. Comparison of IRES and F2A-based locus-specific multicistronic expression in stable mouse lines[J]. PLoS One, 6(12): e28885. |
| de Felipe P, Hughes LE, Ryan MD, et al. 2003. Co-translational, intraribosomal cleavage of polypeptides by the foot-and-mouth disease virus 2A peptide[J]. J Biol Chem, 278(13): 11441-11448. |
| de Felipe P. 2002. Polycistronic viral vectors[J]. Curr Gene Ther, 2(3): 355-378. |
| Deng W, Yang D, Zhao B, et al. 2011. Use of the 2A peptide for generation of multi-transgenic pigs through a single round of nuclear transfer[J]. PLoS One, 6(5): e19986. |
| Ibrahimi A, Vande Velde G, Reumers V, et al. 2009. Highly efficient multicistroniclentiviral vectors with peptide 2A sequences[J]. Hum Gene Ther, 20(8): 845-860. |
| Kawakami K. 2005. Transposon tools and methods in zebrafish[J]. Dev Dyn, 234(2): 244-254. |
| Kim JH, Lee SR, Li LH, et al. 2011. High cleavage efficiency of a 2A peptide derived from porcine teschovirus-1 in human cell lines, zebrafish and mice[J]. PLoS One, 6(4): e18556. |
| Lin YJ, Huang LH, Huang CT. 2013. Enhancement of heterologous gene expression in Flammulina velutipes using polycistronic vectors containing a viral 2A cleavage sequence[J]. PLoS One, 8(3): e59099. |
| Rothwell DG, Crossley R, Bridgeman JS, et al. 2010. Functional expression of secreted proteins from a bicistronic retroviral cassette based on foot-and-mouth disease virus 2A can be position dependent[J]. Hum Gene Ther, 21(11): 1631-1637. |
| Schartl M. 2014. Beyond the zebrafish: diverse fish species for modeling human disease[J]. Dis Model Mech, 7(2): 181-192. |
| TianY, Li W, Wang L, et al. 2013. Expression of 2A peptide mediated tri-fluorescent protein genes were regulated by epigenetics in transgenic sheep[J]. Biochem Biophys Res Commun, 434(3): 681-687. |
| Ward KA. 1991. The application of transgenic techniques for the improvement of domestic animal productivity[J]. Curr Opin Biotechnol, 2(6): 834-839. |
| Yen HH, Scheerlinck JP. 2013. Biological activity of ovine IL-23 expressed using a foot-and-mouth disease virus 2A self-cleaving peptide[J]. Cytokine, 61(3): 744-746. |
| Zon LI. 1999. Zebrafish: a new model for human disease[J]. Genome Res, 9(2): 99-100. |
 2015, Vol. 34
2015, Vol. 34




