扩展功能
文章信息
- 杜海迪, 侯天德, 曹旺杰, 程昉, 桑秋, 宗惠
- DU Haidi, HOU Tiande, CAO Wangjie, CHENG Fang, SANG Qiu, ZONG Hui
- 食物水限制对子午沙鼠肾和肝组织线粒体呼吸链复合物活性及相关自由基代谢的影响
- The Effect of Food Water Deprivation on the Activity of Mitochondrial Respiratory Chain Complexes and Correlated Free Radical Metabolism in the Kidney and Liver Tissues of Meriones meridianus
- 四川动物, 2015, 34(2): 276-280
- Sichuan Journal of Zoology, 2015, 34(2): 276-280
- 10.3969/j.issn.1000-7083.2015.02.019
-
文章历史
- 收稿日期:2014-07-04
- 接受日期:2014-12-05
子午沙鼠Meriones meridianus是我国西部荒漠半荒漠地区常见的啮齿类物种之一,是一种干燥性气候环境耐受的特殊种类。在季节性干旱缺水、气温变化等逆境胁迫条件下,机体水平衡是维持内环境稳定和动物得以生存的重要因素。有关啮齿类动物肝肾组织线粒体膜结构变化及其功能损伤有一定报道(柳君泽,高文祥,1998;Vyatkina et al.,2004;Heather et al.,2012),但国内外关于食物水限制应激对耐旱性啮齿类动物组织线粒体呼吸链复合物活性影响的研究尚未见报道。肾脏是调节水平衡的重要器官,而肝脏在维持血液能量物质平衡中起重要作用。机体水分不足可引起动物肾脏及肝脏组织产生一系列适应性应答反应。作为能量转换的重要组分,线粒体呼吸链复合物活性的变化反映该应激条件下组织细胞能量代谢水平。能量代谢的变化也可诱导活性氧产生和自由基生成增加,在不同条件下,自由基的生成与清除产生新的平衡的过程是机体适应性反应的重要阶段(França et al.,2007)。本文以子午沙鼠为实验材料,观察了不同时间段水限制对子午沙鼠肾和肝组织线粒体呼吸链复合物Ⅰ(CⅠ,NADH脱氢酶)、复合物Ⅱ(CⅡ,琥珀酸脱氢酶)、复合物Ⅲ(CⅢ,细胞色素C还原酶)、复合物Ⅳ(CⅣ,细胞色素C氧化酶)和超氧化物歧化酶(SOD)的活性及脂质过氧化产物丙二醛(MDA)生成的影响,为探讨食物水限制与组织代谢变化的关系和揭示子午沙鼠逆境响应的生理机制提供参考。 1 材料与方法 1.1 实验动物
健康性成熟子午沙鼠捕自甘肃省民勤县(位于腾格里沙漠和巴丹吉林沙漠之间,38°38'N,103°05'E),实验室分笼饲养,饲料以胡萝卜、蔬菜叶子等为主,室温(23±2)℃,相对湿度(35±10)%,自然采光。本实验采用实验室繁殖的第一代健康成年个体。 1.2 动物分组及处理
筛选出健康的成年沙鼠,体质量100 g±4.5 g;随机分为对照组、水限制3 d组、水限制6 d组和水限制9 d组,每组6只。对照组喂饲胡萝卜、蔬菜,食物水限制处理组饲以玉米、小麦种子等。 1.3 试剂与实验仪器
辅酶Q、十二烷基-β-D-麦芽糖苷、还原型辅酶Ⅰ(NADH)、鱼藤酮、氧化型细胞色素C、还原型细胞色素C、抗霉素A、牛血清白蛋白(BSA)、考马斯亮蓝G-250均购自Sigma公司;2,6-二氯酚靛酚(DCPIP)购自Fluka公司;SOD和MDA检测试剂盒购自南京建成生物工程研究所;叠氮钠(NaN3)、琥珀酸钠购自北京索莱宝科技有限公司;其余试剂为国产分析纯。实验仪器为恒温水浴锅,岛津紫外分光光度计(UV1800,日本)、高速冷冻离心机(Beckman,TGL-16M,美国)。 1.4 线粒体提取与活性测定 1.4.1 组织线粒体的制备
子午沙鼠禁水结束后断头采血,即刻处死,迅速取出肾和肝组织,生理盐水冲洗组织,称重并按重量体积比(1∶5)加入Tris-HCl缓冲液匀浆,制成10%的组织匀浆液,于2000×g、15 min低温离心2次,弃沉淀,将2次所得上清混合于12 000×g、15 min低温离心2次,弃上清所得沉淀制成线粒体悬浮液(谢颖等,2011)。-70 ℃保存待用。 1.5 线粒体呼吸链各组分活性及SOD活性、MDA含量测定
测定NADH、DCPIP、细胞色素C的摩尔吸光系数,参照Vyatkina等(2004)的方法测定组织CⅠ~Ⅳ活性,酶活性单位为μmol·(min·mg·pro)-1;蛋白浓度采用考马斯亮蓝法。SOD和MDA的测定按照检测试剂盒操作进行。 1.5.1 CⅠ活性测定
将20 μL线粒体悬浮液加入反应缓冲液(10 mmol Tris-HCl,pH8.0)随后分别加入辅酶Q(80 μmol)、BSA(1 mg·mL-1)、NaN3(0.25 mmol)、抗霉素A(0.4 μmol),混匀后37 ℃孵育3 min,再加入NADH(200 μmol)启动反应。总反应体系3 mL,下同。3 min内连续测定340 nm处NADH吸收值的变化[摩尔吸光系数ε=3.3 L·(mmol·cm)-1],根据每分钟A340nm值的变化反映CⅠ的活性。 1.5.2 CⅡ活性测定
将20 μL线粒体悬浮液加入pH7.4、50 mmol磷酸钾缓冲液,随后分别加入DCPIP(50 μmol)、NaN3(2 mmol)、鱼藤酮(2 μg·mL-1)、抗霉素A(2 μg·mL-1)、辅酶Q(25 μmol),混匀后37 ℃孵育3 min,再加入琥珀酸钠(20 μmol)启动反应。3 min内连续测定600 nm处吸收值的变化[摩尔吸光系数ε=13 L·(mmol·cm)-1],根据每分钟A600nm值的变化反映CⅡ的活性。 1.5.3 CⅢ活性测定
将20 μL线粒体悬浮液加入反应缓冲液(50 mmol Tris-HCl,1 mmol EDTA,250 mmol蔗糖,pH7.4)随后分别加入NaN3(2 mmol)、氧化型细胞色素C(50 μmol)混匀后37 ℃孵育3 min,再加入辅酶Q(80 μmol)启动反应。3 min内连续测定550 nm处细胞色素C[摩尔吸光系数ε=14.1 L·(mmol·cm)-1]吸收值的变化,根据每分钟 A550nm值的变化反映CⅢ的活性。 1.5.4 CⅣ活性测定
将20 μL线粒体悬浮液加入反应缓冲液(10 mmol Tris-HCl,25 mmol 蔗糖,120 mmol KCl,pH7.0)随后加入β-裂解剂(0.025%),混匀后37 ℃孵育3 min,再加入还原型细胞色素C(50 μmol)启动反应。3 min内连续测定550 nm处细胞色素C[摩尔吸光系数ε=14.1 L·(mmol·cm)-1]吸收值的变化,根据每分钟A550nm值的变化反映CⅣ的活性。 1.6 数据统计处理
试验所得数据均以均数±标准差表示,运用SPSS 17.0统计软件进行分析,多组均数间比较采用单因素方差分析方法(Duncan法),P<0.05为差异有统计学意义,P<0.01为差异有高度统计学意义。 2 结果 2.1 食物水限制对子午沙鼠体质量的影响
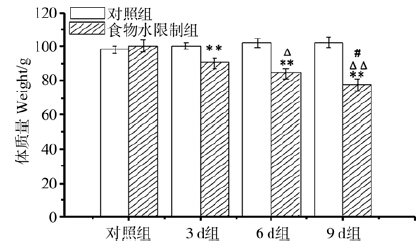
随着水限制时间的增加,子午沙鼠体质量较对照组均有显著的降低(F=58.520、P<0.001)(图 1),在水限制3 d、6 d、9 d期间,体质量下降分别为10.02%(P<0.001)、6.85%(P<0.001)、8.16%(P<0.001),其中3 d组体质量降低幅度较大。
|
|
图 1 子午沙鼠体质量的变化
Fig. 1 The change of weight of Meriones meridianus
注: 对照组、3 d组、6 d组、9 d组分别为食物水限制0 d、3 d、6 d、9 d; 下同。与0 d比较,**P<0.01; 与3 d比较,△P<0.05,△△P<0.01; 与6 d比较,#P<0.05。 Notes: Control group,3 d group,6 d group,9 d group were treated with 0 d,3 d,6 d,9 days of water restriction,respectively; the same below. Compared with 0 d,**P<0.01; compared with 3 d,△P<0.05 and △△P <0.01; compared with 6 d,#P<0.05. |
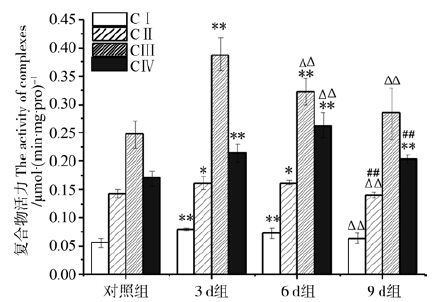
肾和肝脏组织CⅠ~Ⅳ活性在水限制期间均呈现显著变化。肾组织线粒体中CⅠ、CⅡ、CⅢ的活性在水限制期间均显著升高(F=9.774,P=0.008;)F=7.544,、P=0.011;F=21.890,P<0.001)。限水3 d时升高幅度较大,分别高于对照组的45.46%(P<0.001)、12.82%(P=0.015)、60.29%(P<0.001)(图 2)。CⅣ在限水6 d活性增加幅度较大(F=36.940,P<0.001),高于对照组的54.55%(P<0.001)。6 d组CⅢ的活性趋于降低。CⅠ~Ⅳ活性在第9天均显著降低。
|
|
图 2 肾组织线粒体呼吸链复合物Ⅰ~Ⅳ活性
Fig. 2 The activity of mitochondrial respiratory chain complexesⅠ-Ⅳ in kidney tissue
注: 与0 d比较,*P<0.05,**P<0.01; 与3 d比较,△P<0.05,△△P<0.01; 与6 d比较,#P<0.05,##P<0.01; 下同。 Notes: compared with 0 d,*P<0.05 and **P<0.01; compared with 3 d,△P<0.05 and △△P<0.01; compared with 6 d,#P<0.05 and ##P<0.01; the same below. |
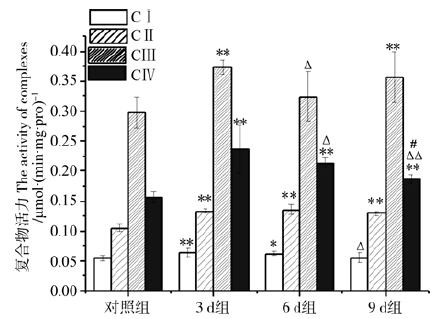
肝组织中CⅠ~Ⅳ的活性均呈现显著变化(F=4.207,P=0.018;F=41.100,P<0.001;F=6.172,P=0.004;F=16.572,P<0.001)。水限制3 d时最高,分别高于对照组的15.47%(P=0.008)、27.68%(P<0.001)、25.77%(P=0.001)、51.05%(P<0.001)(图 3);水限制9 d时CⅡ、CⅢ持续较高,CⅠ、CⅣ活性均降低,除CⅠ降至对照组水平,其余仍高于对照组(P<0.01)。
|
| 图 3 肝组织线粒体呼吸链复合物Ⅰ~Ⅳ活性 Fig. 3 The activity of mitochondrial respiratory chain complexesⅠ-Ⅳ in liver tissue |
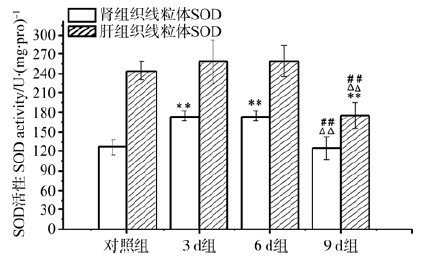
SOD活性和MDA含量变化与呼吸链复合物有所不同,肾中SOD活性随水限制时间增加而升高(F=35.729,P<0.001),水限制3 d与水限制6 d组达到峰值,分别较对照组高37.92%(P<0.001)、37.99%(P<0.001);水限制9 d组则显著降低(图 4)。肝中SOD活性于3 d和6 d未改变,而到9 d低于对照组(P<0.001)。食物水限制使肾和肝线粒体MDA含量升高(F=11.407,P=0.000;F=130.755,P<0.001),肾中MDA含量一直维持高于对照组的水平,而肝中MDA含量在第9天仍持续升高,较对照组高189.38%(P<0.001)(图 5)。
|
|
图 4 肾、肝组织线粒体SOD活性变化
Fig. 4 The change of mitochondrial SOD activity in kidney and liver tissue
注: 与0 d比较,*P<0.05,**P<0.01; 与3 d比较,△△P<0.01; 与6 d比较,##P<0.01; 下同。 Notes: compared with 0 d,*P<0.05 and **P<0.01; compared with 3 d,△△P<0.01; compared with 6 d,##P<0.01; the same below. |
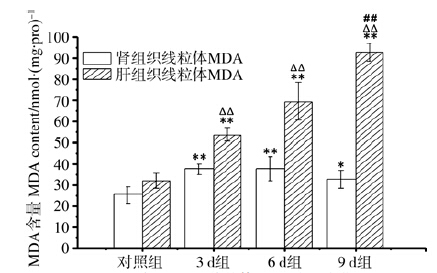
|
| 图 5 肾、肝组织线粒体MDA含量变化 Fig. 5 The change of mitochondrial MDA content in kidney and liver tissue |
食物水限制可引起子午沙鼠肾和肝组织代谢水平升高,线粒体呼吸链复合物4种成分活性升高,水限制3 d时升高幅度最大,6 d时维持高水平,而9 d时有所降低。除此以外,体质量在3 d时降低幅度也较大,因此在水限制的前3 d是机体相关组织代谢适应变化的重要阶段。子午沙鼠肾脏有很强的水分重吸收功能,可在长时间缺乏水摄入和机体水分蒸发的状况下减少水分的排出,增加肾脏对水重吸收以维持体液渗透压的稳定。研究表明,水与食物的剥夺可引起下丘脑释放抗利尿激素增加,可刺激肾小管上皮细胞水通道蛋白的表达与合成的增加,增加水分重吸收(Murillo-Carretero et al.,1999;Shibata et al.,2014)。食物水限制对肾组织线粒体代谢的影响尚未见报道,但有研究观察到哺乳动物在水限制3~5 d时,肾组织线粒体细胞质中的热休克蛋白HSP60被激活且表达增加,以维持细胞对水剥夺应激反应的耐受能力(Itoh et al.,2002)。因此限水期间肾小管上皮细胞对水分重吸收增加的同时,相关代谢增加,组织线粒体呼吸链复合物的活性增加。
肝组织线粒体呼吸链复合物活性反应与肾组织类似,在水限制3 d与6 d时升高幅度最大,而9 d时有所降低但仍高于对照水平。水与食物的剥夺可引起大鼠下丘脑精氨酸加压素表达增多,血浆中儿茶酚胺升高(Kiss et al.,1994)。一方面调节肾脏对水的重吸收,另一方面刺激相应组织代谢增加,以维持机体渗透压和血中葡萄糖等能量物质成分的稳定。对动物的研究观察到,水限制48~72 h时肝组织细胞色素P450表达量可增加3倍(Kim et al.,2001)。另有研究显示,机体在水限制时会减少80%的食物摄入,饥饿14 h时交感神经的兴奋性提高,脂肪组织中甘油三脂分解增加,肝脏对葡萄糖的吸收率降低,脂肪酸浓度增加,脂质氧化水平增加(Soeters et al.,2012),这有利于维持血液中能量物质的稳定,确保心、脑等重要器官的能量供给。在食物水限制初期,子午沙鼠肝组织线粒体呼吸链复合物活性显著升高与维持内环境稳定和血液能量物质平衡有关。随着水限制强度的增加,肝中能量物质储存的消耗和不足,组织呼吸酶活性也随之降低,这可能是长时间水限制使酶活性有所降低的原因之一。
长时间水摄入不足可引起组织一定程度的脱水、氧化与抗氧化失衡,导致自由基产生和抗氧化酶活性改变而造成组织细胞氧化应激(França et al.,2007)。子午沙鼠水限制3~6 d时肾组织线粒体由于代谢水平升高,SOD活性升高,而9 d时SOD活性降低。肝组织线粒体SOD活性在水限制过程中未见升高,9 d时SOD活性低于对照组。线粒体是产生自由基的重要部位,线粒体的电子传递、多种酶促反应及化合物的自氧化作用可不断产生自由基(于燕妮等,2001)。CⅠ和CⅢ是产生超氧阴离子的主要组分(Turrens,1997)。而呼吸链的其他复合物也可参与诱导超氧阴离子(O-2)自由基的生成而引起组织O-2与H2O2的积累(Kwong & Sohal,1998)。肾组织线粒体MDA含量在水限制3~9 d过程中维持较高水平,而肝组织线粒体MDA含量在9 d时仍进一步升高,提示2种组织线粒体自由基代谢水平的差异,肝中MDA含量的持续上升可能与长时间水摄入缺乏时生化反应和物质转化较为旺盛有关。血液因食物摄入减少导致能量物质不足而刺激肝脏的物质转化功能加强以补充循环能量物质是肝中MDA含量持续上升的原因。长时间水限制引起组织SOD活性的降低和呼吸链复合物活性的降低可能与能量物质储备的消耗和氧化抗氧化失衡产生自由基增多对细胞的损伤的双重因素所致。因此,食物水限制引起肾和肝组织线粒体呼吸链复合物活性的升高与肾对水的重吸收和肝代谢增加有关;长时间水限制下组织的相关酶活性难以持续维持高水平,部分原因可能与自由基水平升高有关。机体因水摄入不足所引发的细胞内分子适应机制、呼吸链功能变化,以及由此导致自由基变化的机理等还有待深入研究。
| 柳君泽, 高文祥. 1998. 缺氧大鼠脑线粒体的能量合成特点[J]. 第三军医大学学报, 20(6): 540. |
| 谢颖, 钟才高, 刘新民, 等. 2011. 大鼠肝细胞线粒体提取质量评价的研究[J]. 毒理学杂志, (2): 159-162. |
| 于燕妮, 王守立, 高勤, 等. 2001. SOD诱导剂对慢性氟中毒大鼠骨, 肝, 肾组织中自由基含量的影响[J]. 中国公共卫生, 17(4): 330-331. |
| França MB, Panek AD, Eleutherio ECA. 2007. Oxidative stress and its effects during dehydration[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 146(4): 621-631. |
| Heather LC, Cole MA, Tan JJ, et al. 2012. Metabolic adaptation to chronic hypoxia in cardiac mitochondria[J]. Basic Research in Cardiology, 107(3): 1-12. |
| Itoh H, Komatsuda A, Ohtani H, et al. 2002. Mammalian HSP60 is quickly sorted into the mitochondria under conditions of dehydration[J]. European Journal of Biochemistry, 269(23): 5931-5938. |
| Kim SG, Kim EJ, Kim YG, et al. 2001. Expression of cytochrome p-450s and glutathiones-transferases in the rat liver during water deprivation: effects of glucose supplementation[J]. Journal of Applied Toxicology, 21(2): 123-129. |
| Kiss A, Jezova D, Aguilera G. 1994. Activity of the hypothalamic pituitary adrenal axis and sympathoadrenal system during food and water deprivation in the rat[J]. Brain Research, 663(1): 84-92. |
| Kwong LK, Sohal RS. 1998. Substrate and site specificity of hydrogen peroxide generation in mouse mitochondria[J]. Archives of Biochemistry and Biophysics, 350(1): 118-126. |
| Murillo-Carretero MI, Ilundain AA, Echevarria M.1999. Regulation of aquaporin mRNA expression in rat kidney by water intake[J]. Journal of the American Society of Nephrology, 10(4): 696-703. |
| Shibata Y, Sano T, Tsuchiya N, et al. 2014. Gene expression and localization of two types of AQP5 in Xenopus tropicalis under hydration and dehydration[J]. Am J Physiol Regul Intergr Comp Physiol, 307(2): 44-56. |
| Soeters MR, Soeters PB, Schooneman MG, et al. 2012. Adaptive reciprocity of lipid and glucose metabolism in human short-term starvation [J]. American Journal of Physiology-Endocrinology and Metabolism, 303(12): E1397-E1407. |
| Turrens JF. 1997. Superoxide production by the mitochondrial respiratory chain[J]. Bioscience Reports, 17(1): 3-8. |
| Vyatkina G, Bhatia V, Gerstner A, et al. 2004. Impaired mitochondrial respiratory chain and bioenergetics during chagasic cardiomyopathy development[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 1689(2): 162-173. |
 2015, Vol. 34(2)
2015, Vol. 34(2)




