扩展功能
文章信息
- 胡馨月1, 王红1, 潘永全2, 齐云3, 纪超男1, 杨俊卿1, 何琴4*
- HU Xinyue1, WANG Hong1, PAN Yongquan2, QI Yun3, JI Chaonan1, YANG Junqing1, HE Qin4*
- 咖啡酸对慢性铝负荷大鼠肝损伤的保护作用
- Effects of Caffeic Acid on Liver Damage Induced by Chronic Aluminum Overload in Rats
- 四川动物, 2015, 34(2): 251-255
- Sichuan Journal of Zoology, 2015, 34(2): 251-255
- 10.3969/j.issn.1000-7083.2015.02.015
-
文章历史
- 收稿日期:2014-10-07
- 接受日期:2014-11-17
2. 重庆医科大学实验动物中心, 重庆 400016;
3. 西南药业股份有限公司, 重庆 400038;
4. 重庆医科大学附属第一医院肝胆外科, 重庆 400016
2. The Experimental Animal Center of Chongqing Medical University, Chongqing 400016, China;
3. Southwest Pharmaceutical Co.Ltd., Chongqing 400038, China;
4. Department of Hepatobiliary Surgery, The First Affiliated Hospital, Chongqing Medical University, Chongqing 400016, China
铝是地壳中含量第三的元素,广泛存在于自然界,由于其优良的理化性质,也被广泛运用于人们的日常生活中,如工业铝制品、铝制炊具、铝盐净水剂、食品添加剂、含铝药物等(Shaw & Marler,2013),人们不可避免对铝的摄入。铝并非机体所需微量元素,现有研究表明,铝可在体内蓄积并引发慢性疾病,如阿尔兹海默症(Gupta et al.,2005)、骨软化症(Malluche,2002)、贫血症(Barabasz & Albińska,2002)等。慢性铝负荷也可导致肝细胞结构损害和肝功能异常(Bogdanovi et al.,2008;Türkez et al.,2010;Viezeliene et al.,2011),但其机制至今尚不完全清楚。
5-脂氧酶(5-lipoxygenase,5-LO)是机体催化花生四烯酸(arachidonic acid,AA)生成白三烯(leukotrienes,LTs)的关键酶,与炎症相关性疾病密切相关(刘宏等,2004)。咖啡酸是从植物药中提取的天然化合物,为5-LO的竞争性抑制剂(Koshihara et al.,1984),具有抗氧化和抗炎症等活性。本研究采用慢性口服给铝致大鼠肝损伤模型,观察咖啡酸对肝脏的保护作用,并初步探讨其机制。 1 材料与方法 1.1 材料 1.1.1 实验动物
清洁级雄性SD大鼠28只,体质量(200±20)g,重庆医科大学实验动物中心提供[合格证书号:SCXK(渝)2010-0001]。 1.1.2 试剂与药品
D-葡萄糖酸钠、水合氯化铝(AlCl3·6H2O)均为国产分析纯,咖啡酸(南京青泽医药开发有限公司),总蛋白测定试剂盒、肝功能测试试剂盒、丙二醛(MDA)和超氧化物歧化酶(SOD)试剂盒(南京建成生物科技研究所),5-LO一抗(Goat polyclonal antibody,美国Santa Cruz公司),兔血清(北京鼎国),生物素标记二抗(Biotin-Rabbit anti-Goat IgG,美国Proteintech公司),SP试剂盒和二氨基联苯胺(DAB)染色试剂盒(北京中杉金桥)。 1.1.3 仪器
低温冷冻离心机(Thermo Hybaid,德国),荧光正置显微镜(Olympus,日本),全自动酶标仪(Spectra MaxM2,美国),恒温电热水浴锅(北京长风仪器公司,中国),超纯水系统(Millipore,美国)。 1.2 方法 1.2.1 葡萄糖酸铝溶液配制
称取17.9 g AlCl3·6H2O和9.9 g葡萄糖酸钠,溶于去离子水,待溶液清澈后用0.1 mol·L-1NaOH滴定溶液至pH5.0左右,最后用去离子水定容至100 mL(Al3+浓度为20 g·L-1)。咖啡酸用质量浓度为5 g·L-1的羧甲基纤维素钠(CMC-Na)于研钵中配置成混悬液。 1.2.2 动物分组与模型建立
28只SD大鼠随机分为4组(n=7),即空白对照组(990 mg·kg-1葡萄糖酸钠+CMC-Na溶液)、铝负荷模型组(200 mg·kg-1 Al3+溶液+CMC-Na溶液)、咖啡酸低剂量组(200 mg·kg-1 Al3+溶液+10 mg·kg-1咖啡酸)、咖啡酸高剂量组(200 mg·kg-1Al3+溶液+30 mg·kg-1咖啡酸),咖啡酸与CMC-Na溶液在灌胃给予葡萄糖酸钠和葡萄糖酸铝1 h后灌胃给予,每周5 d,连续20周。 1.2.3 肝功能测定
造模完成后,乙醚麻醉各组大鼠,眼内眦静脉丛取血1~1.2 mL,37 ℃水浴1 h,低温离心机3000 r·min-1离心10 min,取上层血清,按照试剂盒说明测定丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和碱性磷酸酶(ALP)的活性。 1.2.4 MDA含量和SOD活性测定
大鼠取血后断颈处死,分离部分肝组织,用生理盐水冲洗后制备10%组织匀浆液,按照试剂盒说明测定总蛋白及MDA含量,SOD活性。 1.2.5 组织病理学观察
每组分离3只大鼠部分肝组织,固定于4%多聚甲醛48 h,梯度乙醇脱水,石蜡包埋,4 μm切片,苏木精-伊红(HE)染色,显微镜下观察肝组织细胞形态结构变化。 1.2.6 5-LO免疫组织化学染色
肝组织石蜡切片常规脱蜡至水,柠檬酸缓冲液抗原修复,高温至沸,保温5 min,重复4次,室温冷却,3%H2O2 封闭30 min,PBS洗3次,0.1兔血清封闭30 min,1∶[KG-2mm]100 5-LO一抗封闭过夜,37 ℃复温30 min,PBS洗3次,生物素标记兔抗羊二抗封闭30 min,PBS洗3次,HRP封闭15 min,PBS洗3次,显微镜下滴加DAB至显色,流水冲洗,苏木精复染,梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察,用Image-pro plus 6.0软件分析免疫组化图片10×40倍光镜下不同3个视野进行光密度分析。 1.3 数据处理
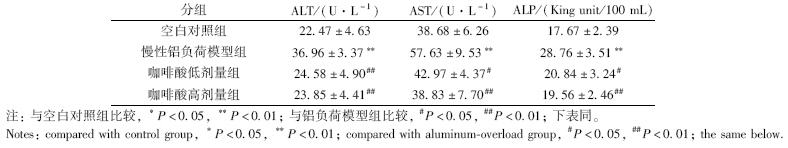
实验数据均以均数±标准差(x±s)表示,实验结果用SPSS 17.0进行统计学分析,组间比较用单因素方差分析,P<0.05表示差异具有统计学意义。 2 结果 2.1 咖啡酸对慢性铝负荷大鼠血清ALT、AST、ALP活性改变的影响
与对照组相比,铝负荷组大鼠血清中ALT、AST、ALP活性均显著升高(P<0.01);给予咖啡酸10 mg·kg-1、30 mg·kg-1后,ALT、AST、ALP活性均明显降低(P<0.05,P<0.01)(表 1)。
|
与空白对照组比较,铝负荷大鼠肝组织MDA含量显著升高(P<0.01);给予咖啡酸10 mg·kg-1、30 mg·kg-1后,MDA含量较模型组降低(P<0.05,P<0.01)。铝负荷大鼠肝组织SOD活性较空白对照组明显下降(P<0.01);给予咖啡酸10 mg·kg-1、30 mg·kg-1后,SOD活性显著上升(P<0.05,P<0.01)(表 2)。

|
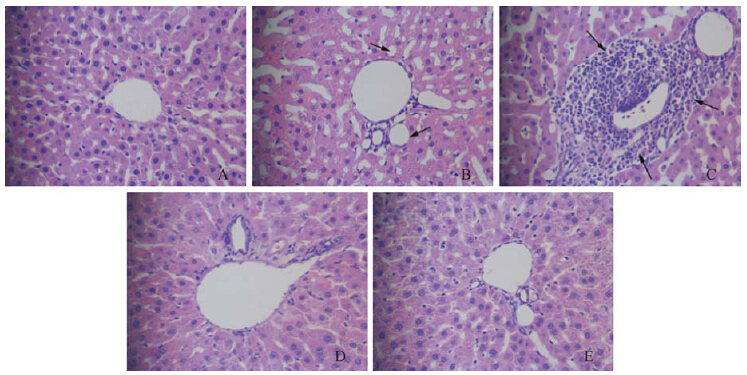
空白对照组大鼠肝细胞结构正常,肝索排列正常;慢性铝负荷大鼠肝组织出现空泡[KG(13x]变性、点状坏死,肝细胞排列紊乱;给予咖啡酸10 mg·kg-1、30 mg·kg-1后,肝细胞损伤明显减轻,肝索排列恢复正常(图版Ⅰ)。
|
|
图版Ⅰ咖啡酸对铝负荷大鼠肝组织病理学变化的影响(HE,×400)
Plate Ⅰ Effect of caffeic acid on liver damage induced by chronic aluminum overload in rats(HE,×400)
A. 空白对照组,B、C. 慢性铝负荷模型组,D. 咖啡酸低剂量组,E. 咖啡酸高剂量组。 A. control group,B and C. aluminum-overload group,D. caffeic acid 10 mg·kg-1 group,E. caffeic acid 30 mg·kg-1 group. |
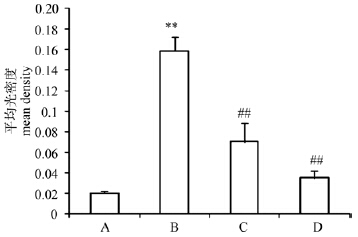
模型组大鼠肝组织血管周围肝细胞胞浆中5-LO表达明显,给予咖啡酸10 mg·kg-1、30 mg·kg-1后,肝细胞内5-LO表达明显减少;免疫组化图片用IPP 6.0分析各组平均光密度值可以看到,模型组大鼠肝细胞5-LO光密度值显著增加(P<0.01),给予咖啡酸10 mg·kg-1、30 mg·kg-1后,光密度值较铝负荷模型组大鼠显著降低(P<0.01)(图版Ⅱ,图 1)。

|
|
图版Ⅱ大鼠肝组织5-LO蛋白表达免疫组化结果(×200,×400)
Plate Ⅱ 5-LO protein expression in rat liver(×200,×400)
A. 空白对照组,B. 铝负荷模型组,C. 咖啡酸低剂量组,D. 咖啡酸高剂量组; 下图同。 A. control group,B. aluminum-overload group,C. caffeic acid 10 mg·kg-1 group,D. caffeic acid 30 mg·kg-1 group; the same below. |
|
| 图 1大鼠肝组织5-LO免疫组化平均光密度 fig. 1 Mean density of 5-LO protein expression in rat liver |
与铁、锰、铜、锌等离子不同,铝不是机体生理功能所必须的微量元素,其在体内蓄积会破坏这些金属离子在体内的平衡(Tomljenovic,2011)。有研究指出铝干扰线粒体电子传递链,生成大量活性氧自由基和Fe3+,最终导致线粒体功能损害,加速细胞凋亡(Wu et al.,2012)。本研究结果显示,灌胃给予葡萄糖酸铝20周后,大鼠肝细胞出现空泡性变,点状坏死,同时肝功能出现异常,ALT、AST和ALP活性均显著升高,这些结果提示铝负荷能够引起肝细胞形态改变和肝功能异常,在日常生活中应该限制铝的摄入。铝负荷模型组大鼠肝组织MDA含量升高,SOD活性降低,提示铝对肝脏的损伤机制可能是引起肝细胞氧化应激。由于活性氧自由基的积累,细胞膜磷脂特别容易受到氧化(Tomljenovic,2011),细胞膜磷脂在磷脂酶A2(phospholipase A2,PLA2)的作用下生成AA,5-LO催化AA生成LTs,继而发生炎症反应,而炎症反应又加重氧化应激损伤,形成恶性循环。
已有研究表明,5-LO基因缺失的ApoE(-/-)小鼠的巨噬细胞浸润减少,半胱天冬酶-3(caspase-3)和核转录因子-κB(NF-κB)活性降低,血清ALT水平下降,肝脏促炎细胞因子的表达减少,减轻肝脏炎性损伤(Martínez-Clemente et al.,2010),5-LO基因缺失能减少对乙酰氨基酚(APAP)引起的肝脏巨噬细胞浸润,细胞因子生成,减轻氧化应激和炎症反应,降低小鼠死亡率(Hohmann et al.,2013)。5-LO抑制剂能减弱肝毒性物质CCl4引起的肝脏氧化应激和炎症反应,降低基质金属蛋白酶-2(MMP-2)活性和金属蛋白酶组织抑制因子-2(TIMP-2)mRNA含量,减轻肝组织纤维化(Titos et al.,2005)。本研究结果发现,口服给予5-LO抑制剂咖啡酸后,能明显减轻铝负荷引起的肝细胞形态改变,显著降低ALT、AST、ALP活性,改善肝功能,减少MDA含量,升高SOD活性,抑制5-LO表达,从而减轻铝负荷引起的炎症反应,起到保护肝组织的作用。
综上所述,咖啡酸能减轻慢性铝负荷所致肝损伤,机制可能与其抑制5-LO表达、减轻氧化应激反应损伤有关。
| 刘宏, 周斌, 陈新生. 2004. 5-脂氧合酶的分子生物学研究[J]. 第二军医大学学报, 25(10): 1124-1126. |
| Barabasz W, Albińska D. 2002. Ecotoxicology of aluminium [J]. Polish J of Envir Stu, 11(3): 199-203. |
| Bogdanovi M, Janeva AB, Bulat P. 2008. Histopathological changes in rat liver after a single high dose of aluminum[J]. Arch Hig RadaToksikol, 59(2): 97-101. |
| Gupta VB, Anitha S, Hegde ML, et al. 2005. Aluminium in Alzheimer's disease: are we still at a crossroad?[J]. Cell Mol Life Sci, 62(2): 143-158. |
| Hohmann MS, Cardoso RD, Pinho-Ribeiro FA, et al. 2013. 5-lipoxygenase deficiency reduces acetaminophen-induced hepatotoxicity and lethality[J]. Biomed Res Int, http://dx.doi.org/10.1155/2013/6227046. |
| Koshihara Y, Neichi T, Murota S, et al. 1984. Caffeic acid is a selective inhibitor for leukotriene biosynthesis[J]. Biochim Biophys Acta, 792(1): 92-97. |
| Malluche HH. 2002. Aluminium and bone disease in chronic renal failure[J]. Journal Nephrol Dial Transplant, 17(2): 21-24. |
| Martínez-Clemente M, Ferré N, González-Périz A, et al. 2010. 5-lipoxygenase deficiency reduces hepatic inflammation and tumor necrosis factor α-induced hepatocyte damage in hyperlipidemia-prone ApoE-null mice[J]. Hepatology, 51(3): 817-827. |
| Shaw CA, Marler TE. 2013.Aluminum and the human diet revisited[J]. Commun Integr Biol, 6(6): e26369. |
| Titos E, Clària J, Planagumà A, et al. 2005. Inhibition of 5-lipoxygenase-activating protein abrogates experimental liver injury: role of Kupffer cells[J]. J Leukoc Biol, 78(4): 871-878. |
| Tomljenovic L. 2011. Aluminum and Alzheimer's disease: after a century of controversy, is there a plausible link?[J]. J Alzheimer's Dis, 23(4): 567-598. |
| Türkez H, Yousef MI, Geyikoglu F. 2010. Propolis prevents aluminium-induced genetic and hepatic damages in rat liver[J]. Food Chemi Toxicol, 48(10): 2741-2746. |
| Viezeliene D, Jansen E, Rodovicius H, et al. 2011. Protective effect of selenium on aluminium-induced oxidative stress in mouse liver in vivo[J]. Envir Toxicol Pharmacol, 31(2): 302-306. |
| Wu Z, Du Y, Xue H, et al. 2012. Aluminum induces neurodegeneration and its toxicity arises from increased iron accumulation and reactive oxygen species (ROS) production[J]. Neurobiol Aging, 33(1): 199.e1-12. |
 2015, Vol. 34(2)
2015, Vol. 34(2)




