扩展功能
文章信息
- 张凤娟, 王岩, 汪露, 李肇阳, 陶波林, 马纪
- ZHANG Fengjuan, WANG Yan, WANG Lu, LI Zhaoyang, TAO Bolin, MA Ji
- 中华齿刺甲抗冻蛋白基因的克隆及温度对其表达的影响
- Molecular Cloning of Antifreeze Protein Gene from Oodescelis chinensis (Coleoptera: Tenebrionidae) and Effect of Temperature on Its Expression
- 四川动物, 2015, 34(4): 518-523
- Sichuan Journal of Zoology, 2015, 34(4): 518-523
- 10.11984/j.issn.1000-7083.2015.04.007
-
文章历史
- 收稿日期:2014-10-30
- 接受日期:2015-01-23
抗冻蛋白(antifreeze protein,AFP)是变温生物为适应寒冷环境而产生的一类多肽或糖肽(DeVries & Wohlschlag,1969)。抗冻蛋白能够改变冰晶形态,抑制新的冰晶生长(Raymond & DeVries,1977)。抗冻蛋白具有来源、种类、结构、活性及功能的多样性。昆虫抗冻蛋白主要在鞘翅目的黄粉虫Tenebrio molitor、赤翅甲Dendroides canadensis、小胸鳖甲Microdera punctipennis、鳞翅目的云杉卷叶蛾Choristoneura fumiferana等少数昆虫中开展了研究(Duman et al.,1998; Liou et al.,1999;Doucet et al.,2002;赵干等,2005)。不同生物体内的抗冻蛋白具有众多同源异构体(isoform)(Davies et al.,2002)。其中,鞘翅目昆虫的抗冻蛋白都有数十个同源异构体,分子量在8.4~13 kD之间,空间结构为右手β螺旋,有6~10圈螺旋不等,每一圈由12个氨基酸TCTXSXXCXXAX(其中X代表任意氨基酸)组成(Graham et al.,1997;Liou et al.,1999)。在每个螺圈中重复出现的TCT基序被认为赋予昆虫抗冻蛋白极高的热滞活性(Liou et al.,1999;Graether et al.,2000)。TCT基序均规则地分布在所形成螺圈的一个侧面,能够与冰晶形成紧密的面对面的互补体(Leinala et al.,2002;Marshall et al.,2002),通过表面互补作用与冰晶结合(Liu et al.,2005)。在二者的结合中,Thr侧链与水分子起着关键作用。大量的Cys在抗冻蛋白内部发挥稳定蛋白质结构的作用。在上述12-氨基酸的重复单元中,一些关键氨基酸残基高度保守,它们在维持抗冻蛋白结构和功能的完整性中发挥重要作用。
昆虫越冬具有避冻(freeze avoiding)和耐冻(freeze tolerance)两种不同的策略(Lee & Denlinger,1991)。大多数昆虫采取避冻对策,通过产生抗冻蛋白和多元醇类小分子渗透保护物质来降低过冷却点,增加抗寒力,即降低结冰概率来提高存活率(Michaud & Denlinger,2007)。目前已研究了抗冻蛋白的鞘翅目昆虫都为避冻型昆虫。少数昆虫采取耐冻对策,即通过提高过冷却点促进胞外结冰,使细胞内亚细胞结构免受伤害(李毅平,龚和,1998)。有学者认为耐冻昆虫也产生抗冻蛋白,但目前对拟步甲科耐冻昆虫抗冻蛋白鲜见报道,对其促进结冰的机制也不清楚。
我们在前期的研究中发现,拟步甲科昆虫的抗冻蛋白氨基酸序列与其生活环境的微生境多样性可能存在一定的关系(侯小娟等,2013)。喜光喜温、日间活动的光滑鳖甲Anatolica polita,其抗冻蛋白氨基酸序列的变异性显著大于避光、不活动的小胸鳖甲抗冻蛋白。此外,拟步甲科昆虫抗冻蛋白基因的表达不仅受低温诱导,还受高温诱导,抗冻蛋白还具有高温保护功能(Qiu et al.,2013)。因此,有必要在不同类型的昆虫中开展广泛的研究,增强对抗冻蛋白的认识。中华齿刺甲Oodescelis chinensis为中国特有种,仅分布于我国新疆的荒漠和半荒漠地区,为夜行性昆虫,生活和越冬均在土壤表层腐殖质多且松软的地方,属耐冻昆虫,在低于过冷却点的温度下仍能存活,是研究耐冻昆虫抗冻蛋白的良好材料。本研究预期解决以下问题:(1)耐冻昆虫中华齿刺甲是否含有抗冻蛋白基因;(2)如有,其抗冻蛋白氨基酸序列变异性如何,是否比微环境较稳定的昆虫抗冻蛋白序列具有更大的变异性?(3)除了受低温诱导之外,中华齿刺甲抗冻蛋白基因的表达是否也受高温诱导?本研究将有助于扩展我们对昆虫抗冻蛋白功能的认识。 1 材料和方法 1.1 试虫
中华齿刺甲成虫及幼虫于2013年春季采自新疆大学校园林带下,由新疆大学黄人鑫教授鉴定。 1.2 主要试剂
Taq DNA聚合酶、DNaseI、RNase inhibitor、dNTP Mixture Oligo(dT)、Reverse Transcriptase M-MLV(RNase H)、DNA Marker、pMD18-T 测序载体均为TaKaRa公司产品; DNA片段回收试剂盒购自生工生物工程(上海)股份有限公司;TRIzol RNA提取液为Invitrogen公司产品;大肠杆菌Trans 5α是北京全式金生物技术有限公司产品;其余所用的化学试剂(无水乙醇、三氯甲烷、异丙醇等)均为国产分析纯。 1.3 昆虫总RNA提取及cDNA的合成
利用TRIzol试剂提取总RNA。将中华齿刺甲成虫和幼虫各3只放入液氮中冷冻;将整只虫体放入液氮预冷的研钵中,研磨至粉末状;将粉末倒入含有1 mL TRIzol裂解液的1.5 mL离心管中,充分混匀。其他后续步骤按说明书操作。将获得的RNA沉淀,于室温干燥2 min后,溶于30~40 μL 焦碳酸二乙酯(DEPC)水中。用1%琼脂糖凝胶电泳检测总RNA的提取结果。取3 μL RNA溶于含27 μL DEPC水的新离心管中,定量。取1 μg RNA在20 μL反应体系中用反转录酶Rtase M-MLV合成cDNA,反转录反应在42 ℃保温1 h,然后冰上冷却,分装后在-80 ℃保存。 1.4 抗冻蛋白基因的扩增
根据本课题组已知的几种拟步甲科昆虫抗冻蛋白基因的保守序列设计PCR扩增引物。上游引物为:5′-ATGGCTTTGACAACAAAATGGTTA-3′,下游引物为:5′-TTAACGTTTGGGACACCCTGTT-3′。以cDNA为模版扩增中华齿刺甲的抗冻蛋白基因。PCR反应条件为:95 ℃5 min;95 ℃30 s,56 ℃30 s,72 ℃30 s,34个循环;72 ℃7 min,4 ℃保存。将PCR产物用纯化试剂盒纯化后,与pMD18-T载体连接,16 ℃过夜。取大肠杆菌DH5α感受态细胞25~50 μL进行转化,过夜培养。挑取阳性单克隆置于600 μL的LB培养基中(含终浓度为1%的氨苄青霉素),37 ℃振荡过夜培养。取过夜培养的菌液进行PCR检测,有目的条带的单克隆送生工生物工程(上海)股份有限公司测序。 1.5 抗冻蛋白基因的序列分析
利用DNAMAN 6.0软件将测序得到的中华齿刺甲抗冻蛋白基因Ocafp的若干个cDNA序列翻译成氨基酸序列,然后使用MEGA 5.0软件,采用邻接法(neighbor-joining,NJ)对氨基酸序列进行聚类分析,利用泊松模型(Poisson model)计算进化距离。通过1000次重复检测系统发育树的置信度和每个分支节点的支持度。 1.6 试虫处理
低温处理以-4 ℃和5 ℃分别处理中华齿刺甲成虫1 h、3 h、5 h。4~5 ℃是对昆虫常用的冷驯化温度,-4 ℃是准噶尔盆地南缘冬季地表下5 cm的平均温度。高温以38 ℃、40 ℃和42 ℃分别处理中华齿刺甲成虫1 h、3 h、5 h。这3个温度的选择是参考我们对其他荒漠拟步甲科昆虫抗冻蛋白基因表达研究所采用的处理温度,以便进行比较。每个处理设3个重复。利用TRIzol试剂提取不同处理的中华齿刺甲总RNA,反转录合成cDNA。 1.7 实时荧光定量PCR与统计分析
根据Ocafp序列设计荧光定量RT-PCR引物,Ocafp基因的上游引物为:5′-TGACAACAAAATGGTTAATAGTAGCA-3′,下游引物为:5′-ATTCGACAATCACTGCATTCTACTG-3′;内参β-actin的上游引物为:5′-GCGACTTGACCGACTACCT-3′,下游引物为:5′-CCGCACGATTCCATACCC-3′。将Ocafp克隆至pMD18-T载体上,构建标准质粒,用构建好的标准质粒制作标准曲线。以不同温度及不同时间处理的昆虫的cDNA为模版,进行荧光定量PCR,反应条件为:95 ℃10 min,58 ℃30 s,72 ℃30 s,40个循环。利用2-△△Ct法计算相对表达量,以室温未做处理的昆虫为对照,计算中华齿刺甲抗冻蛋白基因mRNA水平的倍数变化。实验结果利用Graphpad Prism医学生物统计学软件进行单因素方差分析及多重比较。 2 结果 2.1 中华齿刺甲总RNA的提取
琼脂糖凝胶电泳结果显示,所提取昆虫总RNA条带完整清晰,具有甲虫总RNA的典型特征,即28S RNA自剪切为2个约18S的片段(图 1)。总RNA的OD260/OD280的值在1.8~2.0之间,表明提取的RNA纯度较好。
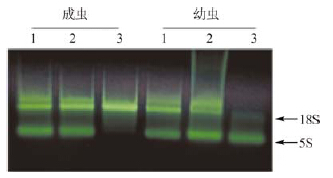
|
| 图 1 中华齿刺甲总RNA的凝胶电泳检测结果 Fig. 1 Results of argrose gel electrophoresis of total RNA from Oodescelis chinensis |
通过测序得到了数十个长短不同的中华齿刺甲抗冻蛋白基因的cDNA序列,命名为Ocafp,其中10个cDNA序列大小较接近,分别编码95~107个氨基酸,预测分子量为10 576.14±532.02,都含有信号肽编码序列。DNAMAN 6.0软件分析表明,这些基因所编码的OcAFP蛋白都具有拟步甲科昆虫抗冻蛋白的序列结构特点,即具有5~6个数目不等的保守基序TCTXSXXCXXAX(其中X代表任意氨基酸)(图 2)。多序列比对发现,在高度保守的信号肽序列中I9和V10存在倒位现象,个别序列的I13和V14存在突变。在保守基序TCTXSXXCXXAX中,除了重复单位a和f之外,高度保守的TCT有多种变异现象,其中TCT中的第一个T在不同的序列中有突变为A、E、S、K、V的情况,第二个T有突变为I、V的现象;C端都以保守的STGCPKR结尾。此外,OcAFP1、OcAFP7、OcAFP8还存在序列插入现象。

|
|
图 2 中华齿刺甲抗冻蛋白氨基酸序列的多序列比对
Fig. 2 Multiple alignments of the amino acid sequences of antifreeze protein from Oodescelis chinensis
N端框中序列为信号肽序列,保守的TCT基序由长条框标出,可以看出其中有较多变异; 重复单位分别标注为a~f。 Signal peptide sequences are boxed at the N-termini,conserved TCT motifs are marked by strip boxes,which shows many different mutations; repeat units are marked as a~f. |
利用MEGA 5.0软件对这10个OcAFP氨基酸序列做聚类分析(图 3),可以看出有2大类,3种主要类型,划分类型的主要特征是TCT中有无变异。其中,OcAFP2、OcAFP3、OcAFP6、OcAFP10聚为一支,为第一类,它们的TCT中没有变异;而另一类群的TCT中都有变异,依据序列的长度和TCT变异的类型又聚为2个分支,其中,OcAFP1、OcAFP7、OcAFP8聚为一支;OcAFP4、OcAFP5、OcAFP11聚为一支。
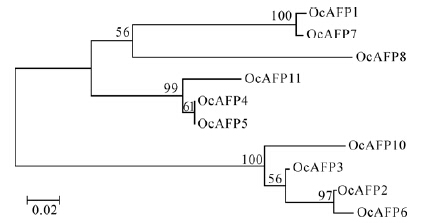
|
| 图 3 中华齿刺甲抗冻蛋白序列的聚类分析 Fig. 3 Cluster analysis of antifreeze protein sequences from Oodescelis chinensis |
从美国国立生物技术信息中心(NCBI)中搜索黄粉虫、光滑鳖甲、云杉卷叶蛾、大洋鳕鱼Zoarces americanus和胡萝卜Daucus carota抗冻蛋白的氨基酸序列,与中华齿刺甲抗冻蛋白序列在MEGA 5.0软件中进行同源性分析,构建系统进化树(图 4),结果表明,不同类群物种的抗冻蛋白序列有很大的差异,在进化上可能具有不同的来源。而同为鞘翅目拟步甲科的中华齿刺甲、黄粉虫和光滑鳖甲的抗冻蛋白很接近,可聚为一支,表明它们有共同的祖先。而分类地位上相距较远的鳞翅目云杉卷叶蛾、大洋鳕鱼及胡萝卜抗冻蛋白序列分别独立成一支。

|
| 图 4 中华齿刺甲抗冻蛋白与其他生物抗冻蛋白氨基酸序列的进化树分析 Fig. 4 Phylogenetic tree of antifreeze proteins from Oodescelis chinensis and other species |
将中华齿刺甲抗冻蛋白与其他生物抗冻蛋白的氨基酸序列进行相似性比较,可见OcAFP2与黄粉虫抗冻蛋白TmAFP和光滑鳖甲抗冻蛋白ApAFP同源,一致性分别为75.60%和57.30%,而与鳞翅目云杉卷叶蛾抗冻蛋白CfAFP、大洋鳕鱼抗冻蛋白ZaAFP、胡萝卜抗冻蛋白DcAFP的相似性较低,一致性仅为8.00%~18.60%。
| OcAFP 2 | 黄粉虫 TmAFP | 光滑鳖甲 ApAFP | 云杉卷叶 蛾CfAFP | 大洋鳕鱼 ZaAFP | 胡萝卜 DcAFP | |
| OcAFP2 | 100% | |||||
| 黄粉虫 TmAFP | 75.60% | 100% | ||||
| 光滑鳖甲 ApAFP | 57.30% | 66.20% | 100% | |||
| 云杉卷叶 蛾CfAFP | 18.60% | 15.10% | 14.30% | 100% | ||
| 大洋鳕鱼 ZaAFP | 8.00% | 9.00% | 6.60% | 7.90% | 100% | |
| 胡萝卜 DcAFP | 9.70% | 8.50% | 8.70% | 10.20% | 9.90% | 100% |
| 注Notes: 黄粉虫Tenebrio molitor,GenBank登录号(accession number)AFD54427.1; 云杉卷叶蛾Choristoneura fumiferana,GenBank登录号(accession number)AAK19296.1; 大洋鳕鱼Zoarces americanus,GenBank登录号(accession number)AAA49348.1; 胡萝卜Daucus carota,GenBank登录号(accession number)AFW20019.1; 光滑鳖甲Anatolica polita,GenBank登录号(accession number)ADU57095.1。 |
由于抗冻蛋白是在低温下发挥作用的,因此,将中华齿刺甲成虫在低温-4 ℃和5 ℃分别处理1 h、3 h、5 h,实时荧光定量PCR检测全部抗冻蛋白基因的表达(图 5:A,B)。结果表明,5 ℃和-4 ℃都能显著诱导Ocafp的表达,其中-4 ℃的诱导效果弱于5 ℃。在-4 ℃处理1 h时Ocafp的表达量达到室温对照的2.7倍,随着-4 ℃处理时间的延长,Ocafp的表达量呈下降再上升的变化趋势。由于个体误差较大,统计学不显著(F3,7=1.831,P=0.229)。在5 ℃处理时,从1 h到3 h表达量逐渐上升至室温对照的3.9倍,显著高于室温对照(F3,8=5.837,P=0.020),到5 h时则降至室温对照的50%。
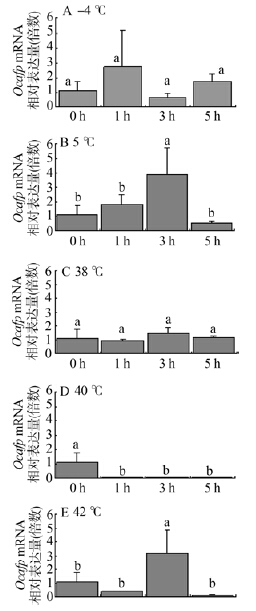
|
| 图 5 Ocafp在不同温度处理下的相对表达量 Fig. 5 Relative mRNA levels of Ocafps at different temperatures |
鉴于其他鞘翅目昆虫抗冻蛋白基因的表达还受高温诱导(Qiu et al.,2013),将中华齿刺甲成虫在38 ℃、40 ℃和42 ℃下分别处理1 h、3 h、5 h,然后实时荧光定量PCR检测Ocafp的表达(图 5:C~E)。结果显示,与室温对照相比,38 ℃对Ocafp的表达无显著影响(F3,8=0.946,P=0.463)。40 ℃可极显著地抑制Ocafp的表达(F3,8=7.934,P=0.009);而42 ℃高温可显著提高Ocafp的表达水平(F3,7=5.762,P=0.026),在42 ℃处理3 h时,Ocafp的表达量达到室温对照的2.8倍,5 h时降为室温对照的10%。实验结果表明,中华齿刺甲抗冻蛋白基因的表达受40 ℃高温抑制,42 ℃高温诱导。 3 讨论
中华齿刺甲是仅分布于新疆荒漠和半荒漠地区的中国特有种,生活在腐殖质多且松软的土壤表层,并在地表的冻土层越冬,冬季采集后在手心稍微捂暖就可自由活动,属耐冻昆虫。我们对中华齿刺甲抗冻蛋白基因进行克隆,得到了众多长短不一、序列变异多样的异构体,命名为Ocafp。其中有10个序列长度较接近,分别编码95~107个氨基酸,预测分子量为10 576.14±532.02,都含有信号肽编码序列。序列分析显示,Ocafp的编码序列OcAFP具有拟步甲科昆虫抗冻蛋白氨基酸序列的显著特征,即含有数目不等的重复单位:TCTXSXXCXXAX(其中X表示任意氨基酸)(Liou et al.,1999)。
对OcAFP1~OcAFP11进行聚类分析显示,中华齿刺甲抗冻蛋白可以分为3种类型,在进化的初期分为两大支,第一支为OcAFP2、OcAFP3、OcAFP6、OcAFP10,除了在信号肽部分有变异外,这一类群的TCT保守基序没有变异,与已经发表的黄粉虫和小胸鳖甲抗冻蛋白的序列非常相似(刘忠渊等,2006;侯小娟等,2013);第二支则相反,保守的TCT基序几乎都发生了变异。该支又分为2组,其中OcAFP4、OcAFP5、OcAFP11为一组,它们的重复单位c~f中,TCT分别突变为TCV、SCV和TCI,在其他拟步甲昆虫抗冻蛋白序列中很少见(刘忠渊等,2006;侯小娟等,2013);OcAFP1、OcAFP7、OcAFP8聚为另一组,其中OcAFP1和OcAFP7的所有TCT都突变为TCI,而OcAFP8的TCT变异更多样,重复单位a、e、f的TCT分别突变为ECI、KCT和VCT,在VCT前还有1个S插入,这些突变在已报道的拟步甲昆虫抗冻蛋白中尚未发现。此外,中华齿刺甲抗冻蛋白C端都以保守的STGCPKR结尾,这与其他昆虫抗冻蛋白也不相同(侯小娟等,2013)。上述序列分析结果表明,耐冻昆虫中华齿刺甲的抗冻蛋白与其他避冻拟步甲昆虫抗冻蛋白有相同的起源,但是又与它们有很大的变异。这种高度变异性可能与中华齿刺甲生活在土壤表层,并在地表冻土层过冬,经历更严酷的环境温度变化有关。在比较微生境相对稳定的小胸鳖甲和微生境变化较大的光滑鳖甲的抗冻蛋白序列时,也发现有类似情况(侯小娟等,2013)。
低温能够诱导昆虫抗冻蛋白基因的表达,在中华齿刺甲中也是如此,这与抗冻蛋白的功能是一致的。本研究中5 ℃和-4 ℃都能显著诱导Ocafp的表达,5 ℃左右的低温是提高昆虫耐寒性的常用冷驯化温度。本研究中,5℃和- 4℃处理中华齿刺甲后抗冻蛋白基因的表达水平只有2.7~3.9倍,远远低于对小胸鳖甲和光滑鳖甲低温处理的效果,这可能与实验是在夏季昆虫中进行有关,早春和秋季昆虫的抗冻蛋白基因表达对低温的响应很强烈(Hou et al.,2010)。
近年来发现,昆虫抗冻蛋白基因的表达除了受低温诱导外,还受干旱、饥饿(Graham et al.,2000)、重金属胁迫(Pedersen et al.,2006)及高温诱导(Qiu et al.,2013),提示昆虫抗冻蛋白可能还具有抗冻以外的其他功能,比如保水、热保护功能(Qiu et al.,2013)。本研究中,中华齿刺甲抗冻蛋白基因的表达受42 ℃高温诱导,对38 ℃无响应,对40 ℃则表现为受到抑制。本研究所设置的这3个高温对Ocafp基因表达的影响截然不同,今后有必要设置细致的温度处理,进行深入研究。我们在研究高温对不同昆虫抗冻蛋白基因表达的影响时发现,它们受诱导的具体温度不同,黄粉虫是38 ℃,小胸鳖甲是42 ℃,光滑鳖甲在42 ℃受到抑制,在47 ℃处理1 h后,呈上调趋势。高温对拟步甲科昆虫抗冻蛋白基因表达影响的机制还不清楚,与昆虫对生境适应性的关系也有待研究。热处理可提高果蝇的耐寒性,这与热处理刺激热激蛋白的表达可能有关(Sejerkilde et al.,2003)。
本研究表明,拟步甲科耐冻昆虫中华齿刺甲也含有抗冻蛋白基因,但其氨基酸序列的变异性大于目前已发表的拟步甲科避冻昆虫抗冻蛋白氨基酸序列。中华齿刺甲抗冻蛋白基因的表达不仅受低温诱导,也受42 ℃高温诱导。拟步甲科昆虫抗冻蛋白基因表达受高温诱导可能具有普遍性,提示抗冻蛋白可能还具有其他非抗冻功能。
| 侯小娟, 梁娜, 邱立明, 等. 2013. 荒漠甲虫光滑鳖甲和小胸鳖甲抗冻蛋白基因及其3'-UTR的序列分析[J]. 应用昆虫学报, 50(5): 1219-1229. |
| 李毅平, 龚和. 1998. 昆虫低温生物学: 昆虫耐冻的生理生化适应机制[J]. 昆虫知识, 35(6): 364-369. |
| 刘忠渊, 王芸, 吕国栋, 等. 2006. Tenebrio molitor抗冻蛋白家族cDNA片段的克隆、序列分析及原核表达[J]. 遗传, 28(12): 1532-1540. |
| 赵干, 马纪, 薛娜, 等. 2005. 新疆准噶尔小胸鳖甲抗冻蛋白基因的克隆和抗冻活性分析[J]. 昆虫学报, 48(5): 667-673. |
| Davies PL, Baardsnes J, Kuiper MJ, et al. 2002. Structure and function of antifreeze proteins[J]. Philosophical Transactions of the Royal Society of London Series B-Biological Sciences, 357: 927-935. |
| DeVries AL, Wohlschlag DE. 1969. Freezing resistance in some Antarctic fishes[J]. Science, 163(3871): 1073-1075. |
| Doucet D, Tyshenko MG, Davies PL, et al. 2002 A family of expressed antifreeze protein genes from the moth, Choristoneura fumiferana[J]. European Journal of Biochemistry, 269: 38-46. |
| Duman JG, Li N, Verleye D, et al. 1998. Molecular characterization and sequencing of antifreeze proteins from larvae of the beetle Dendroides canadensis[J]. Journal of Comparative Physiology B, 168: 225-232. |
| Graether SP, Kuiper MJ, Gagné SM, et al. 2000. Beta-helix structure and ice-binding properties of a hyperactive antifreeze protein from an insect[J]. Nature, 406(6793): 325-328. |
| Graham LA, Liou YC, Walker VK, et al. 1997. Hyperactive antifreeze protein from beetles[J]. Nature, 388(6644): 727-728. |
| Graham LA, Walker VK, Davies PL. 2000. Developmental and environmental regulation of antifreeze proteins in the mealworm beetle Tenebrio molitor[J]. European Journal of Biochemistry, 267(21): 6452-6458. |
| Hou F, Ma J, Liu X, et al. 2010. Seasonal changes in antifreeze protein gene transcription and water content of beetle Microdera punctipennis (Coleoptera, Tenebrionidae) from Gurbantonggut desert in central Asia[J]. Cryo Letters, 31(5): 359-370. |
| Lee RE, Denlinger DL. 1991. Insects at low temperature[M]. New York: Chapman and Hall: 513. |
| Leinala EK, Davies PL, Doucet D, et al. 2002. A beta-helical antifreeze protein isoform with increased activity[J]. Biological Chemistry, 277(36): 33349-33352. |
| Liou YC, Thibault P, Walker VK, et al. 1999. A complex family of highly heterogeneous and internally repetitive hyperactive antifreeze proteins from the beetle Tenebrio molitor[J]. Biochemistry, 38(35): 11415-11424. |
| Liu K, Jia ZC, Chen G, et al. 2005. Systematic size study of an insect antifreeze protein and its interaction with ice[J]. Biophysical Journal, 88(2): 953-958. |
| Marshall CB, Daley ME, Graham LA. 2002. Identification of the ice-binding face of antifreeze protein from Tenebrio molitor[J]. FEBS Letters, 529(2-3): 261-267. |
| Michaud MR, Denlinger DL. 2007. Shifts in carbohydrate, polyol, and amino acid pools during rapid cold hardening and diapause-associated cold hardening on flesh flies (Sarcophaga crassipalpis): a metabolomic comparison[J]. Journal of Comparative Physiology B, 177: 753-763. |
| Pedersen SA, Kristiansen E, Hansen BH, et al. 2006. Cold hardiness in relation to trace metal stress in the freeze-avoiding beetle Tenebrio molitor[J]. Journal of Insect Physiology, 52(8): 846-853. |
| Qiu L, Mao X, Hou F, et al. 2013. A novel function-thermal protective properties of an antifreeze protein from the summer desert beetle Microdera punctipennis[J]. Cryobiology, 66(1): 60-68. |
| Raymond JA, DeVries AL. 1977. Adsorption inhibition as a mechanism of freezing resistance in polar fishes[J]. Proceedings of the National Academy of Sciences of the United States of America, 74(6): 2589-2593. |
| Sejerkilde M, Sørensen JG, Loeschcke V. 2003. Effects of cold and heat hardening on thermal resistance in Drosophila melanogaster[J]. Journal of Insect Physiology, 49(8): 719-726. |
 2015, Vol. 34
2015, Vol. 34




