2. 沈阳药科大学 药学院,沈阳 110016;
3. 沈阳化工大学 应用化学学院,沈阳 110020
2. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China;
3. College of Applied Chemistry, Shenyang University of Chemical Technology, Shenyang 110020, China
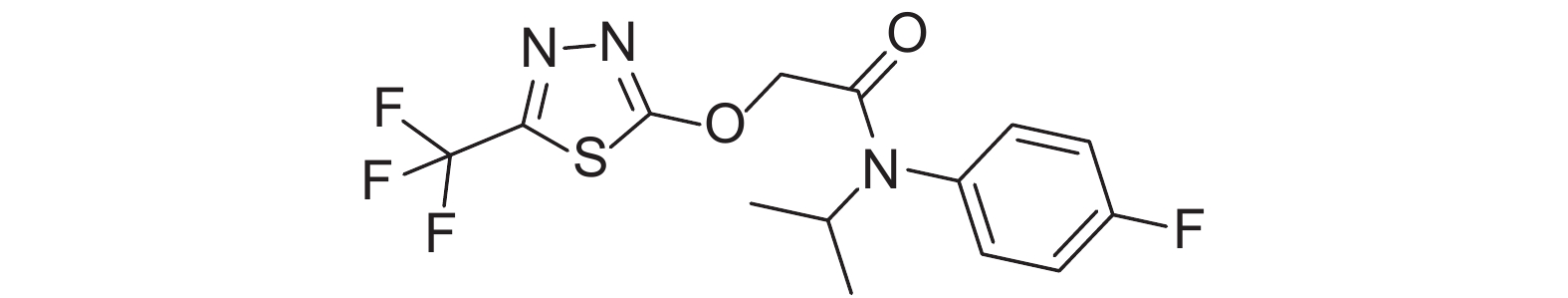
氟噻草胺属芳氧乙酰胺类除草剂,其结构式见图式 1,主要用于玉米、大豆、向日葵等作物上[1],适用于多数一年生禾本科杂草以及一些阔叶杂草的防除[1-2],其作用机制为阻止杂草细胞的分裂,抑制其生长[2]。氟噻草胺具有选择性高、毒性低、作用范围广以及合成简单等优点[3-4]。目前,对氟噻草胺的研究多集中于其药效上[5-6],而对其在环境中的残留检测相对较少[7-8],未见其在大鼠体内组织中分布行为的报道,而相关研究对于农药研发、毒性作用机制研究、毒物的安全性评价以及中毒解救都有重要意义。鉴于此,本研究拟建立大鼠组织中氟噻草胺的LC-MS/MS分析方法[9-10],并采用该方法对氟噻草胺灌胃给药后在大鼠体内各组织中的分布行为进行研究,旨在为其毒性安全性评价提供科学依据。
|
图式1 氟噻草胺结构式 Scheme1 Structural formula of flufenacet |
1 材料与方法 1.1 仪器、药剂与试剂
LC-20A高效液相色谱系统 (日本Shimadzu公司);API 3200质谱联用仪,配备Analyst 1.5.1操作软件和LightSight 2.3软件 (美国AB Sciex公司);Sartorius BSA3233S电子天平[赛多利斯科学仪器 (北京) 有限公司];Milli-Q超纯水机 (美国Millipore公司);KQ5200B型超声清洗器 (昆山市超声仪器有限公司);Sigma 3K15高速离心机 (美国Sigma公司);QT-1涡旋振荡器 (上海琪特分析仪器有限公司);T18 basic新型高速分散机 (德国IKA公司)。
氟噻草胺 (flufenacet,纯度 > 98%) 和啶氧菌酯 (picoxystrobin,内标,纯度 > 98%) 标准品 (沈阳化工研究院有限公司)。乙腈 (色谱纯,美国Fisher Scientific公司);甲酸 (色谱纯,上海阿拉丁公司);CO 2/O2 (麻醉用);超纯水 (自制)。
1.2 供试动物雄性SD大鼠由辽宁长生生物技术有限公司提供,许可证号:SCXK (辽) 2015-0001。动物室温度19~26 ℃,空气相对湿度40%~70%,光照条件为150~300 lx (光照/黑暗各12 h),噪音在60 dB以下。动物的使用经沈阳化工研究院有限公司安全评价中心伦理委员会审批通过。动物饲料为全价颗粒饲料,置于塑料动物盒内饲养,自由进食、饮水。大鼠经适应性饲养5 d后单只饲养于不锈钢笼内,染毒前禁食18 h,均采用灌胃方式染毒,染毒量为每千克体重10 mL。
1.3 检测条件色谱条件:Phenomenex反向C18色谱柱 (50 mm × 4.6 mm,5 μm);流速0.6 mL/min;柱温为室温;进样量10 μL;流动相为体积分数72%的乙腈-水溶液 (含体积分数0.1%甲酸);等度洗脱。
质谱条件:电喷雾离子源 (ESI);离子源温度450 ℃;喷雾电压5 000 V;碰撞气压力20.704 kPa;去簇电压28.00 V;入口电压5.20 V;碰撞入口电压20.73 V;碰撞出口电压11.00 V;雾化气1压力344.827 kPa;雾化气2压力 384.615 kPa,气帘气压力172.413 kPa;多反应监测模式 (MRM);氟噻草胺与内标 (啶氧菌酯) 定量离子对分别为364.10/194.20和368.10/145.20,碰撞能量分别为14.00和26.00 eV。
1.4 生物样品采集与处理 1.4.1 生物样品采集通过预试验可知,400 mg/kg剂量的氟噻草胺未导致SD大鼠死亡,给药后1 h 血浆中出现原药,为吸收相,7 h血浆中原药浓度达到高峰,为分布相,48 h血浆中原药浓度达到最大浓度的5%,为消除相。据此试验设2个处理组:空白溶剂对照组和400 mg/kg染毒组。随机取雄性大鼠16只,包括空白溶剂对照组1只,400 mg/kg染毒组15只,给药前禁食18 h。经口灌胃法一次性给药方式,给药量为每千克体重10 mL,给药后将动物放回饲养笼内,自由进食、饮水。分别于处理后1、7和48 h取染毒组大鼠5只,48 h取对照组大鼠,采用V (CO2)∶V (O2) = 80∶20麻醉,腹主动脉放血后解剖,取心、肝、脾、肺、肾、脑、肌肉、睾丸、脂肪、胃、大肠和小肠,分别用生理盐水和蒸馏水冲洗后,装入惰性塑料袋中,于–20 ℃保存,待测。
1.4.2 样品处理 1.4.2.1 给药样品将样品解冻并剪碎、混匀,分别称取染毒组各组织0.5 g,加入1 mL体积分数70%的乙腈水溶液,匀浆,于15 000 r/min、4 ℃下离心10 min;取上清液100 μL,依次加入20 μL内标 (心脏、肝脏、脾、肺、肾脏、脑、肌肉、睾丸和脂肪添加0.050 mg/L的啶氧菌酯,大肠、小肠和胃添加25.0 mg/L的啶氧菌酯),20 μL乙腈,涡旋混匀;再加入200 μL乙腈,涡旋混匀后于15 000 r/min、4 ℃下离心10 min;取上清液适量,用体积分数70%的乙腈水溶液稀释2倍,待LC-MS/MS测定。
1.4.2.2 空白对照样品取空白组织,加入2倍体积量的70%乙腈水溶液,匀浆,于15 000 r/min、4 ℃下离心10 min,取上清液作为空白对照组织上清液。
1.5 标准溶液配制及标准曲线绘制 1.5.1 标准储备液分别称取氟噻草胺和啶氧菌酯标准品适量,用乙腈溶解并定容至100 mL,得到质量浓度为1 000 mg/L的氟噻草胺和啶氧菌酯标准储备液,于 –20 ℃下保存,备用。
1.5.2 内标溶液量取啶氧菌酯标准储备液,用乙腈稀释,得到质量浓度分别为0.050和25.0 mg/L的内标溶液。
1.5.3 标准曲线绘制用乙腈稀释氟噻草胺标准储备液,得到2个系列的氟噻草胺标准工作溶液,分别为:0.010、0.020、0.040、0.075、0.125、0.250和0.500 mg/L;0.500、1.00、2.00、5.00、12.5、25.0和50.0 mg/L。
1.5.4 质控样品取空白对照组织上清液100 μL,其中心脏、肝脏、脾、肺、肾脏、脑、肌肉、睾丸和脂肪中依次加入20 μL 0.050 mg/L的啶氧菌酯和20 μL氟噻草胺标准工作溶液 (0.010、0.020、0.040、0.075、0.125、0.250和0.500 mg/L),大肠、小肠和胃中加入20 μL 25.0 mg/L的啶氧菌酯和20 μL氟噻草胺标准工作溶液 (0.500、1.00、2.00、5.00、12.5、25.0和50.0 mg/L),涡旋混匀;再加入200 μL乙腈,涡旋混匀后于15 000 r/min、4 ℃下离心10 min;取上清液适量,用体积分数70%的乙腈水溶液稀释2倍,分别获得标准曲线样品:0.002、0.004、0.008、0.015、0.025、0.050和0.100 mg/L (心、肝、脾、肺、肾、脑、肌肉、睾丸、脂肪);0.10、0.20、0.40、1.0、2.5、5.0和10 mg/L (大肠、小肠、胃)。按1.3节的条件测定,绘制标准曲线。
1.6 方法的精密度与准确度用乙腈稀释氟噻草胺标准储备液,得到2个系列的质控样品工作溶液:0.025、0.1和0.4 mg/L以及1.25、5.00 和40.0 mg/L。取空白组织混合上清液100 μL,按1.5.4节操作,获得质控样品 (QC) 的质量浓度分别为:0.005、0.02和0.08 mg/L (心脏、肝脏、脾、肺、肾脏、脑、肌肉、睾丸、脂肪),0.25、1.0和8.0 mg/L (大肠、小肠、胃)。每个浓度5次重复,连续测定3个批次 (不同天进行)。根据各批次的标准曲线,计算QC样品的测得浓度,将测得浓度进行方差分析,计算方法的精密度和准确度。
1.7 基质效应及提取效率考察以肝组织为代表进行基质效应及提取效率考察:1) 取0.005、0.02和0.08 mg/L 3个水平的氟噻草胺QC样品,每个水平重复5次,按1.3节的条件测定,获得相应峰面积 (SA);2) 取大鼠空白肝组织匀浆上清液100 μL,先加入200 μL的乙腈,混匀,其余按1.4.2.2节操作,每个水平重复5次,按1.3节的条件测定,获得相应峰面积 (SB);3) 以流动相替代空白肝组织匀浆上清液,加入0.005、0.02和0.08 mg/L 3个水平的氟噻草胺标准工作溶液,按1.5.4节操作,每个水平重复5次,按1.3节的条件测定,获得相应峰面积 (SC)。以SA/SB × 100%计算提取回收率 (R),以SB/SC × 100%计算待测物基质效应 (ME)。
1.8 储藏稳定性试验以肝组织为代表进行储藏稳定性考察:样品经体积分数为70%的乙腈水溶液提取后:1) 于25 ℃下储藏4 h;2) 于2~8 ℃下储藏24 h;3) 经历3次冻融循环;4) 于 −20 ℃下储藏15 d;5) 于 −20 ℃下储藏30 d。按1.4.2.1节进行样品前处理,按1.3节条件测定,重复3次,得到稳定性样品的峰面积 ( Sa)。取0.005和0.08 mg/L 2个水平的氟噻草胺标准工作溶液,按1.5.4节操作,按1.3节的条件测定,每个水平重复3次,得到新鲜配制样品的峰面积 (Sb)。以Sa/Sb为指标考察氟噻草胺在大鼠肝组织中的稳定性。
2 结果与分析 2.1 色谱条件的优化分别考察了乙腈-水、甲醇-水以及乙腈-乙酸铵作为流动相对氟噻草胺响应值的影响。结果发现:以乙腈-水作为流动相时,氟噻草胺的响应值较高,在水相中添加体积分数0.1%的甲酸后,增加了在ESI+ 模式下的离子化效率。同时还考察了有机相和水相不同配比对待测物及内标响应值的影响。结果发现:以体积分数72%乙腈水溶液 (含0.1%甲酸) 作为流动相时,氟噻草胺与内标的响应值较高,出峰时间合适,内源性物质对样品测定无影响。
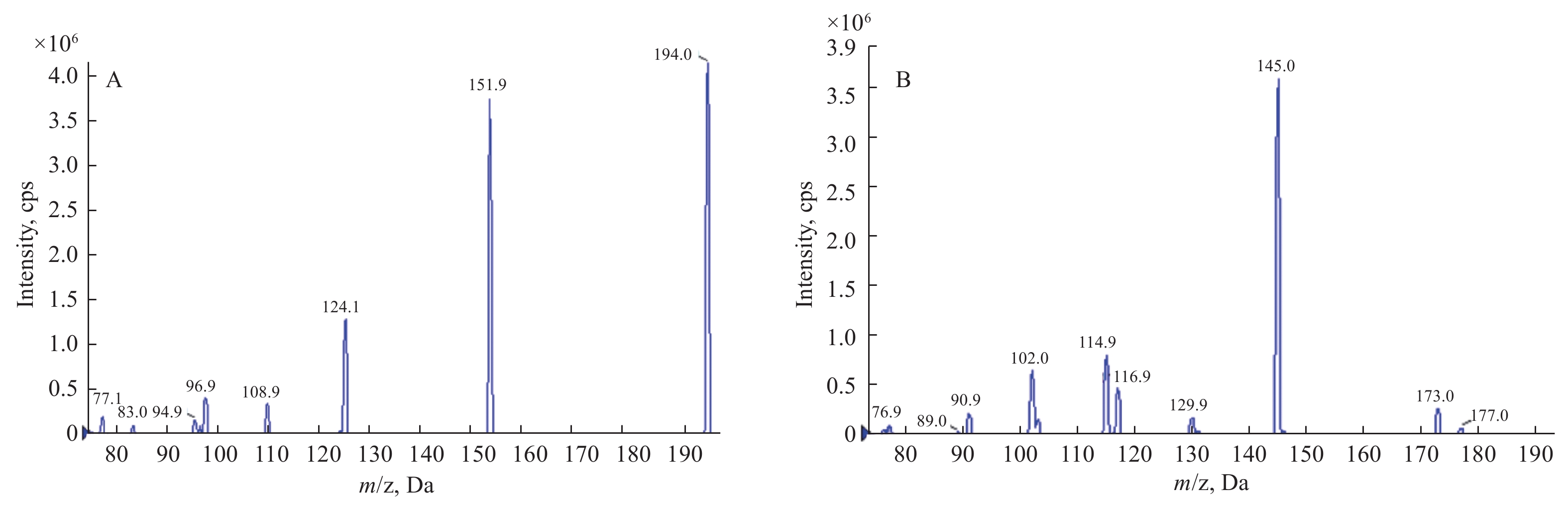
2.2 质谱条件的选择在 m/z 50~500范围内对氟噻草胺及内标啶氧菌酯的标准溶液进行全扫描,获得其总离子流图 (TIC)。根据所得TIC,确定各化合物的母离子 m/z 值,分别以母离子进行产物离子扫描,确定定性和定量离子对;通过多反应监测模式扫描优化碰撞能量、去簇电压及碰撞出口电压等参数。氟噻草胺与啶氧菌酯的二级全扫描质谱图见图1,优化后的结果见1.3节。
|
图 1 氟噻草胺[M+H](A) 与啶氧菌酯 (B) 的二级全扫描质谱图 Fig. 1 Full scan product ion mass spectra of [M+H]+ of flufenacet (A) and picoxystrobin (B) |
2.3 方法的专属性
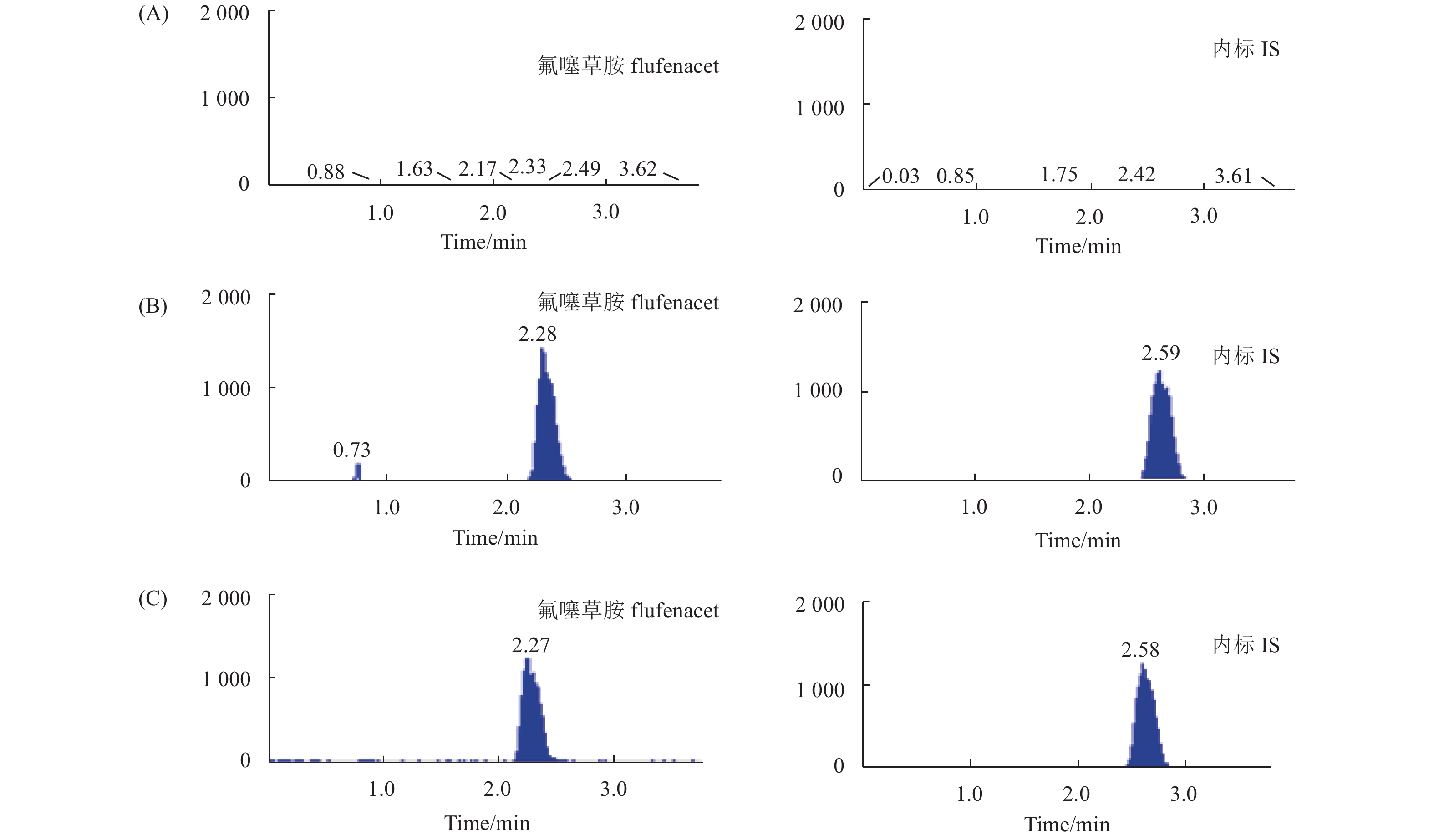
以大鼠肝组织为代表进行考察:取空白肝组织上清液 100 μL,除内标溶液用20 μL乙腈替代外,其余按 1.5.4节操作,获得相应的空白肝组织色谱图 (图2A);用空白肝组织上清液稀释质量浓度0.01 mg/L的氟噻草胺标准工作溶液,得到氟噻草胺定量下限 (LLOQ) 样品,按1.5.4节操作,获得相应的色谱图 (图2B);取染毒组大鼠肝组织,按1.4.2.1节操作,获得相应的色谱图 (图2C)。结果表明,肝组织中的内源性物质对氟噻草胺和内标啶氧菌酯的测定没有影响。
|
A:大鼠肝组织空白样品;B:大鼠肝组织空白样品添加氟噻草胺与内标啶氧菌酯;C:染毒组肝组织样品。 A: Rat blank liver tissue;B: Rat blank liver tissue spiked with flufenacet and picoxystrobin;C: Rat liver tissue sample after exposure. 图 2 大鼠肝组织不同样品的色谱图 Fig. 2 Representative chromatograms of different samples of rat liver tissue |
2.4 标准曲线及定量下限
在保证试验正确度的前提下,为提高试验效率,同时满足各组织样品浓度测定要求,分别用混合基质匀浆液A、B和C (A:心脏、肝脏、脾和肺的混合匀浆液;B:肾脏、脑、肌肉、睾丸和脂肪的混合匀浆液;C:小肠、大肠和胃的混合匀浆液) 制作标准曲线。以氟噻草胺与内标啶氧菌酯的峰面积比值为y,以氟噻草胺的质量浓度为x,根据加权最小二乘法得到标准曲线方程,结果表明:氟噻草胺在0.002~0.1 mg/L和 0.1~10 mg/L范围内线性关系均良好 (表1)。同法得到定量下限 (LLOQ) 样品,重复6次,其相对标准偏差 (RSD) 和相对偏差 (RE) 均小于20%,证明其LLOQ可以达到0.002 mg/L。
|
|
表 1 氟噻草胺在组织匀浆液中的线性方程、相关系数及线性范围 Table 1 Linear equation, correlation coefficients and linear ranges for the determination of flufenacet in tissue homogenate |
2.5 方法的精密度与准确度
结果 (表2) 表明:心脏、肝脏、脾脏、肺、肾脏、脑、肌肉、睾丸和脂肪在0.005、0.02和0.08 mg/L 3个添加水平下,小肠、大肠和胃在0.25、1.0和8.0 mg/L 3个添加水平下,氟噻草胺在大鼠各组织匀浆液中的回收率在87%~118%之间,相对标准偏差在1.3%~11%之间,满足生物样品测定要求[10]。
|
|
表 2 氟噻草胺在大鼠各组织匀浆液中的提取回收率及相对标准偏差 (n = 5) Table 2 Recoveries and RSDs of flufenacet in tissue homogenates (n = 5) |
2.6 基质效应及提取效率
由表3结果可知:氟噻草胺在0.005~0.08 mg/L添加水平下,大鼠肝组织中的提取回收率在96%~106%之间,满足生物样品测定要求[10],基质不影响待测物的测定。
|
|
表 3 氟噻草胺在肝组织匀浆液中的提取回收率与基质效应 (n = 5) Table 3 Extraction recovery and matrix effect for the determination of flufenacet in liver homogenate (n = 5) |
2.7 稳定性考察结果
结果 (表4) 表明:氟噻草胺稳定性在95%~104%之间,表明组织样品在上述处理条件和储存条件下均稳定。
|
|
表 4 氟噻草胺在肝组织匀浆液中的稳定性 Table 4 Stability of flufenacet in liver homogenate |
2.8 组织样品的测定
大鼠经单次灌胃染毒氟噻草胺原药400 mg/kg后,分别于1、7和48 h采集脏器组织样品,按照1.4.2.1节进行样品前处理,按1.3节条件测定,结果见表5。从中可看出:氟噻草胺在各脏器大部分组织中的峰值出现在给药7 h后,48 h后降到各自峰值的5%以下,基本不蓄积。
|
|
表 5 给药后不同时间氟噻草胺在大鼠体内组织中的含量 (
|
3 讨论与结论
组织分布研究是农药毒物代谢动力学研究中的重要组成部分,通过了解农药的组织分布特点有助于确定毒物发挥毒性的靶点,进而对于揭示农药的毒性作用机制、毒物的安全性评价以及中毒解救都具有重要意义。目前,关于氟噻草胺的代谢研究较少,未见其在大鼠体内组织分布的相关报道。
本研究建立了一种高效、专属、灵敏的液相色谱-串联质谱 (LC-MS/MS) 分析方法,对乙腈-水、甲醇-水以及乙腈-乙酸铵等流动相进行了考察,结果发现:以乙腈-水作为流动相时,氟噻草胺的响应值较高,在水相中添加0.1%的甲酸,可增加其在ESI+ 模式下的离子化效率;同时还对流动相的配比进行了考察,确定了体积分数72%乙腈水溶液 (含0.1%甲酸) 的流动相比例。此外,本试验还对质谱条件中的各参数进行了优化。
对建立的LC-MS/MS分析方法进行了验证,符合生物样品分析方法验证要求[10]。采用验证后的分析方法对氟噻草胺灌胃给药后在大鼠体内各组织的分布行为进行了研究。结果表明:氟噻草胺在各脏器组织中均有分布,给药1 h后,除睾丸外,其他组织中均能检测到氟噻草胺,说明氟噻草胺能够快速、广泛地分布于全身各脏器组织中;比较不同脏器组织药物浓度随时间的变化,发现各脏器组织中的药物浓度呈先升后降的变化趋势,除肾脏、脑和小肠中氟噻草胺峰值出现在给药后1 h外,大部分组织中氟噻草胺峰值出现在给药后7 h,其含量由高到低依次为:胃、大肠、小肠、肺、脂肪、心脏、肝脏、肌肉、脾脏、脑、睾丸、肾脏,至48 h时,除脂肪、胃、脾脏及睾丸外其他组织中药物含量均已降至各自峰值的5%以下,表明氟噻草胺在大鼠体内消除较快,基本不蓄积;氟噻草胺除了在胃、大肠及小肠中含量较高外,在肺中分布也较多,这可能与肺血流量比较大有关。氟噻草胺可快速通过血-脑屏障,可能具有神经毒性,同时还可以通过血-睾屏障到达睾丸,表明在该400 mg/kg给药剂量下,其可能具有生殖毒性。
本研究主要对氟噻草胺母体在大鼠体内的分布特点进行了考查,为了全面阐明氟噻草胺的毒性作用机制,还需对其在体内的代谢情况进行研究,后续应在此基础上进行大鼠体内代谢产物的研究。
| [1] |
European Commission. Review report for the active substance flufenacet.[EB/OL]. (2003-07-03). http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/public/?event=activesubstance.detail&language=EN&selectedID=1380.
|
| [2] |
刘宝擅. 氟噻草胺的合成研究[D]. 石家庄: 河北科技大学, 2013. LIU B S. Study on the synthesis process of flufenacet[D].Shijiazhuang: Hebei University of Science and Technology, 2013. |
| [3] |
黎育生, 周桂东, 沈宜全, 等. 氟噻草胺的合成[J]. 现代农药, 2002, 1(2): 8-10. LI Y S, ZHOU G D, SHEN Y Q, et al. Synthesis of flufenacet[J]. Mod Agrochem, 2002, 1(2): 8-10. DOI:10.3969/j.issn.1671-5284.2002.02.003 |
| [4] |
陈杰, 沈建. 氟噻草胺原药的高效液相色谱分析[J]. 农药科学与管理, 2010, 31(9): 46-48. CHEN J, SHEN J. Analysis of flufenacet by HPLC[J]. Pest Sci Admin, 2010, 31(9): 46-48. DOI:10.3969/j.issn.1002-5480.2010.09.015 |
| [5] |
SOLTANI N, DEEN B, BOWLEY S, et al. Effects of pre-emergence applications of flufenacet plus metribuzin on weeds and soybean (Glycine max)
[J]. Crop Prot, 2005, 24(6): 507-511. DOI:10.1016/j.cropro.2004.09.018 |
| [6] |
KLEEMANN S G L, BOUTSALIS P, GILL G S, et al. Applications of pre-emergent pyroxasulfone, flufenacet and their mixtures with triallate for the control of Bromus diandrus (ripgut brome) in no-till wheat (Triticum aestivum) crops of southern Australia
[J]. Crop Prot, 2016, 80: 144-148. DOI:10.1016/j.cropro.2015.11.010 |
| [7] |
BAZOOBANDI M, YADURAJU N T, KULSHRESTHA G. Analysis of flufenacet in soil, wheat grain and straw by gas chromatography[J]. J Chromatogr A, 2000, 886(1-2): 319-322. DOI:10.1016/S0021-9673(00)00429-5 |
| [8] |
WANG D H, ZHANG Q, ZHENG Y, et al. Estimating the combined toxicity of flufenacet and imazaquin to Sorghum with pore water herbicide concentration
[J]. J Environ Sci, 2016, 41: 154-161. DOI:10.1016/j.jes.2015.04.031 |
| [9] |
农药登记毒理学试验方法: GB15670—2017[S]. 北京: 中国农业出版社, 2017. Toxicological test methods of pesticides for registration: GB15670—2017[S]. Beijing: China Agricultural Press, 2017. |
| [10] |
生物样品定量分析方法验证指导原则: 中华人民共和国药典2015年版. 四部[M]. 北京: 中国医药科技出版社, 2015: 363. Guidance on bioanalysis: Method validation and analysis of study samples: The pharmacopoeia of the People's Republic of China 2015 Edition . Vol Ⅴ[M]. Beijing: China Medical Science Press, 2015: 363. |
 2019, Vol. 21
2019, Vol. 21


