2. 加州理工学院 环境科学与工程系,美国帕萨迪纳 加州 91126;
3. 齐齐哈尔大学 化学与化学工程学院,黑龙江 齐齐哈尔 161006
2. Department of Environmental Science and Engineering, California Institute of Technology, Pasadena 91126, California, United States;
3. College of Chemistry and Chemical Engineering, Qiqihar University, Qiqihar 161006, Heilongjiang Province, China
酰胺类除草剂在农田化学除草剂中占有重要地位,仅次于有机磷除草剂[1]。目前广泛使用的酰胺类除草剂共15种,包括乙草胺、异丙草胺、丙草胺、敌草胺和异丙甲草胺等,主要用于去除水稻、玉米和大豆等农作物田的杂草[2]。化学除草剂在给农作物产量带来巨大提升的同时,残留的除草剂也会对水体、土壤及大气环境造成污染,进而危害人类健康[3]。
目前针对酰胺类除草剂残留的检测技术主要包括色谱法[4-5]和色谱-质谱联用法[6-7]。色谱法属于初筛方法,干扰较多,容易出现假阳性结果,需要进一步确认。相对色谱法而言,色谱-质谱联用法具有检测限低、灵敏度高和线性范围宽等优点,但需要固相萃取、分散液液微萃取等复杂的前处理过程,测试仪器及人力成本均较高,且不易现场检测。因此,方便、快捷且灵敏度高的农药检测技术成为目前农药检测的一项重要需求。
光传感技术是指分析对象被识别时,发光中心的光物理特性会被影响,例如发射峰位置发生偏移、荧光强度发生变化以及新峰的出现等,从而将识别信息转化为光学信号,达到传感的目的。该技术具有操作简单、反应灵敏度高等特点,在阴阳离子以及小分子检测上已展现出巨大的应用潜力[8]。本研究拟设计一种基于金属有机框架材料 (MOF) 的光传感技术来实现水体中残留酰胺类除草剂的可视化检测。
MOF也被称为多孔配位聚合物,指的是一类以金属离子或金属簇为节点,通过配位方式与有机配体连接构建而成的新型多孔晶体材料[9],具有特殊的拓扑结构、规则的基元排列和高度的结构可设计性[10]。MOF中金属中心的选择具有多样性,几乎覆盖了元素周期表中所有金属离子,包括主族金属离子、过渡金属离子和镧系金属离子等,其中镧系金属离子由于其独特的4f电子层结构,不仅具有发光效率高、荧光寿命长、斯托克斯位移大以及发光颜色纯度高等光学特性[11],而且还具有发光丰富的特点,其发射峰包含紫外、可见和近红外波段[12],因此选择不同镧系金属离子作为MOF材料的节点时,可以得到具有不同发光特征峰的镧系金属有机框架材料 (Ln-MOF)。镧系金属离子铽 (Tb3+) 和铕 (Eu3+) 除了上述光学性质外,还具有对环境敏感的特性,其发光强度会受配位原子和配位环境的影响[13],因而常常被用于光传感技术。
目前以单一镧系金属离子Tb3+或Eu3+作为节点的MOF,已被制备并成功应用于Fe3+、Cu2+、Hg2+ 等金属离子[14-15]和丙酮、甲醇、乙醇、异丙醇等挥发性有机小分子[16-17]的检测中,其主要原理是:金属离子和小分子的存在会增强或猝灭有机配体与镧系金属离子之间能量的传递,从而导致镧系金属离子发光强度和荧光寿命发生改变。但该类单掺杂镧系金属的发光强度和荧光寿命往往受检测环境的影响,准确度不高[18],而双掺杂镧系金属离子的MOF可以通过不同发光中心之间的荧光强度比值实现自我矫正,从而减小单镧系金属离子掺杂发光的不稳定性,提高检测准确度[19]。本研究拟在已有研究Tb (BTC)(H2O)1.5 • (DMF) (MOF-76,其中BTC为均苯三甲酸,1, 3, 5-benzenetricarboxylate)[20]的基础上,掺入对环境敏感的Eu3+ 离子,得到Tb3+ 和Eu3+ 离子双掺杂的Ln-MOF,并用于光传感检测水体中酰胺类除草剂残留。该Ln-MOF在光传感的应用上具有以下优势:一是MOF中镧系离子被BTC中的羧酸固定在特殊的位置,形成具有永久孔隙率的刚性结构[20],可以在水中稳定存在,而且去除客体分子后,不会破坏材料的结构,能够重复使用;二是MOF的多孔性结构可以增加农药与 MOF中金属位点或有机配体的结合几率[21],提高检测灵敏度;三是配体BTC具有大的共轭π键,在紫外光下具有大的摩尔吸光系数,对激发光的吸收强,而且还可以通过“天线作用”将吸收的光传递给镧系离子,进一步提高镧系离子的发光效率[22],增强检测效果。
本研究采用2种方法制备Tb3+和Eu3+离子共掺杂的Ln-MOF,通过比较其结构和性质确定最优的合成方法;采用所制备的Ln-MOF对水体中残留的5种酰胺类除草剂进行检测,初步探索了可视化定性检测农药残留的可行性;通过进一步的浓度梯度试验,探索了定量检测农药浓度的可能性;最后通过对用湖水配制的酰胺类除草剂进行检测,验证该方法在实际水体中检测除草剂残留的可行性。
1 材料与方法 1.1 药剂与仪器95.1%乙草胺 (acetochlor) 原药、95.0%异丙草胺 (propisochlor) 原药和95.5%丙草胺 (pretilachlor) 原药,山东侨昌化学有限公司;95.0%敌草胺 (napropamide) 原药和97.0%异丙甲草胺 (metolachlor) 原药,武汉远成科技发展有限公司,各农药信息见表1。六水合硝酸铽和六水合硝酸铕,纯度99.9%,美国Strem化学有限公司;配体均苯三甲酸 (BTC),纯度为99%,百灵威科技有限公司。N, N-二甲基甲酰胺 (DMF),色谱级 (≥99.9%) 和无水甲醇,分析纯,阿拉丁试剂 (上海) 有限公司,所有试剂均未经进一步提纯,直接使用。
|
|
表 1 供试除草剂的基本信息 Table 1 Information about the test herbicides |
FP-8500荧光光谱仪 (JASCO日本分光公司);SU-8010冷场发射扫描电子显微镜 (日本日立公司);XRD-7000 X射线衍射仪 (日本岛津公司);VO200真空干燥箱 (德国Memmert)。
1.2 Ln-MOF的合成和表征 1.2.1 Ln-MOF的合成1.2.1.1 水热法 分别准确称取六水合硝酸铽0.119 8 g、六水合硝酸铕0.006 9 g和有机配体均苯三甲酸0.08 g于50 mL离心管中,加入6.4 mL超纯水溶解后,加入8 mL乙醇和8 mL DMF,混合均匀后转移至35 mL水热反应釜中,60 ℃下反应2 d。将反应产物转移至50 mL离心管中,8 000 r/min离心,去除上清液,固体用20 mL DMF和甲醇溶液各洗涤3次,氮吹后于150 ℃下真空 (2 × 103 Pa) 干燥24 h。
1.2.1.2 微波法 分别准确称取六水合硝酸铽0.082 4 g、六水合硝酸铕0.008 4 g和有机配体均苯三甲酸0.04 g于35 mL的微波反应管中,加入20 mL DMF,超声处理使试剂完全溶解后放入微波合成仪中,在微波功率150 W、温度150 ℃条件下反应15 min。洗涤、干燥步骤与水热法一致。
1.2.2 Ln-MOF表征采用扫描电子显微镜对Ln-MOF的表面形貌以及微区成分进行表征,获得扫描电镜 (SEM) 结果;利用X射线衍射仪,以Cu Kα为射线源[λ = 1.5406 Å (0.154 06 nm)],测试了X射线衍射谱 (XRD),扫描范围为5°~45°;在激发光源为290 nm下,用荧光光谱仪测试其发射光谱。
1.3 供试除草剂可视化检测试验 1.3.1 定性检测试验1 mmoL/L除草剂水溶液的配制:分别称取0.05 mmoL的供试除草剂于50 mL比色管中,加入3 mL甲醇作为助溶剂,涡旋,待农药溶解后用超纯水定容至50 mL。用锡箔纸包裹,现配现用,以防止发生光降解。
在50 mL锥形瓶中,加入5 mg Ln-MOF样品和25 mL、1 mmoL/L的各除草剂水溶液,涡旋后,静置2 h。抽滤,与农药结合后的Ln-MOF将保留在滤纸上,将滤纸在真空条件 (2 × 103 Pa) 下100 ℃干燥12 h。于254 nm紫外灯下照射观察其颜色变化,根据不同的发光颜色定性检测不同的除草剂。收集滤纸上与农药结合后的Ln-MOF并测定其荧光光谱,进一步比较5种除草剂农药对Tb3+ 和Eu3+ 发光强度的猝灭程度,分析不同农药对发光中心的差异性影响,按 (1) 式计算。
| $ I=\left(R-R_{0}\right) / R_{0} $ | (1) |
式中:I表示农药对Ln-MOF中发光镧系中心Tb3+ (547 nm) 和Eu3+ (619 nm) 离子的影响;R为有农药存在时混合镧系金属框架材料中发光镧系中心Tb3+ (547 nm) 和Eu3+ (619 nm) 离子的荧光强度比值I (Tb3+)/I (Eu3+);R0为Ln-MOF在水体中的荧光强度比值。
1.3.2 定量检测试验按照1.3.1节中定性检测试验方法,首先配制浓度分别为0.1和0.5 mmoL/L的5种供试除草剂水溶液,接着与合成的Ln-MOF反应;最后通过抽滤的方法收集与农药结合后的Ln-MOF用于荧光光谱测定。根据I (Tb3+)/I (Eu3+) 与农药浓度的关系研究其定量检测的可能性。对于具有线性关系的农药,再计算农药浓度分别为0.2、0.7和0.9 mmoL/L时的I (Tb3+)/I (Eu3+),并根据该比值与农药浓度的关系确定定量检测农药的方法。
1.4 实际样品检测试验以用浙江大学启真湖湖水配制的5种供试除草剂溶液 (1 mmoL/L) 为研究对象,采用所合成的Ln-MOF对湖水中酰胺类除草剂残留进行定性检测。为避免水中悬浮物、泥沙等对检测结果的影响,先用水系 (0.22 μm) 滤膜对湖水进行过滤,再用于除草剂溶液配制。
1.5 数据处理所得数据采用Microsoft Office Excel (2007) 进行数据统计,用Origin85作图以及误差分析。
2 结果与分析 2.1 合成方法的选择图1是采用水热法和微波法合成所得Ln-MOF的SEM图,其中水热法合成样品为紧密的块状 (图1a);而微波法合成样品呈簇状,比较蓬松 (图1b)。

|
图 1 不同方法合成Ln-MOF的SEM图 Fig. 1 SEM images of Ln-MOF prepared by different synthesis methods |
从图2结果可以看出:水热法和微波法合成的样品衍射峰位置相差不大,均与单晶模拟谱图匹配较好,表明两种方法合成所得样品均具有较好的结晶度和物相纯度。由于水热法需要反应时间较长,而微波合成法只需要15 min,因此微波法合成Ln-MOF更便捷。
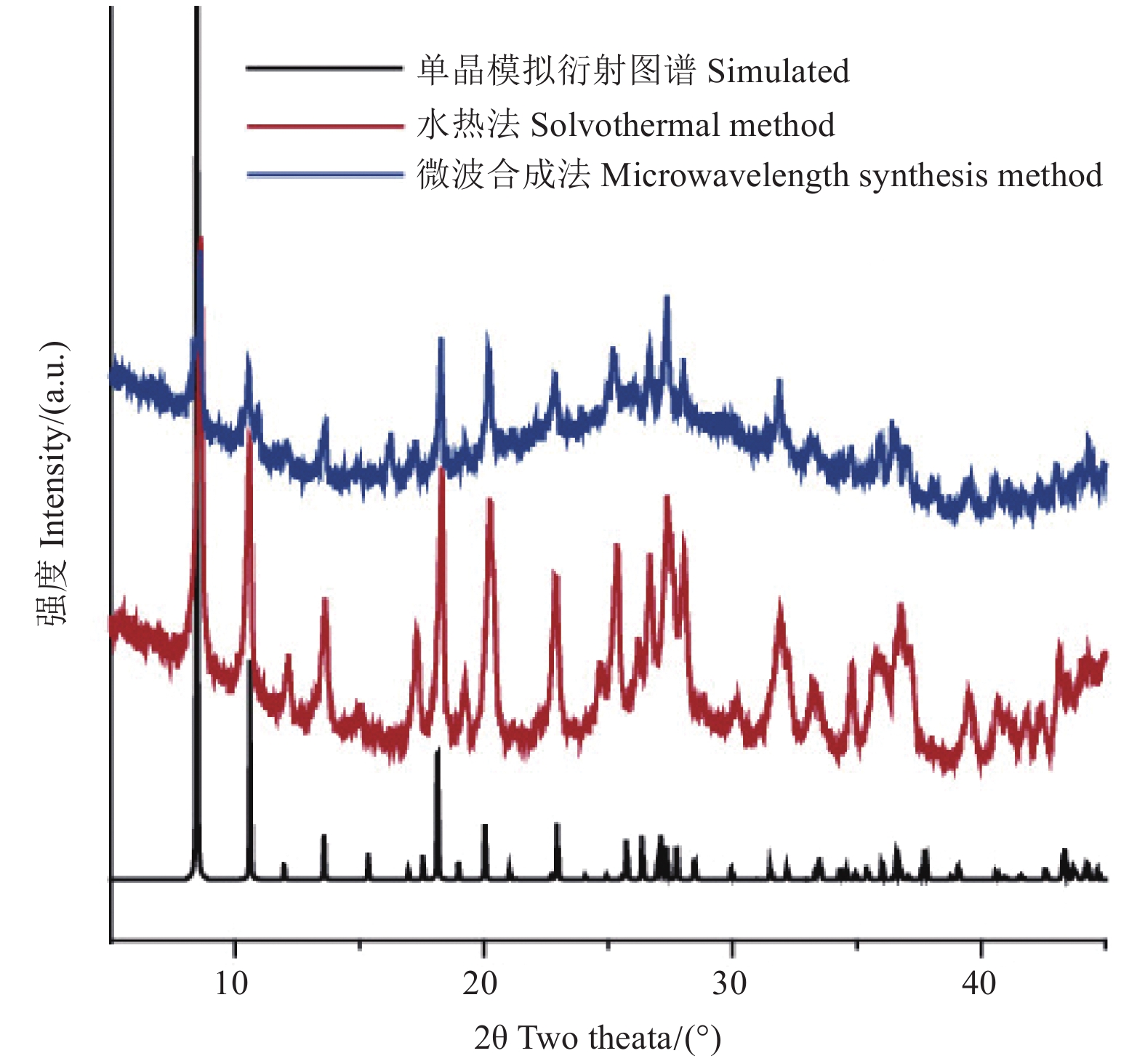
|
图 2 采用不同合成方法所得Ln-MOF的XRD图 Fig. 2 XRD of Ln-MOF prepared by different synthesis methods |
荧光光谱检测结果 (图3) 表明:在290 nm的激发光下,两种合成方法所得的Ln-MOF表现出相同的发射峰,分别是489、547、592和 619 nm。其中489 nm和547 nm对应的是Tb3+离子的发射峰,592 nm和 619 nm对应的是Eu3+离子的发射峰,但微波法合成所得Ln-MOF的发光强度比水热法的强1.3倍。

|
图 3 290 nm激发下Ln-MOF的发射光谱图 Fig. 3 The emission spectra of Ln-MOF under 290 nm excitation |
综合Ln-MOF制备方法的便捷度及其光谱性质,最终选择微波法合成Ln-MOF,并采用该材料进行水体中酰胺类除草剂的残留分析。
2.2 可视化残留分析检测结果 2.2.1 定性分析Ln-MOF与不同酰胺类除草剂混合后的发射光谱、荧光比值变化以及在254 nm紫外灯照射下的光学照片结果见图4。

|
图 4 Ln-MOF与不同除草剂反应后发射光谱 (a)、荧光比值变化 (b) 和光学照片 (c) Fig. 4 The emission spectra (a), the change of emission intensity ratio (b) and optical photographs (c) of Ln-MOF in the presence of different herbicides |
从图4a可以看出,与超纯水混合的Ln-MOF样品整体发光强度变弱,通过对荧光光谱计算发现水对两发光中心的荧光强度比值I (Tb3+)/I (Eu3+) 影响不大,由原来的0.80变为0.78,这可能是由水中O–H键振动对镧系金属离子发光的猝灭作用引起的[24]。而Ln-MOF与除草剂水溶液混合后,不同种类的除草剂会对Tb3+和Eu3+的发光产生不同的抑制作用。根据公式 (1) 计算不同农药对发光中心的差异性影响,结果如图4b所示,图中位于负半轴的比值表明该农药对Tb3+离子发射峰的抑制作用更强,而位于正半轴的比值表明对Eu3+离子的抑制作用更强,绝对值越大影响越大。可以看出,乙草胺对Eu3+的抑制作用最大,而异丙甲草胺对Tb3+离子的抑制作用最大。这可能是因为不同农药具有不同的结构和官能团,因而会与Ln-MOF产生不同的氢键结合及静电反应等,最终影响配体与镧系金属离子以及镧系金属离子之间的能量传递[25]。由于不同农药对发光中心Tb3+和Eu3+会产生不同的抑制作用,致使Tb3+ (绿光) 和Eu3+ (红光) 发光强度比值发生变化,在紫外光照射下,整个体系的发射光会呈现出不同的颜色 (图4c),最终实现对水体中5种酰胺类除草剂的可视化检测。
2.2.2 定量分析为了实现定量检测农药的目的,研究了农药浓度与荧光强度比值之间的相关性。在农药浓度为1 mmoL/L时不同农药对Ln-MOF荧光强度比值影响的基础上,研究了农药浓度分别为0.1和0.5 mmoL/L时农药对Ln-MOF荧光强度比值的影响,结果如图5所示。在农药浓度分别为0.1和0.5 mmoL/L时,不同农药对Ln-MOF的荧光强度比值也具有不同影响。随着丙草胺浓度的增加,荧光强度比值逐渐变大,这表明丙草胺浓度越大对Eu3+的抑制作用越明显,而其他除草剂的浓度与荧光强度比值之间没有相关性。
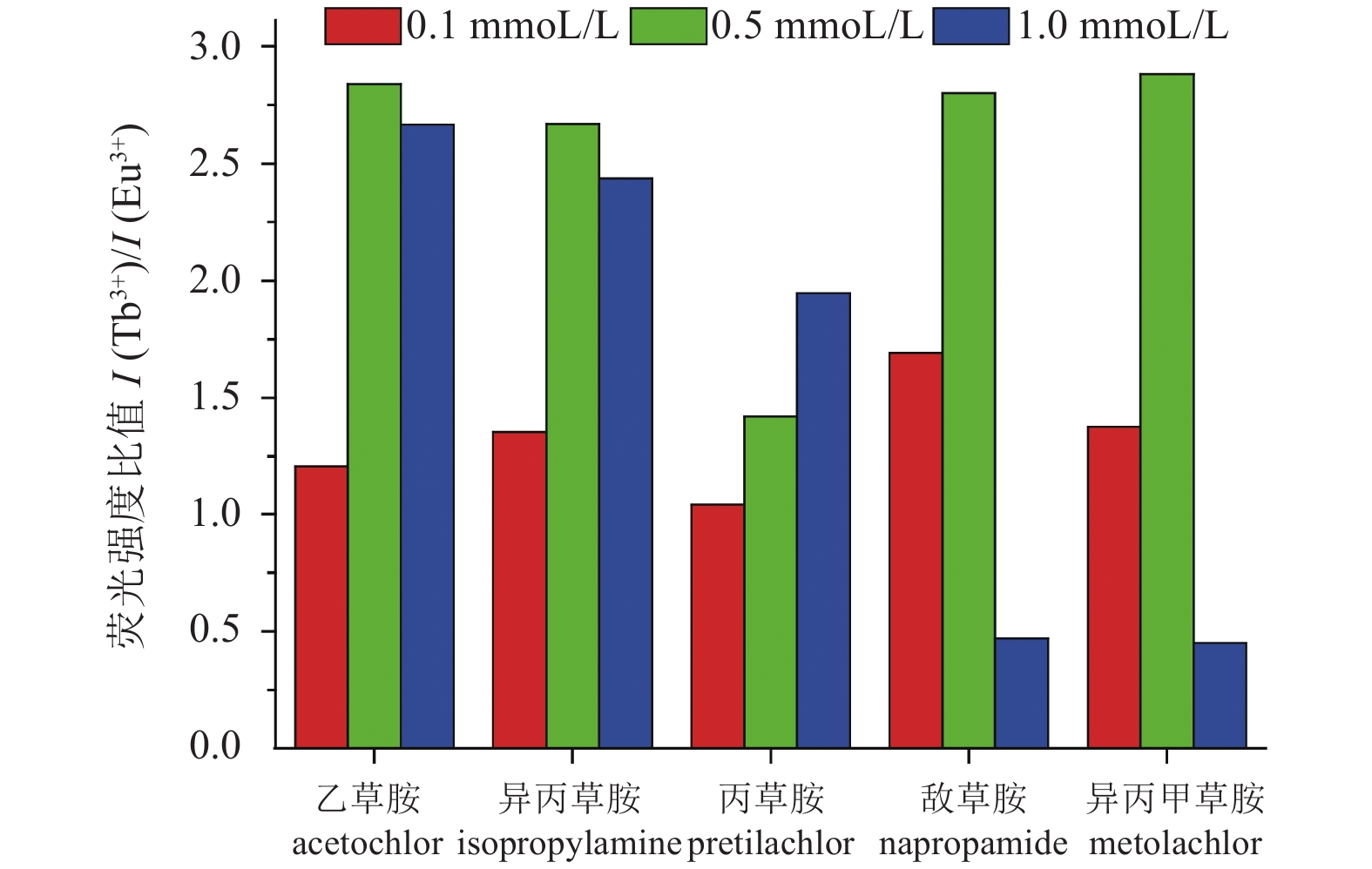
|
图 5 不同浓度的5种除草剂对Ln-MOF荧光强度比值的影响 Fig. 5 The influence of five herbicides with different concentrations on the emission intensity ratios of Ln-MOF |
为了进一步探究定量检测水体中丙草胺的可能性,在0.1、0.5和1 mmoL/L 3个检测浓度的基础上,增加了丙草胺浓度分别为0.2、0.7和0.9 mmoL/L时其对Ln-MOF中双发光中心荧光强度比值I (Tb3+)/I (Eu3+) 的影响,结果见图6。可以看出,当丙草胺的浓度为0.1~1 mmoL/L时,其浓度与荧光强度比值呈较好的线性相关,线性回归方程为:I (Tb3+)/I (Eu3+) = 0.888 8c + 0.964 2,R2 = 0.998,检测限为0.08 mmoL/L,展现了利用该Ln-MOF作为丙草胺定量检测的可行性。
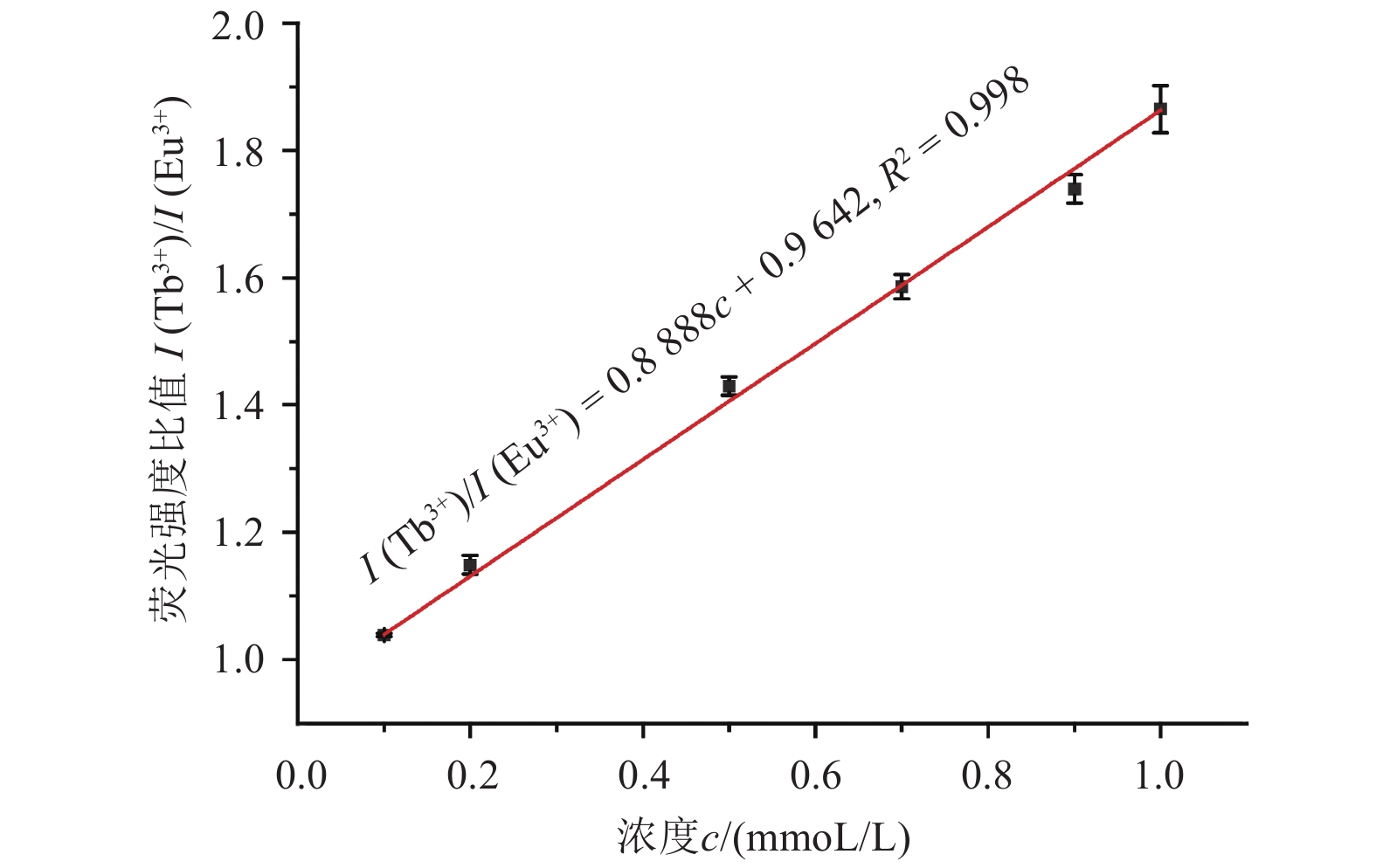
|
图 6 在不同浓度的丙草胺溶液中Ln-MOF的荧光强度比值 Fig. 6 Emission intensity ratio of Ln-MOF in the presence of pretilachlor of different concentrations |
2.3 实际样品检测结果
图7为与用湖水配制的不同酰胺类除草剂混合后材料的发射光谱及荧光比值变化结果。可以看出,在用湖水配制的溶液中,不同种类的除草剂会对Tb3+和Eu3+的发光产生不同的抑制作用,最终导致Ln-MOF中金属中心Tb3+和Eu3+的发光强度比值具有差异性变化,说明该材料对用实际水体配制的酰胺类除草剂也具有一定的定性检测能力。

|
图 7 Ln-MOF与湖水中不同除草剂反应后发射光谱 (a) 和荧光比值变化图 (b) Fig. 7 The emission spectra (a) and emission intensity ratio (b) of Ln-MOF in the presence of different herbicides in lake water |
3 结论
相较于水热合成方法,简便的微波法更适于合成用于光传感的双掺杂镧系金属 (Tb3+和Eu3+) 有机框架材料 (Ln-MOF)。本研究首次将双掺杂Ln-MOF用于水体中农药的检测,实现了水体中乙草胺、异丙草胺、丙草胺、敌草胺和异丙甲草胺共5种酰胺类除草剂的可视化检测;该方法尤其适合水体中丙草胺的残留检测,当丙草胺的浓度在0.1~1 mmoL/L范围内时,其浓度与Tb3+和Eu3+发光中心的荧光强度比值I (Tb3+)/I (Eu3+) 呈很好的线性关系,I (Tb3+)/I (Eu3+) = 0.888 8c + 0.964 2,R2 = 0.998,检测限为0.08 mmoL/L,故该双掺杂Ln-MOF可以实现水体中丙草胺浓度的定量检测;此外,Ln-MOF对于用实际水样配制的除草剂也具有定性检测的能力。
本研究主要探究了共掺杂镧系金属有机框架材料 (Ln-MOF) 应用于水体中酰胺类除草剂残留可视化检测的可行性,有关除草剂与Ln-MOF材料结合后对发光强度产生差异性影响的理论研究还有待进一步探索。
| [1] |
苏少泉. 酰胺类除草剂评述[J]. 农药, 2002, 41(11): 1-5. SU S Q. Review of amide herbicides[J]. Chin J Pestic, 2002, 41(11): 1-5. DOI:10.3969/j.issn.1006-0413.2002.11.001 |
| [2] |
VASILAKOGLOU I B, ELEFTHEROHORINOS I G, DHIMA K B. Activity, adsorption and mobility of three acetanilide and two new amide herbicides[J]. Weed Res, 2001, 41(6): 535-546. DOI:10.1046/j.1365-3180.2001.00256.x |
| [3] |
ZHAO R S, DIAO C P, WANG X, et al. Rapid determination of amide herbicides in environmental water samples with dispersive liquid-liquid microextraction prior to gas chromatography-mass spectrometry[J]. Anal Bioanal Chem, 2008, 391(8): 2915-2921. DOI:10.1007/s00216-008-2208-4 |
| [4] |
XUE N D, LI F S, HOU H, et al. Occurrence of endocrine-disrupting pesticide residues in wetland sediments from Beijing, China[J]. Environ Toxicol Chem, 2008, 27(5): 1055-1062. DOI:10.1897/07-511.1 |
| [5] |
李建中, 储晓刚, 蔡会霞, 等. 高效液相色谱法同时测定大豆中12种酰胺类除草剂的残留量[J]. 色谱, 2006, 24(6): 585-588. LI J Z, CHU X G, CAI H X, et al. Simultaneous determination of residues of 12 amide herbicides in soybeans by high performance liquid chromatography[J]. Chin J Chromatogr, 2006, 24(6): 585-588. DOI:10.3321/j.issn:1000-8713.2006.06.011 |
| [6] |
沈伟健, 徐锦忠, 杨雯筌, 等. 两种离子源技术气相色谱-质谱法检测茶叶中酰胺类除草剂的残留量[J]. 色谱, 2007, 25(5): 753-757. SHEN W J, XU J Z, YANG W Q, et al. Determination of acetanilide herbicide residues in tea by gas chromatography-mass spectrometry with two different ionization techniques[J]. Chin J Chromatogr, 2007, 25(5): 753-757. DOI:10.3321/j.issn:1000-8713.2007.05.028 |
| [7] |
吴春英, 白鹭, 谷风, 等. 固相萃取-超高效液相色谱-串联质谱法同时测定地表水中的 18 种酰胺类除草剂[J]. 理化检验(化学分册), 2016, 52(5): 602-606. WU C Y, BAI L, GU F, et al. Simultaneous determination of 18 amide herbicides in surface water by SPE-UPLC-MS/MS[J]. Phys Test Chem Anal (Part B Chem Anal), 2016, 52(5): 602-606. |
| [8] |
CADIAU A, BRITES C D S, COSTA P M F J, et al. Ratiometric nanothermometer based on an emissive Ln3+-organic framework
[J]. ACS Nano, 2013, 7(8): 7213-7218. DOI:10.1021/nn402608w |
| [9] |
LONG J R, YAGHI O M. The pervasive chemistry of metal-organic frameworks[J]. Chem Soc Rev, 2009, 38(5): 1213-1214. DOI:10.1039/b903811f |
| [10] |
LI B, WEN H M, CUI Y J, et al. Multifunctional lanthanide coordination polymers[J]. Prog Polym Sci, 2015(48): 40-84. |
| [11] |
MOORE E G, SAMUEL A P S, RAYMOND K N. From antenna to assay: lessons learned in lanthanide luminescence[J]. Accounts Chem Res, 2009, 42(4): 542-552. DOI:10.1021/ar800211j |
| [12] |
CUI Y J, CHEN B L, QIAN G D. Lanthanide metal-organic frameworks for luminescent sensing and light-emitting applications[J]. Coord Chem Rev, 2014(273-274): 76-86. |
| [13] |
DANG S, ZHANG J H, SUN Z M, et al. Luminescent lanthanide metal-organic frameworks with a large SHG response[J]. Chem Commun, 2012, 48(90): 11139-11141. DOI:10.1039/c2cc35432b |
| [14] |
LU W G, JIANG L, FENG X L, et al. Three-dimensional lanthanide anionic metal-organic frameworks with tunable luminescent properties induced by cation exchange[J]. Inorg Chem, 2009, 48(15): 6997-6999. DOI:10.1021/ic900506z |
| [15] |
XIAO Y Q, CUI Y J, ZHENG Q, et al. A microporous luminescent metal–organic framework for highly selective and sensitive sensing of Cu2+ in aqueous solution
[J]. Chem Commun, 2010, 46(30): 5503-5505. DOI:10.1039/c0cc00148a |
| [16] |
MA D Y, WANG W X, LI Y W, et al. In situ 2, 5-pyrazinedicarboxylate and oxalate ligands synthesis leading to a microporous europium-organic framework capable of selective sensing of small molecules[J]. CrystEngComm, 2010, 12(12): 4372-4377. DOI:10.1039/c0ce00135j |
| [17] |
XIAO Y Q, WANG L B, CUI Y J, et al. Molecular sensing with lanthanide luminescence in a 3D porous metal-organic framework[J]. J Alloy Compd, 2009, 484(1-2): 601-604. DOI:10.1016/j.jallcom.2009.05.004 |
| [18] |
CUI Y J, ZOU W F, SONG R J, et al. A ratiometric and colorimetric luminescent thermometer over a wide temperature range based on a lanthanide coordination polymer[J]. Chem Commun, 2014, 50(6): 719-721. DOI:10.1039/C3CC47225F |
| [19] |
ZHAN C, OU S, ZOU C, et al. A luminescent mixed-lanthanide-organic framework sensor for decoding different volatile organic molecules[J]. Anal Chem, 2014, 86(13): 6648-6653. DOI:10.1021/ac5013442 |
| [20] |
ROSI N L, KIM J, EDDAOUDI M, et al. Rod packings and metal-organic frameworks constructed from rod-shaped secondary building units[J]. J Am Chem Soc, 2005, 127(5): 1504-1518. DOI:10.1021/ja045123o |
| [21] |
HU Z C, DEIBERT B J, LI J. Luminescent metal-organic frameworks for chemical sensing and explosive detection[J]. Chem Soc Rev, 2014, 43(16): 5815-5840. DOI:10.1039/C4CS00010B |
| [22] |
BÜNZLI J C G. Lanthanide luminescence for biomedical analyses and imaging[J]. Chem Rev, 2010, 110(5): 2729-2755. DOI:10.1021/cr900362e |
| [23] |
YANG W T, FENG J, SONG S Y, et al. Microwave-assisted modular fabrication of nanoscale luminescent metal-organic framework for molecular sensing[J]. ChemPhysChem, 2012, 13(11): 2734-2738. DOI:10.1002/cphc.v13.11 |
| [24] |
XU H, CAO C S, KANG X M, et al. Lanthanide-based metal-organic frameworks as luminescent probes[J]. Dalton Trans, 2016, 45(45): 18003-18017. DOI:10.1039/C6DT02213H |
| [25] |
GAO Y X, YU G, LIU K, et al. Luminescent mixed-crystal Ln-MOF thin film for the recognition and detection of pharmaceuticals[J]. Sens Actuator B-Chem, 2018, 257: 931-935. DOI:10.1016/j.snb.2017.10.180 |
 2019, Vol. 21
2019, Vol. 21