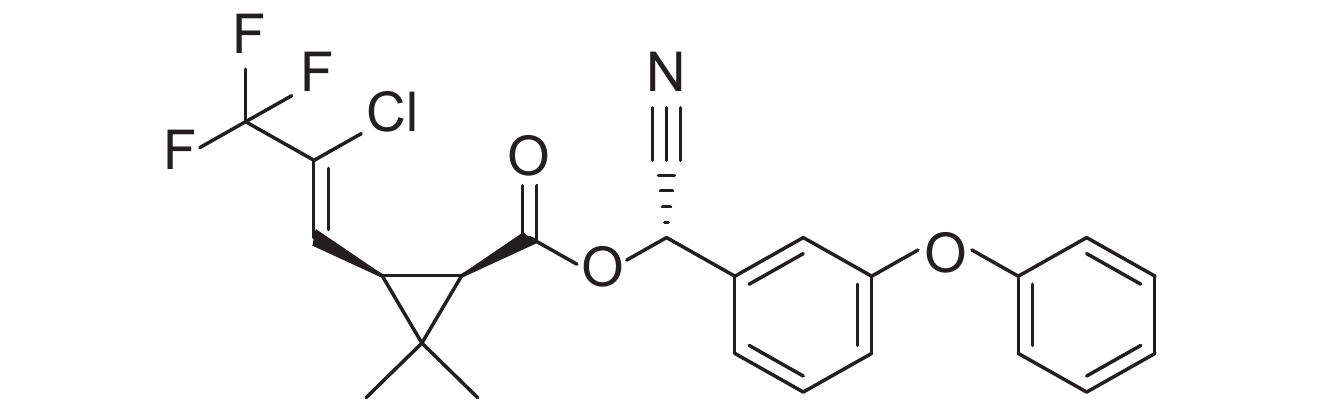
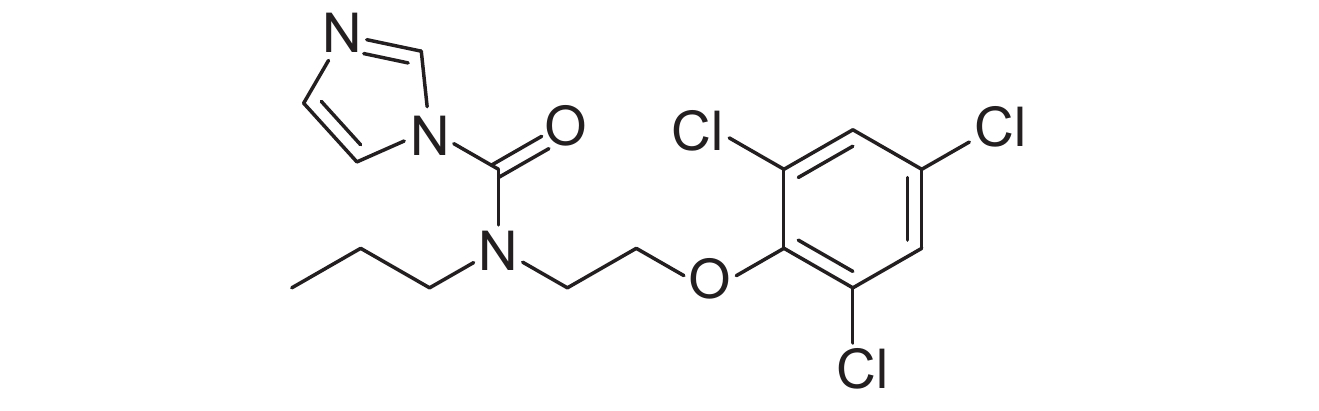
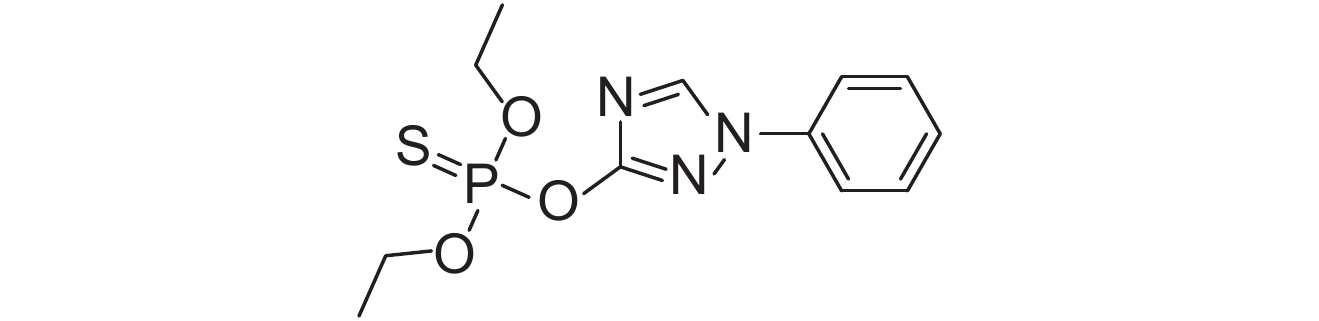
2. 中国农业科学院 农业质量标准与检测技术研究所,北京 100081
2. Institute of Quality Standards and Testing Technology for Agro-Products, Chinese Academy of Agricultural Sciences, Beijing 100081, China
近年来,农药多残留现象在世界各国和国际组织进行的食品安全风险监测中较为普遍,从而引发了国际社会的高度关注[1-2]。根据最近10年欧洲食品安全风险监测结果,尽管只有大约2%的食品中农药残留水平超过最大残留限量标准 (MRL),但同时含有多种农药残留样品的比例已超过30%,单个样品中最多可含有10种以上农药残留[3]。食品中农药多残留现象来源于农业生产过程中混合使用农药,如混合使用杀虫剂、杀菌剂及除草剂等,以达到同时治理多种病虫草害的效果[4]。中国已有超过七成的河流和地下水中同时检测出了5种以上的农药残留,饮用水源也同样面临着多种农药混合污染的风险[5]。此外,环境和食物中残留的多种农药具有内分泌干扰效应,能够结合并活化体内的雌激素受体、雄激素受体、芳香烃类受体及孕烷X受体等,并能模仿激素的作用,或者阻断、抑制激素的功能,从而改变体内正常激素水平和内分泌功能。此外,内分泌干扰类农药还能扰乱激素的合成、代谢和排泄,降低人体内的激素水平,引起内分泌紊乱、生殖异常以及致畸、致癌、致突变等[6]。因此,对多种农药残留的联合毒性效应及其作用机制进行研究,具有十分重要的理论和实际意义[7-11]。
农药混合物各组分之间可能存在相加、拮抗和协同等几种相互作用关系,从而产生联合毒性效应。食品、饮用水和环境中残留的多种农药进入人体后所引起的联合毒性效应通常超过单一农药。在一项针对水体中三嗪类除草剂污染毒性的研究中发现,18种农药组分在各自EC1 (有效作用浓度的1%) 低浓度水平下组成的混合物,其联合毒性效应可达单个组分毒性效应的数十倍[12]。根据中国近年来人群样本的生物学监测结果,大多数人体内均可检出多种不同的农药残留[13],然而,有关多种农药混合物对人体健康的毒性效应研究尚未见报道。此外,由于农药残留种类繁多,组合方式复杂,因此需要快速准确的毒性评价方法,以有效进行食品中农药残留混合物的联合毒性效应评价。体外细胞毒性评价作为传统动物模型毒性评价的替代方法,在化合物安全性评价领域得到了越来越多的研究和应用,为农药混合物的毒性筛选和评价提供了高效、快捷的手段。
MTT(噻唑蓝)是一种能接收氢离子的黄色染料,可作用于活细胞中的线粒体呼吸链,在活细胞线粒体琥珀酸脱氢酶和细胞色素C的作用下,其四唑环开裂,生成蓝紫色的还原产物甲瓒结晶,其生成量与活细胞数目成正比。采用MTT法测定细胞活性具有操作简单、结果稳定等特性,自1962年De等[14]报道以来已被广泛用于各种化学物质体外细胞活性的测定中[8, 14-15]。
本研究选取农业生产中使用较为频繁、残留检出率和超标率较高的8种农药:阿维菌素、啶虫脒、多菌灵、百菌清、毒死蜱、高效氯氟氰菊酯、咪酰胺和三唑磷,采用MTT比色法测定了农药多残留联合暴露下对人肝癌细胞系HepG2增殖的抑制作用,以期探明农药残留混合物的联合毒性效应,为食品安全及人体健康风险评估提供参考。
1 材料与方法 1.1 药剂、培养基、生物试材及仪器供试8种农药 (阿维菌素、啶虫脒、多菌灵、百菌清、毒死蜱、高效氯氟氰菊酯、咪酰胺及三唑磷) 原药均购自天津阿尔塔科技有限公司,其纯度等信息见表1;MEM液体细胞培养基及0.01 mmol/L PBS (pH=7.4) 磷酸盐缓冲液购自Hyclone公司;0.25%液体胰酶及胎牛血清购自Gibco公司;MTT粉末购自Sigma公司;异丙醇购自北京雁栖湾生物技术有限公司;其他化学试剂均为国产分析纯。
|
|
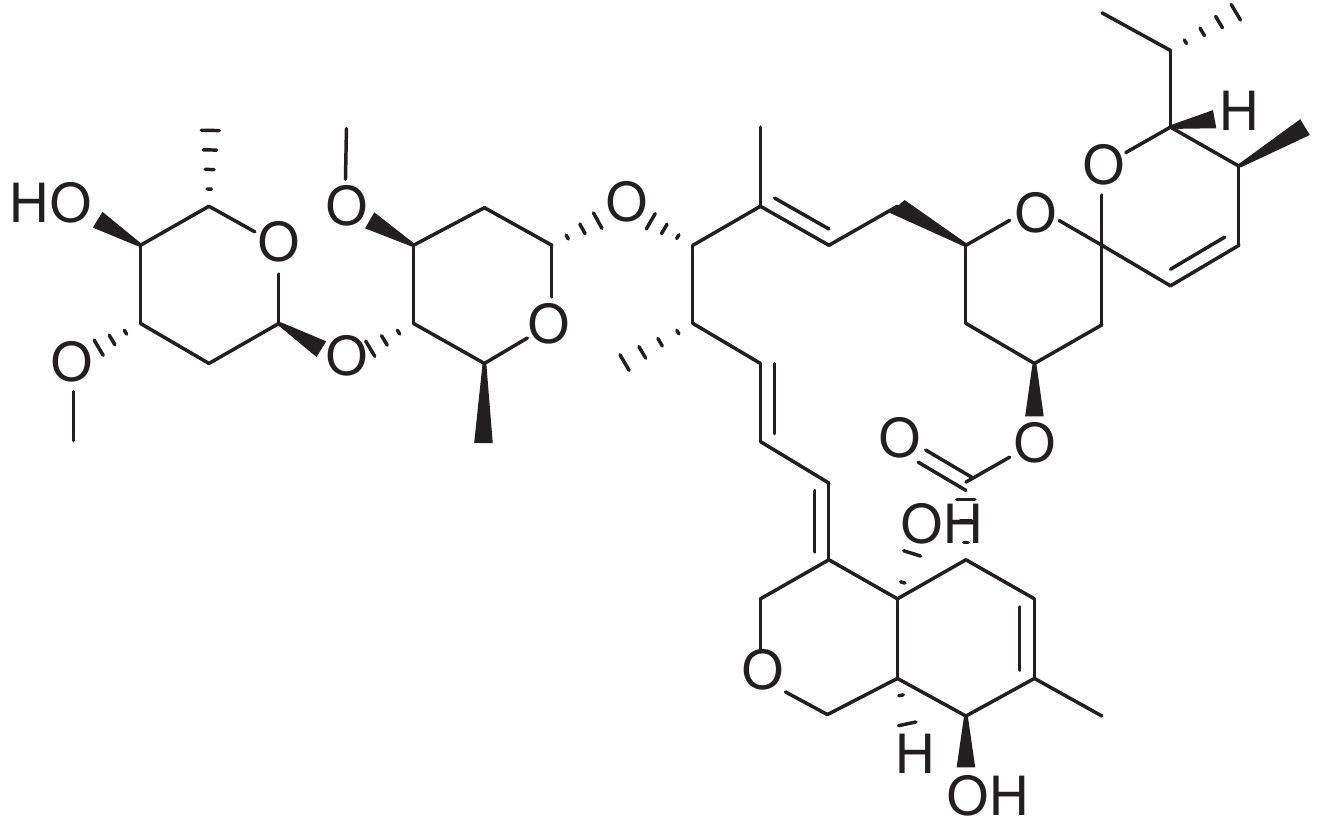
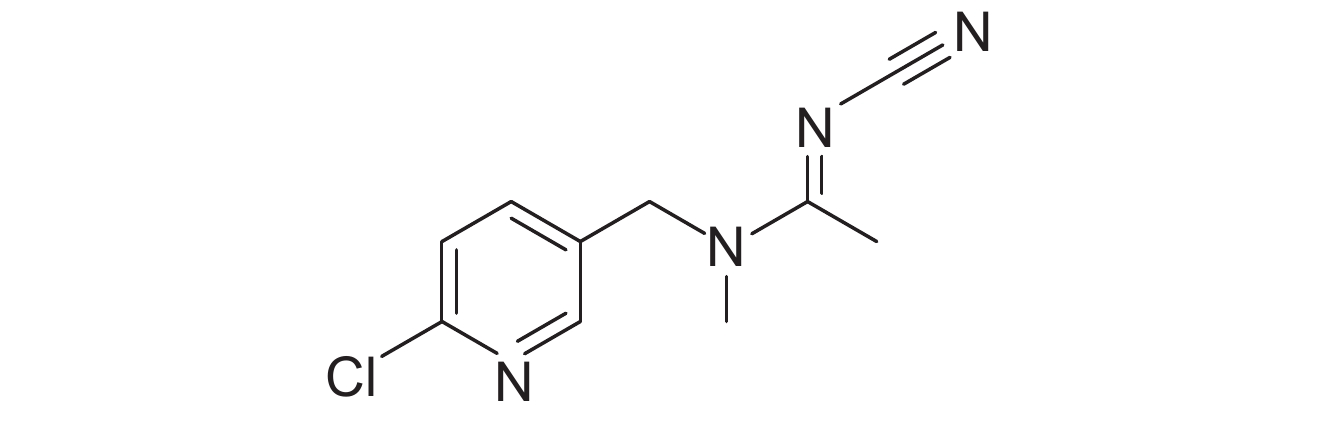
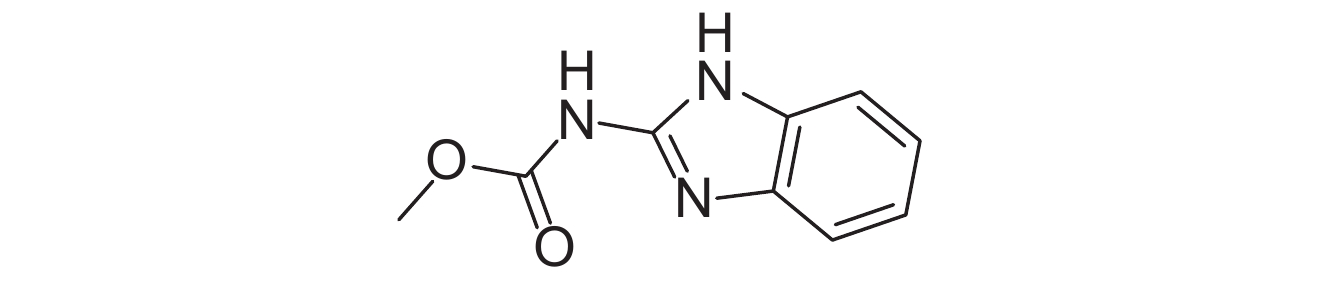
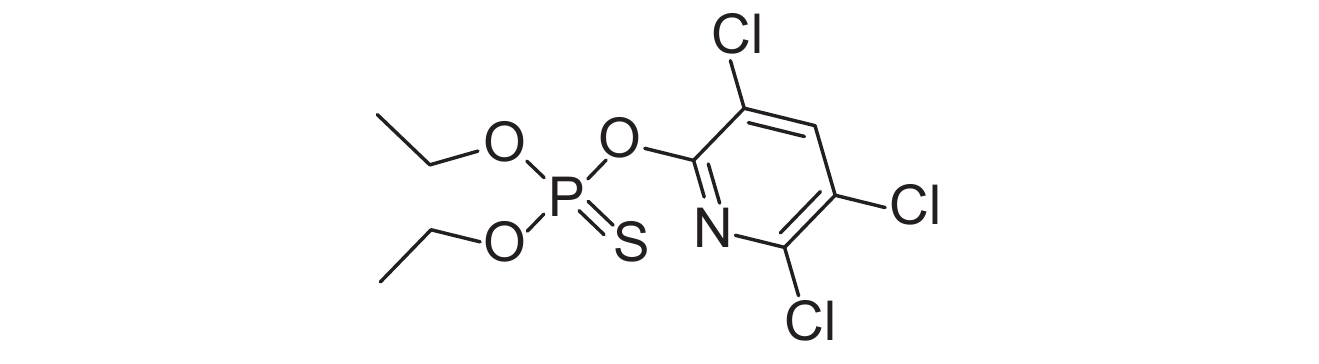
表 1 供试8种农药的理化性质及分子结构 Table 1 The physicochemical properties and structural formulas of eight tested pesticides |
Hirayama HVE-50高压灭菌锅,日本Hirayama公司;Eppendorf 5430低速离心机及Eppendorf Mixmate PCB-11多孔板摇床,德国艾本德公司;Thermo 3111恒温细胞培养箱,美国Thermo公司;Lafil400 Plus可携式生化废液抽吸系统,中国台湾洛科公司;BCM-1600A超净台及旭东空调净化工作台,苏净安泰公司;Molecular Devices Emax plus多功能酶标检测仪,美国MD公司。
将8种农药原药用二甲基亚砜 (DMSO) 溶解,配成100 mmol/L的标准储备液,–20 ℃储存,试验时再用无血清培养基稀释至待测浓度。
5 mg/mL MTT的配制:按质量体积比5 mg : 1 mL的比例,称取一定量的MTT粉末溶于PBS中,采用锡箔纸避光加热搅拌,待MTT完全溶解后,用0.22 mm滤膜过滤以除去溶液里的细菌,分装至2 mL离心管中,–20 ℃避光保存,待用。
HepG2人肝癌细胞株购自中国科学院上海生命科学研究院细胞资源中心,用含体积分数为10%胎牛血清的MEM培养基,在含5% CO2、37 ℃恒温细胞培养箱中培养。每1~2 d换液1次,每3~4 d传代1次。取处于对数生长期的细胞用于后续试验或冻存。
1.2 MTT试验步骤取HepG2细胞悬液,调整密度为3.5 × 105 cells/mL,按100 μL/孔接种于96孔透明细胞培养板中,于5% CO2、37 ℃培养箱中贴壁孵育24 h。吸去培养基,重新加入90 μL新鲜无血清培养基,试验组再加入10 μL农药复合物,对照组加入10 μL含相同浓度DMSO的无血清培养基,同时设空白对照,均于5% CO2、37 ℃培养箱中继续孵育24 h。除去含农药的培养基,每孔加入100 μL含10% MTT的细胞培养基,于相同条件培养箱中继续孵育3.5 h。除去培养基,每孔加入100 μL酸性异丙醇溶液 (含HCl 0.04 g/L),于550 r/min下振荡4 min,使甲瓚结晶充分溶解,采用酶联免疫检测仪在570 nm处测定各孔的吸光度值 (A)[1]。细胞存活率计算公式见式1。
| ${{R}_{\rm{v}}/{\text{%}}} = \frac{{{A_1}{\rm{ - }}{A_0}}}{{{A_2}{\rm{ - }}{A_0}}} \times 100 $ | (1) |
式中,Rv为细胞存活率 (%),A0为空白对照组吸光度值,A1为实验组吸光度值,A2为对照组吸光度值。
1.3 农药多残留组合浓度的设定前期研究发现,在供试的8种农药中,有5种对HepG2细胞增殖呈现出明显的抑制活性,其IC50值分别为:阿维菌素31.43 mg/L,多菌灵84.12 mg/L,百菌清10.64 mg/L,高效氯氟氰菊酯9.90 mg/L,咪酰胺94.17 mg/L;其余3种农药则没有明显的细胞增殖抑制作用:啶虫脒的IC50值大于200 mg/L,毒死蜱大于350 mg/L,三唑磷大于300 mg/L[11]。由于高效氯氟氰菊酯的IC50值仅为9.90 mg/L,因此在农药多残留组合中其添加质量浓度设置为小于5.00 mg/L,以便其细胞增殖抑制试验浓度保持在效应浓度的80%~90%范围内。同时,参考农产品中农药残留量的实际检出值和农药急性毒性试验结果[16],确定细胞增殖抑制试验中各农药多残留组合的最大测定浓度 (表2),试验中按照每组农药多残留组合的类别和包含的农药数量预先配制其最大测定浓度,再从该浓度开始按0.6倍等比稀释,得到每个组合的6个浓度梯度,分别测定其对细胞增殖的抑制活性。
|
|
表 2 农药多残留组合及组合中各单剂的最大测定浓度 Table 2 Mixtures of pesticides and the maximum detected concentrations of individual pesticides in mixtures |
2 结果与讨论 2.1 二元联合暴露对HepG2细胞增殖的抑制作用
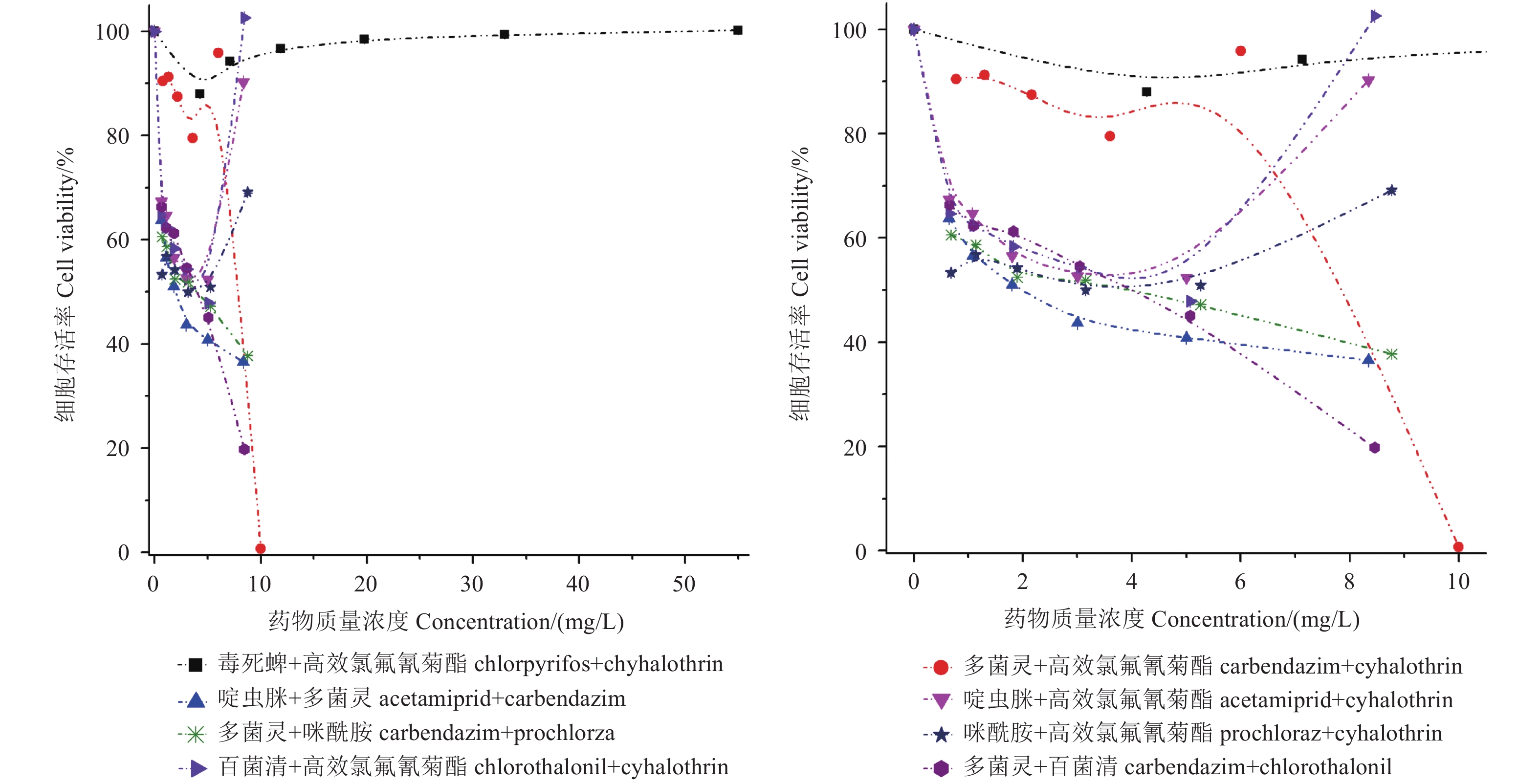
由图1可知:24 h内,联合暴露质量浓度在55.00 mg/L以下时,随着毒死蜱+高效氯氟氰菊酯组合质量浓度增大,HepG2细胞的存活率并未出现明显降低,即该组合农药对HepG2细胞增殖的抑制作用未表现出明显的剂量-效应关系;而多菌灵+高效氯氟氰菊酯联合暴露质量浓度在10.00 mg/L以下时,对HepG2细胞增殖的抑制作用呈现明显的S型走势,整体而言随着组合农药质量浓度增大,HepG2细胞存活率降低;啶虫脒+多菌灵、多菌灵+咪酰胺以及多菌灵+百菌清3个二元组合对HepG2细胞增殖的抑制作用均表现为明显的剂量-效应关系——随组合农药质量浓度增大,HepG2细胞存活率呈线性降低;而啶虫脒+高效氯氟氰菊酯、咪酰胺+高效氯氟氰菊酯及百菌清+高效氯氟氰菊酯3个组合则随着农药质量浓度增大,对HepG2细胞增殖的抑制作用反而降低。
|
图 1 二元农药组合联合暴露24 h对HepG2细胞增殖的抑制作用 Fig. 1 Inhibitory effect of binary pesticide combinations on HepG2 cell proliferation after 24 h treatment |
2.2 三元联合暴露对HepG2细胞增殖的抑制作用
由图2可知:在24 h内,随着毒死蜱+啶虫脒+高效氯氟氰菊酯三元组合农药质量浓度增大,HepG2细胞存活率变化不明显,即该组合联合暴露对HepG2细胞增殖抑制作用的剂量-效应关系不明显;而在毒死蜱+啶虫脒+多菌灵、多菌灵+咪酰胺+百菌清和多菌灵+咪酰胺+高效氯氟氰菊酯3种联合暴露模式下,则随着农药质量浓度增大,HepG2细胞存活率呈线性降低,表现为明显的剂量-效应关系;多菌灵+阿维菌素+高效氯氟氰菊酯和百菌清+阿维菌素+高效氯氟氰菊酯2组三元组合对细胞增殖的抑制作用随组合农药质量浓度增大呈S型曲线变化——HepG2细胞存活率先迅速降低,至15.00 mg/L之后则缓慢降低。

|
图 2 三元农药组合联合暴露24 h对HepG2细胞增殖的抑制作用 Fig. 2 Inhibitory effect of ternary pesticide combinations on HepG2 cell proliferation after 24 h treatment |
2.3 四元联合暴露对HepG2细胞增殖的抑制作用
由图3可知:三唑磷+高效氯氟氰菊酯+毒死蜱+多菌灵、三唑磷+高效氯氟氰菊酯+多菌灵+阿维菌素2种四元组合对HepG2细胞增殖的抑制作用随农药质量浓度升高呈S型曲线变化——细胞存活率先迅速降低,至20.00 mg/L之后则缓慢降低;三唑磷+高效氯氟氰菊酯+毒死蜱+啶虫咪组合对HepG2细胞增殖的抑制作用随农药质量浓度升高变化不明显;多菌灵+高效氯氟氰菊酯+咪酰胺+百菌清、多菌灵+高效氯氟氰菊酯+百菌清+阿维菌素2种四元组合对HepG2细胞增殖的抑制作用则呈现明显的剂量-效应关系——随组合农药质量浓度升高,HepG2细胞存活率呈线性降低。

|
图 3 四元农药组合联合暴露24 h对HepG2细胞增殖的抑制作用 Fig. 3 Inhibitory effect of quaternary pesticide combinations on HepG2 cell proliferation after 24 h treatment |
2.4 五元及六元联合暴露对HepG2细胞增殖的抑制作用
由图4可知:在多菌灵+百菌清+阿维菌素+高效氯氟氰菊酯+咪酰胺、毒死蜱+阿维菌素+啶虫咪+高效氯氟氰菊酯+三唑磷2种五元组合联合暴露模式下,随组合农药质量浓度增大,对HepG2细胞增殖的抑制作用呈现S型曲线变化——前期细胞存活率迅速降低,之后缓慢降低;而啶虫脒+毒死蜱+三唑磷+多菌灵+高效氯氟氰菊酯+阿维菌素六元组合对HepG2细胞增殖的抑制作用则呈现明显剂量-效应关系——随组合农药质量浓度增大,细胞存活率呈线性降低。
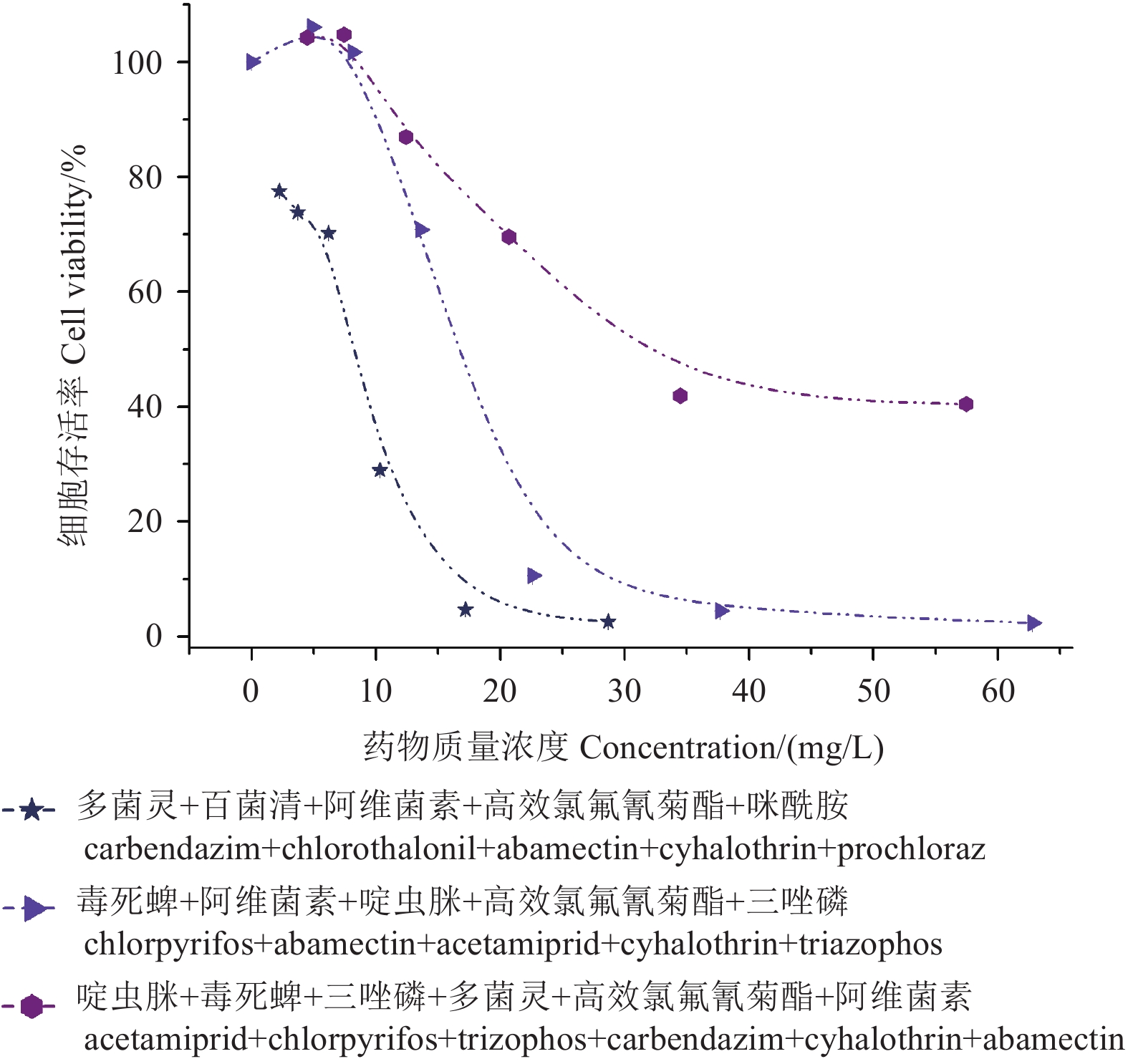
|
图 4 五元及六元农药组合联合暴露24 h对HepG2细胞增殖的抑制作用 Fig. 4 Inhibitory effect of five- and six-components combinations on HepG2 cell proliferation after 24 h treatment |
3 讨论与结论
农药产生毒性作用的方式主要有以下几种[17]:1) 通过细胞基础代谢调控及生长分化等过程中的关键蛋白产生效应;2) 干预线粒体呼吸链复合物或损害氧化磷酸化过程,引起线粒体功能异常,导致细胞凋亡或代谢紊乱;3) 通过降低细胞内酶的抗氧化能力引起活性氧 (ROS) 水平升高,进而影响细胞内代谢活动并改变凋亡程序相关信号传导蛋白的表达,导致DNA损伤;4) 激活参与能量代谢调控的核酸受体。农药在细胞内的多样化作用靶标位点和通路是其毒性作用的关键因素,也是多种农药共同作用产生联合效应的基础[17]。本研究选取的8种农药均为农产品生产过程中使用较为频繁、残留检出率或超标率较高,或是急性毒性较强的农药品种。根据MTT比色法测定的各农药单独作用时对HepG2人肝癌细胞增殖的抑制作用结果,不同农药对细胞存活率的影响存在较大差异,其毒性效应顺序为:高效氯氟氰菊酯>百菌清>阿维菌素>多菌灵>咪酰胺>啶虫脒>三唑磷>毒死蜱[11]。前期研究显示,农药单剂 (咪酰胺、阿维菌素)、二元组合 (咪酰胺+氯氟氰菊酯、多菌灵+阿维菌素) 及三元组合 (百菌清+咪酰胺+氯氟氰菊酯) 均是通过活性氧(ROS)诱导的细胞凋亡信号通路而引发细胞的死亡[11]。本研究中在部分农药组合的联合暴露下,随着农药质量浓度增大,细胞存活率反而呈现增长趋势,如二元组合中的啶虫脒+高效氯氟氰菊酯、咪酰胺+高效氯氟氰菊酯及百菌清+高效氯氟氰菊酯,这与传统毒理学的剂量-反应曲线规律有所不同。近年来也有报道[18-19]认为,外源化学物质的内分泌干扰作用剂量-效应关系并非传统毒理学概念的剂量-反应曲线,即并不一定呈现简单的上升或下降曲线,而可能会呈现出“U”形或“倒U”形等曲线。这一结果提示,上述3种二元农药多残留组合的细胞毒性作用可能与细胞内分泌功能相关的通路或是受体等存在关联。
肝脏作为外源物质的主要代谢器官和靶器官,在环境和人类毒理学研究领域受到广泛关注。HepG2人肝癌细胞作为肝脏细胞的模型,已被普遍应用于对体外毒素毒性效应的评估研究中[8, 11,20]。本研究结果表明,8种农药的不同多残留组合对HepG2人肝癌细胞增殖的抑制作用呈现以下不同类型:1) 浓度效应依赖关系,即随着组合农药质量浓度升高,细胞存活率降低,并表现为明显的S型或线性降低趋势,表明随着组合农药质量浓度增大,其对细胞的毒性作用逐渐增强;2) 无浓度效应关系,即随组合农药质量浓度升高,其对细胞增殖并未表现出明显的抑制效果,表明该农药组合对细胞的毒性作用不明显。
本研究明确了8种农药多残留组合对HepG2人肝癌细胞增殖的抑制效应,所测定的22个组合中,大多数组合的剂量-效应关系基本符合传统的毒理学剂量-效应曲线关系,证实了农药多残留在较低的剂量即有可能产生较强的细胞毒性作用,为进一步评估农药多残留的肝脏细胞毒性机制奠定了基础。
| [1] |
USDA (U. S. Department of Agriculture). Pesticide data program 25th annual summary, calendar year 2015. PDP Annual Summary, 2015.
|
| [2] |
European Food Safety Authority(EFSA). The 2014 European Union report on pesticide residues in food[J]. EFSA J, 2016, 14(10): e04611. DOI:10.2903/j.efsa.2016.4611 |
| [3] |
PRUTNER W, NICKEN P, HAUNHORST E, et al. Effects of single pesticides and binary pesticide mixtures on estrone production in H295R cells[J]. Arch Toxicol, 2013, 87(12): 2201-2214. DOI:10.1007/s00204-013-1081-x |
| [4] |
吴正军. 浅谈现代农业中农药的混用[J]. 现代农业科技, 2007(6): 68-69. WU Z J. Discussion on the mix use of pesticides in modern agriculture[J]. Mod Agric Sci Technol, 2007(6): 68-69. DOI:10.3969/j.issn.1007-5739.2007.06.050 |
| [5] |
宋宁慧, 卜元卿, 单正军. 农药对地表水污染状况研究概述[J]. 生态与农村环境学报, 2010, 26(Suppl.1): 49-57. SONG N H, BU Y Q, SHAN Z J. A review of studies on pesticide pollution in surface water[J]. J Ecol Rural Environ, 2010, 26(Suppl.1): 49-57. |
| [6] |
CREMONESE C, PICCOLI C, PASQUALOTTO F, et al. Occupational exposure to pesticides, reproductive hormone levels and sperm quality in Young Brazilian men[J]. Reprod Toxicol, 2017, 67: 174-185. DOI:10.1016/j.reprotox.2017.01.001 |
| [7] |
孙金秀, 陈波, 姚佩佩. 农药混剂联合毒性评价[J]. 卫生研究, 2000, 29(2): 65-68. SUN J X, CHEN B, YAO P P. Assessment on acute toxicity of combined pesticides[J]. J Hyg Res, 2000, 29(2): 65-68. DOI:10.3969/j.issn.1000-8020.2000.02.001 |
| [8] |
TAKAKURA N, SANDERS P, FESSARD V, et al. In vitro combined cytotoxic effects of pesticide cocktails simultaneously found in the French diet
[J]. Food Chem Toxicol, 2013, 52: 153-162. DOI:10.1016/j.fct.2012.11.011 |
| [9] |
ILBOUDO S, FOUCHE E, RIZZATI V, et al. In vitro impact of five pesticides alone or in combination on human intestinal cell line Caco-2
[J]. Toxicol Rep, 2014, 1: 474-489. DOI:10.1016/j.toxrep.2014.07.008 |
| [10] |
SALEEM U, EJAZ S, ASHRAF M, et al. Mutagenic and cytotoxic potential of endosulfan and lambda-cyhalothrin: in vitro study describing individual and combined effects of pesticides
[J]. J Environ Sci, 2014, 26(7): 1471-1479. DOI:10.1016/j.jes.2014.05.013 |
| [11] |
MA M M, CHEN C, YANG G L, et al. Combined cytotoxic effects of pesticide mixtures present in the Chinese diet on human hepatocarcinoma cell line[J]. Chemosphere, 2016, 159: 256-266. DOI:10.1016/j.chemosphere.2016.05.050 |
| [12] |
FAUST M, ALTENBURGER R, BACKHAUS T, et al. Predicting the joint algal toxicity of multi-component s-triazine mixtures at low-effect concentrations of individual toxicants
[J]. Aquat Toxicol, 2001, 56(1): 13-32. DOI:10.1016/S0166-445X(01)00187-4 |
| [13] |
佟鹤芳. 常见农药污染物在人体血液样本中的检测及人体负荷水平研究[D]. 北京: 北京协和医学院, 2013. TONG H F. Detection of common pesticide pollutants in human blood samples and study on human load level[D]. Beijing, China: Peking Union Medical College, 2013. |
| [14] |
DE P, CHATTERJEE R. Nucleolar localization of succinic dehydrogenase in human malignant cells with MTT[J]. Experientia, 1962, 18(12): 562. |
| [15] |
MOSMANN T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983, 65(1-2): 55-63. DOI:10.1016/0022-1759(83)90303-4 |
| [16] |
杨桂玲. 农产品中农药多残留联合暴露风险评估方法研究[D]. 北京: 中国农业科学院, 2017. YANG G L. Risk assessment of combined exposure to multiple pesticide residues in agricultural products[D]. Beijing, China: Chinese Academy of Agricultural Sciences, 2017. |
| [17] |
RIZZATI V, BRIAND O, GUILLOU H, et al. Effects of pesticide mixtures in human and animal models: an update of the recent literature[J]. Chem Interactions, 2016, 254: 231-246. DOI:10.1016/j.cbi.2016.06.003 |
| [18] |
GORE A C, CHAPPELL V A, FENTON S E, et al. Executive summary to EDC-2: the endocrine society’s second scientific statement on endocrine-disrupting chemicals[J]. Endocr Rev, 2015, 36(6): 593-602. DOI:10.1210/er.2015-1093 |
| [19] |
VANDENBERG L N, COLBORN T, HAYES T B, et al. Hormones and endocrine-disrupting chemicals: low-dose effects and nonmonotonic dose responses[J]. Endocr Rev, 2012, 33(3): 378-455. DOI:10.1210/er.2011-1050 |
| [20] |
安丽, 鲍清, 施万英, 等. 乙羧氟草醚农药对大鼠肝脏毒性的研究[J]. 中国工业医学杂志, 2004, 17(3): 181-182. AN L, BAO Q, SHI W Y, et al. Hepatoxicity of fluoroglycoften-ethyl pesticide in rats[J]. Chin J Ind Med, 2004, 17(3): 181-182. DOI:10.3969/j.issn.1002-221X.2004.03.022 |
 2019, Vol. 21
2019, Vol. 21