2. 浙江钱江生物化学股份有限公司,浙江 海宁 314400
2. Zhejiang Qianjiang Biochemical Co., Ltd, Haining 314400, Zhejiang Province, China
随着研究的深入,微生物 (真菌、细菌、放线菌、酵母和病毒) 农药及其相关产品以其选择性高、对人畜无害、对自然环境污染小以及不易产生抗药性等特点成为替代化学农药的首选,同时也是目前发展最快速、推广应用最成功的生物农药产品[1]。在微生物农药中,以生防细菌为主,而芽孢杆菌是目前应用最广的生防细菌[2],其中贝莱斯芽孢杆菌Bacillus velezensis是一种新型生防细菌,近几年研究发现,该菌对促植物生长、抗病虫害和诱导系统抗病性等具有明显效果[3]。本研究所用的B. velezensis TCS001菌株分离自渤海海泥,已被证明有广谱的抑菌活性,其发酵滤液对黄瓜灰霉病菌Botrytis cinerea菌丝生长和孢子萌发均存在显著的抑制效果[4]。而发酵滤液中除了含有微量的代谢活性物质外,还含有大量杂质,其抑菌活性受到培养基中化合物的种类及比例,以及发酵培养的各种条件参数的影响[5]。因此,对生防菌的发酵条件进行研究,通过提高发酵滤液的抑菌活性而间接提高活性物质的浓度,可为其活性产物的分离提取及结构鉴定等后续研究提供基础[6]。
目前已有较多关于发酵培养基及培养条件优化的报道,常用的试验方法包括单因素法、全因素法、正交试验法、均匀设计法和响应面分析法等[7],这些方法均可获得良好效果。单因素试验是保持其他因子不变,研究单个因子的影响,试验设计无法说明所涉及的所有因素的交互作用;而且单因素试验需要多次试验才能找到最佳水平,既耗时间又耗材料[8]。响应面分析法 (Response Surface Methodogy, RSM) 可通过较少的试验次数研究多个影响因素的作用,推算出目标值的优化条件,被广泛应用于培养基和培养条件的优化中[9]。目前,国内外利用响应面分析法优化B. velezensis的发酵条件鲜有报道,多数研究是直接挑选影响因素进行优化[10-13],因素选择存在一定主观性,研究结果科学依据不足。鉴于此,本研究以B. velezensis TCS001为研究对象,结合Plackett-Burman(PB) 设计筛选出关键影响因子,再利用响应面分析法,以其发酵滤液的抑菌活性为响应值优化TCS001的发酵条件,旨在为其工业化生产提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 供试菌株贝莱斯芽孢杆菌Bacillus velezensis TCS001,菌株分离自中国渤海海泥,由本实验室筛选、保存及鉴定。黄瓜灰霉病菌Botrytis cinerea,由本实验室提供。
1.1.2 培养基NA培养基:蛋白胨10.0 g/L,牛肉浸膏3.0 g/L,葡萄糖10.0 g/L,酵母粉1.0 g/L,琼脂粉 18.0 g/L,pH 7.0~7.2;
种子培养基:胰蛋白胨7.0 g/L,酵母粉2.0 g/L,葡萄糖2.0 g/L,NaCl 6.0 g/L,KCl 0.06 g/L,MgCl2·6H2O 0.5 g/L,pH 7.0~7.2;
6种基础发酵培养基:NB培养基:蛋白胨10.0 g/L,牛肉浸膏3.0 g/L,葡萄糖10.0 g/L,酵母粉1.0 g/L,pH 7.0~7.2;LB培养基:酵母粉5.0 g/L,胰蛋白胨10.0 g/L,NaCl 10.0 g/L,pH 7.0~7.2;BP培养基:牛肉浸膏5.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L,pH 7.0~7.2;SOB培养基:蛋白胨20.0 g/L,酵母粉5.0 g/L,NaCl 0.5 g/L,KCl 0.18 g/L,MgCl2·H2O 0.95 g/L,pH 7.0~7.2;BPY培养基:牛肉浸膏5.0 g/L,蛋白胨10.0 g/L,酵母粉5.0 g/L,葡萄糖5.0 g/L,pH 7.0~7.2;YT培养基:蛋白胨10.0 g/L,酵母粉5.0 g/L,葡萄糖1.0 g/L,NaCl 5.0 g/L,pH 7.0~7.2。
1.1.3 供试黄瓜黄瓜Cucumis sativus L.宝扬5号,上海市宝山区蔬菜科学技术推广站。
1.2 试验方法 1.2.1 TCS001发酵滤液离体抑菌活性测定采用菌丝生长速率法[14]。将TCS001发酵液于4 ℃、12 000 r/min条件下离心20 min,取上清液经22 μm微孔滤膜过滤3次,得到发酵滤液。按体积分数为20%的比例,将发酵滤液与50 ℃左右的PDA培养基混匀,倒平板,凝固后,在PDA平板中心接入直径7 mm生长旺盛的黄瓜灰霉病病原菌菌饼,菌丝面朝下。每个处理设3个重复。于植物生长培养箱中,在 (25 ± 0.1)℃条件下暗培养,待对照组病原菌直径长至培养皿直径的3/4时,采用十字交叉法测量病原菌直径,对照组直径为d1(mm),处理组直径为d2(mm),按 (1) 式计算抑菌率 (Ia),利用SPSS 22.0软件对抑菌率进行单因素方差分析。
| $ I_{\rm{a}} /{\text{%}}=\frac{{d}_{1}-{d}_{2}}{{d}_{1}-7} \times 100 $ | (1) |
制备TCS001种子液[4]。以体积分数4%种子液的接种量分别接种于含有供试6种基础发酵培养基的摇瓶中,以温度 (27 ± 0.1) ℃、转速140 r/min和发酵培养时间 36 h为初始发酵条件进行发酵培养,每处理设3组重复。取出发酵液,按照1.2.1节的方法制备发酵滤液,测定其对黄瓜灰霉病菌的抑菌活性。
1.2.3 响应面法优化TCS001发酵条件 1.2.3.1 Plackett-Burman设计法确定发酵主要影响因素采用Minitab 17软件的Plackett-Burman(PB)设计法进行试验设计,设置1.2.2节最佳基础培养基和初始发酵条件中各个因素的高低两个水平,低水平 (–1) 为初始值,高水平 (1) 为低水平的1.25倍值,每组处理重复3次。采用1.2.1节的方法获得不同处理下TCS001发酵滤液的抑菌率,试验结果利用Minitab 17软件分析,确定影响发酵结果的主要影响因素。
1.2.3.2 最陡爬坡法确定发酵条件响应中心点根据PB试验得出的一次拟合方程,确定主要影响因素;再根据拟合方程中各变量的系数确定主要因素的爬坡方向和变化步长。在主要影响因素中,正效应因子设置各水平值时在原始基础上依次增加,负效应因子条件值在原始基础上依次降低,其他非主要影响因素根据效应因子的正负,选择相应的高或低值保持不变,以此设置最陡爬坡试验[15]。
1.2.3.3 响应面分析法确定主要影响因素最优水平根据最陡爬坡试验结果,确定主要影响因子的响应中心点。以TCS001发酵滤液的抑制率为响应值,采用Box-Behnken 设计法进行因素优化试验,建立最佳发酵条件,并以1.2.1节的方法验证其响应面法获得的预测值。
1.2.4 TCS001发酵液对盆栽黄瓜灰霉病菌病斑抑制效果选取长势一致的、两片真叶期黄瓜苗,用喉头喷雾器分别将3 mL TCS001优化发酵液和基础发酵液均匀喷施于黄瓜苗。以喷施等量清水为对照组,每组处理重复10盆,每盆3株。自然晾干24 h后接种病原菌。取在PDA平板培养6 d、生长旺盛的黄瓜灰霉病菌,用直径为7 mm的打孔器,打取获得灰霉病菌菌饼,菌丝朝下贴于黄瓜第一片展开的真叶上[16]。处理后将黄瓜苗置于 (28 ± 1) ℃、相对湿度80%~90%和光照 (L/D) = 16 h/8 h的植物培养室中,恒温保湿培养7 d,用游标卡尺以十字交叉垂直法测量病斑直径各1次,取平均值,D1代表对照组病斑直径(mm),D2代表药剂处理组病斑直径(mm),按公式 (2) 计算病斑抑制率 (Ib)。
| $ I_{\rm{b}}{\text{%}}=\frac{{D}_{1}-{D}_{2}}{{D}_{1}} \times 100 $ | (2) |
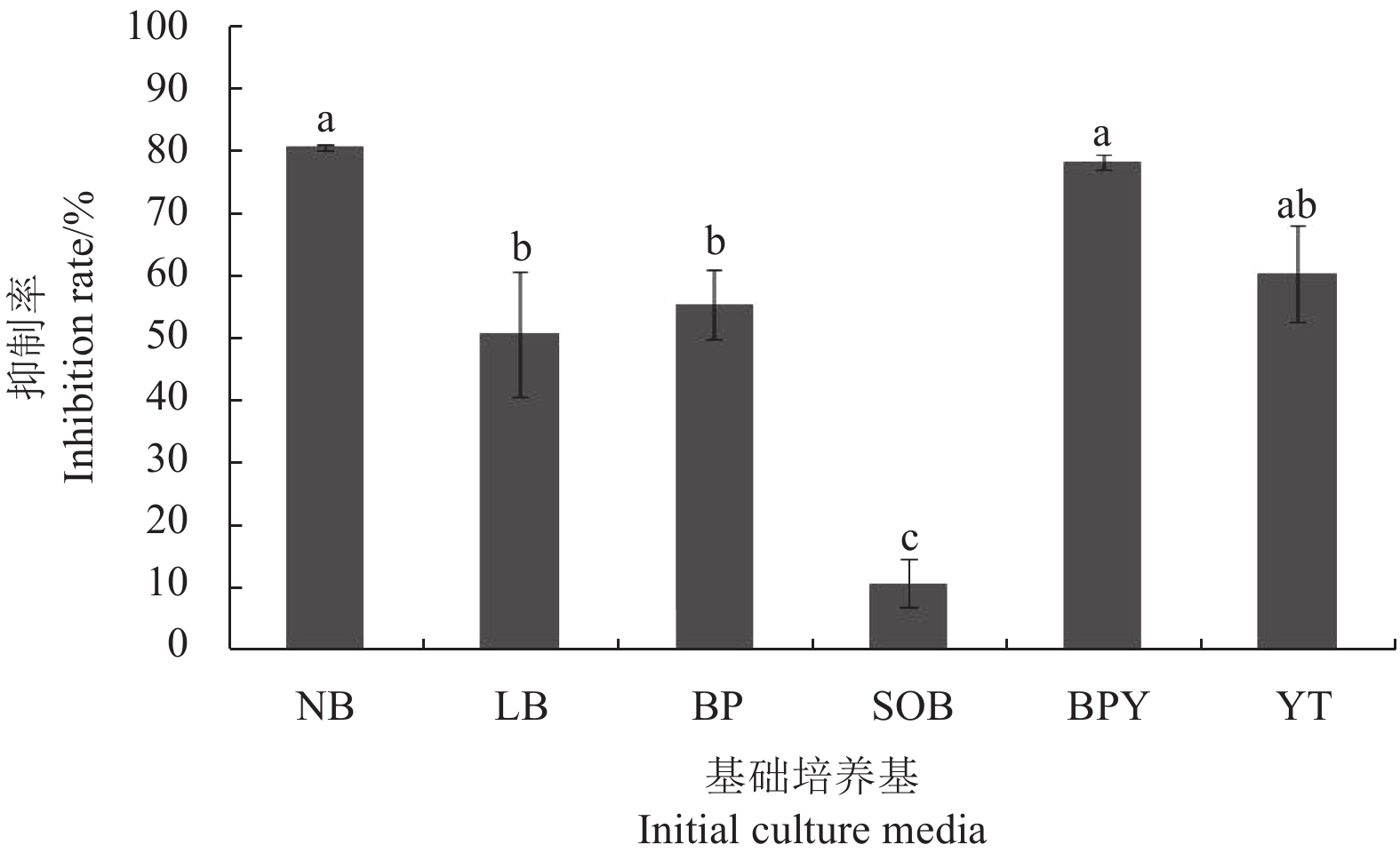
图1显示:菌株TCS001在6种不同基础培养基中发酵培养,其发酵滤液的抑菌活性明显不同,其中,以NB和BPY作基础培养基时,TCS001发酵滤液的抑菌效果显著优于其他培养基 (P < 0.05),抑制率分别为80.9%和78.6%,两者无显著差异,综合考虑成本等多方面因素,最终选择NB为基础培养基进行下一步试验。
|
注:图中不同小写字母表示在0.05水平上差异显著。 Note: The different letters indicate the significant differences at P = 0.05 level. 图 1 不同基础培养基对TCS001发酵滤液对黄瓜灰霉病菌抑菌活性的影响 Fig. 1 Effects of different initial culture media on the inhibition activity of strain TCS001 fermentation filtrate against B. cinerea |
2.2 影响发酵结果的主要因素确定
PB试验设计及结果见表1,结果回归分析见表2。由表2可知,因素B牛肉浸膏 (P = 0.001)、E转速 (P = 0.003) 和I温度 (P = 0.012) 的可信度水平均高于95%(P < 0.05),说明这3个因素对发酵滤液的抑菌率有显著影响,而其他因素的可信度水平均低于95%( P > 0.05),说明在测试范围内,这些因素对发酵滤液的抑菌率无显著影响 [17]。
|
|
表 1 Plackett-Burman试验设计及结果 Table 1 Design and results of Plackett-Burman experimental |
|
|
表 2 Plackett-Burman试验设计的回归分析 Table 2 Regression analysis of experimental results based on Plackett-Burman design |
在有显著影响的3个因素中,影响作用由大到小依次是牛肉浸膏、转速和温度,故选择这3个因素进行下一步试验。
2.3 响应中心点及发酵条件确定由最陡爬坡路径试验的结果 (表3)可知:当牛肉浸膏质量4.5 g、转速160 r/min和温度25 ℃时,TCS001菌株发酵滤液对黄瓜灰霉菌的抑制率最高,为87.2%,因此选择此点作为响应中心点,进一步进行Box-Behnken试验设计 (表4)。
|
|
表 3 最陡爬坡路径试验设计及结果 Table 3 Design and results of the experiments using steepest-ascent method |
|
|
表 4 Box-Behnken设计编码水平表 Table 4 Values of coded levels used for the Box-Behnken design |
2.4 Box-Behnken试验设计结果与分析
Box-Behnken试验设计与结果见表5。利用DX-8软件对表5中的数据进行拟合,得到TCS001发酵滤液抑菌率 (Y) 对牛肉浸膏质量 (A, g)、转速 (B, r/min) 和温度 (C, ℃) 的二次多项回归方程模型为:
|
|
表 5 Box-Behnken试验设计方案及结果 Table 5 The design scheme and test results of the Box-Behnken design |
| $ \begin{split} Y=\;&89.76-3.16 A+1.73 B-1.00 C-0.36 A B+0.079 A C\\ &+1.77 B C-3.29 A^{2}-2.27 B^{2}-3.24 C^{2} \end{split} $ |
对该模型进行方差分析和差异显著性检验,结果见表6。
|
|
表 6 Box-Behnken试验设计回归分析结果 Table 6 Regression analysis of experimental results based on Box-Behnken design |
由表6可知:该模型回归极显著 (P < 0.000 1),说明该模型可用于对TCS001发酵滤液抑菌率的预测。F值分析结果表明,3个要素对抑菌率均有显著影响,且BC之间存在一定的交互作用;方程失拟项为1.98 > 0.05,表明其失拟不显著,模型较稳定,能很好地进行预测;决定系数 R2 = 0.987 4,说明该模型拟合度较好,能较好地反映预测[18]。
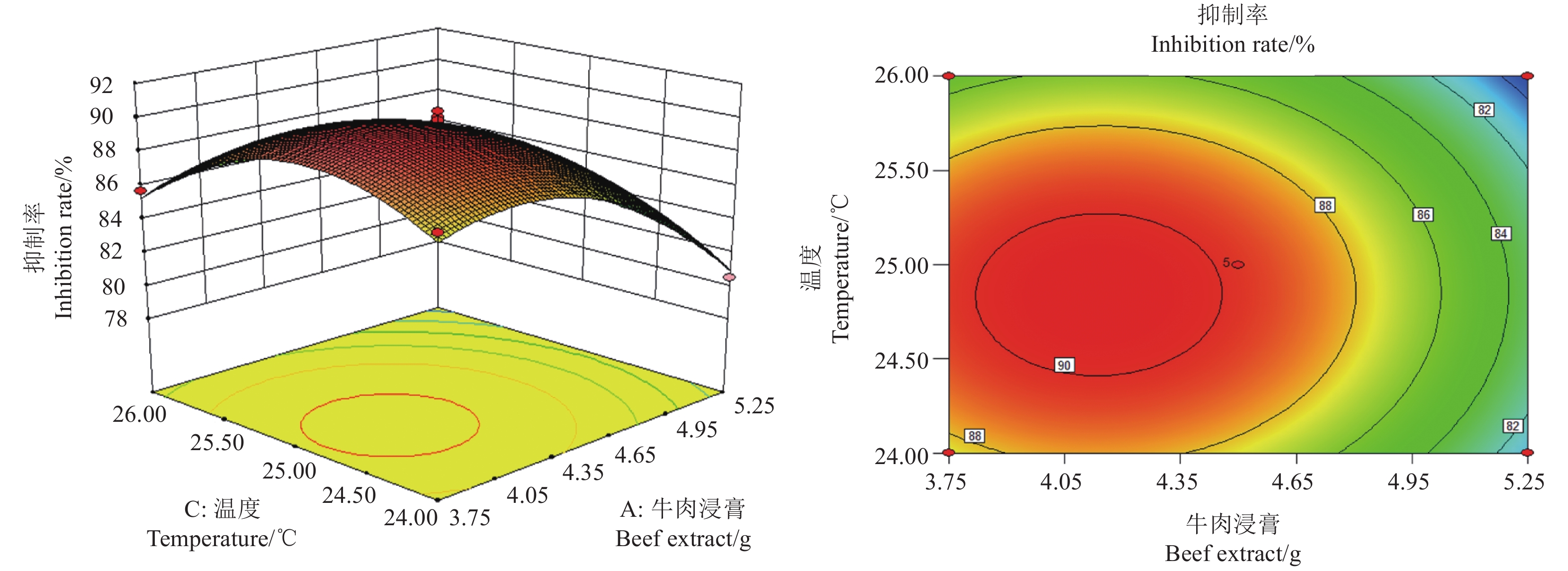
2.5 响应面分析根据方程模拟结果,采用Dx-8软件绘制响应面曲线图和等高线图 (图2、3和4)。三幅曲面图都为凸面图,说明抑菌率有最大值。通过求解回归方程,得到TCS001发酵滤液抑菌率最大时的发酵条件为:牛肉浸膏4 g、转速164 r/min、温度25 ℃,在此条件下抑菌率预测值为90.9%。

|
图 2 转速和牛肉浸膏含量交互作用对TCS001发酵滤液抑菌活性的影响 Fig. 2 The influence of interaction between the shaking speed and the beef extract on the activity of the strain TCS001 fermentation filtrate |
|
图 3 温度和牛肉浸膏含量交互作用对TCS001发酵滤液抑菌活性的影响 Fig. 3 The influence of interaction between the temperature and the beef extract on the activity of the strain TCS001 fermentation filtrate |

|
图 4 转速和温度交互作用对TCS001发酵滤液抑菌活性的影响 Fig. 4 The influence of interaction between the shaking speed and the temperature on the activity of the strain TCS001 fermentation filtrate |
2.6 响应面最优条件验证
按照1.2.1节发酵滤液抑菌率的试验方法对模型优化后的培养基进行符合度验证。采用优化后的最佳发酵条件制备TCS001发酵液,即蛋白胨10.0 g,葡萄糖12.5 g,牛肉浸膏4.0 g,酵母粉1.0 g,蒸馏水1 000 mL,装液量(体积分数)40%,种子培养时间16 h,接种量(体积分数)3%、转速164 r/min,温度25 ℃,pH值 7.0、发酵培养时间36 h。试验重复3次,3次实际测试抑菌率结果分别为91.4%(图5-A)、89.2%(图5-B)、87.3%(图5-C),平均值为89.3% ± 2.1%,与预测值91.0%吻合良好,说明建立的模型有效。

|
CK:对照组;A、B、C:处理组的3个重复。 CK: Control group. A, B, C: Three repeats of treatment group. 图 5 在最佳发酵条件下TCS001发酵滤液对黄瓜灰霉菌的抑制率 Fig. 5 Inhibition rates of TCS001 under the optimized fermentation conditions against B. cinerea |
2.7 优化后TCS001发酵液对活体盆栽黄瓜灰霉病的病斑抑制效果
由图6和图7看出,用优化前后的发酵条件培养的发酵液喷雾处理黄瓜苗后,黄瓜叶片灰霉病的病斑直径分别为25.33和10.29 mm,可见,采用优化后的发酵条件得到TCS001发酵液对黄瓜叶片的灰霉病菌病斑抑制率提高了36.9%。

|
注:图中不同小写字母表示在0.05水平上差异显著。 Note: The different letters indicate the significant differences at P = 0.05 level. 图 6 优化前后TCS001发酵液对黄瓜灰霉菌的病斑抑制效果 Fig. 6 Inhibitory effect on the disease lesions of B. cinerea treated by TCS001 fermentation broth |

|
注:A:清水处理;B:初始发酵液处理;C:优化后的发酵液处理。 Note:A: Water treatment; B: Initial fermentation broth treatment; C: Optimized fermentation broth treatment. 图 7 优化前后TCS001发酵液对黄瓜灰霉病的病斑抑制效果照片 Fig. 7 The inhibitory effect on the disease lesions of B. cinerea treated by different fermentation broth |
3 讨论
抑菌活性物质的生成是生防菌株发挥防病功能的重要机制之一,而活性物质的生成效率不仅与菌株自身遗传特性相关,亦受菌株培养条件的影响[19]。不同生防菌株对培养基营养及发酵条件的需求不同,因此需要对特定的菌株筛选适宜的培养基配方及发酵条件。如张雯等[20]利用响应面法对Bacillus subtilis BS08进行发酵条件优化,筛选出温度、接种量和pH值为主要影响因素,最适发酵条件为:酵母浸膏14 g/L,无水葡萄糖14 g/L,硫酸镁1 g/L, 接种量7.0%, pH值8.2,培养温度38 ℃,转速200 r/min,发酵时间24 h。优化后发酵液中抑菌类活性物质含量达450 mg/L,比已有报道提高48%;方翔等[21]采用单因素试验结合正交试验优化Bacillus velezensis XP-27的发酵条件,得到最适发酵条件为:牛肉膏1.0%,淀粉1.5%,K2HPO4 0.05%,MgSO4·7H2O 0.1%,初始pH值8.0,培养温度30 °C,接种量7%,发酵时间120 h。优化后抑菌效果提高78.18%。
可见,在人工发酵过程中根据生防菌株的生长特性以及产生抑菌活性物质的营养需求,对菌株发酵培养基和发酵条件进行优化可有效提高菌株产生抑菌活性物质的水平,同时降低生产成本,获得最佳的生产效率和经济效益。本研究以发酵滤液抑制黄瓜灰霉病菌的活性为指标,在摇瓶发酵条件下对B. velezensis TCS001进行初始发酵培养基筛选,对培养基组分比例及发酵条件进行优化。结果表明:菌株TCS001最适初始发酵培养基为NB培养基,与产生次生抑菌活性物质相关的主要影响因素为牛肉浸膏含量、转速和温度。当牛肉浸膏含量为4.0 g/L、转速为164 r/min和温度为25 ℃时,TCS001发酵滤液离体抑菌活性最高,达91.0%,活体盆栽抑菌活性提高36.9%。上述研究结果表明,B. velezensis TCS001与其他生防菌株的发酵培养基组分和培养条件相差很大,而造成这种差异的可能机制尚需做进一步深入探讨。
发酵培养基的组成和发酵条件会对生防菌株发酵产生次生抑菌活性物质的产量和种类产生影响。如Khan等[22]研究了49种不同碳源对B. subtilis DK1-SA11抑菌活性的影响,发现以D-甘露糖为碳源时,抑菌活性提高33.3%,以D-阿拉伯醇为碳源时,抑菌活性降低44.4%。Arokiyaraj等[23]研究发现,培养基中加入适量的氯化锰能显著提高Bacillus cereus角蛋白酶产量 (102.6 U/g),而加入硫酸锌和硫酸铜则会降低角蛋白酶产量。本研究优化后得到的培养基组成和培养条件能够显著提高菌株TCS001等量发酵液的抑菌活性,根据相关文献报道可知,B. velezensis发酵液中可能含有伊枯草菌素、表面活性素、泛革素和大环内酯类化合物等抑菌活性物质[24-26],后续研究将在本文研究基础上,分离纯化B. velezensis TCS001发酵液中的主要抑菌活性成分,深入探究该菌株对灰霉菌具有抑制作用的相关机理,并评估其用于田间防治效果,为在生产中利用该菌株进行黄瓜灰霉病的生物防治奠定坚实的研究基础。
| [1] |
胡霞, 苑艳辉, 姚卫容, 等. 微生物农药发展概况[J]. 农药, 2005, 44(2): 49-52. HU X, YUAN Y H, YAO W R, et al. Status of microbial pesticide development[J]. Pesticides, 2005, 44(2): 49-52. DOI:10.3969/j.issn.1006-0413.2005.02.001 |
| [2] |
BHATTACHARYYA P N, JHA D K. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture[J]. World J Microbiol Biotechnol, 2012, 28(4): 1327-1350. DOI:10.1007/s11274-011-0979-9 |
| [3] |
NAM M H. Biological control of strawberry Fusarium wilt caused by Fusarium oxysporum f. sp. fragariae using Bacillus velezensis BS87 and RK1 formulation
[J]. J Microbiol Biotechnol, 2009, 19(5): 520-524. DOI:10.4014/jmb.0805.333 |
| [4] |
杨可, 郑柯斌, 黄晓慧, 等. 海洋生境贝莱斯芽孢杆菌 TCS001 的鉴定及抑真菌活性[J]. 农药学学报, 2018, 20(3): 333-339. YANG K, ZHENG K B, HUANG X H, et al. Identification and antifungal activity of marine Bacillus velezensis strain TCS001 [J]. Chin J Pestic Sci, 2018, 20(3): 333-339. |
| [5] |
SANCHEZ S, DEMAIN A L. Metabolic regulation of fermentation processes[J]. Enzym Microb Technol, 2002, 31(7): 895-906. DOI:10.1016/S0141-0229(02)00172-2 |
| [6] |
纪明山, 王毅婧. 地衣芽孢杆菌生防菌株 SDYT-79 发酵条件优化[J]. 沈阳农业大学学报, 2011, 42(2): 164-169. JI M S, WANG Y J. Optimizing fermentation condition for the antagonistic Bacillus licheniformis SDYT-79 strain [J]. Shenyang Agric Univ, 2011, 42(2): 164-169. DOI:10.3969/j.issn.1000-1700.2011.02.007 |
| [7] |
王永宏, 张强, 张兴, 等. 响应面法优化 Xenorhabdus nematophila 发酵培养基的研究
[J]. 西北农林科技大学学报 (自然科学版), 2009, 37(7): 140-146. WANG Y H, ZHANG Q, ZHANG X, et al. Enhanced antibiotic activity of Xenorhabdus nematophila by fermentation medium optimization with response surface methodology [J]. J Northwest A&F Univ (Nat Sci Ed), 2009, 37(7): 140-146. |
| [8] |
KIM K K, KANG J G, MOON S S, et al. Isolation and identification of antifungal N-butylbenzenesulphonamide produced by Pseudomonassp. AB2
[J]. J Antibiot, 2000, 53(2): 131-136. DOI:10.7164/antibiotics.53.131 |
| [9] |
GRAHOVAC J, GRAHOVAC M, DODIĆ J, et al. Optimization of cultivation medium for enhanced production of antifungal metabolites by Streptomyces hygroscopicus
[J]. Crop Prot, 2014, 65: 143-152. DOI:10.1016/j.cropro.2014.07.020 |
| [10] |
MOGHANNEM S A M, FARAG M M S, SHEHAB A M, et al. Exopolysaccharide production from Bacillus velezensis KY471306 using statistical experimental design
[J]. Braz J Microbiol, 2018, 49(3): 452-462. DOI:10.1016/j.bjm.2017.05.012 |
| [11] |
KIM M, KANG DUK-UN, LEE J. Construction of a recombinant Escherichia coli JM109/A-68 for production of carboxymethylcellulase and comparison of its production with its wild type, Bacillus velezensis A-68 in a pilot-scale bioreactor
[J]. Biotechnol Bioproc E, 2016, 21(5): 601-611. DOI:10.1007/s12257-016-0468-y |
| [12] |
李姝江, 王淋敏, 谯天敏, 等. 利用响应面法优化贝莱斯芽孢杆菌 ZJ20 发酵参数[J]. 西北农林科技大学学报 (自然科学版), 2019, 47(2): 88-96. LI S J, WANG L M, QIAO T M, et al. Optimization of Bacillus velezensis ZJ20 fermentation parameters by response surface methodology [J]. J Northwest A&F Univ (Nat Sci Ed), 2019, 47(2): 88-96. |
| [13] |
黄铭慧. 大豆尖镰孢根腐病拮抗菌 X2 生防菌剂的研制与应用[D]. 哈尔滨: 东北农业大学, 2017. HUANG M H. Research and application on antagonistic Bacteria (X2) powder for suppressing soybean root rot induced by Fusarium oxysporum[D]. Harbin: Northeast Agricultural University, 2017. |
| [14] |
杨胜清, 张帆, 马贵龙. 贝莱斯芽孢杆菌 S6 拮抗物质分离纯化及抑菌机理[J]. 农药, 2017, 56(9): 645-648, 660. YANG S Q, ZHANG F, MA G L. Purification and inhibitive mechanism of antagonist substances from Bacillus velezensis S6 strain [J]. Agrochemicals, 2017, 56(9): 645-648, 660. |
| [15] |
邓志平, 陈浩, 陈三凤. 利用响应面法优化固氮类芽孢杆菌Paenibacillus sp.1-49 的发酵培养基
[J]. 微生物学报, 2016, 56(9): 1415-1425. DENG Z P, CHEN H, CHEN S F. Medium optimization for nitrogen fixer Paenibacillus sp.1-49 [J]. Acta Microbiologica Sinica, 2016, 56(9): 1415-1425. |
| [16] |
陈艳光. 枯草芽孢杆菌 BSD-2 诱导黄瓜抗灰霉病作用机理研究[D]. 石家庄: 河北师范大学, 2015. CHEN Y G. Mechanisms of induced systemic resistance (ISR) in cucumber against Botrytis cinerea by Bacillus subtilis BSD-2[D]. Shijiazhuang: Hebei Normal University, 2015. |
| [17] |
SHAFI J, SUN Z H, JI M S, et al. ANN and RSM based modelling for optimization of cell dry mass of Bacillussp. strain B67 and its antifungal activity against Botrytis cinerea
[J]. Biotechnol Biotechnol Equip, 2018, 32(1): 58-68. DOI:10.1080/13102818.2017.1379359 |
| [18] |
MORAIS E S, MENDONÇA P V, COELHO J F J, et al. Deep eutectic solvent aqueous solutions as efficient media for the solubilization of hardwood xylans[J]. ChemSusChem, 2018, 11(4): 753-762. DOI:10.1002/cssc.201702007 |
| [19] |
JOSE PA, SIVAKALA KK, et al. Formulation and statistical optimization of culture medium for improved production of antimicrobial compound by Streptomyces sp. JAJ06
[J]. Int J Microbiol, 2013, 2019: 1-9. |
| [20] |
张雯, 卞丹, 沈燕秋, 等. 枯草芽孢杆菌抑菌活性物质鉴定、抑菌特性及发酵条件优化[J]. 中国食品学报, 2017, 12: 105-115. ZHANG W, BIAN D, SHEN Y Q, et al. Identification and characterization of antibacterial metabolites and optimization of cultural conditions for Bacillus subtilis [J]. J Chin Institute Food Sci Technol, 2017, 12: 105-115. |
| [21] |
方翔, 徐伟芳, 牛娜, 等. 一株桑树内生拮抗菌的分离、鉴定及发酵条件优化[J]. 微生物学报, 2018, 58(12): 103-116. FANG X, XU W F, NIU N, et al. Screening, identification and optimization of fermentation conditions of an antagonistic endophytic bacterium from mulberry[J]. Acta Microbiologica Sinica, 2018, 58(12): 103-116. |
| [22] |
KHAN M N, LIN H, LI M, et al. Identification and growth optimization of a Marine Bacillus DK1-SA11 having potential of producing broad spectrum antimicrobial compounds
[J]. Pak J Pharm Sci, 2017, 30(3): 839-853. |
| [23] |
AROKIYARAJ S, VARGHESE R, ALI AHMED B, et al. Optimizing the fermentation conditions and enhanced production of keratinase from Bacillus cereus isolated from halophilic environment
[J]. Saudi J Biol Sci, 2019, 26(2): 378-381. DOI:10.1016/j.sjbs.2018.10.011 |
| [24] |
曾欣, 张亚惠, 等. 温郁金内生拮抗细菌 B-11 的分离及其抑菌活性[J]. 微生物学通报, 2019, 46(5): 1018-1029. ZENG X, ZHANG Y H, et al. Antimicrobial activity of endophytic bacterium strain B-11 isolated from Curcuma wenyujin [J]. Microbiol China, 2019, 46(5): 1018-1029. |
| [25] |
冯语嫣, 刘晓凡, 等. 葡萄抑菌附生细菌筛选鉴定及其结构表征[J]. 食品与发酵工业, 2019, 45(5): 31-37. FENG Y Y, LIU X F, et al. Screening, identification, and structure characterization of grape epiphytic bacteria[J]. Food Ferment Ind, 2019, 45(5): 31-37. |
| [26] |
PAN H Q, LI Q L, HU J C. The complete genome sequence of Bacillus velezensis 9912D reveals its biocontrol mechanism as a novel commercial biological fungicide agent
[J]. J Biotechnol, 2017, 247: 25-28. DOI:10.1016/j.jbiotec.2017.02.022 |
 2019, Vol. 21
2019, Vol. 21


