类拟盘多毛孢真菌 (Pestalotiopsis-like fungi),包括拟盘多毛孢属Pestalotiopsis、新拟盘多毛孢属Neopestalotiopsis和假拟盘多毛孢属Pseudopestalotiopsis,是黑盘孢科Amphisphaeriaceae中的无性形真菌类群[1-3]。该真菌类群在世界范围内广泛分布,在热带和亚热带生态系统中生物多样性尤其丰富,其宿主专一性不高,能够引起多种植物的多种病害,如即可引起木榄Bruguiera gymnorrhiza赤斑病、危害秋茄Kandelia candel引起褐斑病、危害白骨壤Avicennia mariana引起灰斑病[4],也可以对蓝莓Vaccinium corymbosum造成侵染,引起叶斑病[5]和枝枯病[6-7],是重要的植物病原菌。
拟盘多毛孢属Pestalotiopsis sp.真菌对草莓造成的侵染,国内外已有报道,如长丝拟盘多毛孢P. longisetula [8]与茶褐斑拟盘多毛孢P. guepinii[9]可侵染草莓造成叶斑病。目前,西班牙、阿根廷和印度等地已报道,新拟盘多毛孢N. clavispora (同P. clavispora) 可侵染草莓造成根腐和茎腐病[10-12]。中国仅2016年在北京和青岛市发现由N. clavispora引起的草莓叶斑病[13]和根腐病[14],是中国草莓 Fragaria × ananassa 上发现的一种新病害。除危害草莓外,新拟盘多毛孢N. clavispora还可侵染牛油果Persea americana[15]、碧根果Carya illinoensis[16]、月季Rosa chinensis[17]、狭叶费菜Phedimus aizoon[18]和茶树Camellia sinensis[19]等作物,给农业生产造成严重危害。
当前化学杀菌剂仍是世界各国防治类拟盘多毛孢真菌病害的主要手段,但目前在中国的草莓生产中尚未有登记用于防治该类病害的药剂。戊唑醇 (三唑类)、嘧菌酯 (甲氧基丙烯酸酯类,QoIs) 和苯醚甲环唑 (三唑类) 是已在草莓上登记的田间常用防治其他真菌病害的杀菌剂[20-22],但有些真菌对部分杀菌剂已产生严重的抗药性[21],为筛选出高效的用于防治草莓新拟盘多毛孢N. clavispora病害的杀菌剂,笔者对从主要草莓产区采集具有草莓新拟盘多毛孢病害典型症状的病叶进行分离鉴定,选择已登记的用于草莓灰霉病、白粉病和炭疽病等真菌病害防治的3 种药剂:戊唑醇、嘧菌酯、苯醚甲环唑和不同作用机制和作用方式的杀菌剂:百菌清 (取代苯类)、氟环唑 (三唑类)、腈菌唑 (三唑类)、代森锰锌 (硫代氨基甲酸酯类)、咪鲜胺 (咪唑类) 以及1 种新型杀菌剂双苯菌胺为供试药剂,测定了其对新拟盘多毛孢N. clavispora的毒力,以期为草莓新病害的科学防治提供参考。
1 材料与方法 1.1 试验材料 1.1.1 供试菌株采集2014—2018年从中国草莓主要产区叶斑病发生严重的地区 (山东、北京、广东及云南) 采集具有叶斑病典型症状的病叶,进行分离、纯化和培养。
1.1.2 供试药剂和试剂97%咪鲜胺 (prochloraz) 原药,杭州庆丰农化有限公司;98%苯醚甲环唑 (difenoconazole) 原药,杭州宇龙农化有限公司;98.5%代森锰锌 (mancozeb) 原药,河北贺森化工有限公司;98%腈菌唑 (myclobutanil) 原药和97.8%氟环唑 (epoxiconazole) 原药,河南中原种衣剂厂;98%百菌清 (chlorothalonil) 原药,河南省春光农化有限公司;98%双苯菌胺 (SYP-14288) 原药,沈阳化工研究院;98.5%嘧菌酯 (azoxystrobin) 原药,江阴苏利化学股份有限公司;97.5%戊唑醇 (tebuconazole) 原药,江苏丰登农药有限公司。
二甲基亚砜 (DMSO),分析纯,北京化工厂;99% 水杨肟酸 (SHAM),Sigma-Aldrich (用二甲基亚砜配成 1.0 × 104 μg/mL 的母液,用于QoIs杀菌剂 (嘧菌酯) 室内毒力测定中抑制旁路氧化途径)。
1.2 试验方法 1.2.1 病原菌的分离纯化参照方中达的方法进行病叶的常规组织分离[23]。取叶片病健交界处组织,用1.5% 的次氯酸钠溶液表面消毒 1~2 min,以无菌水冲洗 3 次,于无菌滤纸上吸干水分。将组织块置于常规 PDA (200 g土豆、20 g葡萄糖、18 g琼脂粉,1 000 mL水) 培养基上培养,并进行病原菌的分离和单孢纯化,每片病叶只保留1个单孢菌株。获得的病原菌纯培养物,保存于北京农学院植物保护实验室。
1.2.2 形态学鉴定获得纯培养的菌株后,参考文献[24]方法,在显微镜下对病原菌形态进行观察拍照,观察记录菌落的形状、颜色、气生菌丝的疏密程度以及分生孢子形态等。
1.2.3 致病性测定根据柯赫氏法则,参考文献[24]方法将分离获得的菌株接种到草莓叶片和果实上。每个菌株接种5个草莓叶片和果实,以接种无菌水的叶片和果实为对照,3 d后观察并记录发病情况。
1.2.4 分子生物学鉴定 1.2.4.1 DNA提取与PCR扩增采用北京博迈德生物科技有限公司提供的基因组DNA快速抽提试剂盒 (真菌) 进行病菌基因组DNA的提取。选用rDNA-ITS (Internal Transcribed Spacer,内转录间隔区) 片段,采用引物ITS4 (TCCTCCGCTTATTGATATGC) 和ITS5 (GGAAGTAAAAGTCGTAACAAGG) 进行PCR扩增[25]。PCR 反应体系为50 μL:正反向引物各1 μL,DNA模板1 μL,ddH2O 22 μL,2 × PCR Master Mix (含2 × Taq DNA Polymerase, 2 × PCR Buffer, 2 × dNTP) 25 μL。PCR扩增反应程序:95 ℃预变性5 min,95 ℃变性30 s,52 ℃退火45 s,72 ℃延伸90 s,35个循环,72 ℃延伸10 min[26]。PCR 扩增产物经1%琼脂糖凝胶电泳检测后,送由北京博迈德生物科技有限公司完成测序工作。
1.2.4.2 系统发育分析将测序获得的菌株序列与表1中的序列进行同源性比较,以Mega6.0进行多序列比对后,以同属近源种截盘多毛孢Truncatella angustata (AF377300和AF405306) 为外群,选择HKY模型,用Mrbayes的贝叶斯法构建系统发育树。以确定采集得到的菌株与已报道的菌株的同源性,分析各菌株的亲缘关系。
|
|
表 1 Neopestalotiopsis clavispora系统发育分析使用的菌株信息 Table 1 Strains information of Neopestalotiopsis clavispora that used for phylogenetic analysis |
1.2.5 杀菌剂对供试病原菌的室内毒力测定
用二甲基亚砜 (QoIs 杀菌剂需要加入1.0 × 104 μg/mL 的水杨肟酸) 将供试药剂溶解配制成一定质量浓度的药剂母液,再用二甲基亚砜稀释成系列质量浓度的药液供试 (见表2)。采用菌丝生长速率法[27]测定9种杀菌剂对供试菌株的毒力作用。
|
|
表 2 供试杀菌剂母液及系列稀释质量浓度 Table 2 Initial concentration and series dilution concentrations of the fungicides |
1.3 数据统计分析
参考文献[20]求出各浓度药剂对菌丝生长的抑制率。
将药剂浓度转化为对数作为横坐标 (x),抑制率转化成几率值作为纵坐标 (y),求出毒力回归方程y = ax + b和相关系数 (r),计算出药剂的有效抑制中浓度EC50 (μg/mL)。对计算得出的结果用SPSS软件进行统计分析。
2 结果与分析 2.1 病原菌分离纯化与形态特征观察经病原菌分离和纯化,从具有典型症状的病叶 (图1a) 组织上获得8株菌株,其中6株来自广东惠州 (编号:GD-1~6)、1株来自北京昌平 (编号:BJ-1) 和1株来自云南保山 (编号:BS-1)。菌株在PDA上25 ℃培养5 d后,菌落呈白色丝绒状,近圆形,边缘规则,后期菌落正面未见明显的色素产生,背面淡橘黄色 (图1b);分生孢子呈纺锤形,直径为 (26.56~32.72) μm × (8.08~9.52) μm,分生孢子有4个隔膜,5个细胞,分隔处缢缩不明显,中间3个细胞颜色较深为橄榄色,顶端与尾部细胞颜色较淡,多数呈透明状,顶端2~4 (多为 3) 根附属丝,尾部1根附属丝,附属丝无色透明 (图1c)。根据形态特征,8株病原菌属于拟盘多毛孢属Pestalotiopsis Steyaert真菌。

|
a:叶部症状;b: PDA培养基上菌落形态;c:分生孢子;d:接种草莓叶片;e:接种草莓果实。 a:Symptoms in leaf;b:Colony morphology on PDA medium;c:Conidia;d:Symptoms on inoculated strawberry leaf; e:Symptom on inoculated strawberry fruit. 图 1 草莓叶斑病症状、病原菌形态特征以及致病性 Fig. 1 Symptoms of strawberry leaf spot, morphological characteristics and pathogenicity of the pathogen |
2.2 病原菌的致病性
接种草莓叶片后,3 d左右可见叶片变黑,菌丝较少,形状不规则,与田间症状相同;接种草莓果实后,3~4 d可见褐色病斑,表面凹陷腐烂,产生的菌丝呈白色,到后期白色菌丝内部出现黑色小点,为病原菌的分生孢子盘 (图1d,1e)。根据柯赫氏法则,从接种发病的草莓叶片和果实上可以重新分离到该病原菌,证明用于接种的病原菌是引起草莓叶斑病的病原菌。
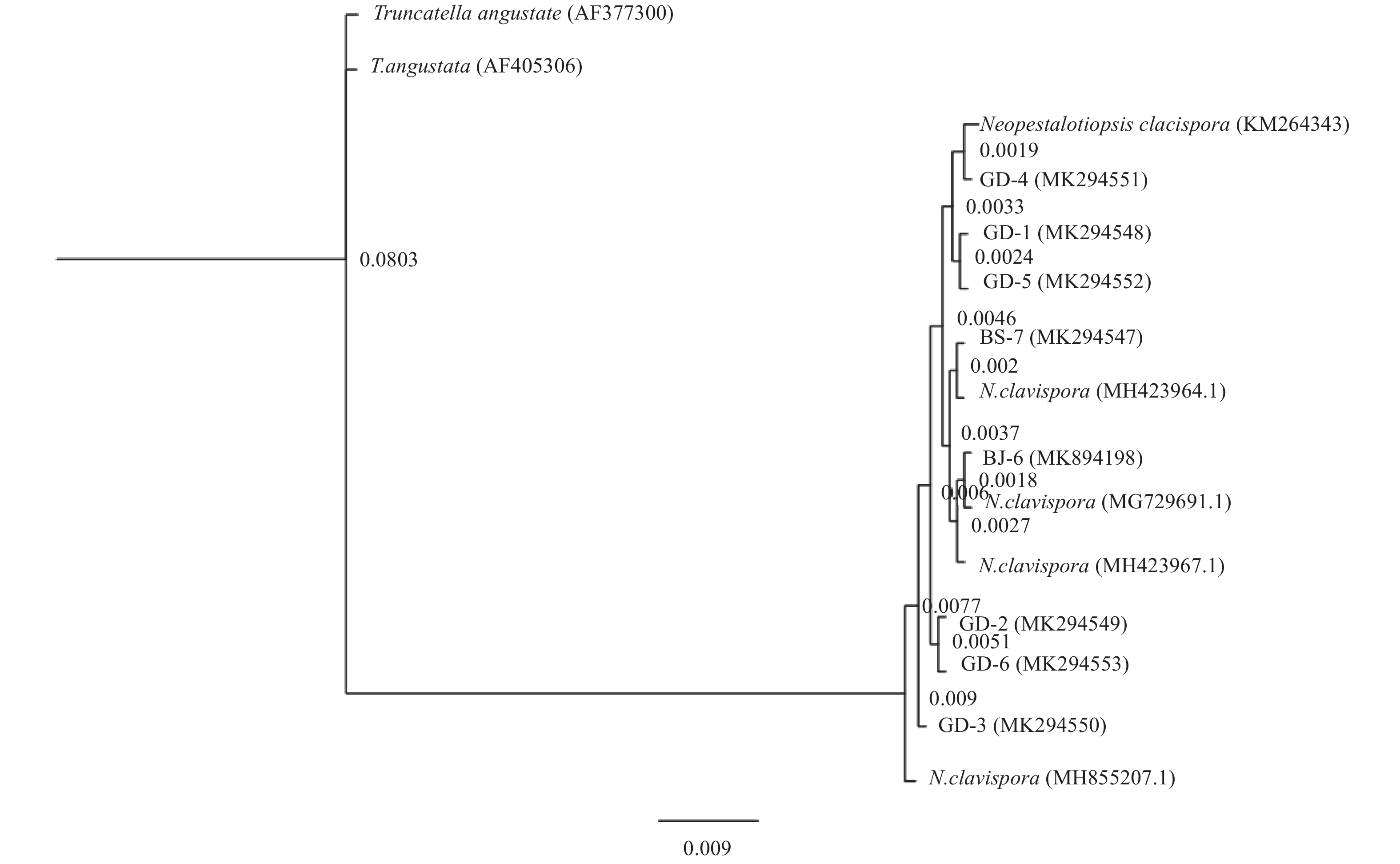
2.3 病原菌的系统发育分析采用 1.2.4.2 所述方法,以8株病原菌 GD-1~6、BJ-1和BS-1的基因组 DNA 为模板,PCR 扩增 rDNA-ITS 片段并测序,获得序列长度为500~600 bp。将序列提交GenBank (NCBI),获得基因登录号 (MK294548、MK294549、MK294550、MK294551、MK294552、MK294553、MK894198、MK294547)。选取不同寄主和地域来源的7个同源序列进行系统发育树分析。结果表明,8株菌株均与N. clavispora聚于一个分支上,标尺值为0.009 (图2)。结合菌株形态特征以及分子生物学分析结果,确定8株分离获得菌株为新拟盘多毛孢N. clavispora。
|
图 2 基于rDNA-ITS序列构建N. clavispora系统发育树 Fig. 2 Construction of N. clavispora phylogenetic tree based on rDNA-ITS sequences of strains and their related species |
2.4 供试杀菌剂对新拟盘多毛孢的毒力
结果 (表3) 表明:在供试的9种杀菌剂中,双苯菌胺对8株新拟盘多毛孢 N. clavispora的毒力最强,平均EC50值为 (0.004 ± 0.002) μg/mL;其次为咪鲜胺、嘧菌酯、戊唑醇、氟环唑、苯醚甲环唑和腈菌唑,平均EC50值在0.006~0.803 μg/mL之间;百菌清毒力较低,而代森锰锌对新拟盘多毛孢 N. clavispora几乎没有抑制作用。
|
|
表 3 9种杀菌剂对N. clavispora的毒力 Table 3 Toxicities of 9 fungicides to N. clavispora |
3 结论与讨论
拟盘多毛孢属真菌在自然界中广泛存在,种类繁多,已报道该属真菌种类达240多种,其中多数种可引起植物病害,造成严重的经济损失[7,28]。2015年西班牙首次报道了由新拟盘多毛孢 N. clavispora 侵染草莓可造成根冠变色及棕褐色坏死斑[12],而中国于2016年在北京和青岛发现该病原菌可侵染草莓[13-14]。本研究中采集到的草莓叶斑病危害症状与文献报道过的由N. clavispora引起的叶部病害症状一致[12]。Jeewon 等[29-30]指出,拟盘多毛孢属真菌的形态学和分子生物学特征具有一定的对应关系,将两者相结合进行鉴定,结果更为准确。本研究通过形态学特征、rDNA-ITS系统发育分析相结合的方法明确了分离自北京昌平、云南保山及广东惠州的8株病原菌为新拟盘多毛孢N. clavispora。
本研究中选择市场上常用的防治草莓真菌病害的杀菌剂:氟环唑、苯醚甲环唑、戊唑醇、百菌清、腈菌唑、嘧菌酯、代森锰锌、咪鲜胺[31-32]以及新型杀菌剂——双苯菌胺进行室内毒力测定。结果表明,双苯菌胺对该病菌菌丝生长有很强的抑制作用,可作为防治草莓叶斑病的首选药剂。双苯菌胺,研发代号SYP-14288是由沈阳化工研究院创制的新型杀菌剂,具有低毒、高效、广谱的特点[33],但因其作用方式主要为保护作用[34],建议在病害发生之前提前使用。此外,咪鲜胺对N. clavispora的毒力作用也较强,平均EC50值为 (0.006 ± 0.002) μg/mL。在已有报道中,咪鲜胺被推荐用作防治草莓炭疽病的高效防治药剂[31],在本研究中未发现对咪鲜胺的抗性菌株,因此,也可以将咪鲜胺作为草莓新拟盘多毛孢叶斑病化学防治的推荐药剂。嘧菌酯、戊唑醇、氟环唑和苯醚甲环唑可以作为备选药剂与替代药剂,以延缓抗药性的产生。8株供试菌株对戊唑醇最高EC50值与最低EC50值的倍数大于100倍,推测所采集到的菌株对戊唑醇可能已经出现抗性。
通过对供试菌株进行室内毒力测定可以看出,多种供试药剂对该病原菌菌丝生长具有很好的抑制效果,但在田间施药时,由于会受到多种因素如温度、光照、湿度等的影响,所选药剂在培养基中的作用效果与在田间草莓叶片上的作用效果可能会存在一定的差异,因此本研究结果仍需进一步的田间药效试验加以验证,以更准确地指导对草莓新拟盘多毛孢叶斑病的科学防治。
| [1] |
BARR M E. Pestalosphaeria, a new genus in the Amphisphaeriaceae
[J]. Mycologia, 1975, 67(1): 187-194. DOI:10.1080/00275514.1975.12019740 |
| [2] |
LEE S, CROUS P W, WINGFIELD M J. Pestalotioid fungi from Restionaceae in the cape floral kingdom[J]. Stud Mycol, 2006, 55: 175-187. DOI:10.3114/sim.55.1.175 |
| [3] |
MAHARACHCHIKUMBURA S S N, HYDE K D, GROENEWALD J Z, et al. Pestalotiopsis revisited
[J]. Stud Mycol, 2014, 79: 121-186. DOI:10.1016/j.simyco.2014.09.005 |
| [4] |
黄泽余, 周志权, 黄平明, 等. 广西红树林真菌病害调查初报[J]. 广西科学院学报, 1997, 13(4): 41-45. HUANG Z Y, ZHOU Z Q, HUANG P M, et al. Brief report on fungus disease attached to mangrove in Guangxi[J]. J Guangxi Acad Sci, 1997, 13(4): 41-45. |
| [5] |
石凌波, 李媛, 费诺亚, 等. 蓝莓拟盘多毛孢叶斑病病原菌鉴定[J]. 中国南方果树, 2017, 46(1): 24-28. SHI L B, LI Y, FEI N Y, et al. Identification of the Pestalotiopsis pathogen of blueberry leaf spot [J]. South China Fruits, 2017, 46(1): 24-28. |
| [6] |
赵洪海, 岳清华, 梁晨. 蓝莓拟盘多毛孢枝枯病的病原菌[J]. 菌物学报, 2014, 33(3): 577-583. ZHAO H H, YUE Q H, LIANG C. The pathogen causing Pestalotiopsis twig dieback of blueberry [J]. Mycosystema, 2014, 33(3): 577-583. |
| [7] |
ESPINOZA J G, BRICENO E X, KEITH L M, et al. Canker and twig dieback of blueberry caused by Pestalotiopsis spp. and a Truncatella spp. in Chile
[J]. Plant Dis, 2008, 92(10): 1407-1414. DOI:10.1094/PDIS-92-10-1407 |
| [8] |
TEIXEIRA M A, MARTINS R M S, VIEIRA R F, et al. In vitro identification and control of Pestalotiopsis longisetula fungus, pathogens strawberry crop
[J]. Revista Agrogeoambiental, 2015, 7(3): 59-65. |
| [9] |
WEBER R W S, ENTROP A P. Dactylonectria torresensis as the main component of the black root rot complex of strawberries and raspberries in northern Germany
[J]. Erwerbs-Obstbau, 2017, 59(3): 157-169. DOI:10.1007/s10341-017-0343-9 |
| [10] |
OBREGÓN V G, MENEGUZZI N G, IBAÑEZ J M, et al. First report of Neopestalotiopsis clavispora causing root and crown rot on strawberry plants in Argentina
[J]. Plant Dis, 2018, 102(9): 1856. |
| [11] |
MAHAPATRA S, BANERJEE J, KUMAR K, et al. Leaf spot and fruit rot of strawberry caused by Neopestalotiopsis clavispora in Indo-Gangetic plains of India
[J]. Indian Phytopathol, 2018, 71(2): 279-283. DOI:10.1007/s42360-018-0043-x |
| [12] |
CHAMORRO M, AGUADO A, de los SANTOS B. First report of root and crown rot caused by Pestalotiopsis clavispora (Neopestalotiopsis clavispora) on strawberry in Spain
[J]. Plant Dis, 2016, 100(7): 1495. |
| [13] |
赵景楠, 马喆, 刘正坪, 等. 草莓拟盘多毛孢叶斑病的病原菌[J]. 菌物学报, 2016, 35(1): 114-120. ZHAO J N, MA Z, LIU Z P, et al. Pestalotiopsis clavispora causing leaf spot on strawberry [J]. Mycosystema, 2016, 35(1): 114-120. |
| [14] |
赵宇, 钱恒伟, 徐鹏程, 等. 青岛市草莓根腐病病原菌分离及鉴定[J]. 中国植保导刊, 2016, 36(1): 43-46, 82. ZHAO Y, QIAN H W, XU P C, et al. Isolation and identification of pathogen of strawberry root rot in Qingdao[J]. China Plant Prot, 2016, 36(1): 43-46, 82. DOI:10.3969/j.issn.1672-6820.2016.01.009 |
| [15] |
VALENCIA A L, TORRES R, LATORRE B A. First report of Pestalotiopsis clavispora and Pestalotiopsis spp. causing postharvest stem end rot of avocado in Chile
[J]. Plant Dis, 2011, 95(4): 492. |
| [16] |
LAZAROTTO M, MUNIZ M F B, POLETTO T, et al. First report of Pestalotiopsis clavispora causing leaf spot of Carya illinoensis in Brazil
[J]. Plant Dis, 2012, 96(12): 1826. |
| [17] |
FENG Y R, LIU B S, SUN B B. First report of leaf blotch caused by Pestalotiopsis clavispora on Rosa chinensis in China
[J]. Plant Dis, 2014, 98(7): 1009. |
| [18] |
YANG L N, MIAO X Y, BAI Q R, et al. NeoPestalotiopsis clavispora causing leaf spot on Phedimus aizoon var. latifolius, a new disease in China
[J]. Plant Dis, 2017, 101(11): 1952-1953. |
| [19] |
CHEN Y J, ZENG L, SHU N, et al. Pestalotiopsis-like species causing gray blight disease on Camellia sinensis in China
[J]. Plant Dis, 2018, 102(1): 98-106. DOI:10.1094/PDIS-05-17-0642-RE |
| [20] |
徐英, 马森, 杨奎, 等. 40% 戊唑醇悬浮剂对草莓炭疽病的毒力测定及田间防效[J]. 农药, 2017, 56(11): 853-855. XU Y, MA S, YANG K, et al. The toxicity determination and field efficacy trials of tebuconazole 40% SC against Fragaria ananassa colletotrichum [J]. Agrochemicals, 2017, 56(11): 853-855. |
| [21] |
张佳, 张璨, 芦帆, 等. 草莓灰霉病菌对嘧菌酯的抗性检测及抗性菌株的生物学特性研究[J]. 植物病理学报, 2016, 46(1): 124-130. ZHANG J, ZHANG C, LU F, et al. Detection of resistance to azoxystrobin and characterization of the azoxystrobin-resistant isolates in Botrytis cinerea from strawberry [J]. Acta Phytopathol Sin, 2016, 46(1): 124-130. |
| [22] |
张颂函, 陈秀, 赵莉, 等. 6 种杀菌剂防治草莓白粉病的田间药效评价[J]. 农药科学与管理, 2017, 38(6): 55-58. ZHANG S H, CHEN X, ZHAO L, et al. Evaluation on field efficacy of six fungicides against powdery mildew on strawberry[J]. Pestic Sci Admin, 2017, 38(6): 55-58. DOI:10.3969/j.issn.1002-5480.2017.06.010 |
| [23] |
方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 427. FANG Z D. Plant disease research methods[M]. Beijing: China Agriculture Press, 1998: 427. |
| [24] |
温浩, 张桂军, 毕扬, 等. 草莓棒孢叶斑病的病原菌鉴定及其对9种杀菌剂的敏感性[J]. 农药学学报, 2019, 21(3): 279-284. WEN H, ZHANG G J, BI Y, et al. Pathogen identification of Corynespora leaf spot on strawberry and its sensitivity to nine fungicides [J]. Chin J Pestic Sci, 2019, 21(3): 279-284. |
| [25] |
宋玉. 拟盘多毛孢属(Pestalotiopsis)真菌系统学研究及条形码基因的评价[D]. 贵阳: 贵州大学, 2015. SONG Y. Taxonomy of the genus Pestalotiopsis and evaluation of its DNA barcoding[D]. Guiyang: Guizhou University, 2015. |
| [26] |
WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR Protocols. Elsevier, 1990: 315-322. DOI: 10.1016/b978-0-12-372180-8.50042-1
|
| [27] |
慕立义. 植物化学保护研究方法[M]. 北京: 中国农业出版社, 1994: 76-81. MU L Y. Research methods of chemical plant protection[M]. Beijing: China Agriculture Press, 1994: 76-81. |
| [28] |
韦继光, 徐同, 潘秀湖, 等. 拟盘多毛孢属的分类学研究进展[J]. 广西农业生物科学, 2006, 25(1): 78-85. WEI J G, XU T, PAN X H, et al. Progress of research on taxonomy of Pestalotiopsis [J]. J Guangxi Agric Biol Sci, 2006, 25(1): 78-85. |
| [29] |
JEEWON R, LIEW E C Y, HYDE K D. Phylogenetic evaluation of species nomenclature of Pestalotiopsis in relation to host association
[J]. Fungal Divers, 2004, 17: 39-55. |
| [30] |
JEEWON R, LIEW E C Y, SIMPSON J A, et al. Phylogenetic significance of morphological characters in the taxonomy of Pestalotiopsis species
[J]. Mol Phylogenetics Evol, 2003, 27(3): 372-383. DOI:10.1016/S1055-7903(03)00010-1 |
| [31] |
韩永超, 曾祥国, 向发云, 等. 湖北省草莓炭疽病菌对咪鲜胺的敏感性[J]. 农药学学报, 2014, 16(5): 535-540. HAN Y C, ZENG X G, XIANG F Y, et al. Sensitivity of Colletotrichum spp. from strawberry to prochloraz in Hubei Province of China [J]. Chin J Pestic Sci, 2014, 16(5): 535-540. DOI:10.3969/j.issn.1008-7303.2014.05.07 |
| [32] |
耿文龙, 张夏兰, 胡盼, 等. 草莓褐色叶斑病病原菌生物学特性及其室内药剂筛选[C]//中国植物病理学会2012年学术年会论文集. 北京: 中国农业科学技术出版社, 2012: 28. GENG W L, ZHANG X L, HU P, et al. Biological characteristics and laboratory evaluation of fungitoxicants against Pilidium lythri causing tan-brown leaf spot of strawberry[C]//Proceedings of the Annual Meeting of Chinese Society for Plant Pathology (2012). Beijing: China Agricultural Science and Technology Press, 2012: 28. |
| [33] |
倪笑霞. 双苯菌胺的抑菌谱及其对辣椒疫霉的作用机制研究[D]. 北京: 中国农业大学, 2013. NI X X. Study on the antifungal spectrum and the mode of action of the novel fungicide SYP-14288 to Phytophthora capsici[D]. Beijing: China Agricultural University, 2013. |
| [34] |
兰杰, 陈宣明, 司乃国, 等. 双苯菌胺对菌核病生物活性及田间应用技术研究[M]//中国植物病害化学防治研究: 第9卷, 2014: 51-57. LAN J, CHEN X M, SI N G, et al. The lab and field efficacy of SYP14288 against cucumber downy mildew[M]//Chemical control of plant diseases in China: Vol. 9, 2014: 51-57. |
 2019, Vol. 21
2019, Vol. 21


