2. 中国农业大学 昆虫学系,北京 100193
2. Department of Entomology, China Agricultural University, Beijing 100193, China
草地贪夜蛾Spodoptera frugiperda (J. E. Smith) 属鳞翅目 (Lepidoptera) 夜蛾科 (Noctuidae) 灰翅夜蛾属 (Spodoptera),又名秋黏虫,起源于美洲地区,是玉米生产上的主要害虫之一,也是巴西历史上最具破坏性的玉米作物害虫之一[1-3]。其幼虫以多种植物为食,可为害玉米、水稻、高粱、小米、甘蔗、蔬菜作物和棉花等,若防控不及时,可能造成重大产量损失。该虫容易世代重叠,具有很强的适应性和迁徙能力,因而使得其能在任何条件适宜的地区爆发为害。草地贪夜蛾存在与寄主相关的两种生态分型:玉米型草地贪夜蛾更喜欢取食玉米和高粱,而水稻型更喜食水稻[4-5]。这种差异性不仅限于其对寄主的偏好,还延伸到它们的生理[6-7]、交配行为[8],以及对杀虫剂的敏感性[9-10]等方面。
自1996年以来,世界各地陆续开始推广种植能表达苏云金芽孢杆菌 (Bacillus thuringiensis, Bt) 杀虫蛋白的转基因作物,用于鳞翅目害虫防治,其中草地贪夜蛾是主要的防治对象之一[11]。然而,草地贪夜蛾对Bt蛋白的田间抗药性发展已威胁到转Bt作物的可持续利用[12-13]。自2010—2018年间,已先后有多篇论文报道了草地贪夜蛾对转Cry1F、Cry1Ab、Cry2A和Vip3A基因作物的田间抗性[14-20],表明单一依赖转Bt作物并不足以防治该害虫。
草地贪夜蛾作为外来入侵物种,于2019年1月进入中国云南省,后相继在广西、贵州、广东及湖南等地发生、为害,目前已扩散至中国的粮食主产省安徽。由于经历过多个国家化学农药和生物农药的防治,有关这些入侵中国的草地贪夜蛾的具体抗药性状况目前尚不明确[21-23],基于此,迫切需要针对草地贪夜蛾开展一系列科学有效的抗药性监测和抗性机理研究。2019年,李永平等[23]和崔丽等[24] 针对草地贪夜蛾抗药性发生现状及化学防治技术,从抗药性程度及交互抗性、种群遗传以及化学防治的关键技术等方面进行了讨论,及时为草地贪夜蛾的化学防治提供了理论支持。本文拟主要综述有关草地贪夜蛾抗药性监测发展历史,以及抗性机理研究的进展,以期为当前中国草地贪夜蛾的田间防治及尽早开展其抗药性监测和研究提供参考。
1 草地贪夜蛾对杀虫剂的抗性发展于PubMed文献数据库中检索关键词“fall armyworm”和“resistance”,共检索到172篇文献,从1975—2016的统计数据分析看,有关草地贪夜蛾抗药性的报道呈现逐年上升的趋势 (图1)。综合来看,不同地区对杀虫剂的依赖程度和使用频率导致了各地草地贪夜蛾抗性程度的不同。在转Bt玉米推广种植之前,化学防治一直是草地贪夜蛾主要分布国家和地区如美国和巴西等必需的防治手段,常用药剂主要是传统的有机磷类、氨基甲酸酯类和拟除虫菊酯类杀虫剂,而有关其对杀虫剂的抗性报道也主要集中在上述 3 类药剂上,且抗性发生区域大多集中在美国佛罗里达州、波多黎各及墨西哥、巴西等地。此外,也有少量关于草地贪夜蛾对酰胺类杀虫剂如氯虫苯甲酰胺和氟苯虫酰胺抗性的报道。
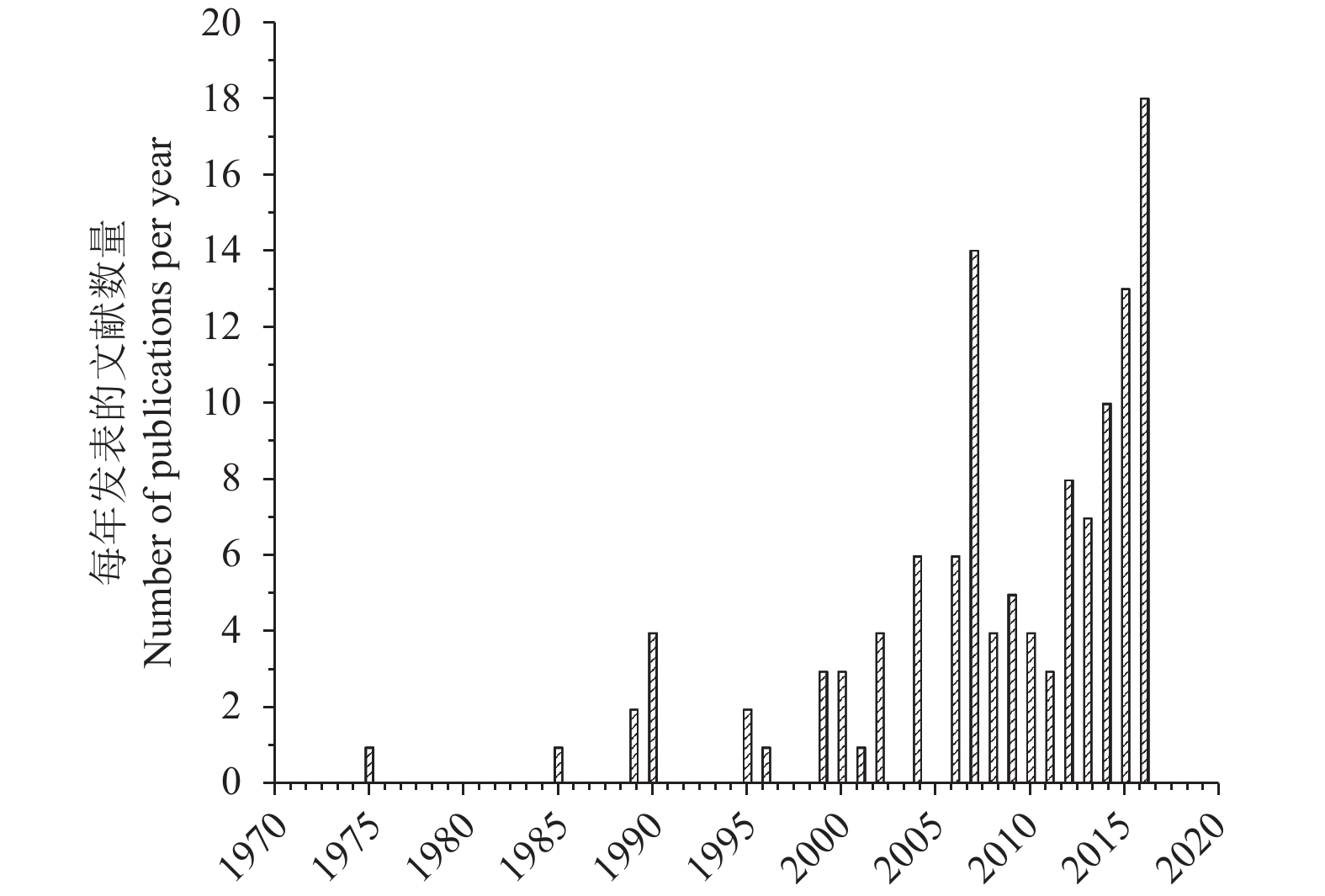
|
图 1 1975—2016年PubMed收录的报道草地贪夜蛾抗药性的文章 Fig. 1 Literatures indexed by PubMed on insecticide resistance of S. frugiperda between 1975 and 2016 |
1.1 草地贪夜蛾对有机磷类杀虫剂的抗性
20世纪70年代,有机磷类农药作为DDT的替代品开始用于田间害虫的防治。1981年,Wood等[25]报道了美国哈蒙德地区草地贪夜蛾对甲基对硫磷 (methyl parathion, 113倍) 和敌百虫 (trichlorfon,31倍) 的抗性。1991年,Yu等[26]报道,与实验室敏感种群相比,美国佛罗里达州北部玉米田的草地贪夜蛾对常用有机磷类杀虫剂产生了不同程度的抗性,其中,对毒死蜱 (chlorpyrifos)、甲基对硫磷 (methyl parathion)、二嗪磷 (diazinon)、甲丙硫磷 (sulprofos)、敌敌畏 (dichlorvos) 及马拉硫磷 (malathion) 的田间抗性在12~271倍之间,处于中到高等抗性水平;2003年,他们发现采自佛罗里达州斯特拉地区的草地贪夜蛾对甲基对硫磷的抗性倍数高达354[27];而到2007年,他们在佛罗里达州北部城市盖恩斯维尔和斯特拉采集的草地贪夜蛾对甲基对硫磷的抗性水平却有所降低,分别为30倍和39倍[28]。Gutiérrez-Moreno等[29]2019年的研究表明,墨西哥索诺拉省的草地贪夜蛾对毒死蜱产生了20倍的抗性,而波多黎各种群的抗性倍数为47,抗性水平高于墨西哥种群。
以上有关草地贪夜蛾对有机磷类杀虫剂抗性的发展动态可以甲基对硫磷为例,在草地贪夜蛾已对甲基对硫磷产生高抗性 (354倍) 的美国佛罗里达州斯特拉地区,使用其他药剂进行防治,3年后其对甲基对硫磷的抗性显著降低 (39倍)[27-28]。同时,根据抗性监测报道,草地贪夜蛾对毒死蜱一直维持在中等抗性水平 (20~25倍)[26, 29]。因此,在用药策略上需注意防范草地贪夜蛾对毒死蜱和甲基对硫磷产生高抗性风险,应采取科学停用及轮换用药等措施。
1.2 草地贪夜蛾对氨基甲酸酯类杀虫剂的抗性自Young等[30]1979年首次报道美国乔治亚州草地贪夜蛾对甲萘威 (carbaryl) 产生了中等水平抗性以来,有关草地贪夜蛾对氨基甲酸酯类杀虫剂的抗性不断被报道。如Wood等[25]1981年报道,美国哈蒙德地区草地贪夜蛾对甲萘威产生了41倍的抗性;1991年,Carpenter等[31]监测到美国佛罗里达州吉尔县玉米上草地贪夜蛾对灭多威 (methomyl) 产生了4.25倍的低水平抗性;1997年,Adamczyk 等[9]对美国路易斯安那州草地贪夜蛾的抗药性监测发现,采自牧草和玉米上的草地贪夜蛾对灭多威仍较为敏感,抗性倍数介于0.01~1.97之间;1991年,Yu等[26]对佛罗里达州盖恩斯维尔地区的草地贪夜蛾种群进行了监测,发现其对氨基甲酸酯类杀虫剂的抗性倍数在14 ~ 192之间,其中对硫双威 (thiodicarb) 和灭多威的抗性分别为26.1和14.4倍,对甲萘威的抗性倍数则大于192;2003年,Yu等[27]对佛罗里达州西特拉地区玉米上的草地贪夜蛾进行了抗药性监测,发现其对甲萘威的抗性已高达562倍;2007年他们对采自佛罗里达州北部 (盖恩斯维尔和西特拉地区) 的两个草地贪夜蛾种群进行了监测,发现其对甲萘威的抗性分别达到了1 159倍和626倍[28]。比较上述报道发现:1991—2007年间,美国佛罗里达州盖恩维斯地区草地贪夜蛾对甲萘威的抗性上升了6.04倍,平均每年上升0.38倍;2003—2007年间,美国西特拉地区草地贪夜蛾对甲萘威的抗性也上升了1.11倍,平均每年上升0.28倍;2019年的最新监测数据表明,美国波多黎各地区草地贪夜蛾对灭多威和硫双威的抗性倍数分别为223和124,均已达到高抗性水平[29]。
从上述有关草地贪夜蛾对氨基甲酸酯类杀虫剂抗性的监测报道看,美国佛罗里达州北部地区草地贪夜蛾对甲萘威的抗性发展最为突出,自1979年首次报道草地贪夜蛾对甲萘威产生了中等水平抗性之后[30],持续到2007年,美国草地贪夜蛾对甲萘威的田间抗性已发展到高峰,如其盖恩维斯地区草地贪夜蛾田间抗性高达1 159倍[28]。此外,监测结果显示,草地贪夜蛾对传统的氨基甲酸酯类杀虫剂灭多威和硫双威能够产生高水平抗性[29]。因此,在使用此类杀虫剂防治草地贪夜蛾时,应明确其有效防治剂量,避免造成作物质量及产量损失。同时由氨基甲酸酯类杀虫剂在美国的抗性发展情况可知,不同地区的田间抗性发展快慢存在明显差异,可能主要与当地的用药背景有关。
1.3 草地贪夜蛾对拟除虫菊酯类杀虫剂的抗性拟除虫菊酯类农药出现于20世纪80年代初,凭借其杀虫谱广、防效高及毒性低等特点而迅速成为防治农业害虫的首选药剂,并在草地贪夜蛾的防治中发挥了重要的作用[32]。然而,随着拟除虫菊酯类杀虫剂在田间的推广应用,其抗性问题也日渐突出。自Wood等[25]1981年首次报道美国哈蒙德地区草地贪夜蛾对氯菊酯 (permethrin) 产生了17倍的抗性以来,1991年,Yu等[26]报道了佛罗里达州北部玉米田间草地贪夜蛾对8种常用拟除除虫菊酯类杀虫剂的抗性监测结果,主要包括氯菊酯 (13.9倍)、氯氰菊酯 (cypermethrin,5.6倍)、氟氯氰菊酯 (cyhalothrin,12.5倍)、氰戊菊酯 (fenvalerate,1.7倍)、四溴菊酯 (tralomethrin,41.2倍)、联苯菊酯 (bifenthrin,29.4倍)、胺菊酯 (tetramethrin,4.6倍) 和氟胺氰菊酯 (fluvalinate,216倍)。该结果显示,草地贪夜蛾对拟除虫菊酯类杀虫剂的抗性水平分别在2~216倍之间,其中对氟胺氰菊酯的抗性最高,对氰戊菊酯则仍保持敏感。1997年,Adamczyk 等[9] 比较了分别采自牧草和玉米上的田间草地贪夜蛾种群对高效氯氰菊酯的敏感性差异,发现其抗性倍数介于0.40~3.07之间,且玉米田草地贪夜蛾比牧草上的抗药性高。据报道,2013年抗性比例最高的墨西哥草地贪夜蛾种群对氯菊酯的抗性倍数为19,而2015年在相同地点采集的墨西哥种群草地贪夜蛾对氯菊酯的抗性却较低 (3倍)[28]。
综上可知,同一国家和地区以不同寄主为食的草地贪夜蛾种群,其对药剂的敏感性也不同,因此应及时监测不同寄主上草地贪夜蛾的抗药性动态,为选择高效、低成本的杀虫剂进行田间防治提供科学依据。
1.4 草地贪夜蛾对其他类型杀虫剂的抗性现状截至2017年,美洲地区的草地贪夜蛾已对至少29种杀虫剂产生了抗性,其中主要包括已知作用机制的化学杀虫剂氨基甲酸酯类 (1A亚组)、有机磷类 (1B亚组)、拟除虫菊酯类 (3组) 以及苏云金芽孢杆菌Cry1F蛋白等[24, 33]。Huang 等[34]的文章指出,在北美地区采用高剂量与庇护所相结合的抗性管理策略下,使用Bt转基因作物防治鳞翅目害虫15年后,部分地区已监测到一些靶标害虫存在田间对Bt的抗性问题,如美国波多黎各的草地贪夜蛾、南非地区的非洲茎螟Busseola fusca及印度的棉红铃虫Pectinophora gossypiella等。对于已出现Bt抗性草地贪夜蛾的地区,需结合使用不同作用机制的杀虫剂进行防治,因此,草地贪夜蛾对Bt抗性与其对其他杀虫剂之间的交互抗性问题值得关注,据Zhu等[35] 于2015年报道,抗Bt的草地贪夜蛾对乙酰甲胺磷 (acephate) 产生了19倍的交互抗性。
Belay等[36] 2012年的报道显示,在美国波多黎各圣伊莎贝尔地区,使用氯虫苯甲酰胺 (chlorantraniliprole)、氟苯虫酰胺 (flubendiamide)、多杀菌素 (spinosad)、乙基多杀菌素 (spinetoram)、茚虫威 (indoxacarb) 及甲氧虫酰肼 (methoxyfenozide) 等药剂均可有效控制草地贪夜蛾。然而仅经过6年的时间,Gutiérrez-Moreno等[29]2018年发现美国波多黎各田间草地贪夜蛾种群已对多种新型作用机制杀虫剂产生了高水平抗性,如氟苯虫酰胺 (500倍) 和氯虫苯甲酰胺 (160倍),对乙基多杀菌素 (14倍) 也显示出了中等水平抗性,此外对多杀菌素 (8倍)、甲氨基阿维菌素苯甲酸盐 (emamectin benzoate,简称甲维盐,7倍) 和阿维菌素 (abamectin,7倍) 均处于低水平抗性阶段。
氯虫苯甲酰胺是美国杜邦公司研发的新一代双酰胺类杀虫剂,通过激活昆虫鱼尼丁受体,过度释放细胞内储存的钙离子,导致昆虫肌肉收缩,丧失行动能力,进而死亡[37]。2019年的最新研究结果表明,在美国波多黎各部分地区已监测到草地贪夜蛾对氯虫苯甲酰胺 (160倍) 和氟苯虫酰胺 (500倍) 的高水平抗性[29];同年,Bolzan等[38]发现室内筛选所得抗氯虫苯甲酰胺草地贪夜蛾种群 (237倍) 与其他酰胺类杀虫剂之间存在不同程度的交互抗性,其中与溴氰虫酰胺存在低水平交互抗性 (27倍),而与氟苯虫酰胺则存在高达42 000倍的交互抗性,因此应高度注意防范草地贪夜蛾对双酰胺类杀虫剂的田间抗性。
2018年世界粮农组织正式通报了草地贪夜蛾对整个非洲大陆的入侵情况[39]。据非洲最新的敏感性研究报道[40],采用不同商品化制剂以田间推荐剂量处理,氯虫苯甲酰胺、乙基多杀菌素和多杀菌素均可有效防治草地贪夜蛾,但85%甲萘威可湿性粉剂 (2 kg/hm2) 和50%马拉硫磷乳油 (2 L/hm2) 的48 h致死率却很低,分别仅为13.9%和32.8%,这与前述关于草地贪夜蛾已对甲萘威[26]和有机磷类杀虫剂[30]产生高水平抗性的报道一致。
以上报道表明,草地贪夜蛾对一些新型作用机制的杀虫剂也产生了中到高水平抗性,且其敏感性基线非常低,以对氯虫苯甲酰胺和氟苯双酰胺的敏感性基线为例,其LD50值分别为0.001和0.003 μg/头[29]。因此,随着草地贪夜蛾入侵的深入,应加快研究建立其对常用杀虫剂的敏感性基线,及早监测草地贪夜蛾在中国的抗药性演化动态,为其科学有效防治提供数据支持。
2 草地贪夜蛾的抗药性机理害虫抗药性的产生往往与持续的田间药剂选择压及害虫本身的生物学特性有关[41-43]。自1979年首次报道草地贪夜蛾对甲萘威的抗性以来[30],针对草地贪夜蛾抗药性机理的研究逐年增多。目前普遍认为,草地贪夜蛾对杀虫剂的抗性机制主要包括以下3个方面:表皮穿透性降低、解毒作用增强和靶标敏感性下降,其中代谢解毒作用增强和靶标敏感性下降是导致草地贪夜蛾对杀虫剂产生抗性的主要机制[44]。
Mccord等[45]早在1987年就研究了草地贪夜蛾对甲萘威的抗性生理机制,发现增效醚 (piperonyl butoxide,PBO) 能使草地贪夜蛾对甲萘威的抗性水平从90倍下降至6倍,增效作用显著,表明细胞色素P450多功能氧化酶 (P450s) 可能在抗性的产生中起了主要作用。同时,离体代谢研究表明,抗性种群中肠粗酶液氧化代谢甲萘威的活性是敏感种群的5倍。此外,采用 14C标记的甲萘威进行的表皮穿透研究显示,点滴处理24 h后,甲萘威对抗性种群幼虫表皮的穿透率仅为45%,而对敏感种群穿透率可达68%[45]。揭示了草地贪夜蛾对甲萘威的高抗性主要由其表皮穿透性降低和氧化代谢作用增强 (通过羟基化和环氧化) 这两部分机理形成[45]。
Dumas等[46]1990年通过杆状病毒介导法研究发现,离体表达的磷酸三酯酶 (phosphotriesterase,OPD) 蛋白能够显著提高草地贪夜蛾对对氧磷 (paraoxon) 的水解代谢能力,使其抗性提高280倍,说明酯酶水解代谢能力增强是草地贪夜蛾对对氧磷产生抗性的主要机制。Yu等[47]1996年研究发现,草地贪夜蛾田间种群的解毒酶活性显著升高,外源化合物对田间种群的多功能氧化酶系 (mixed-function oxidases,MFO) 和谷胱甘肽-S-转移酶 (glutathione transferases,GSTs) 活性的诱导作用均显著降低,且敌敌畏对敏感种群乙酰胆碱酯酶 (acetylcholinesterase,AChE) 的抑制作用显著高于对田间种群的抑制作用,据此推测草地贪夜蛾田间种群对杀虫剂的广谱抗性可能由多种机制共同引起,包括微粒体多功能氧化酶系、谷胱甘肽-S-转移酶和酯酶对杀虫剂解毒作用的增强以及靶标部位敏感性下降 (比如不敏感的乙酰胆碱酯酶)。而其中有关有机磷类和氨基甲酸酯类化合物的类似解毒代谢抗性机制,在棉花贪夜蛾Spodopteralittoralis、黑尾叶蝉Nephotettix cincticeps、小菜蛾Plutellaxylostella、浅色按蚊Anopheles albimanus及东亚飞蝗Locusta migratoria manilensis[48-52]等害虫上也均有报道。
目前,交互抗性机制研究已越来成为抗性研究的热点。基于高抗Cry1F转基因玉米的草地贪夜蛾种群对乙酰甲胺磷具有中等水平的交互抗性,Zhu等[35]进一步研究发现,该抗性种群碱性磷酸酶 (alkaline phosphatase,ALP)、氨肽酶 (aminopeptidase, APN)、乙醛酸酯酶 (1-NA- specific esterase) 和萘磺酸酯酶 (2-NA- specific esterase)、胰蛋白酶 (trypsin) 和胰凝乳蛋白酶 (chymotrypsin) 活性均显著降低,而其PNPA-特异性酯酶和谷胱甘肽-S-转移酶活性显著升高,后者被认为是导致草地贪夜蛾对乙酰甲胺磷产生抗性的代谢抗性机制。Bolzan等[38] 研究发现,氟苯虫酰胺和氯虫苯甲酰胺存在高水平交互抗性风险,经放射配体与蛋白结合试验表明,尽管两者具有不同的化学结构,却均能与昆虫鱼尼丁受体结合,且具有共同的结合位点[53]。而有研究发现,昆虫鱼尼丁受体I4734M及G4946E基因突变是导致鳞翅目害虫对氯虫苯甲酰胺产生抗性的主要因素[53-56]。Boaventura等[55] 2019年关于草地贪夜蛾对氯虫苯甲酰胺抗性机制的最新研究表明,使用不同增效剂抑制草地贪夜蛾解毒代谢酶的活性,并未显著提高抗性筛选种群对氯虫苯甲酰胺的敏感性,表明解毒代谢抗性并非草地贪夜蛾对氯虫苯甲酰胺产生抗性的主要因素,而通过对鱼尼丁受体基因的测序表明,靶标受体点突变才是导致其抗性的主要因素。此外,基于聚合酶链式反应 (PCR) 的等位基因鉴定方法也已经建立,可用于快速监测草地贪夜蛾对氯虫苯甲酰胺等双酰胺类杀虫剂的抗性基因频率[55]。
综上所述,草地贪夜蛾对杀虫剂抗性的形成与其解毒酶活性增强和靶标敏感性降低有关,同时靶标受体突变往往会导致高水平的抗性。国外有关草地贪夜蛾抗药性机理的研究,对中国草地贪夜蛾的防治及抗药性治理提供了理论基础,而及早开展草地贪夜蛾对新型药剂的抗性风险评估和机理研究具有深远的意义。
3 讨论与展望不同地区的用药历史与害虫对杀虫剂的抗性密切相关,草地贪夜蛾入侵中国之后,由于不断受到各种作用方式杀虫剂的选择作用,势必导致其对杀虫剂抗性的进一步发展。赵胜园等[21] 2019年的研究表明,多数传统杀虫剂对新近入侵中国云南省的草地贪夜蛾2龄幼虫的防治效果均不理想,相对而言,甲维盐、氯虫苯甲酰胺及乙基多杀菌素均有非常强的杀虫活性。2007年,Yu等[28]研究发现,已对氨基甲酸酯类和有机磷类产生抗性的草地贪夜蛾田间种群对茚虫威 (indoxacarb) 不存在交互抗性,且茚虫威对田间草地贪夜蛾具有较强的杀虫活性。因此,与传统农药不存在交互抗性的甲维盐、氯虫苯甲酰胺和茚虫威等可以考虑作为防治草地贪夜蛾种群的优选药剂使用,以克服田间草地贪夜蛾对传统杀虫剂的抗性。
不同国家/地区的草地贪夜蛾对杀虫剂表现出不同程度的抗性,反映了不同国家及区域之间害虫防治策略的差异。张磊等2019年的最新研究表明,入侵中国云南省的草地贪夜蛾大部分为玉米型[22]。Adamczyk 等[9]及Ingber等[10]报道,不同生态分型草地贪夜蛾对药剂的敏感性不同,其中玉米型抗药性更高。随着害虫对传统杀虫剂抗性的发展,一些新型药剂陆续被推广应用,如茚虫威是第一个商品化的二嗪类杀虫剂,主要通过触杀和胃毒方式进入昆虫体内,对鳞翅目害虫具有卓越的杀虫活性,对非靶标生物安全,是替代有机磷类和拟除虫菊酯类杀虫剂防治鳞翅目害虫的理想药剂[57-58];氯虫苯甲酰胺是新一代双酰胺类杀虫剂,其高效、广谱,对鳞翅目害虫有很好的防治效果,同时还能控制多种非鳞翅目害虫[37];而甲维盐是一种半合成的高效、低毒生物源杀虫剂,已被用于蔬菜、果树及棉花等作物害虫的防治。倘若短期内在田间大量盲目使用此类高效、低毒的杀虫剂,势必会加大药剂对靶标害虫的选择压力,带来很大的抗药性风险,因此应及时监测不同地区草地贪夜蛾的抗药性动态,尽快制定合理的杀虫剂轮换和复配用药策略,指导科学用药,以延长杀虫剂的田间使用寿命。
针对当前中国草地贪夜蛾爆发所面临的化学防治需求,有必要借鉴国外已有的登记药剂和防治经验[24],同时结合国内草地贪夜蛾对药剂敏感性基线的研究建立工作,合理开展草地贪夜蛾的田间化学防治,并及时进行其抗性风险及抗性机理研究。
| [1] |
CRUZ I, TURPIN F T. Yield impact of larval infestations of the fall armyworm (Lepidoptera: Noctuidae) to midwhorl growth stage of corn[J]. J Econ Entomol, 1983, 76(5): 1052-1054. DOI:10.1093/jee/76.5.1052 |
| [2] |
SPARKS A N. A review of the biology of the fall armyworm[J]. Fla Entomol, 1979, 62(2): 82-87. DOI:10.2307/3494083 |
| [3] |
CRUZ I, DE LOURDES CORRÊA FIGUEIREDO M, DA SILVA R B, et al. Using sex pheromone traps in the decision-making process for pesticide application against fall armyworm (Spodoptera frugiperda [Smith] [Lepidoptera: Noctuidae]) larvae in maize
[J]. Int J Pest Manage, 2012, 58(1): 83-90. DOI:10.1080/09670874.2012.655702 |
| [4] |
PROWELL D P, MCMICHAEL M, SILVAIN J F. Multilocus genetic analysis of host use, introgression, and speciation in host strains of fall armyworm (Lepidoptera: Noctuidae)[J]. Ann Entomol Soc Am, 2004, 97(5): 1034-1044. DOI:10.1603/0013-8746(2004)097[1034:MGAOHU]2.0.CO;2 |
| [5] |
PASHLEY D P. Host-associated genetic differentiation in fall armyworm (Lepidoptera: Noctuidae): a sibling species complex?[J]. Ann Entomol Soc Am, 1986, 79(6): 898-904. DOI:10.1093/aesa/79.6.898 |
| [6] |
PASHLEY D P. Quantitative genetics, development, and physiological adaptation in host strains of fall armyworm[J]. Evolution, 1988, 42(1): 93-102. |
| [7] |
SALDAMANDO C I, VELEZ-ARANGO A M. Host plant association and genetic differentiation of corn and rice strains of Spodoptera frugiperda smith (Lepidoptera: Noctuidae) in Colombia
[J]. Neotrop Entomol, 2010, 39(6): 921-929. DOI:10.1590/S1519-566X2010000600012 |
| [8] |
PASHLEY D P, HAMMOND A M, HARDY T N. Reproductive isolating mechanisms in fall armyworm host strains (Lepidoptera: Noctuidae)[J]. Ann Entomol Soc Am, 1992, 85(4): 400-405. DOI:10.1093/aesa/85.4.400 |
| [9] |
ADAMCZYK JR J J, HOLLOWAY J W, LEONARD B R, et al. Susceptibility of fall armyworm collected from different plant hosts to selected insecticides and transgenic Bt cotton[J]. J Cotton Sci, 1997, 1(1): 21-28. |
| [10] |
INGBER D A, MASON C E, FLEXNER L. Cry1 Bt susceptibilities of fall armyworm (Lepidoptera: Noctuidae) host strains[J]. J Econ Entomol, 2018, 111(1): 361-368. DOI:10.1093/jee/tox311 |
| [11] |
JAMES C. Global status of commercialized biotech/GM crops. 2015[EB/OL]. [2019-06-20]. http://www.isaaa.org/resources/publications/briefs/51/default.asp.
|
| [12] |
TABASHNIK B E, BRÉVAUL T, CARRIÈRE Y. Insect resistance to Bt crops: lessons from the first billion acres[J]. Nat Biotechnol, 2013, 31(6): 510-521. DOI:10.1038/nbt.2597 |
| [13] |
CARRIÈRE Y, CRICKMORE N, TABASHNIK B E. Optimizing pyramided transgenic Bt crops for sustainable pest management[J]. Nat Biotechnol, 2015, 33(2): 161-168. DOI:10.1038/nbt.3099 |
| [14] |
STORER N P, BABCOCK J M, SCHLENZ M, et al. Discovery and characterization of field resistance to Bt maize: Spodoptera frugiperda (Lepidoptera: Noctuidae) in Puerto Rico
[J]. J Econ Entomol, 2010, 103(4): 1031-1038. DOI:10.1603/EC10040 |
| [15] |
OMOTO C, BERNARDI O, SALMERON E, et al. Field‐evolved resistance to Cry1Ab maize by Spodoptera frugiperda in Brazil
[J]. Pest Manag Sci, 2016, 72(9): 1727-1736. DOI:10.1002/ps.2016.72.issue-9 |
| [16] |
FARIAS J R, ANDOW D A, HORIKOSHI R J, et al. Field-evolved resistance to Cry1F maize by Spodoptera frugiperda (Lepidoptera: Noctuidae) in Brazil
[J]. Crop Prot, 2014, 64: 150-158. DOI:10.1016/j.cropro.2014.06.019 |
| [17] |
HUANG F N, QURESHI J A, MEAGHER JR R L, et al. Cry1F resistance in fall armyworm Spodoptera frugiperda: single gene versus pyramided Bt maize
[J]. PLoS One, 2014, 9(11): e112958. DOI:10.1371/journal.pone.0112958 |
| [18] |
LI G P, REISIG D, MIAO J, et al. Frequency of Cry1F non-recessive resistance alleles in North Carolina field populations of Spodoptera frugiperda (Lepidoptera: Noctuidae)
[J]. PLoS One, 2016, 11(4): e0154492. DOI:10.1371/journal.pone.0154492 |
| [19] |
HUANG F N, QURESHI J A, HEAD G P, et al. Frequency of Bacillus thuringiensis Cry1A.105 resistance alleles in field populations of the fall armyworm, Spodoptera frugiperda, in Louisiana and Florida
[J]. Crop Prot, 2016, 83: 83-89. DOI:10.1016/j.cropro.2016.01.019 |
| [20] |
YANG F, KERNS D L, HEAD G P, et al. Cross-resistance to purified Bt proteins, Bt corn and Bt cotton in a Cry2Ab2-corn resistant strain of Spodoptera frugiperda
[J]. Pest Manag Sci, 2017, 73(12): 2495-2503. DOI:10.1002/ps.2017.73.issue-12 |
| [21] |
赵胜园, 孙小旭, 张浩文, 等. 常用化学杀虫剂对草地贪夜蛾防效的室内测定[J]. 植物保护, 2019, 45(3): 10-14. ZHAO S Y, SUN X X, ZHANG H W, et al. Laboratory test on the control efficacy of common chemical insecticides against Spodoptera frugiperda [J]. Plant Protection, 2019, 45(3): 10-14. |
| [22] |
张磊, 靳明辉, 张丹丹, 等. 入侵云南草地贪夜蛾的分子鉴定[J]. 植物保护, 2019, 45(2): 19-24. ZHANG L, JIN M H, ZHANG D D, et al. Molecular identification of invasive fall armyworm Spodoptera frugiperda in Yunnan Province [J]. Plant Protection, 2019, 45(2): 19-24. |
| [23] |
李永平, 张帅, 王晓军, 等. 草地贪夜蛾抗药性现状及化学防治策略[J]. 植物保护, 2019, 45(4): 14-19. LI Y P, ZHANG S, WANG X J, et al. Current status of insecticide resistance in Spodoptera frugiperda and strategies for its chemical control [J]. Plant Protection, 2019, 45(4): 14-19. |
| [24] |
崔丽, 芮昌辉, 李永平, 等. 国外草地贪夜蛾化学防治技术的研究与应用[J]. 植物保护, 2019, 45(4): 7-13. CUI L, RUI C H, LI Y P, et al. Research and application of chemical control technology against Spodoptera frugiperda (Lepidoptera: Noctuidae) in foreign countries [J]. Plant Protection, 2019, 45(4): 7-13. |
| [25] |
WOOD K A, WILSON B H, GRAVES J B. Influence of host plant on the susceptibility of the fall armyworm to insecticides[J]. J Econ Entomol, 1981, 74(1): 96-98. DOI:10.1093/jee/74.1.96 |
| [26] |
YU S J. Insecticide resistance in the fall armyworm, Spodoptera frugiperda (J. E. Smith)
[J]. Pestic Biochem Physiol, 1991, 39(1): 84-91. DOI:10.1016/0048-3575(91)90216-9 |
| [27] |
YU S J, NGUYEN S N, ABO-ELGHAR G E. Biochemical characteristics of insecticide resistance in the fall armyworm, Spodoptera frugiperda (J. E. Smith)
[J]. Pestic Biochem Physiol, 2003, 77(1): 1-11. DOI:10.1016/S0048-3575(03)00079-8 |
| [28] |
YU S J, MCCORD JR E. Lack of cross-resistance to indoxacarb in insecticide-resistant Spodoptera frugiperda (Lepidoptera: Noctuidae) and Plutella xylostella (Lepidoptera: Yponomeutidae)
[J]. Pest Manag Sci, 2007, 63(1): 63-67. DOI:10.1002/(ISSN)1526-4998 |
| [29] |
GUTIÉRREZ-MORENO R, MOTA-SANCHEZ D, BLANCO C A, et al. Field-evolved resistance of the fall armyworm (Lepidoptera: Noctuidae) to synthetic insecticides in Puerto Rico and Mexico[J]. J Econ Entomol, 2019, 112(2): 792-802. DOI:10.1093/jee/toy372 |
| [30] |
YOUNG J R, MCMILLIAN W W. Differential feeding by two strains of fall armyworm larvae on carbaryl treated surfaces[J]. J Econ Entomol, 1979, 72(2): 202-203. DOI:10.1093/jee/72.2.202 |
| [31] |
CARPENTER J E, YOUNG J R. Interaction of inherited sterility and insecticide resistance in the fall armyworm (Lepidoptera: Noctuidae)[J]. J Econ Entomol, 1991, 84(1): 25-27. DOI:10.1093/jee/84.1.25 |
| [32] |
MCCAFFERY A R, KING A B S, WALKER A J, et al. Resistance to synthetic pyrethroids in the bollworm, Heliothis armigera from Andhra Pradesh, India
[J]. Pest Manag Sci, 1989, 27(1): 65-76. DOI:10.1002/ps.v27:1 |
| [33] |
WHALON M E, MOTA-SANCHEZ D, HOLLINGWORTH R M. The arthropod pesticide resistance database[DB/OL]. Michigan State University, [2019-06-25]. https://www.pesticideresistance.org/search.php.
|
| [34] |
HUANG F N, ANDOW D A, BUSCHMAN L L. Success of the high-dose/refuge resistance management strategy after 15 years of Bt crop use in North America[J]. Entomol Exp Appl, 2011, 140(1): 1-16. DOI:10.1111/eea.2011.140.issue-1 |
| [35] |
ZHU Y C, BLANCO C A, PORTILLA M, et al. Evidence of multiple/cross resistance to Bt and organophosphate insecticides in Puerto Rico population of the fall armyworm, Spodoptera frugiperda
[J]. Pestic Biochem Physiol, 2015, 122: 15-21. DOI:10.1016/j.pestbp.2015.01.007 |
| [36] |
BELAY D K, HUCKABA R M, FOSTER J E. Susceptibility of the fall armyworm, Spodoptera frugiperda (Lepidoptera: Noctuidae), at santa isabel, Puerto Rico, to different insecticides
[J]. Fla Entomol, 2012, 95(2): 476-478. DOI:10.1653/024.095.0232 |
| [37] |
LI Y X, MAO M Z, LI Y M, et al. Modulations of high-voltage activated Ca2+ channels in the central neurones of Spodoptera exigua by chlorantraniliprole
[J]. Physiol Entomol, 2011, 36(3): 230-234. DOI:10.1111/pen.2011.36.issue-3 |
| [38] |
BOLZAN A, PADOVEZ F E, NASCIMENTO A R, et al. Selection and characterization of the inheritance of resistance of Spodoptera frugiperda (Lepidoptera: Noctuidae) to chlorantraniliprole and cross-resistance to other diamide insecticides[J/OL]. Pest Manag Sci, (2019-03-25)[2019-06-20]. https://www.x-mol.com/paper/5384943.
|
| [39] |
COLES W. CABI warns of rapid spread of crop-devastating fall armyworm across Asia, 2018[DB/OL]. [2019-06-25]. https://www.freshplaza.com/article/198827/CABI-warns-of-rapid-spread-of-crop-devastating-fall-armyworm-across-Asia.
|
| [40] |
SISAY B, TEFERA T, WAKGARI M, et al. The efficacy of selected synthetic insecticides and botanicals against fall armyworm, Spodoptera frugiperda, in maize
[J]. Insects, 2019, 10(2): 45. DOI:10.3390/insects10020045 |
| [41] |
王建军, 董红刚, 袁林泽. 斜纹夜蛾对茚虫威的抗药性汰选及交互抗性测定[J]. 植物保护学报, 2008, 35(6): 525-529. WANG J J, DONG H G, YUAN L Z. Selection for indoxacarb resistance in Spodoptera litura and investigation on cross-resistance in the selected population [J]. Acta Phytophylacica Sinica, 2008, 35(6): 525-529. DOI:10.3321/j.issn:0577-7518.2008.06.009 |
| [42] |
王伟. 甜菜夜蛾对茚虫威的抗性风险评估及抗性机理研究[D]. 泰安: 山东农业大学, 2011. WANG W. Risk assessment and resistance mechanism to indoxacarb in Spodoptera exigua (Hübner) (Lepidoptera: Noctuidae)[D]. Taian: Shandong Agricultural University, 2011. |
| [43] |
王芹芹, 崔丽, 王奇渊, 等. 棉铃虫对茚虫威的抗性机理: PBO, DEF 和 DEM 的增效作用及解毒酶活性[J]. 昆虫学报, 2017, 60(8): 912-919. WANG Q Q, CUI L, WANG Q Y, et al. Mechanisms of resistance to indoxacarb in Helicoverpa armigera (Lepidoptera: Noctuidae): the synergistic effects of PBO, DEF and DEM and the activities of detoxification enzymes [J]. Acta Entomologica Sinica, 2017, 60(8): 912-919. |
| [44] |
TEIXEIRA L A, ANDALORO J T. Diamide insecticides: global efforts to address insect resistance stewardship challenges[J]. Pestic Biochem Physiol, 2013, 106(3): 76-78. DOI:10.1016/j.pestbp.2013.01.010 |
| [45] |
MCCORD JR E, YU S J. The mechanisms of carbaryl resistance in the fall armyworm, Spodoptera frugiperda (J. E. Smith)
[J]. Pestic Biochem Physiol, 1987, 27(1): 114-122. DOI:10.1016/0048-3575(87)90103-9 |
| [46] |
DUMAS D P, WILD J R, RAUSHEL F M. Expression of Pseudomonas phosphotriesterase activity in the fall armyworm confers resistance to insecticides
[J]. Experientia, 1990, 46(7): 729-731. DOI:10.1007/BF01939948 |
| [47] |
YU S J. Detection and biochemical characterization of insecticide resistance in fall armyworm (Lepidoptera: Noctuidae)[J]. J Econ Entomol, 1992, 85(3): 675-682. DOI:10.1093/jee/85.3.675 |
| [48] |
HANNA M A, ATALLAH Y H. Penetration and biodegradation of carbaryl in susceptible and resistant strains of the Egyptian cotton leafworm[J]. J Econ Entomol, 1971, 64(6): 1391-1394. DOI:10.1093/jee/64.6.1391 |
| [49] |
IWATA T, HAMA H. Insensitivity of cholinesterase in Nephotettix cincticeps resistant to carbamate and organophosphorus insecticides
[J]. J Econ Entomol, 1972, 65(3): 643-644. DOI:10.1093/jee/65.3.643 |
| [50] |
VOSS G. Cholinesterase autoanalysis: a rapid method for biochemical studies on susceptible and resistant insects[J]. J Econ Entomol, 1980, 73(2): 189-192. DOI:10.1093/jee/73.2.189 |
| [51] |
CORDÓN-ROSALES C, BEACH R F, BROGDON W G. Field evaluation of methods for estimating carbamate resistance in Anopheles albimanus mosquitos from a microplate assay for insensitive acetylcholinesterase
[J]. Bull World Health Organ, 1990, 68(3): 323-329. |
| [52] |
YANG M L, ZHANG J Z, ZHU K Y, et al. Increased activity and reduced sensitivity of acetylcholinesterase associated with malathion resistance in a field population of the oriental migratory locust, Locusta migratoria manilensis (Meyen)
[J]. Pestic Biochem Physiol, 2008, 91(1): 32-38. DOI:10.1016/j.pestbp.2007.12.004 |
| [53] |
QI S Z, CASIDA J E. Species differences in chlorantraniliprole and flubendiamide insecticide binding sites in the ryanodine receptor[J]. Pestic Biochem Physiol, 2013, 107(3): 321-326. DOI:10.1016/j.pestbp.2013.09.004 |
| [54] |
QI S Z, LÜMMEN P, NAUEN R, et al. Diamide insecticide target site specificity in the heliothis and musca ryanodine receptors relative to toxicity[J]. J Agric Food Chem, 2014, 62(18): 4077-4082. DOI:10.1021/jf501236h |
| [55] |
BOAVENTURA D, BOLZAN A, PADOVEZ F E, et al. Detection of a ryanodine receptor target-site mutation in diamide insecticide resistant fall armyworm, Spodoptera frugiperda[J/OL]. Pest Manag Sci,(2019-07-08)[2019-07-10]. https://www.x-mol.com/paper/5711146.
|
| [56] |
ZUO Y Y, WANG H, XU Y J, et al. CRISPR/Cas9 mediated G4946E substitution in the ryanodine receptor of Spodoptera exigua confers high levels of resistance to diamide insecticides
[J]. Insect Biochem Mol Biol, 2017, 89: 79-85. DOI:10.1016/j.ibmb.2017.09.005 |
| [57] |
李富根, 艾国民, 李友顺, 等. 茚虫威的作用机制与抗性研究进展[J]. 农药, 2013, 52(8): 558-560. LI F G, AI G M, LI Y S, et al. Progress on mechanism of action and insecticide resistance of the oxadiazine indoxacarb in insects[J]. Agrochemicals, 2013, 52(8): 558-560. |
| [58] |
王建军, 董红刚. 新型高效杀虫剂茚虫威毒理学研究进展[J]. 植物保护, 2009, 35(3): 20-22. WANG J J, DONG H G. Advances in toxicology of the novel insecticide indoxacarb[J]. Plant Protection, 2009, 35(3): 20-22. DOI:10.3969/j.issn.0529-1542.2009.03.005 |
 2019, Vol. 21
2019, Vol. 21


