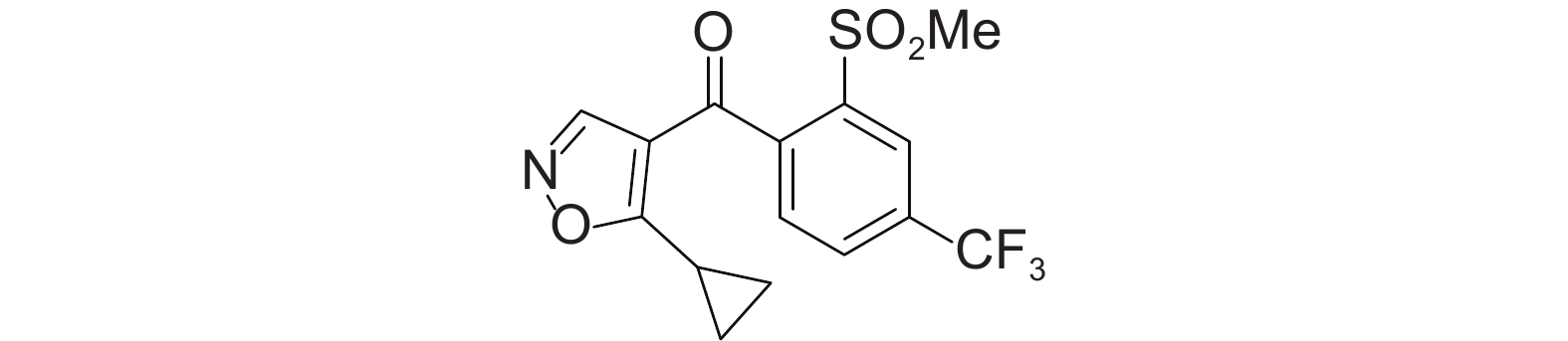
异噁唑草酮 (isoxaflutole,结构式见图式1)是一种选择性内吸型苗前除草剂,由罗纳-普朗克公司 (现为拜耳公司) 于2001 年开发成功,最初主要应用于玉米田[1],目前广泛用于芽前或芽后早期防除玉米、甘蔗和甜菜等作物田杂草[2]。其具有遇雨再激活特性,因土壤墒情不好而滞留于表层土壤中的有效成分仍能保持较长时间不被分解,一旦降雨,其噁唑环迅速裂解转变为二酮腈而起杀草作用,对已长到4~5叶期的敏感型杂草也能起到杀伤和抑制作用,从而降低了使用时对天气条件的要求,因而更具竞争优势,已长期占据玉米田除草剂和羟基苯基丙酮酸双氧化酶 (HPPD) 抑制剂市场中第二的位置,成为替代甲草胺、乙草胺、异丙甲草胺和莠去津等除草剂的首选品种[3-5]。
|
图式1 异噁唑草酮结构式 Scheme1 The structural formula of isoxaflutole |
由于异噁唑草酮杀草谱广,有效除草时期长 (可达42 d),其广泛应用可能对人类造成潜在的健康威胁和生态环境污染[6-7]。但目前关于异噁唑草酮的研究主要集中在药效和残留等方面[5-10],有关其环境行为特性的研究还较少。Lin等[11-12]研究了异噁唑草酮的水解和光解特性,结果表明:其光解及水解均特别敏感,在土壤表面的光解半衰期为20~23 h,其水溶液 (250 μg/L) 的光解半衰期 (pH 7.18,25 ℃) < 9 h;Alletto等[13]对异噁唑草酮在耕地土壤中的吸附特性及影响因子进行了研究,发现其吸附性能与耕地土壤理化性质具有相关性;Ramanarayanan等[14]研究了异噁唑草酮在不同类型土壤中的降解特性,结果表明其降解速率与土壤理化性质相关,其在好氧条件下的消解半衰期为0.3~4.3 d。表明异噁唑草酮的环境行为特性与试验土壤理化性质相关,而有关异噁唑草酮在中国典型土壤中的环境行为特性研究尚未见报道。
农药在土壤中的降解、淋溶以及在土壤表面的光解是农药环境行为的重要组成部分,研究农药在土壤中的降解迁移规律对其安全性评价及科学使用具有重要意义[15-18]。本研究参照《化学农药环境安全评价试验准则》[19] (以下简称《准则》),选择具有代表性的浙江省萧山潮土、余杭水稻土和东阳红壤土为供试土壤,开展了异噁唑草酮在土壤表面光解及在不同类型土壤中的降解和淋溶特性研究,同时分析了该农药对周围环境及地下水的污染风险,旨在为其科学合理使用及环境风险评估提供基础数据和技术支持。
1 材料与方法 1.1 供试材料 1.1.1 土壤供试土壤分别采自浙江省杭州市萧山区、余杭区和东阳市。土样经自然风干后过2 mm筛,室温下保存备用。3种土壤均为农田耕作层土壤,基本理化性质见表1。
|
|
表 1 供试土壤主要理化性质 Table 1 Physico-chemical properties of the tested soils |
1.1.2 药剂、试剂及耗材
95%异噁唑草酮 (isoxaflutole) 原药 (百灵威科技有限公司);99.5%异噁唑草酮标准品 (Dr. Ehrenstorfer GmbH)。色谱纯及分析纯乙腈,其余试剂丙酮、甲醇和氯化钠均为分析纯;试验用水为纯净水。C18-N小柱 (500 mg,6 mL,天津博纳艾杰尔科技有限公司)。
1.1.3 主要仪器设备Agilent1260高效液相色谱仪 (HPLC,配UV检测器,美国Agilent科技有限公司);AB104-S电子天平[精度为0.000 1 g,梅特勒-托利多国际贸易 (上海) 有限公司];XT5409氙灯光解恒温试验箱及XT5107-IH480恒温恒湿培养箱 (杭州雪中炭恒温技术有限公司);DHP-9052型电热恒温培养箱 (上海精密仪器仪表有限公司);UV-A紫外辐照计 (北京师范大学光电仪器厂);TES-1330A照度计 (泰仕电子工业股份有限公司) 等。
1.2 试验方法 1.2.1 异噁唑草酮工作溶液、标准溶液配制及标准曲线绘制准确称取95%异噁唑草酮原药0.1 g (精确至0.000 1 g),用丙酮溶解并定容至100 mL,得到1 000 mg/L的原药储备溶液,再用丙酮稀释得到100 mg/L的原药工作溶液。
准确称取异噁唑草酮标准品0.01 g (精确至0.000 1 g),用色谱纯乙腈配制成100 mg/L的标准储备液,再依次用乙腈稀释,得到20.0、10.0、5.0、1.0、0.5、0.1和0.05 mg/L的异噁唑草酮系列标准工作溶液。以峰面积为纵坐标,质量浓度为横坐标绘制标准曲线。
1.2.2 土壤表面光解试验参照《准则》[19],任选1种土壤 (红壤) 开展试验。称取过0.25 mm筛的红壤土4 g,置于10 cm × 3 cm的玻璃平板上,加适量水搅拌成泥浆状并涂布均匀,涡旋5~10 s,室温下阴干,制成土层厚度约1.0~1.2 mm的土壤薄层。均匀滴加0.2 mL、100 mg/L的异噁唑草酮工作溶液于土壤薄层表面,使土壤中异噁唑草酮的初始质量分数为5 mg/kg,待溶剂挥发后,将薄板放入自制玻璃缸中,盖上石英玻璃板,置于光解恒温试验箱中进行光解。试验温度为25 ℃ ± 2 ℃,照度为 8 000 lx,试样接受紫外强度 (测定波长365 nm) 为 (100 ± 10) µw/cm2。分别于0、3、6、9、12、22、48、72及168 h取样,测定土壤中异噁唑草酮残留量。试验重复2次,同时设黑暗条件下的对照处理。
1.2.3 土壤降解试验采用室内模拟试验方法[19],分别研究异噁唑草酮在好氧和厌氧条件下的土壤降解特性。
土壤好氧条件下的降解:分别称取3种供试土壤样品各20 g于100 mL三角瓶中,加纯净水至土壤饱和持水量的40%,用透气硅胶塞塞紧瓶口,置于恒温箱 (25 ℃ ± 1 ℃) 中避光预培养14 d。向预培养后的土壤中分别均匀缓慢滴加0.2 mL、1 000 mg/L的异噁唑草酮原药储备溶液,使药剂初始质量分数为10 mg/kg,涡旋5~10 s后加纯净水,调整含水量为土壤饱和持水量的60%。塞紧瓶口,置于恒温箱中继续避光培养,定期取样,测定土壤中农药残留量。
土壤厌氧条件下的降解:将上述好氧降解试验中的土样继续培养一段时间,培养时长依据异噁唑草酮的好氧降解半衰期确定:如该半衰期 < 30 d,则培养1个半衰期;半衰期 > 30 d,则培养30 d。之后分别向三角瓶中加入30 mL纯净水 (使土壤表面保持约1 cm水层) 并更换为磨砂玻璃塞,定期取样,测定土壤中异噁唑草酮的残留量。
绘制土壤中异噁唑草酮的降解动态曲线时至少取7个点,并确保其中5个点的残留量为初始含量的20%~80%,根据检测结果确定后续样品取样时间,至降解率大于90% 时终止试验,取样时间详见表2。培养期间及时调节三角瓶内水分含量,以保持原有持水状态。
|
|
表 2 异噁唑草酮在不同处理土壤中的取样时间 Table 2 Sampling time of isoxaflutole in soils afterdifferent treatment |
上述试验均重复2次,同时设置不加异噁唑草酮的对照处理。
1.2.4 土壤中淋溶试验采用薄层层析法[19]。称取过0.25 mm筛的土样10 g于玻璃层析板 (20 cm × 7.5 cm) 上,加7.5 mL蒸馏水搅拌成泥浆状,用玻棒涂布均匀,涡旋5~30 s,在室温下放置24 h晾干。薄板上土层厚度随土质的粗细程度不同而控制在0.5~1 mm之间。将0.1 mL、100 mg/L的95%异噁唑草酮原药工作溶液滴于距薄板底部1.5 cm处,以纯净水为展开剂在室温下展开,当展开至距薄板底部19.5 cm处时取出薄板并晾干。将展开部分土层等距离分成6段 (每段3 cm),测定各段土壤中异噁唑草酮的残留量,根据残留量最高段移动的距离,按 (1) 式计算淋溶系数 (Rf) 值。
| ${R_{\rm f}} = \frac{L}{{{L_{\max }}}}$ | (1) |
式中:L—原点至层析斑点中心的距离 (mm);Lmax—原点至展开剂前沿的距离 (mm)。
1.3 样品提取与测定条件提取:向土壤样品中依次加入10 mL纯净水及50 mL乙腈,振荡提取30 min;抽滤,滤液转入装有10 g氯化钠的具塞量筒中,振摇1 min,静置分层;吸取25 mL乙腈相,于40 ℃水浴旋转蒸发至干,用 5 mL V (甲醇) : V (水) = 20 : 80的甲醇水溶液溶解,待净化。
净化:依次用5 mL甲醇、5 mL纯净水预淋洗C18-N小柱;将上述提取液转入柱中,弃去淋出液;用 5 mL V (甲醇) : V (水) = 20 : 80的甲醇溶液淋洗,弃去淋出液;最后用5 mL色谱纯乙腈洗脱,收集洗脱液过0.45 μm滤膜,待HPLC检测。
HPLC检测条件:Agilent Eclipse XDB-C18色谱柱 (4.6 mm × 250 mm,5 µm);检测波长270 nm;柱温40 ℃;流速0.8 mL/min;进样量20 μL。流动相:V (乙腈) : V (水) = 70 : 30。
1.4 基质效应测定采用不同类型土壤空白提取液分别配制基质匹配标准溶液,按上述方法测定基质匹配标准曲线。按 (2) 式计算基质效应 (ME)。ME绝对值在10%以内则基质效应可忽略不计,ME绝对值大于10%则表明存在一定的基质效应[10]。
| $ {M_{\rm{E}}}/{\text{%}} = \left( {{K_{\rm b}} - {K_{\rm a}}} \right)/{K_{\rm a}} \times 100 $ | (2) |
式中:Kb—基质匹配曲线斜率,Ka—纯溶剂标准曲线斜率。
2 结果与分析 2.1 方法的线性及基质效应结果 (表3) 表明:在进样质量浓度0.05~20.0 mg/L范围内,异噁唑草酮的峰面积与质量浓度间呈良好线性关系,3种类型土壤均表现为基质减弱效应,ME绝对值为2.03%~2.17%,均小于10%,基质效应可忽略,故选择纯溶剂标准工作曲线进行定量。
|
|
表 3 异噁唑草酮的线性方程、相关系数及基质效应 Table 3 Linear equations, correlation coefficients and matrix effects (ME) for isoxaflutole |
2.2 方法的准确度与精密度
在不同类型空白土壤样品中分别添加3个水平的异噁唑草酮标准工作溶液,每个水平重复5次,回收率及相对标准偏差 (RSD) 测定结果见表4。方法的准确度和精密度均满足农药残留分析要求[20]。异噁唑草酮在3种土壤中的最低检测浓度均为0.025 mg/kg。
|
|
表 4 土壤中异噁唑草酮的添加回收率及相对标准偏差 (n = 5) Table 4 Spiked recoveries and RSDs of isoxaflutole in soil samples (n = 5) |
2.3 异噁唑草酮在土壤表面的光解特性
异噁唑草酮在红壤土表面的光解特性测定结果见表5。从中可见,人工光源氙灯及黑暗对照处理中,异噁唑草酮的降解均符合一级动力学方程,半衰期分别为82.5 h (3.4 d) 和126 h (5.3 d)。JMPR评估报告[21]中对异噁唑草酮在土壤表面光解的评估结果为:其在砂壤土中的光解半衰期为22.8 h,黑暗对照为19.7 h。本结果与之差别较大,原因可能与供试土壤的pH值及含水量不同有关。本研究中土壤的pH值和含水量相对较低,异噁唑草酮的消解速率随之减慢,因而所得光解半衰期相对较长。
|
|
表 5 异噁唑草酮在土壤表面的光解特性 Table 5 The photolytic properties of isoxaflutole on the surface of soil |
光照条件下异噁唑草酮的半衰期 (82.5 h) 较黑暗对照 (126 h) 短,而黑暗对照的光解半衰期126 h (5.3 d) 与2.4节其在红壤土中的好氧降解半衰期 (5.8 d) 基本一致,表明光照条件能促进异噁唑草酮在土壤表面降解,但导致其在土壤表面残留量变化的主要因素仍然是土壤中降解。
2.4 异噁唑草酮在土壤中的降解特性由表6可见:无论好氧还是厌氧条件下,异噁唑草酮在潮土、水稻土及红壤土中的降解均符合一级动力学方程,其好氧降解半衰期分别为10.5、43.3和139 h,厌氧降解半衰期分别为19.4、18.4和158 h。研究表明,异噁唑草酮在好氧和厌氧条件下降解均较快,半衰期较短,这与Ramanarayanan等[14]的研究结果一致,他们得到异噁唑草酮在实验室通气条件土壤中的半衰期为0.3~4.3 d。研究中还发现,异噁唑草酮在潮土及红壤土中的好氧降解半衰期均较厌氧降解半衰期短,但在水稻土中则是厌氧降解半衰期较好氧降解半衰期短,原因可能是由于在积水厌氧条件下,其降解速率除了和土壤pH值相关外,与土壤有机质含量和阳离子交换量也有一定的相关性。
|
|
表 6 异噁唑草酮在3种土壤中的降解动态 Table 6 Degradation dynamic of isoxaflutole in three tested soils |
相关性分析表明,异噁唑草酮在不同类型土壤中的降解速率差异和pH值呈显著正相关性,即随着土壤pH值升高,降解速率加快。Beltrán等[22]发现,异噁唑草酮在潮湿土壤中溶解于水中后,可迅速打开其异噁唑环而转变为具有生物活性的代谢物二酮腈。由于pH值和土壤含水量显著影响该反应的速率,随pH值和土壤含水量升高反应速率加快[23],因此异噁唑草酮的降解也随之加快。
JMPR评估报告[21] 中对异噁唑草酮的水解特性评估结果为其在碱性条件下水解最快,在pH值为5、7和9的缓冲溶液中其水解半衰期分别为11.1 d、20.1 h和3.2 h,本研究结果与Beltrán等[22]的研究结果及JMPR对其水解特性的评估结果类似,表明异噁唑草酮在土壤中的主要降解方式是水解。
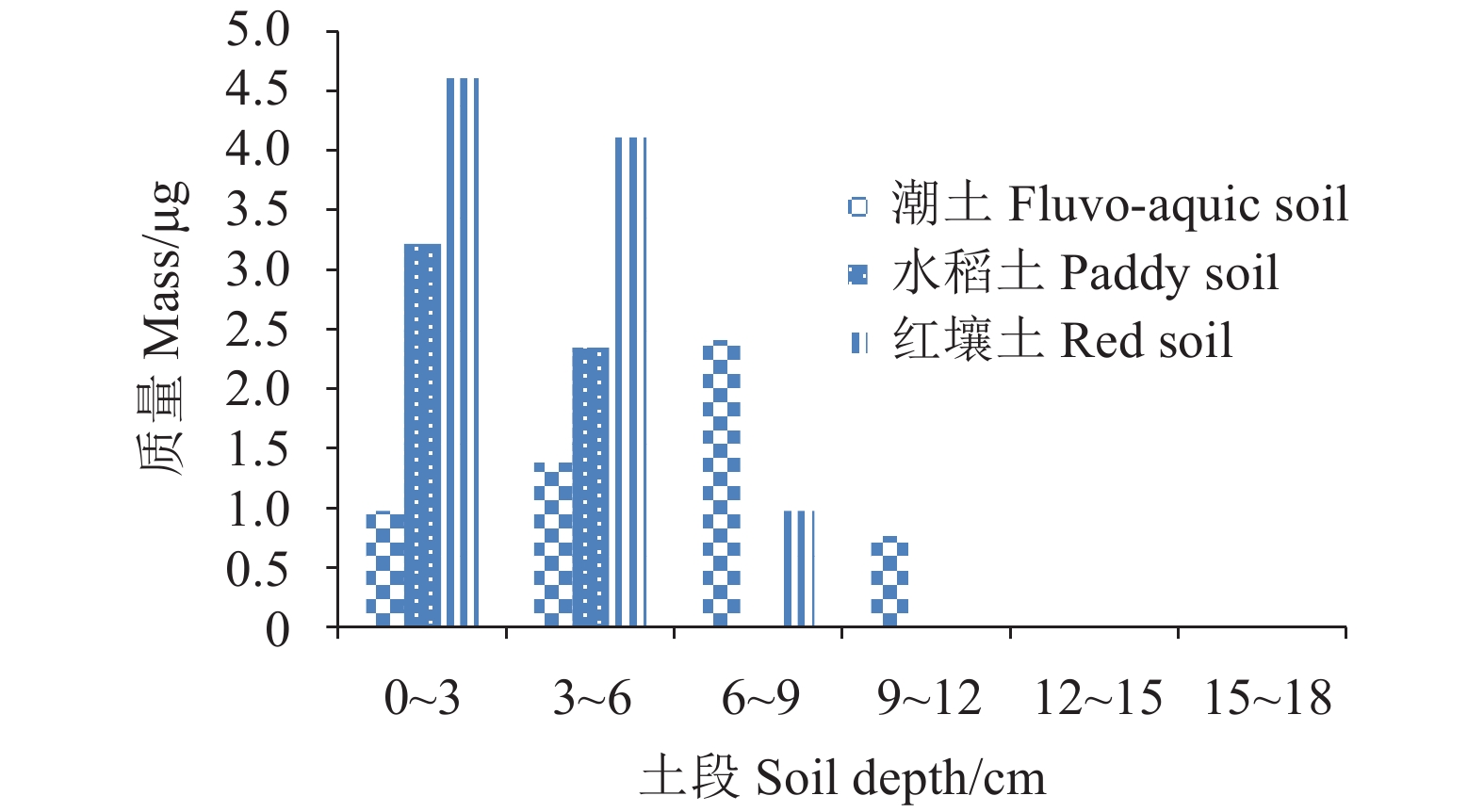
2.5 异噁唑草酮在土壤中的淋溶特性结果见图1。在潮土中,异噁唑草酮主要分布在0~12 cm段土层,且在6~9 cm段土层中含量最高,Rf 值为0.417 0;水稻土中主要分布在0~6 cm段土层,0~3 cm段土层中含量最高,Rf 值为0.083 3;红壤土中主要分布在0~9 cm段土层,0~3 cm段土层中含量最高,Rf 值为0.083 3。根据《准则》[19]中划分标准,Rf 值≤0.1表明基本不移动,Rf 值为0.35~0.65 (含) 之间为具有一定的移动性,故异噁唑草酮在潮土中属于中等移动性,在水稻土和红壤土中属不易移动农药。
|
图 1 异噁唑草酮在土壤薄层各段土层中的分布 Fig. 1 Distribution of isoxaflutole in different depths of soil thin-layer |
异噁唑草酮在红壤土、水稻土和潮土中的总检出量分别为9.67、5.55和5.13 μg,占引入总量的百分比为96.7%、55.5%和51.3%。这与异噁唑草酮在不同酸碱性土壤中的降解速率不同有关[21],随着土壤pH值升高,其降解速率加快,因而总检出量降低。
研究还发现,异噁唑草酮在有机质含量和阳离子交换量较高的水稻土中不易移动,而在有机质含量和阳离子交换量较低的偏碱性潮土中为中等移动;在pH值较低 (5.10) 的红壤土中为不易移动。通过将Rf 值与供试土壤的有机质含量、阳离子交换量、黏粒含量和pH值进行相关性分析,发现异噁唑草酮在不同土壤中的移动性与土壤的有机质含量和阳离子交换量呈显著负相关性,与pH值呈显著正相关性,与黏粒含量则无相关性。
3 结论与讨论采用高效液相色谱法测定异噁唑草酮在不同类型土壤中的残留量,样品前处理方法基本无基质效应干扰,操作简便,方法的准确度和精密度均满足试验开展的要求。
研究表明:异噁唑草酮在3种不同类型土壤中的降解均符合一级动力学方程,其在潮土、水稻土和红壤土中的好氧降解半衰期分别为10.5、43.3和139 h,厌氧降解半衰期分别为19.4、18.4和158 h,属于易降解性农药。异噁唑草酮在不同类型土壤中的降解速率与土壤pH值呈显著正相关性。表明异噁唑草酮在土壤中的主要降解方式是水解,随pH值升高其降解速率加快。
农药在土壤中的移动性是评价其对地下水污染影响程度的重要指标。根据《准则》[19]划分标准,本研究中,异噁唑草酮在潮土中为中等移动性,在水稻土和红壤土中基本不移动。其在不同类型土壤中的移动性差异与土壤的有机质含量和阳离子交换量呈显著负相关性,和pH值呈显著正相关性。该结果与文献报道土壤有机质含量越高越有利于对农药的吸附,从而降低其移动能力[24]的结论一致。异噁唑草酮在土壤表面的光解遵循一级动力学方程ct = 4.23e–0.008t (r = 0.937),半衰期为82.5 h,表明光照条件能促进其降解,但并不是影响异噁唑草酮在环境中降解的主要因素。
异噁唑草酮在土壤中可迅速转变为具有生物活性的代谢产物二酮腈[22],本研究未对该代谢产物的环境行为进行研究。根据JMPR报告[21],二酮腈在水中稳定,在土壤中消解缓慢,其好氧降解半衰期为10~39 d,光解半衰期≥30 d。而且其在土壤中移动性较强,在土壤表面覆水5 cm 后,异噁唑草酮仅停留于0~3 cm土层,而二酮腈则可移动至9 cm土层[1]。Alletto 等[25] 开展的田间试验也表明,二酮腈可迁移至40 cm土层,而异噁唑草酮最深仅迁移至5 cm土层。因而生产中应同时关注二酮腈对周围环境及地下水的污染风险。
综上所述,异噁唑草酮在土壤表面难光解,在有机质含量高的水稻土及pH值较低的红壤土中不易移动,在pH较高的潮土中为中等移动性,在土壤中极易降解,不易对周围环境及地下水造成污染风险。
目前,中国尚未制定异噁唑草酮在农产品中的残留限量 (MRL) 标准,国际食品法典委员会 (CAC) 也仅制定了为数不多的临时限量标准。为确保其安全使用,需对异噁唑草酮及其代谢产物二酮腈的环境安全性进行系统评价,特别是对其从土壤迁移至作物中的规律及环境毒理效应等方面需进行深入研究。
| [1] |
PALLETT K E, CRAMP S M, LITTLE J P, et al. Isoxaflutole: the background to its discovery and the basis of its herbicidal properties[J]. Pest Manag Sci, 2001, 57(2): 133-142. DOI:10.1002/(ISSN)1526-4998 |
| [2] |
华乃震. HPPD 抑制剂除草剂的研究进展及应用述评 [J]. 农药市场信息, 2017, 15/30(总594期): 28-30. HUA N Z. Review on research progress and application of herbicide HPPD inhibitor[J]. Pesticide Market Information, 2017, 15/30(Total 594): 28-30. |
| [3] |
PALLETT K E, LITTLE J P, SHEEKEY M, et al. The mode of action of isoxaflutole: I. Physiological effects, metabolism, and selectivity[J]. Pestic Biochem Physiol, 1998, 62(2): 113-124. DOI:10.1006/pest.1998.2378 |
| [4] |
Pesticide properties database[EB/OL]. [2018-08-02]. http://sitem.herts.ac.uk/aeru/ppdb/en/Reports/412.htm.
|
| [5] |
苏少泉. 异噁唑草酮的开发、使用与除草剂新品种筛选的思考[J]. 农药研究与应用, 2008, 12(1): 1-6. SU S Q. The development and application of isoxaflutole and thinking about screening of new herbicides[J]. Agrochem Res Appl, 2008, 12(1): 1-6. |
| [6] |
高兴祥, 孙作文, 李美, 等. 异噁唑草酮防除玉米田杂草及玉米安全性效果测定[J]. 玉米科学, 2016, 24(5): 157-160. GAO X X, SUN Z W, LI M, et al. Weed control effect of isoxaflutole and its safety to maize in glasshouse and field[J]. J Maize Sci, 2016, 24(5): 157-160. |
| [7] |
卢宗志, 祝彦海, 李洪鑫, 等. 异噁唑草酮单用及混用对玉米田杂草的防治效果[J]. 农药, 2017, 56(11): 840-843. LU Z Z, ZHU Y H, LI H X, et al. Effect experiments of isoxaflutole and its mixture with other herbicides for control weed in corn field[J]. Pesticides, 2017, 56(11): 840-843. |
| [8] |
杨长志, 王传松, 程阳, 等. HPLC-MS/MS 测定玉米中异噁唑草酮及代谢物残留量[J]. 食品科学, 2011, 32(22): 280-284. YANG C Z, WANG C S, CHENG Y, et al. Determination of isoxaflutole and its metabolite residues in maize by HPLC-MS/MS[J]. Food Sci, 2011, 32(22): 280-284. |
| [9] |
罗佳, 沈睿至, 杨长志. 液相色谱-串质谱法测定大米中异噁唑草酮及代谢物残留量[J]. 食品安全质量检测学报, 2015, 6(7): 2863-2868. LUO J, SHEN R Z, YANG C Z. Determination of isoxaflutole and its metabolites residues in rice by liquid chromatography-mass spectrometry/mass spectrometry[J]. J Food Saf Qual, 2015, 6(7): 2863-2868. |
| [10] |
王东, 闫思月, 贾春虹, 等. 分散固相萃取/超高效液相色谱-串联质谱法测定玉米和土壤中噻酮磺隆-异噁唑草酮及其代谢物残留[J]. 分析测试学报, 2017, 36(3): 355-360. WANG D, YAN S Y, JIA C H, et al. Determination of thiencarbazone-methyl, isoxaflutole and their metabolites residues in corn and soil by dispersive solid-phase extraction combined with ultra performance liquid chromatography-tandem mass spectrometry[J]. J Instrum Anal, 2017, 36(3): 355-360. DOI:10.3969/j.issn.1004-4957.2017.03.010 |
| [11] |
LIN C H, LERCH R N, THURMAN E M, et al. Determination of isoxaflutole (balance) and its metabolites in water using solid phase extraction followed by high-performance liquid chromatography with ultraviolet or mass spectrometry[J]. J Agric Food Chem, 2002, 50(21): 5816-5824. DOI:10.1021/jf025622d |
| [12] |
LIN C H, LERCH R N, GARRETT H E, et al. Improved HPLC-MS/MS method for determination of isoxaflutole (balance) and its metabolites in soils and forage plants[J]. J Agric Food Chem, 2007, 55(10): 3805-3815. DOI:10.1021/jf063322g |
| [13] |
ALLETTO L, BENOIT P, BERGHEAUD V, et al. Variability of retention process of isoxaflutole and its diketonitrile metabolite in soil under conventional and conservation tillage[J]. Pest Manag Sci, 2012, 68(4): 610-617. DOI:10.1002/ps.2304 |
| [14] |
RAMANARAYANAN T, NARASIMHAN B, SRINIVASAN R. Characterization of fate and transport of isoxaflutole, a soil-applied corn herbicide, in surface water using a watershed model[J]. J Agric Food Chem, 2005, 53(22): 8848-8858. DOI:10.1021/jf0508596 |
| [15] |
DOLL T E, FRIMMEL F H. Fate of pharmaceuticals––photodegradation by simulated solar UV-light[J]. Chemosphere, 2003, 52(10): 1757-1769. DOI:10.1016/S0045-6535(03)00446-6 |
| [16] |
叶凤娇, 孔德洋, 单正军, 等. 苯氧羧酸类除草剂土壤降解特性研究[J]. 环境化学, 2010, 29(6): 1147-1151. YE F J, KONG D Y, SHAN Z J, et al. Degradation of phenoxy acid herbicides in soils[J]. Environ Chem, 2010, 29(6): 1147-1151. |
| [17] |
程冰峰, 杨倩文, 周自豪, 等. 叶菌唑的光解和土壤降解特性[J]. 环境化学, 2018, 37(10): 2230-2236. CHENG B F, YANG Q W, ZHOU Z H, et al. Photolysis and soil degradation of metconazole[J]. Environ Chem, 2018, 37(10): 2230-2236. DOI:10.7524/j.issn.0254-6108.2017112007 |
| [18] |
李璇, 冯岩, 王娇, 等. 氨唑草酮在土壤中的降解、吸附与淋溶特性[J]. 农药, 2017, 56(10): 757-759. LI X, FENG Y, WANG J, et al. Degradation, adsorption and leaching of amicarbazone in soil[J]. Agrochemicals, 2017, 56(10): 757-759. |
| [19] |
化学农药环境安全评价试验准则: GB/T 31270—2014[S].北京: 中国标准出版社, 2015. Test guidelines on environmental safety assessment for chemical pesticides: GB/T 31270—2014[S]. Beijing: Standards Press of China, 2015. |
| [20] |
农作物中农药残留试验准则: NY/T 788—2018[S].中华人民共和国农业行业标准, 2018-07-27. Guideline for the testing of pesticide residues in crops : NY/T 788—2018[S]. Agricultural industry standard of the People's Republic of China, 2018-07-27. |
| [21] |
FAO. List of pesticide evaluated by JMPR and JMPS. JMPR No. (268). 2013 (T, R) Evaluation.Isoxaflutole (268) [R/OL]. [2018-12-20]. http://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/JMPR/Evaluation13/Isoxaflutole.pdf.
|
| [22] |
BELTRÁN E, FENET H, COOPER J F, et al. Fate of isoxaflutole in soil under controlled conditions[J]. J Agric Food Chem, 2003, 51(1): 146-151. DOI:10.1021/jf0207878 |
| [23] |
TAYLOR-LOVELL S, SIMS G K, WAX L M. Effects of moisture, temperature, and biological activity on the degradation of isoxaflutole in soil[J]. J Agric Food Chem, 2002, 50(20): 5626-5633. DOI:10.1021/jf011486l |
| [24] |
AHANGAR A G, SMERNIK R J, KOOKANA R S, et al. The effect of solvent-conditioning on soil organic matter sorption affinity for diuron and phenanthrene[J]. Chemosphere, 2009, 76(8): 1062-1066. DOI:10.1016/j.chemosphere.2009.04.027 |
| [25] |
ALLETTO L, BENOIT P, JUSTES E, et al. Tillage and fallow period management effects on the fate of the herbicide isoxaflutole in an irrigated continuous-maize field[J]. Agric Ecosyst Environ, 2012, 153: 40-49. DOI:10.1016/j.agee.2012.03.002 |
 2019, Vol. 21
2019, Vol. 21


