目前,手性农药在全球商业化农药中约占30%,在近10年商品化的44种新农药中约有43%为手性农药[1],但市场上的手性农药大多以外消旋体的形式销售和使用,单一对映体占比不足10%[2]。越来越多的研究表明,手性对映体的生物活性差异很大,如:R-甲霜灵的杀菌活性是S-甲霜灵的10倍左右[3-4];R-沙利度胺对孕妇有镇静止吐的功效,而S-沙利度胺对婴儿则有致畸作用[5]。因此,对手性农药进行拆分以获得单一对映体,有助于进一步开展对映体选择性的相关研究,从而提升农药的环境安全性。
目前,手性拆分技术以色谱法为主,常用的有气相色谱 (GC) 法[6-8]、高效液相色谱 (HPLC) 法[9-10]、超临界流体色谱 (SFC) 法和毛细管电泳 (CE)[11-14]法等。与GC和HPLC法相比,毛细管电泳法在手性拆分上具有适用种类多、分离效率高、分析时间短、操作便捷和使用成本低等优点[15-17],但由于毛细管电泳的进样量小、紫外检测器的检测限较高,导致方法的灵敏度低,从而限制了其在痕量分析检测中的应用。近年来,为弥补CE法灵敏度低的缺点,相关学者利用在线富集技术进行了诸多研究[18-20],其中,堆积法作为一种重要的在线富集技术已在痕量检测中得到广泛应用[21-23]。
抑霉唑 (imazalil) 是一种常用的手性农药 (结构式如图式1),属于咪唑类内吸性杀菌剂,是苯并咪唑类杀菌剂的替代药剂,主要用于柑橘、苹果等瓜果类在贮运期发生的绿青病及绿霉病的防治[24]。
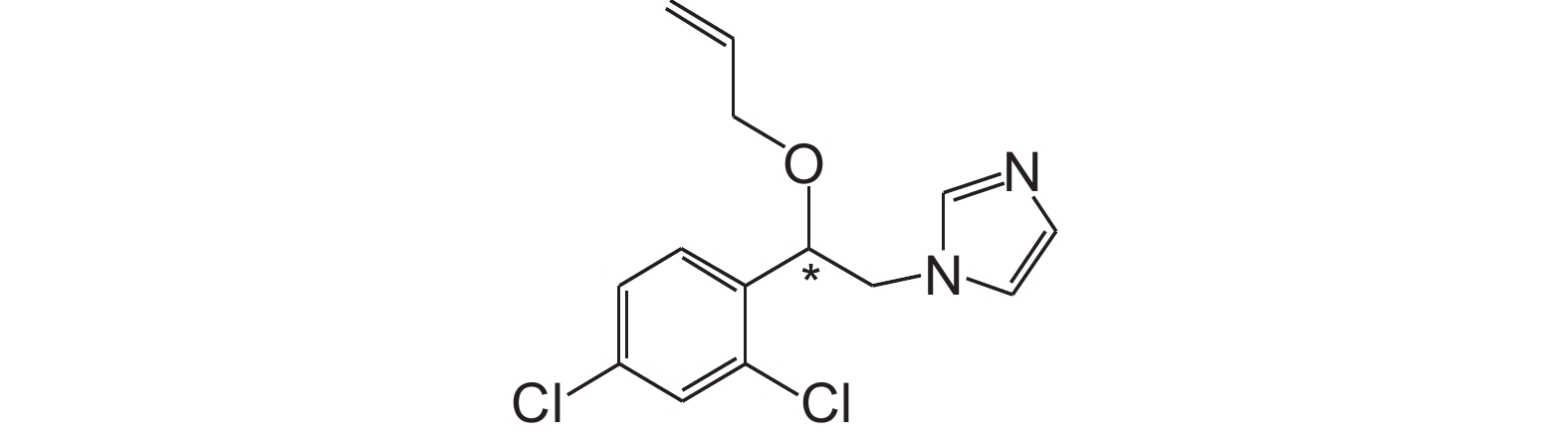
|
图式1 抑霉唑结构式 (*代表手性中心) Scheme1 The structural formula of imazalil (*denotes the chiral center) |
目前,在抑霉唑手性拆分研究中,多采用高效液相色谱-手性固定相法 (HPLC-CSP) 作为分离方法,例如:Chai等[25]以纤维素-三 (4-甲基苯甲酸酯) (CTMB) 和纤维素-三 (3-氯-4-甲基苯基氨基甲酸酯) (CCMPC) 为手性固定相对抑霉唑进行手性拆分,分别获得了12.68和4.75的最佳分离度;Li等[26]以CCMPC为手性固定相拆分抑霉唑,获得了<0.60 μg/kg的定量限和1.75的分离度。虽然HPLC-CSP法能获得满意的分离度和较高的灵敏度,但分析时间长、操作复杂且成本高,对于拆分价格便宜的抑霉唑来说过于昂贵。因此,采用操作简易、成本低廉的CE法对抑霉唑进行手性拆分研究具有现实意义,而Kodama等[27]的研究也表明,CE法同样能实现抑霉唑的良好拆分 (分离度为6.0)。由于CE法的灵敏度较低,所以需在其基础上增加在线富集的研究。因此,笔者以抑霉唑为研究对象,以β-环糊精[28]为手性选择剂,采用毛细管电泳法对抑霉唑对映体进行了手性拆分,并采用堆积法对抑霉唑的在线富集进行了研究。
1 材料与方法 1.1 试验材料Beckman P/ACE MDQ毛细管电泳系统 (Beckman Coulter,Inc.,美国),自带紫外检测器;MIlli-Q纯水仪 (Millipore,美国);规格为50 μm (内径) × 65 cm的未涂层熔融石英毛细管 (永年锐沣色谱器件有限公司,中国);抑霉唑和β-环糊精 (β-CD),购自Dr. Ehrenstorfer Gmbh (德国);甲醇、乙腈和异丙醇为色谱纯,购自Burdick & Jackson (韩国);NaH 2PO4和NH4H2PO4为分析纯,购自广东光华科技股份有限公司 (中国)。
1.2 毛细管电泳分析毛细管使用前的活化:用甲醇冲洗8 min;超纯水冲洗4 min;1 mol/L 的盐酸冲洗8 min;超纯水冲洗4 min;0.1 mol/L 的氢氧化钠冲洗8 min;超纯水冲洗4 min;缓冲溶液冲洗5 min。每次进样前的平衡:超纯水冲洗5 min;0.1 mol/L 的氢氧化钠冲洗5 min。
分析条件:紫外检测波长214 nm;分离电压20~30 kV (反向电压);柱温25 ℃;进样压力3.4~13.8 kPa;进样时间3.0~99.9 s。
1.3 抑霉唑手性拆分条件的优化1) β-CD浓度的优化。在50 mmol/L NaH2PO4 + 5 mmol/L NH4H2PO4的缓冲体系和25 kV分离电压的基础分离条件下,对β-CD浓度进行优化。β-CD的优化浓度设定为3、5、10和15 mmol/L。
2) 有机添加剂的优化。在5 mmol/L β-CD + 50 mmol/L NaH2PO4 + 5 mmol/L NH4H2PO4的缓冲体系和25 kV分离电压的基础分离条件下,选用甲醇、乙腈和异丙醇3种有机溶剂,分别在各溶剂的体积分数为2.5%、5%、7.5%和10%下进行优化。
3) NaH2PO4浓度的优化。在5 mmol/L β-CD + 2.5% 异丙醇 + 5 mmol/L NH4H2PO4的缓冲体系和25 kV分离电压的基础分离条件下,对NaH2PO4浓度进行优化。NaH2PO4的优化浓度设定为25、50、75和100 mmol/L。
4) NH4H2PO4浓度的优化。在5 mmol/L β-CD + 2.5% 异丙醇 + 75 mmol/L NaH2PO4的缓冲体系和25 kV分离电压的基础分离条件下,对NH4H2PO4浓度进行优化。NH4H2PO4的优化浓度设定为0、5、10和15 mmol/L。
5) 分离电压的优化。在5 mmol/L β-CD + 2.5% 异丙醇 + 75 mmol/L NaH2PO4 + 5 mmol/L NH4H2PO4的缓冲体系下,分别在20、25和30 kV下进行优化。
1.4 抑霉唑在线富集在优化的拆分条件下 (考虑到重复性,缓冲体系中不再包含有机添加剂),采用堆积法对抑霉唑进行在线富集研究。采用压力进样模式,以50 mg/L的抑霉唑在3.4 kPa × 3.0 s进样条件下所得的电泳图为原始对照,通过增加进样压力或延长进样时间的方式对5 mg/L抑霉唑的分离度和富集效果进行研究。
1.5 分离度与富集倍数的计算试验数据使用32 Karat Version 7.0软件处理。分离度 (R) 和富集倍数 (F) 分别按公式 (1) 和 (2) 计算。
| $R = \frac{{{\rm{2}}\left( {{{{t}}_{\rm{2}}}{\rm{ - }}{{{t}}_{\rm{1}}}} \right)}}{{{W_2} + {W_1}}}$ | (1) |
(1) 式中:t为迁移时间;W为基线峰宽 (用时间表示);1和2分别代表两个组分。
| $F = \frac{S}{{{S_0}}} \times {{n}}$ | (2) |
(2) 式中:S0为50 mg/L样品在3.4 kPa × 3.0 s进样条件下的峰面积;S为5 mg/L样品在不同进样条件下的峰面积;n为稀释倍数,本研究以50 mg/L的样品质量浓度为基准,对5 mg/L的样品进行富集,则n = 10。
2 结果与分析 2.1 抑霉唑手性拆分条件的优化 2.1.1 β-CD浓度对分离度的影响结果 (图1) 表明:在设定的β-CD浓度范围内,随着β-CD浓度的增加,抑霉唑对映体的分离度不断减小。但在观察出峰情况时发现,对映体保留时间随着β-CD浓度的增加先缩短后延长,当β-CD浓度为5 mmol/L时,保留时间最短。虽然在3 mmol/L的β-CD条件下分离度最高,但其结果不稳定且重现性较差。最终以5 mmol/L的β-CD为优化条件进行后续优化试验。
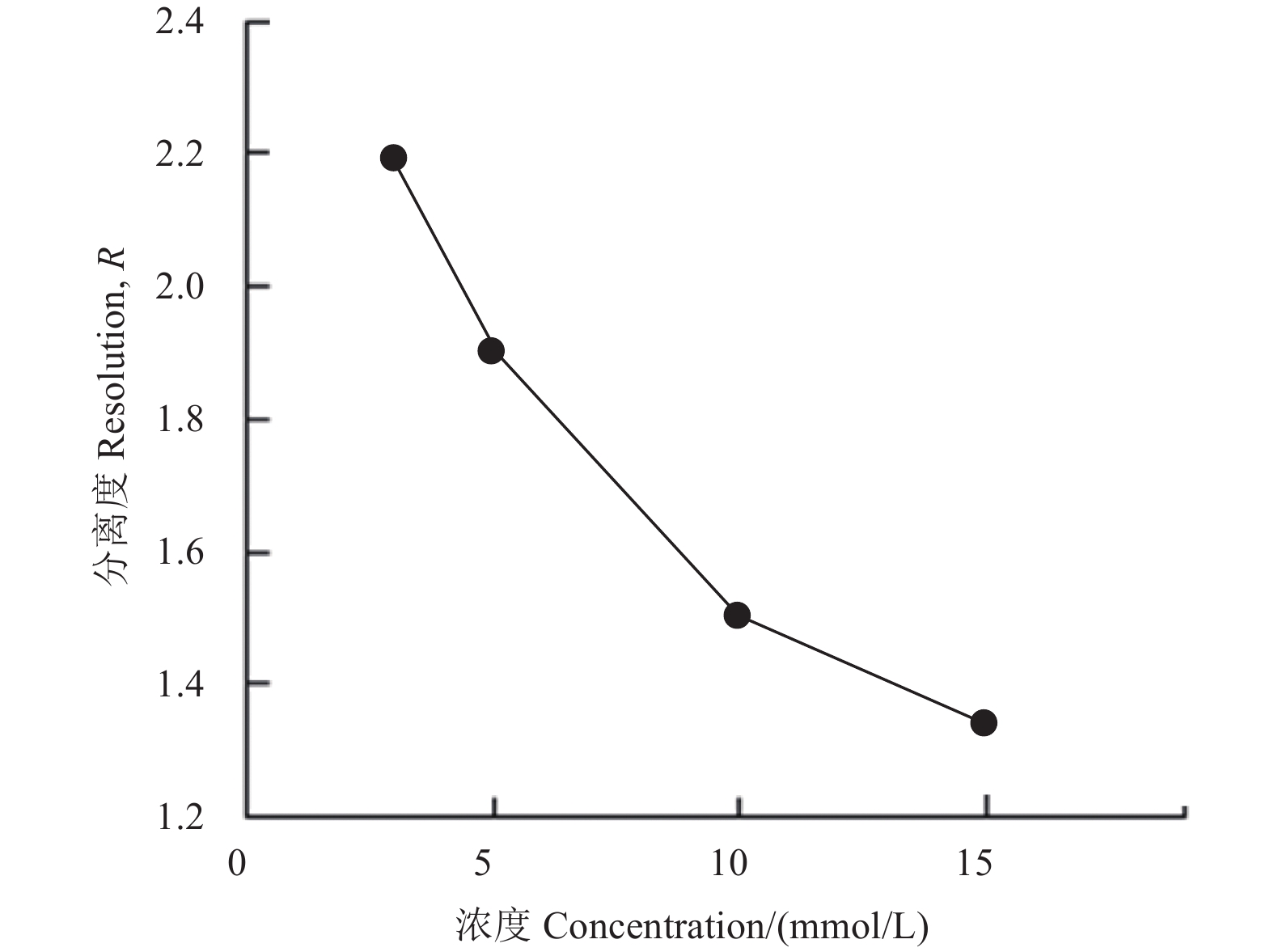
|
图 1 不同β-CD浓度下抑霉唑对映异构体的分离度 Fig. 1 The resolution of imazalil enantiomers under the different concentrations of β-CD |
2.1.2 有机添加剂对分离度的影响
结果 (图2) 表明:添加体积分数为2.5%的异丙醇,能明显促进抑霉唑对映体的分离,但随着其体积分数的增加,分离度不断减小;添加不同量的甲醇对抑霉唑对映体的分离度均无明显促进或抑制作用;而添加乙腈明显抑制了抑霉唑对映体的分离。因此,以2.5%的异丙醇为优化条件进行后续优化。
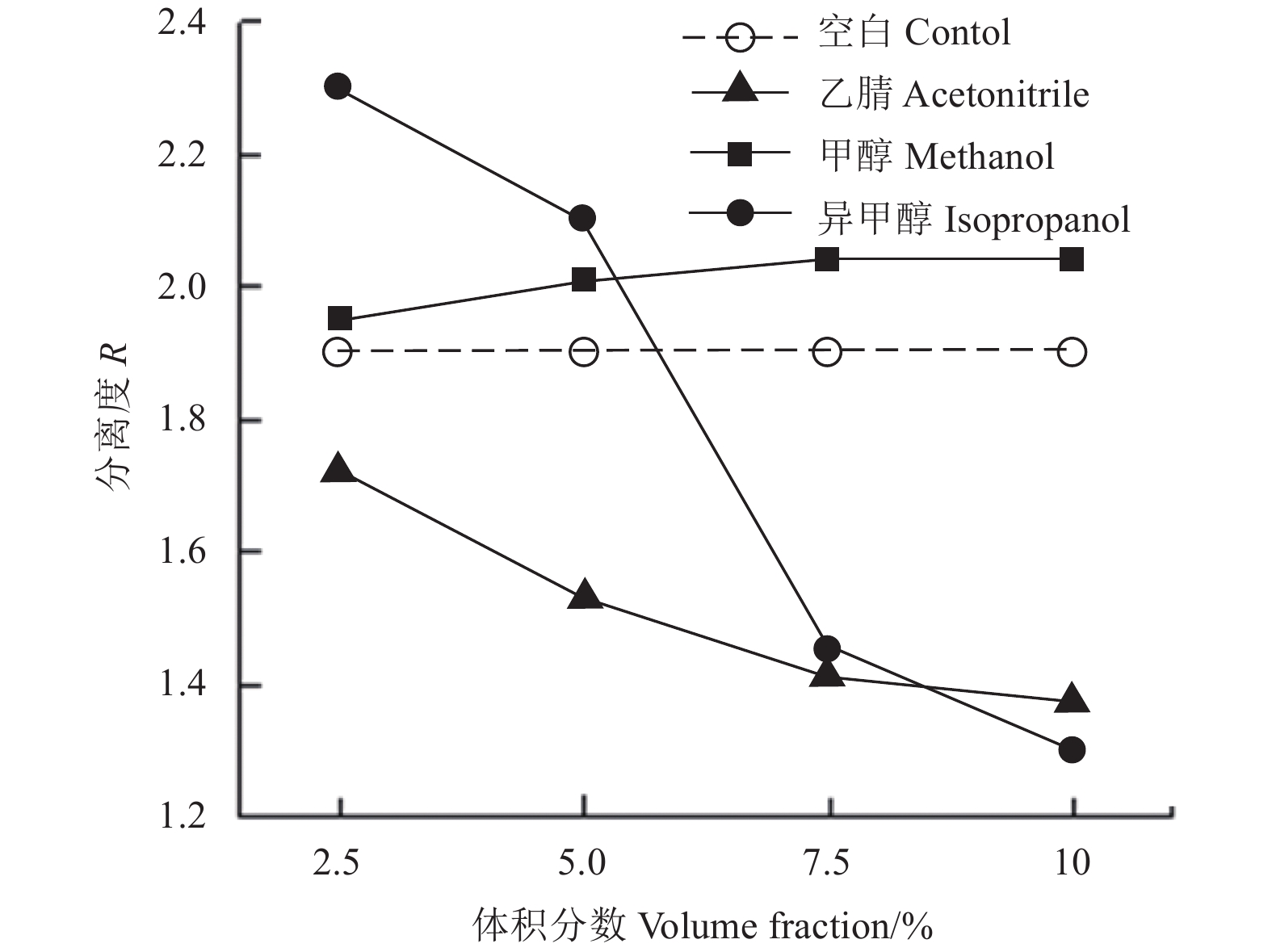
|
图 2 有机添加剂种类及用量对抑霉唑对映异构体分离度的影响 Fig. 2 The effects of the kind and the volume fraction of organic additives on the resolution of imazalil enantiomers |
2.1.3 NaH2PO4浓度对分离度的影响
在25 kV的分离电压下,当NaH2PO4的浓度在25、50、75 和100 mmol/L时,对应的抑霉唑对映体的分离度分别为1.90、2.30、2.80和3.20,且对映体的基线峰宽基本不变,保留时间随浓度增加而延长,但当浓度为100 mmol/L时,由于电流过大,对映体的保留时间和分离效果均不稳定。因此,以75 mmol/L的 NaH2PO4为优化条件进行后续优化。
2.1.4 NH4H2PO4浓度对分离度的影响在25 kV的分离电压下,当NH4H2PO4的浓度在0、5、10和15 mmol/L时,对应的抑霉唑对映体的分离度分别为2.17、2.80、2.33和2.30,其中当NH4H2PO4的浓度为5 mmol/L时,分离度最佳,且对映体的基线峰宽分别为0.23、0.17、0.22和0.20,保留时间基本不变。因此,以5 mmol/L的NH4H2PO4为优化条件进行后续优化。
2.1.5 分离电压对分离度的影响结果 (图3) 表明:当分离电压为20、25和30 kV时,对应的抑霉唑对映体的分离度分别为3.0、2.8和2.4,且分离电压越大,保留时间越短。其中当分离电压为20 kV时,分离度达到最大,但继续减小分离电压会导致对映体保留时间和拆分效果不稳定。因此,将分离电压确定为20 kV。
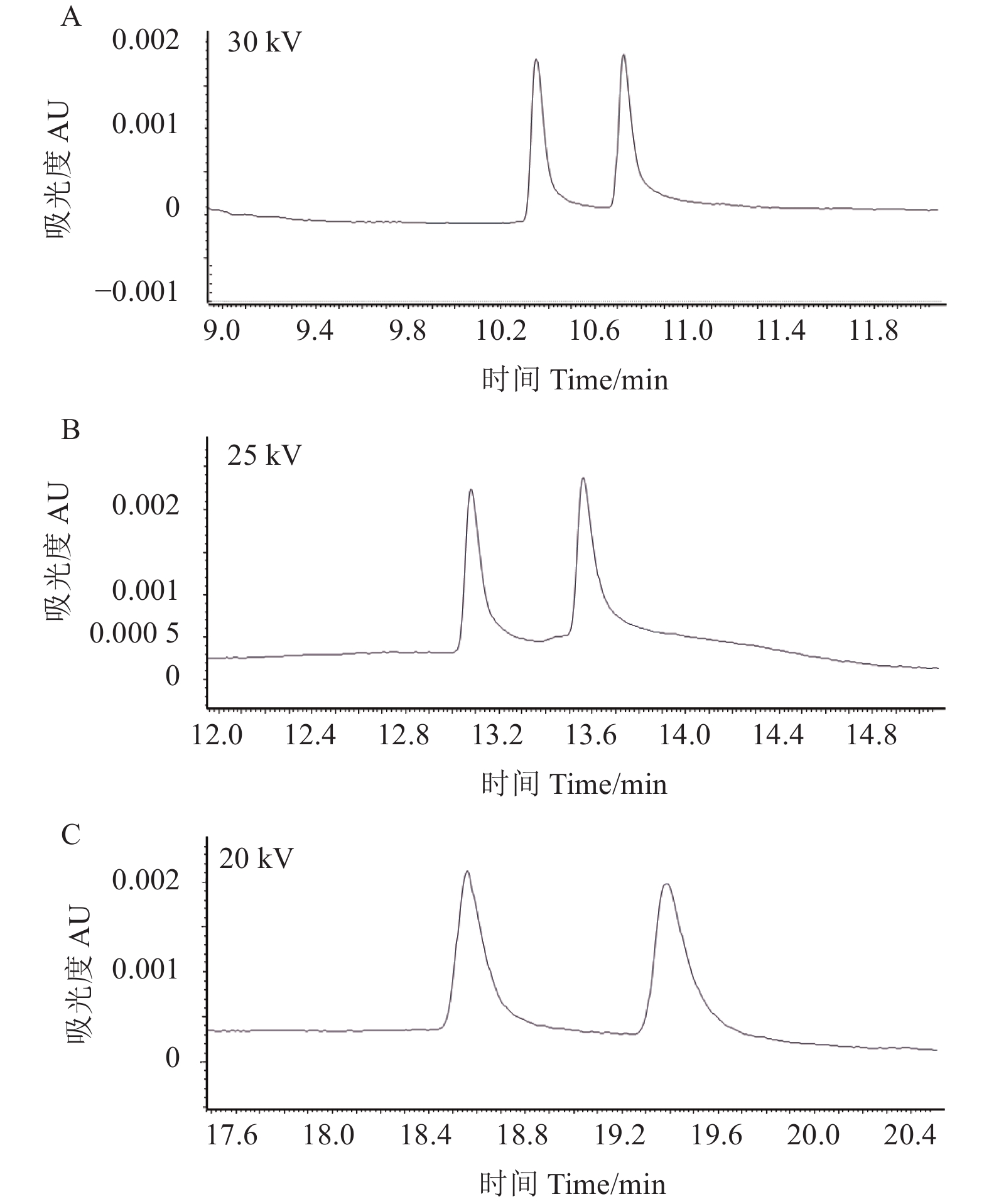
|
图 3 不同分离电压下的抑霉唑电泳图 Fig. 3 The electrophoretogram of imazalil under different separation voltages |
综上,在优化后的缓冲体系和分离电压条件下,抑霉唑对映体的分离度达到3.0,拆分效果如图3C所示。
2.2 抑霉唑在线富集的效果由50 mg/L的样品在3.4 kPa × 3.0 s进样条件下所得电泳图谱 (图4A) 与5 mg/L样品在3.4 kPa × 60.0 s进样条件下所得电泳图谱 (图4B) 可知,在不含有机添加剂及优化后的缓冲体系中,增加进样时间仅取得7~8倍的富集效果。
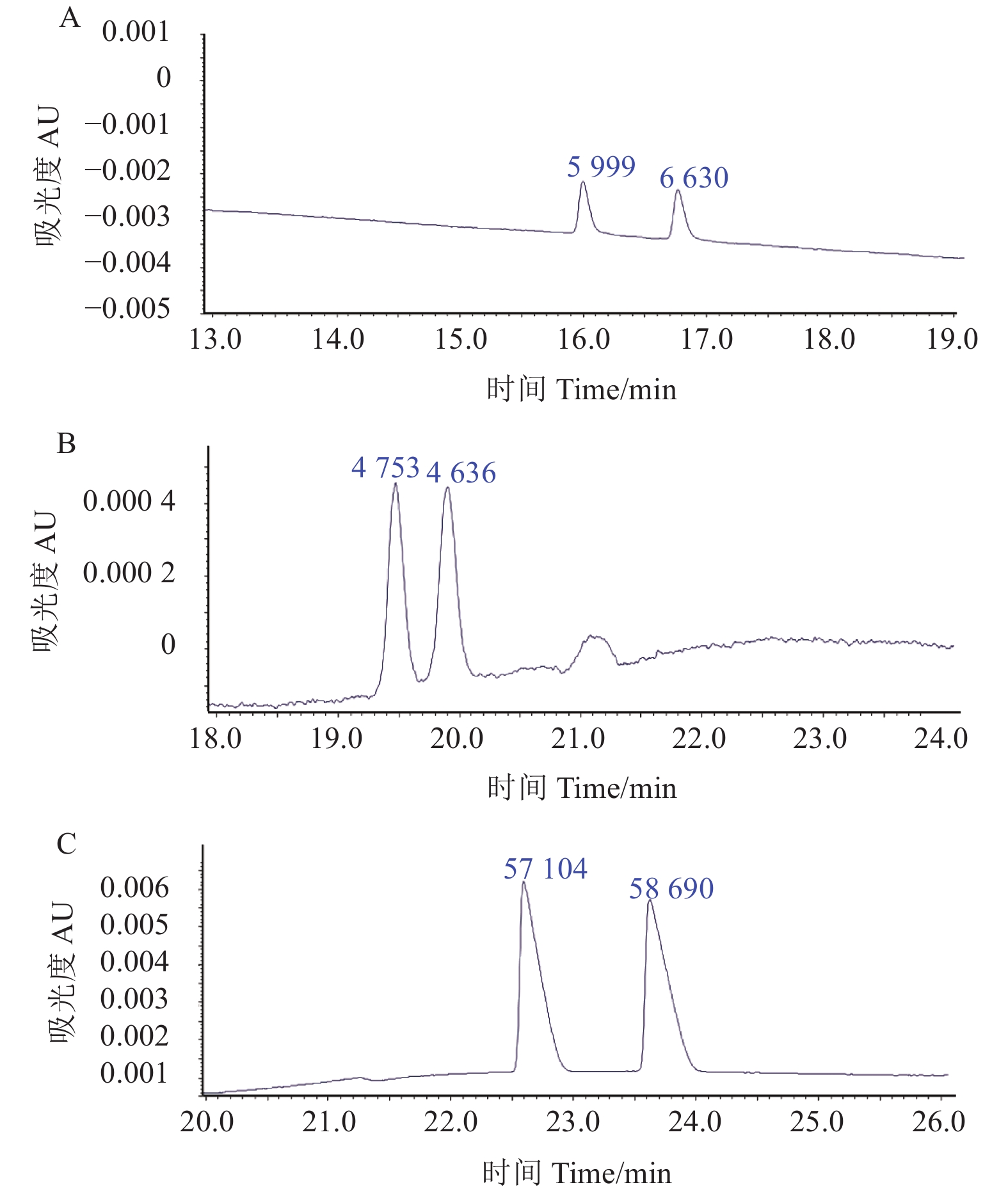
|
A:抑霉唑质量浓度50 mg/L,进样条件3.4 kPa×3.0 s,5 mmol/L β-CD,缓冲体系为75 mmol/L NaH2PO4 + 5 mmol/L NH4H2PO4;B:抑霉唑质量浓度5 mg/L,进样条件3.4 kPa×60.0 s,缓冲体系同A;C:抑霉唑质量浓度5 mg/L,进样条件13.8 kPa×99.9 s,5 mmol/L β-CD,缓冲体系:75 mmol/L NaH2PO4 + 5 mmol/L NH4H2PO4+ 50 mmol/L H3PO4。蓝色数字为计算所得峰面积。 A: imazalil concentration 50 mg/L, injection condition 3.4 kPa × 3.0 s, 5 mmol/L β-CD, the buffer system: 75 mmol/L NaH2PO4 + 5 mmol/L NH4H2PO4; B: imazalil concentration 5 mg/L, injection condition 3.4 kPa × 60.0 s, the buffer system was same as A; C: imazalil concentration 5 mg/L, injection condition 13.8 kPa × 990.9 s, 5 mmol/L β-CD, the buffer system: 75 mmol/L NaH2PO4 + 5 mmol/L NH4H2PO4+ 50 mmol/L H3PO4. The blue numbers iodicated the peak area. 图 4 不同进样条件下的抑霉唑在线富集电泳图 (堆积法) Fig. 4 The electrophoretogram of imazalil under the different injection conditions after on-column preconcentration (stacking method) |
因此,为提高富集效果,还需要增加样品区带与缓冲体系区带的电导差异。于是,在优化后的5 mmol/L β-CD + 75 mmol/L NaH2PO4 + 5 mmol/L NH4H2PO4的基础上加入50 mmol/L H3PO4,以加强电导效果。此时,5 mg/L样品在13.8 kPa × 99.9 s的进样条件下,富集倍数可达到91~92倍 (图4C)。此外,分析图4的电泳图谱可知,对映体的出峰时间会随着进样压力的增大和进样时间的延长而延长,且增大进样压力或延长进样时间对对映体分离度的影响不大。
本研究中所有操作均重复3次,结果重复性良好,样品检测限 (信噪比S/N = 3) 为0.5 mg/L,相对标准偏差为1.8% ~ 4.0%。
3 讨论与结论毛细管电泳 (CE) 法因具有高效、快速、便捷和廉价等优点,成为近年来发展迅速的分离分析方法,在手性拆分方面更是潜力巨大,但目前尚未见应用该法对抑霉唑同时进行手性拆分和在线富集条件优化的研究。此外,目前采用CE法进行化合物手性拆分的研究存在普及性和操作性不强的问题,主要是因为手性选择剂价格昂贵或试验条件苛刻。本研究通过选择廉价的手性选择剂,简化了试验操作和试验条件,旨在推广CE法在农药的手性拆分和在线富集中的应用。
环糊精及其衍生物是采用CE法进行化合物对映体手性拆分研究中应用最为广泛的手性选择剂,其中,β-CD因其所具有得空腔可与大多数对映体相匹配,且成本低廉而成为了最常用的天然手性选择剂[29]。因此,本研究选择β-CD为手性选择剂,研究了其浓度对抑霉唑对映体分离度的影响。结果表明:添加5mmol/L的β-CD效果最好,该结果与Chu等[30]的研究结果基本一致。Chu等的研究表明,随着β-CD浓度的升高,抑霉唑的两个对映体与β-CD的包合能力差异越大,但是β-CD的浓度越高,其黏度就会越大,造成电渗能力降低,最终影响对映体的分离。此外,Wren等[31]的研究认为,手性选择剂的浓度选择与其和客体形成的包合常数有关,包合常数越大,则所需手性选择剂的浓度越低,故在优化手性选择剂浓度时,选择剂与待测物之间的包合常数是重要的参考之一。本研究通过对缓冲体系组分及分离电压等的逐一优化,初步取得了较理想的CE法手性拆分的试验条件:缓冲体系为2.5% 异丙醇 + 75 mmol/L NaH2PO4 + 5 mmol/LNH4H2PO4,分离电压为20 kV时,手性拆分抑霉唑的分离度为3.0。对比Kodama等[27]的研究,其以β-CD的衍生物(2-羟丙基)-β-环糊精 (2-HP-β-CD) 为手性选择剂对抑霉唑对映体进行拆分,2-HP-β-CD的最佳添加浓度为4 mmol/L,且分离度可达6,可见,仍存在更多廉价且手性拆分能力强的手性选择剂有待选择,其中二元手性选择剂体系在CE法中的应用也应是后续研究的方向。此外,还可以对缓冲体系的选择进行研究,并开展一些结构近似化合物拆分条件的比较研究,为拆分方法的普适性应用奠定基础。
本研究除了采用CE法对抑霉唑的手性拆分条件进行优化外,还采用堆积法对其在线富集进行了初步研究。结果表明:在缓冲体系中添加50 mmol/L的H3PO4以加强电导效果后,在13.8 kPa × 99.9 s的条件下进样,抑霉唑的富集效果最佳,富集倍数可达91~92倍。目前,由于缺乏对抑霉唑在线富集的研究报道,尚无研究结果可比较,且本研究方法仅基于对标准样品的研究,所以对抑霉唑而言,堆积法是否是其最佳的在线富集方法仍有待进一步检验。因此,采用扫集法[32]、选择性耗尽进样-扫集法 (堆积法与扫集法联用) [33]等技术进一步研究抑霉唑的在线富集效果,并进行对比分析也是后续研究的方向。
综上所述,本研究采用毛细管区带电泳技术,对抑霉唑对映体进行了手性拆分和在线富集研究,通过对手性选择剂的种类与浓度、缓冲液的pH与浓度以及分离电压等进行优化,得到了分离度为3.0的抑霉唑最佳手性分离条件:缓冲液5 mmol/L β-CD + 2.5%异丙醇+ 75 mmol/L NaH2PO4 + 5 mmol/L NH4H2PO4,分离电压为20 kV。堆积法在线富集的结果表明,在添加了50 mmol/L H3PO4后,抑霉唑达到91~92倍的最佳富集效果。
| [1] |
JESCHKE P. Current status of chirality in agrochemicals[J]. Pest Manag Sci, 2018, 74(11): 2389-2404. DOI:10.1002/ps.2018.74.issue-11 |
| [2] |
GELLAD W F, CHOI P, MIZAH M, et al. Assessing the chiral switch: approval and use of single-enantiomer drugs, 2001 to 2011[J]. Am J Manag Care, 2014, 20(3): e90-e97. |
| [3] |
BUSER H R, MÜLLER M D, POIGER T, et al. Environmental behavior of the chiral acetamide pesticide metalaxyl: enantioselective degradation and chiral stability in soil[J]. Environ Sci Technol, 2002, 36(2): 221-226. DOI:10.1021/es010134s |
| [4] |
CHEN S W, LIU W P. Enantioselective degradation of metalaxyl in anaerobic activated sewage sludge[J]. Bull Environ Contam Toxicol, 2009, 82(3): 327-331. DOI:10.1007/s00128-008-9559-6 |
| [5] |
诸平. 手性分子研究的过去、现在与未来: 2001 年诺贝尔化学奖深远意义剖析[J]. 宝鸡文理学院学报(自然科学版), 2002, 22(1): 70-74. ZHU P. Chiral molecules research: past, present, and future[J]. J Baoji Coll Arts Sci (Nat Sci Ed), 2002, 22(1): 70-74. DOI:10.3969/j.issn.1007-1261.2002.01.021 |
| [6] |
NAGAI T, KUROSU A, MATSUSHIMA K, et al. Simultaneous identification of the enantiomers and diastereomers of N, O-di-trifluoroacetylated ephedrine and norephedrine in blood plasma using chiral capillary gas chromatography-mass spectrometry with selected ion monitoring
[J]. J Anal Toxicol., 2012, 36(2): 96-105. DOI:10.1093/jat/bkr010 |
| [7] |
SCHURIG V, JUZA M. Analytical separation of enantiomers by gas chromatography on chiral stationary phases[M]//Advances in Chromatography. CRC Press, 2014: 117-168.
|
| [8] |
MORRISON C, SMITH F J, TOMASZEWSKI T, et al. Chiral gas chromatography as a tool for investigations into illicitly manufactured methylamphetamine[J]. Chirality, 2011, 23(7): 519-522. DOI:10.1002/chir.20957 |
| [9] |
PENG L M, JAYAPALAN S, CHANKVETADZE B, et al. Reversed-phase chiral HPLC and LC/MS analysis with tris (chloromethylphenylcarbamate) derivatives of cellulose and amylose as chiral stationary phases[J]. J Chromatogr A, 2010, 1217(44): 6942-6955. DOI:10.1016/j.chroma.2010.08.075 |
| [10] |
TSUTSUI H, FUJII S, SAKAMOTO T, et al. Chiral amines as reagents for HPLC-MS enantioseparation of chiral carboxylic acids[J]. J Sep Sci, 2012, 35(13): 1551-1559. DOI:10.1002/jssc.201200091 |
| [11] |
MENG L, WANG B, LUO F, et al. Application of dispersive liquid-liquid microextraction and CE with UV detection for the chiral separation and determination of the multiple illicit drugs on forensic samples[J]. Forensic Sci Int, 2011, 209(1-3): 42-47. DOI:10.1016/j.forsciint.2010.12.003 |
| [12] |
WAGNER Z, TÁBI T, JAKÓ T, et al. Chiral separation and determination of excitatory amino acids in brain samples by CE-LIF using dual cyclodextrin system[J]. Anal Bioanal Chem, 2012, 404(8): 2363-2368. DOI:10.1007/s00216-012-6384-x |
| [13] |
ZHANG H Z, QI L, QIAO J, et al. Determination of sodium benzoate by chiral ligand exchange CE based on its inhibitory activity in D-amino acid oxidase mediated oxidation of D-serine
[J]. Anal Chim Acta, 2011, 691(1-2): 103-109. DOI:10.1016/j.aca.2011.02.039 |
| [14] |
刘海兴, 于爱民, 刘凤芹, 等. 毛细管电泳在手性物质分离中的应用[J]. 化学试剂, 2005, 27(9): 535-540. LIU H X, YU A M, LIU F Q, et al. Application of capillary electrophoresis in chiral separation[J]. Chem Reagents, 2005, 27(9): 535-540. DOI:10.3969/j.issn.0258-3283.2005.09.007 |
| [15] |
ALTRIA K D, ELDER D. Overview of the status and applications of capillary electrophoresis to the analysis of small molecules[J]. J Chromatogr A, 2004, 1023(1): 1-14. DOI:10.1016/j.chroma.2003.10.054 |
| [16] |
KANG J W, WISTUBA D, SCHURIG V. Recent progress in enantiomeric separation by capillary electrochromatography[J]. Electrophoresis, 2002, 23(22-23): 4005-4021. DOI:10.1002/elps.200290015 |
| [17] |
RIZZI A. Fundamental aspects of chiral separations by capillary electrophoresis[J]. Electrophoresis, 2001, 22(15): 3079-3106. DOI:10.1002/1522-2683(200109)22:15<3079::aid-elps3079>3.0.co;2-f |
| [18] |
QUIRINO J P, TERABE S. Exceeding 5000-fold concentration of dilute analytes in micellar electrokinetic chromatography[J]. Science, 1998, 282(5388): 465-468. DOI:10.1126/science.282.5388.465 |
| [19] |
YU L J, LI S F Y. Dynamic pH junction-sweeping capillary electrophoresis for online preconcentration of toxic pyrrolizidine alkaloids in Chinese herbal medicine[J]. Electrophoresis, 2005, 26(22): 4360-4367. DOI:10.1002/elps.200500267 |
| [20] |
卢玉超, 王海燕, 宋萍萍, 等. 毛细管电泳-场强放大样品堆积法检测染发剂中的7种苯胺类物质[J]. 色谱, 2011, 29(11): 1122-1127. LU Y C, WANG H Y, SONG P P, et al. Determination of seven aromatic amines in hair dyes by capillary electrophoresis coupled with field-amplified sample stacking[J]. Chin J Chromatogr, 2011, 29(11): 1122-1127. |
| [21] |
LEVENT A, YARDIM Y, DEMIR C. Determination of trace metal and mineral levels in the tobacco and cigarette samples using by fass[J]. J Chem Soc Pakistan, 2013, 35(2): 257-261. |
| [22] |
WANG X, MASSCHELEIN E, HESPEL P, et al. Simultaneous determination of nitrite and nitrate in human plasma by on-capillary preconcentration with field-amplified sample stacking[J]. Electrophoresis, 2012, 33(2): 402-405. DOI:10.1002/elps.v33.2 |
| [23] |
TŮMA P, ŠUSTKOVÁ-FIŠEROVÁ M, OPEKAR F, et al. Large-volume sample stacking for in vivo monitoring of trace levels of γ-aminobutyric acid, Glycine and glutamate in microdialysates of periaqueductal gray matter by capillary electrophoresis with contactless conductivity detection
[J]. J Chromatogr A, 2013, 1303: 94-99. DOI:10.1016/j.chroma.2013.06.019 |
| [24] |
冯丹, 孙学鹏, 姜丽英, 等. 浙江衢州地区柑橘绿霉病菌对抑霉唑和多菌灵的抗性水平及其分子机制[J]. 农药学学报, 2011, 13(4): 341-346. FENG D, SUN X P, JIANG L Y, et al. Resistance level and mechanism of Penicillium digitatum to imazalil and carbendazim in Quzhou, Zhejiang [J]. Chin J Pestic Sci, 2011, 13(4): 341-346. DOI:10.3969/j.issn.1008-7303.2011.04.02 |
| [25] |
CHAI T, YANG W, QIU J, et al. Direct enantioseparation of nitrogen-heterocyclic pesticides on cellulose-based chiral column by high-performance liquid chromatography[J]. Chirality, 2015, 27(1): 32-38. DOI:10.1002/chir.22385 |
| [26] |
LI R N, DONG F S, XU J, et al. Enantioseparation of imazalil and monitoring of its enantioselective degradation in apples and soils using ultrahigh-performance liquid chromatography-tandem mass spectrometry[J]. J Agric Food Chem, 2017, 65(16): 3259-3267. DOI:10.1021/acs.jafc.7b00258 |
| [27] |
KODAMA S, YAMAMOTO A, OHURA T, et al. Enantioseparation of imazalil residue in orange by capillary electrophoresis with 2-hydroxypropyl-β-cyclodextrin as a chiral selector
[J]. J Agric Food Chem, 2003, 51(21): 6128-6131. DOI:10.1021/jf030282x |
| [28] |
SHI J H, DING Z J, HU Y. Experimental and theoretical studies on the enantioseparation and chiral recognition of mandelate and cyclohexylmandelate on permethylated β-cyclodextrin chiral stationary phase
[J]. Chromatographia, 2011, 74(3-4): 319-325. DOI:10.1007/s10337-011-2069-4 |
| [29] |
FANALI S. Enantioselective determination by capillary electrophoresis with cyclodextrins as chiral selectors[J]. J Chromatogr A, 2000, 875(1-2): 89-122. DOI:10.1016/S0021-9673(99)01309-6 |
| [30] |
CHU B L, GUO B Y, PENG Z L, et al. Studies on degradation of imazalil enantiomers in soil using capillary electrophoresis[J]. J Sep Sci, 2007, 30(6): 923-929. DOI:10.1002/(ISSN)1615-9314 |
| [31] |
WREN S A C, ROWE R C. Theoretical aspects of chiral separation in capillary electrophoresis: I. Initial evaluation of a model[J]. J Chromatogr A, 1992, 603(1-2): 235-241. DOI:10.1016/0021-9673(92)85366-2 |
| [32] |
SERA Y, MATSUBARA N, OTSUKA K, et al. Sweeping on a microchip: Concentration profiles of the focused zone in micellar electrokinetic chromatography[J]. Electrophoresis, 2001, 22(16): 3509-3513. DOI:10.1002/(ISSN)1522-2683(200109)22:16<3509 |
| [33] |
QUIRINO J P, TERABE S. Approaching a million-fold sensitivity increase in capillary electrophoresis with direct ultraviolet detection: cation-selective exhaustive injection and sweeping[J]. Anal Chem, 2000, 72(5): 1023-1030. DOI:10.1021/ac990344b |
 2019, Vol. 21
2019, Vol. 21


