2. 青岛清原化合物有限公司,山东 青岛 266071
2. Qingdao Kingagroot Chemical Compound Co., Ltd., Qingdao 266071, Shandong Province, China
千金子Leptochloa chinensis (L.) Nees作为水稻田中仅次于稗草Echinochloa crus-galli (L.) Beauv.的第二大恶性禾本科杂草,遍布于中国水稻种植区,具有成株率高、分蘖力强且对常用除草剂不敏感等特点,对水稻生长和产量构成严重威胁[1-2]。
乙酰辅酶A羧化酶 (ACCase) 抑制剂类除草剂,主要包括芳氧苯氧基丙烯酸酯类、环己烯酮类及苯基吡唑啉类。氰氟草酯属于芳氧苯氧基丙烯酸酯类抑制剂,因其对千金子有特效而被广泛应用于水稻田。随着ACCase抑制剂类除草剂长期不合理使用,禾本科杂草对该类除草剂已产生不同程度的抗药性[3-6]。目前研究者普遍认为,杂草对ACCase抑制剂类除草剂的抗性机制分为靶标抗性和非靶标抗性。非靶标抗性主要与禾本科杂草体内相关酶及其代谢有关。文马强等[7]通过抗性种群与敏感种群千金子相关酶活力的比较发现,抗性种群中的谷胱甘肽S-转移酶、超氧化物歧化酶、过氧化物酶和过氧化氢酶活力增强,进而推断千金子对ACCase抑制剂的抗性与相关酶活性有关。靶标抗性作为ACCase抑制剂类除草剂的主要抗性机制,研究者认为可能是由于ACCase酶CT结构域内单氨基酸发生改变,进而降低其与除草剂的结合能力而产生抗药性[8]。目前,已报道的ACCase的CT结构域中的突变有:色氨酸 (Trp)-2027被半胱氨酸 (Cys) 取代;异亮氨酸 (Ile)-1781被缬氨酸 (Val)、亮氨酸 (Leu)、丝氨酸 (Thr) 取代;色氨酸 (Trp)-1999被半胱氨酸 (Cys)、亮氨酸 (Leu)、丝氨酸 (Ser) 取代;异亮氨酸 (Ile)-2041被天冬酰胺 (Asn)、缬氨酸 (Val)取代;天门冬氨酸 (Asp)-2078被甘氨酸 (Gly) 取代;半胱氨酸 (Cys)-2088被精氨酸 (Arg) 取代;甘氨酸 (Gly)-2096-被丙氨酸 (Ala)、丝氨酸 (Ser) 取代[9–16]。
目前鲜有关于华东稻区千金子对氰氟草酯抗性水平的报道。本研究拟对采自华东稻区稻田的千金子种群采用整株生物测定法检测,以明确千金子对氰氟草酯的抗性水平,并通过分子手段检测靶标酶ACCase基因氨基酸变异位点,旨在为水稻田千金子抗性分子机制研究提供基础,同时为水稻田千金子的科学防治及抗性治理提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 供试种子2017年9月,在华东部分稻区水稻田中采集成熟的千金子种子 (表1),单株采收,晾干,于4 ℃种子室保存。千金子敏感种群LC-S采自上海崇明光明农场附近未使用过除草剂的非耕地。
|
|
表 1 千金子采集地点 Table 1 Collection sites of L. chinensis |
1.1.2 试验设备
GXZ型智能光照培养箱 (宁波江南仪器厂);3WP-2000型行走式喷雾塔 (农业农村部南京农业机械化研究所);多样品组织研磨仪 (上海净信实业发展有限公司);VORTEX-5涡旋混匀器 (北京东南仪诚实验室设备有限公司);Eppendorf 5418小型台式高速离心机 (南京贝登电子商务有限公司);Bio-Rad T100 PCR仪 (赛默飞世尔仪器有限公司);DYY-7C电泳仪 (北京六一生物科技有限公司);XZ21K-T高速冷冻离心机 (长沙湘智离心机仪器有限公司);DK-8D三温三控水槽 (上海博迅实业有限公司)。
1.1.3 药剂及试剂10%氰氟草酯 (cyhalofop-butyl) 乳油 (美国陶氏益农公司);85%赤霉素A3结晶粉 (湖南神隆超级稻丰产生化有限公司);十六烷基-三甲基-溴化铵 (CTAB)、三 (羟甲基) 氨基甲烷、氯化钠、氢氧化钠、乙二胺四乙酸 (EDTA)、琼脂糖和4S Red Plus核酸染色剂 [生工生物工程 (上海) 有限公司];其余为国药集团化学试剂有限公司分析纯试剂。
1.2 试验方法 1.2.1 供试植物培养将大田土壤与营养土按照体积比1 : 1混匀,装入直径8 cm、高8 cm的塑料营养钵中。将土壤充分浇水后,播撒拌土后的千金子种子,每盆播撒20粒左右 (播种前种子用400 mg/L的85%赤霉素A3溶液浸泡24 h),放入光照培养箱中催芽。催芽条件为14 h (昼)/10 h (夜),38 ℃(昼)/25 ℃(夜)。3 d后取出,置于温室培养,培养温度35 ℃(昼)/20 ℃(夜)。
1.2.2 千金子对氰氟草酯抗性水平检测采用整株生物测定法[17]:待千金子生长至2~3叶期时,间苗,每盆保留10株;于4叶期再间苗1次,保留8株;进行喷药处理。10%氰氟草酯乳油的剂量设为有效成分:0 (CK)、9.38、18.75、37.5、75、150和600 g/hm2;根据前期试验结果,敏感种群(LC-S)使用10%氰氟草酯乳油的剂量设为有效成分:0 (CK)、2.34、4.69、9.38、18.75、37.5和75 g/hm2。每处理3次重复,28 d后剪取地上部分,称量鲜物质质量 (m),计算鲜重防效 (E)。
1.2.3 千金子抗性种群ACCase基因分子机理分析 1.2.3.1 引物设计根据NCBI的GenBank登记的千金子ACCase部分序列 (AY803783.1、AY662693.1) 及序列同源性比对设计引物对 (F: 5′-ATTCTCGTATTGGCTCATCT-3′;R: 5′-CGACTCTTCCCAATCAACAA-3′),引物包含已报道的7个可导致杂草抗药性的氨基酸变异位点。用TaKaRaLA Taq酶扩增约1 300 bp的目的条带,扩增条件为:94 ℃ 3 min;94 ℃ 1 min,55 ℃ 30 s,72 ℃ 1 min,30 个循环;72 ℃ 10 min。所得PCR产物经电泳分离并切胶纯化回收后用扩增引物进行DNA测序。
1.2.3.2 千金子基因组DNA的提取参考王关林的CTAB(hexadecyl trimethyl ammonium bromide) 法[18]提取DNA。每个种群选取6个单株,每个单株选取100 mg幼叶,剪碎置于2 mL离心管中,液氮冻存后,用组织研磨机破碎60 s;加入65 ℃预热的2 × CTAB裂解液 (质量分数2%的CTAB,40 mmol/L β-巯基乙醇,0.1 mol/L的Tris-HCl,1.4 mol/L NaCl,10 mmol/L EDTA,pH 8.0) 500 µL,快速颠倒混匀后在65 ℃水浴放置1~2 h,其间上下颠倒混匀数次;加入等体积苯酚-氯仿-异戊醇 (25: 24: 1),混匀,于12 000 r/min 离心10 min;取上清液,加入等体积氯仿,颠倒混合,12 000 r/min离心10 min;取上层液相,加入1/10体积3 mol/L的醋酸钠 (pH 5.2) 调节pH值,充分沉降DNA;加入等体积、–20 ℃预冷的异丙醇,颠倒混匀,12 000 r/min离心10 min,弃上清液;用 –20 ℃预冷的70%乙醇洗涤DNA,12 000 r/min离心5 min;弃上清液,晾干,加入30 µL TE溶解。
1.2.3.3 DNA浓度和纯度的确定采用吸光光度法测定样品的OD260/OD280比值,衡量所提取DNA的纯度 (若该比值 > 1.9,表明有RNA污染;若比值 < 1.6,表明有蛋白质、酚等污染)。
1.3 统计分析试验重复3次,使用DPS统计软件几率值分析法分别求出千金子敏感种群和抗性种群的毒力回归方程、GR50、相关系数和抗性指数 (抗性种群GR50/敏感种群GR50)。DNA测序结果由北京擎科新业生物技术有限公司青岛测序部完成,用DNA测序分析软件Chromas v2.6.5分析7个氨基酸变异位点。
2 结果与分析 2.1 千金子种群对氰氟草酯的抗性水平参照Beckie等[19]的研究报道,就采自华东部分稻区25个千金子种群对氰氟草酯的抗性水平进行了分级评价。结果 (表2) 表明:与温室敏感种群LC-S相比,25个稻区千金子种群对氰氟草酯均产生了一定水平的抗性。其中,LC-17-276、LC-17-281、LC-17-282、LC-17-283、LC-17-289和LC-17-290种群的抗性水平较高,GR50分别为有效成分132、229、184、277、175和240 g/hm2,抗性指数分别为16、21、27、30、12和15;其余种群具有中低水平抗性。
|
|
表 2 不同千金子种群对氰氟草酯的抗性水平 Table 2 Resistance levels of different L. chinensis populations to cyhalofop-butyl |
2.2 千金子ACCase基因差异性分析
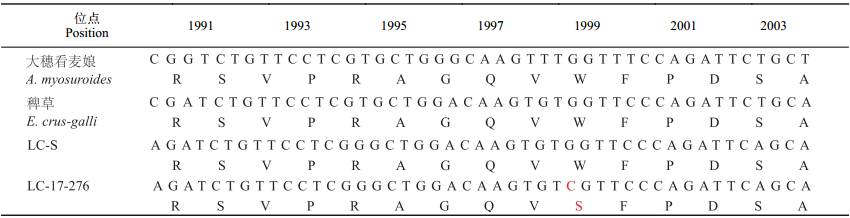
对10个抗性种群的CT结构域进行扩增,获得1 359 bp片段 (图1),该区域包含了1 744~2 196位氨基酸序列。以大穗看麦娘Alopecurus myosuroides作为模式植株,考虑到稗草E. crus-galli与千金子非常相似,用于比较。通过氨基酸序列比较分析发现,LC-17-276种群6个单株的CT结构域中的色氨酸 (Trp)-1999都被丝氨酸 (Ser) 所取代(表3),即LC-17-276种群的ACCase酶1999位氨基酸编码碱基序列由TGG变异为TCG(表4);其他9个种群未见ACCase酶的CT结构域位点变异。
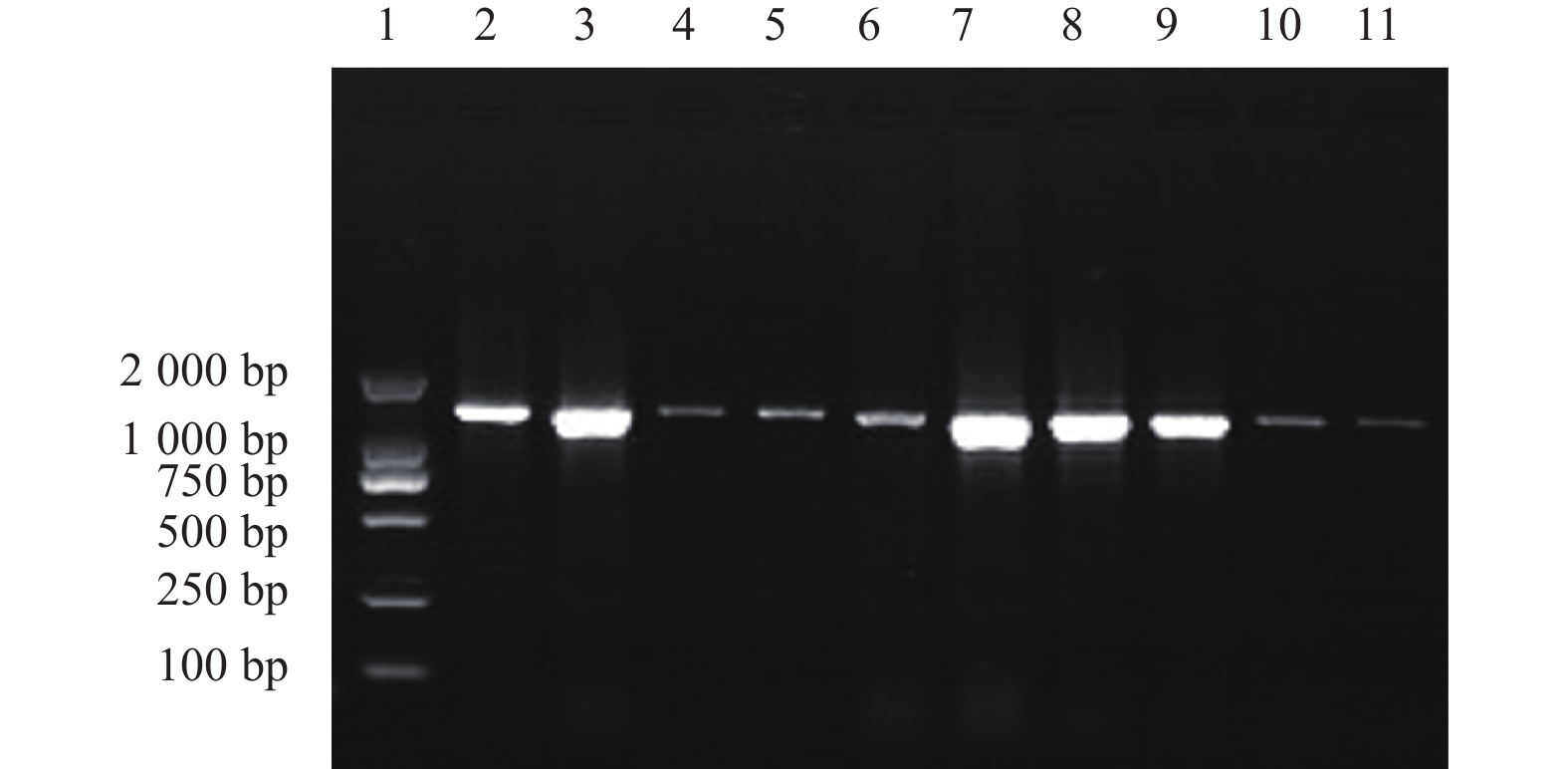
|
1: Marker, 2: LC-17-276, 3: LC-17-281, 4: LC-17-282, 5: LC-17-283, 6: LC-17-284, 7: LC-17-289, 8: LC-17-290, 9: LC-17-294, 10: LC-17-297, 11: LC-17-298. 图 1 10个千金子种群CT区PCR扩增 Fig. 1 PCR amplification of CT region in 10 species |
|
|
表 3 不同千金子种群ACCase基因CT结构域氨基酸差异比对 Table 3 Amino acid substitution in the CT domain of ACCase gene from different L. chinensis |
|
|
表 4 ACCase CT区域氨基酸序列比对 Table 4 Amino acid sequence alignment of ACCase CT region |
3 讨论
通过对华东部分稻区千金子进行整株生物测定,发现该稻区千金子对氰氟草酯已普遍产生抗药性,其中LC-17-276、LC-17-281、LC-17-282、LC-17-283、LC-17-289和LC-17-290种群具有高水平抗性,占种群总数的24%,其他19个种群具有中低水平抗性,占76%。
近年来,随着氰氟草酯被普遍用于千金子等禾本科杂草的防治,有关千金子对氰氟草酯产生抗性的报道不断增加。文马强等报道湖南稻田千金子对氰氟草酯的抗性指数为1.2~11[7];Riahman等报道马来西亚稻田的千金子对氰氟草酯已普遍产生抗性[20];2016年Yu等报道采自浙江余杭的千金子种群对氰氟草酯具有高水平抗性,并揭示了其抗性机制[21]。本研究结果表明,华东部分稻区水稻田千金子对氰氟草酯也产生了广泛的抗性,这与生产实践中千金子的防除难度越来越大的现状相一致。
本研究首次报道了抗性千金子种群ACCase CT结构域中的色氨酸 (Trp)-1999被丝氨酸 (Ser) 取代的变异类型,与之前多花黑麦草ACCase CT结构域中的色氨酸 (Trp)-1999被丝氨酸 (Ser) 取代而产生抗性的报道相一致,因此该突变很可能是导致千金子对氰氟草酯产生抗性的重要原因之一[12]。
目前,华东部分稻区水稻田千金子对氰氟草酯的抗性还处于起始或发展阶段,本研究发现抗性千金子ACCase CT结构域中的色氨酸 (Trp)-1 999被丝氨酸 (Ser) 取代的新变异类型,对预防和控制抗性的过快发展,为寻求延缓抗性快速发展的策略,以及水稻田千金子的科学防治及抗性治理均具有重要意义。
| [1] |
董立尧, 武淑文, 高同春, 等. 千金子发生特点与危害及其防除研究进展[J]. 中国农学通报, 2003, 19(1): 55-61. DONG L Y, WU S W, GAO T C, et al. Advances in the research on occurrence characteristics and damages of Leptochloa chinensis (L.) Nees. and its control [J]. Chin Agric Sci Bull, 2003, 19(1): 55-61. DOI:10.3969/j.issn.1000-6850.2003.01.018 |
| [2] |
魏守辉, 朱文达, 杨小红, 等. 湖北省水稻田杂草的种类组成及其群落特征[J]. 华中农业大学学报, 2013, 32(2): 44-49. WEI S H, ZHU W D, YANG X H, et al. Species composition and characterization of weed community in rice fields in Hubei Province[J]. J Huazhong Agric Univ, 2013, 32(2): 44-49. DOI:10.3969/j.issn.1000-2421.2013.02.008 |
| [3] |
夏向东, 马洪菊, 许孟涵, 等. 杂草对芳氧苯氧丙酸类 (APPs) 除草剂的抗性分子机理研究进展[J]. 农药学学报, 2013, 15(6): 609-614. XIA X D, MA H J, XU M H, et al. Research progress on molecular mechanism of resistant weeds to aryloxyphenoxypropionate herbicides[J]. Chin J Pestic Sci, 2013, 15(6): 609-614. DOI:10.3969/j.issn.1008-7303.2013.06.02 |
| [4] |
LIU W, HARRISON D K, CHALUPSKA D, et al. Single-site mutations in the carboxyltransferase domain of plastid acetyl-CoA carboxylase confer resistance to grass-specific herbicides[J]. Proc Natl Acad Sci, 2007, 104(9): 3627-3632. DOI:10.1073/pnas.0611572104 |
| [5] |
YU Q, COLLAVO A, ZHENG M Q, et al. Diversity of acetyl-coenzyme A carboxylase mutations in resistant Lolium populations: evaluation using clethodim
[J]. Plant Physiol, 2007, 145(2): 547-558. DOI:10.1104/pp.107.105262 |
| [6] |
PETIT C, BAY G, PERNIN F, et al. Prevalence of cross- or multiple resistance to the acetyl-coenzyme A carboxylase inhibitors fenoxaprop, clodinafop and pinoxaden in black-grass (Alopecurus myosuroides Huds.) in France
[J]. Pest Manag Sci, 2009. DOI:10.1002/ps.1851 |
| [7] |
文马强, 周小毛, 刘佳, 等. 直播水稻田千金子对氰氟草酯抗性测定及抗性生化机理研究[J]. 南方农业学报, 2017, 48(4): 647-652. WEN M Q, ZHOU X M, LIU J, et al. Resistance of Leptochloa chinensis (L) Nees. to cyhalofop-butyl in rice field of direct seeding and resistance biochemical mechanism research [J]. J South Agric, 2017, 48(4): 647-652. DOI:10.3969/j.issn.2095-1191.2017.04.013 |
| [8] |
COLLAVO A, PANOZZO S, LUCCHESI G, et al. Characterisation and management of Phalaris paradoxa resistant to ACCase-inhibitors
[J]. Crop Prot, 2011, 30(3): 293-299. DOI:10.1016/j.cropro.2010.11.011 |
| [9] |
LI L X, BI Y L, LIU W T, et al. Molecular basis for resistance to fenoxaprop-p-ethyl in American sloughgrass (Beckmannia syzigachne Steud.)
[J]. Pestic Biochem Physiol, 2013, 105(2): 118-121. DOI:10.1016/j.pestbp.2012.12.007 |
| [10] |
KAUNDUN S S, HUTCHINGS S J, DALE R P, et al. Role of a novel I1781T mutation and other mechanisms in conferring resistance to acetyl-CoA carboxylase inhibiting herbicides in a black-grass population[J]. Plos One, 2013, 8(7): e69568. DOI:10.1371/journal.pone.0069568 |
| [11] |
XU H L, LI J, ZHANG D, et al. Mutations at codon position 1999 of acetyl-CoA carboxylase confer resistance to ACCase-inhibiting herbicides in Japanese foxtail (Alopecurus japonicus)
[J]. Pest Manag Sci, 2014, 70(12): 1894-1901. DOI:10.1002/ps.2014.70.issue-12 |
| [12] |
KAUNDUN S S, BAILLY G C, DALE R P, et al. A novel W1999S mutation and non-target site resistance impact on acetyl-CoA carboxylase inhibiting herbicides to varying degrees in a UK Lolium multiflorum population
[J]. Plos One, 2013, 8(2): e58012. DOI:10.1371/journal.pone.0058012 |
| [13] |
TANG H W, LI J, DONG L Y, et al. Molecular bases for resistance to acetyl-coenzyme A carboxylase inhibitor in Japanese foxtail (Alopecurus japonicus)
[J]. Pest Manag Sci, 2012, 68(9): 1241-1247. DOI:10.1002/ps.v68.9 |
| [14] |
TANG W, ZHOU F Y, CHEN J, et al. Resistance to ACCase-inhibiting herbicides in an Asia minor bluegrass (Polypogon fugax) population in China
[J]. Pestic Biochem Physiol, 2014, 108: 16-20. DOI:10.1016/j.pestbp.2013.11.001 |
| [15] |
CRUZ-HIPOLITO H, OSUNA M D, DOMÍNGUEZ-VALENZUELA J A, et al. Mechanism of resistance to ACCase-inhibiting herbicides in wild oat (Avena fatua) from Latin America
[J]. J Agric Food Chem, 2011, 59(13): 7261-7267. DOI:10.1021/jf201074k |
| [16] |
CRUZ-HIPOLITO H, DOMÍNGUEZ-VALENZUELA J A, OSUNA M D, et al. Resistance mechanism to acetyl coenzyme A carboxylase inhibiting herbicides in Phalaris paradoxa collected in Mexican wheat fields
[J]. Plant Soil, 2012, 355(1-2): 121-130. DOI:10.1007/s11104-011-1085-3 |
| [17] |
王庆亚, 董立尧, 娄远来, 等. 农田杂草抗药性及其检测鉴定方法[J]. 杂草科学, 2002, 20(2): 1-5. WANG Q Y, DONG L Y, LOU Y L, et al. Review on the herbicide resistance of weeds in crop and its checking and determining methods[J]. Weed Sci, 2002, 20(2): 1-5. DOI:10.3969/j.issn.1003-935X.2002.02.001 |
| [18] |
王关林, 方宏筠. 植物基因工程[M]. 北京: 科学出版社, 2016. WANG G L, FANG H J. Plant gengtic engineering[M]. Beijing: Science Press, 2016. |
| [19] |
BECKIE H J, TARDIF F J. Herbicide cross resistance in weeds[J]. Crop Prot, 2012, 35: 15-28. |
| [20] |
RAHMAN M M, ISMAIL S, SOFIAN-AZIRUN M. Identification of resistant biotypes of Leptochloa chinensis in rice field and their control with herbicides
[J]. Afr J Biotechnol, 2011, 10(15): 2904-2914. DOI:10.5897/AJB |
| [21] |
YU J X, GAO H T, PAN L, et al. Mechanism of resistance to cyhalofop-butyl in Chinese sprangletop (Leptochloa chinensis (L.) Nees)
[J]. Pestic Biochem Physiol, 2017, 143: 306-311. DOI:10.1016/j.pestbp.2016.11.001 |
 2019, Vol. 21
2019, Vol. 21