多主棒孢霉Corynespora cassiicola是危害草莓的新型病原真菌,目前仅在中国河南省郑州市发现该病菌危害草莓[1]。该病发病初期在草莓叶片上形成小而圆的淡褐色斑点,病斑7 d内可从直径10 mm扩大到20 mm,形成黄色晕圈,在潮湿的环境中,病斑叶片的表面可以发现棕色的分生孢子[1],最终导致整个叶片枯死,对草莓产业的发展存在很大威胁。
已有研究表明,多主棒孢霉C. cassiicola是一种世界性分布的真菌病害[2],除危害草莓外,还可危害多种作物,寄主范围广泛,如:可侵染黄瓜 Cucumis sativus[3-9]、烟草 Nicotiana tabacum L.[10]、苦荬菜 Ixeris polycephala[11]、长寿花 Kalanchoe blossfeldiana[5]、单叶蔓荆 Vitex rotundifolia[12]、生菜 var. ramosa Hort.[13]、棉花 Gossypium spp.[14]、金银花 Lonicera japonica Thunb.[15]、甘薯 Dioscorea esculenta (Lour.) Burkill[16]和蓝莓 Vaccinium spp.[17]等。目前化学防治是控制该病害的主要手段,但在中国的草莓生产中登记用于防治该病害的药剂仍为空白,因此亟待筛选出有效的防治药剂。
笔者对采自山东省诸城市草莓叶斑病发病叶片上的病原菌进行了分离及鉴定,并选用已在草莓上登记用于防治其他真菌病害的3种药剂戊唑醇、嘧菌酯和苯醚甲环唑和并未在草莓上登记、但具有不同作用机制和作用方式的5种常用杀菌剂,以及1种新型杀菌剂双苯菌胺共9种杀菌剂为供试药剂,测定了其对草莓棒孢叶斑病的毒力,初步筛选出毒力较高的药剂,旨在为草莓棒孢叶斑病的化学防治提供参考。
1 材料与方法 1.1 试验材料 1.1.1 供试菌株2018年从山东省诸城市采集草莓发病叶,经常规组织分离、单孢纯化[18],获得病原菌纯培养物,保存于北京农学院植物保护实验室。
1.1.2 供试培养基马铃薯葡萄糖琼脂培养基 (PDA):200 g土豆、20 g葡萄糖、18 g琼脂粉,1 000 mL水。
水琼脂 (WA) 培养基:20 g琼脂粉定容于1 000 mL水中,于121 ℃高压湿热灭菌20 min。
1.1.3 供试药剂97%咪鲜胺 (prochloraz) 原药,杭州庆丰农化有限公司;98%苯醚甲环唑 (difenoconazole) 原药,杭州宇龙农化有限公司;98.5%代森锰锌 (mancozeb) 原药,河北贺森化工有限公司;98%腈菌唑 (myclobutanil) 原药,河南中原种衣剂厂;98%百菌清 (chlorothalonil) 原药,河南省春光农化有限公司;双苯菌胺 (SYP-14288) 原药,沈阳化工研究院;97.8%氟环唑 (epoxiconazole) 原药,河南中原种衣剂厂;98.5%嘧菌酯 (azoxystrobin) 原药,江阴苏利化学有限公司;戊唑醇 (tebuconazole),江苏丰登农药有限公司。二甲基亚砜,北京化工厂;99%水杨肟酸 (SHAM),Sigma-Aldrich (用二甲基亚砜配成1.0 × 104 mg/L的母液,用于QoIs杀菌剂室内毒力测定中抑制旁路氧化途径)。
1.2 试验方法 1.2.1 供试病原菌菌株的分离与鉴定 1.2.1.1 菌株分离参考方中达[18]的方法,取草莓叶片上发病与健康交界处的组织,用灭菌的剪刀剪成直径3~5 mm大小的正方形,先用75%酒精浸泡30 s,再在质量分数为1%的次氯酸钠溶液中浸泡1~2 min,最后用无菌水洗涤3次。晾干,接种到PDA平板上于28 ℃恒温、黑暗条件下培养,3 d后挑取组织外围的菌落最边缘处生长活力最为旺盛的菌丝,转接到新的PDA平板上进行纯化,获得病原菌纯培养物。转存至PDA试管中,于4 ℃甘油中保存。
1.2.1.2 培养形态观察将分离到的全部菌株接种于PDA平板上 (9 cm皿,15 mL培养基),于28 ℃恒温、黑暗条件下培养,5 d后在菌落边缘生长状态相同的位置打取直径5 mm的菌饼。每皿接种1个菌饼于PDA平板中央,28 ℃黑暗条件下培养5~8 d,观察记录菌落的形状、颜色、气生菌丝的疏密程度以及分生孢子形状等。
1.2.1.3 致病力测定根据柯赫氏法则,将分离得到的病原菌接种到草莓叶片和果实中,以验证其致病性。将供试菌株在PDA上25 ℃黑暗培养6 d,收集分生孢子,用加入吐温-20的灭菌水为溶剂配制成浓度为106个/mL的孢子悬浮液,备用。
取新鲜的草莓叶片与果实,用自来水冲洗后进行消毒处理 (75%酒精,30 s;1%次氯酸钠,1 min;无菌水冲洗3次)。晾干,用接种针刺伤,接种菌株,每个菌株接种5个叶片和果实。以接种无菌水的叶片和果实为对照。将接种物置于灭菌WA培养基上保湿,封口后置于28 ℃培养箱中,12 h/12 h光暗交替培养,待其充分发病后进行病原菌的分离与鉴定及形态学观察。
1.2.2 菌株鉴定 1.2.2.1 基因组DNA提取采用北京博迈德生物科技有限公司提供的基因组DNA快速抽提试剂盒 (真菌) 进行病菌基因组DNA的提取。
1.2.2.2 PCR扩增和测序以真菌基因组DNA为模板,采用ITS引物ITS4和ITS5进行PCR扩增[19]。PCR反应体系为50 μL:正反向引物各1 μL,DNA模板1 μL,ddH2O 22 μL,2 × PCR Master Mix (含2 × Taq DNA Polymerase, 2 × PCR Buffer, 2 × dNTP) 25 μL。PCR扩增反应程序:95 ℃预变性30 s,95 ℃变性30 s,52 ℃退火45 s,72 ℃延伸90 s, 35个循环,72 ℃延伸10 min[20]。PCR扩增产物经1%琼脂糖凝胶电泳检测后,送北京六合华大基因科技有限公司进行测序。
1.2.2.3 系统发育分析登录GenBank网站,采用BLAST软件对测序结果以及表1中的序列进行同源性比较,以Mega6.0进行多序列比对后,以同属近源种C. smithii (HE584869.1) 作为外群,选择HKY模型,用Mrbayes的贝叶斯法构建系统发育树。以确定采集得到的菌株与已报道的菌株的同源性,分析各菌株的亲缘关系。
|
|
表 1 Corynespora cassiicola系统发育分析使用的菌株信息 Table 1 Strains information of Corynespora cassiicola that used for phylogenetic analysis |
1.2.3 供试病原菌对杀菌剂的敏感性测定
使用二甲基亚砜 (DMSO) 将供试9种杀菌剂配制成表2所示质量浓度的母液,继而稀释成不同系列质量浓度的药液,供试。采用菌丝生长速率法[21]测定9种杀菌剂对所分离得到的2个供试菌株SD18-5和SD18-8菌丝生长的抑制作用。将供试菌株接种于PDA平板上,于25 ℃、黑暗条件下预培养5 d,打取直径 5 mm的菌碟,接种于直径9 cm、含系列质量浓度杀菌剂的PDA平板上,以无药平板为对照,每处理重复3次。将平板置于25 ℃黑暗培养8 d,采用十字交叉法测量各处理的菌落直径,计算各杀菌剂不同浓度处理对病原菌菌丝生长的抑制率。以抑制率的几率值为纵坐标 (y),药剂质量浓度对数值为横坐标 (x),求出毒力回归方程 y = ax + b、相关系数 (r) 和药剂的有效抑制中浓度 (EC50,μg/mL)。
|
|
表 2 供试杀菌剂母液及系列质量浓度 Table 2 Initial concentration and series dilution concentrations of the fungicides |
2 结果与分析 2.1 病原菌菌株形态观察与致病力
研究结果表明:在PDA培养基上的菌落正面颜色为灰色至灰黑色,棉絮状(图1a),背面颜色以灰黑色为主 (图1b)。分生孢子透明,呈棒状,一端略细,直径为 (22.3~29.7) μm × (6.5~8.4) μm (图1c)。将该病原菌接种到草莓叶片后,3 d左右叶片变黑,出现浅灰色霉层,菌丝较多 (图1d);接种草莓果实后,3~4 d可见褐色病斑,表面菌丝白色到浅灰色 (图1e)。根据形态学观察初步鉴定病原菌为疑似多主棒孢霉Corynespora cassiicola (Berk. & M.A. Curtis) C.T. Wei [1]。

|
a:菌落形态正面图;b:菌落形态背面图;c:分生孢子;d:接种草莓叶片;e:接种草莓果实。 a: frontal view of colony morphology; b: back view of colony morphology; c: the conidia of C. cassiicola; d: the pathogenicity of C. cassiicola on strawberry leaves; e: the pathogenicity of C. cassiicola on strawberry fruits. 图 1 C. cassiicola菌落形态、致病性以及分生孢子图 Fig. 1 The symptoms of colony morphology, pathogenicity, and conidia of C. cassiicola |
2.2 系统发育分析
采用1.2.2.2所述的方法,以病原菌株SD18-5和SD18-8的基因组DNA为模板,PCR扩增rDNA-ITS片段并测序,分别获得长度为569 bp和567 bp的序列。分别将序列提交GeneBank (NCBI),获得基因登录号 (MK294544.1) 和 (MK294545.1)。利用ITS基因,基于HKY模型,以C. smithii (HE584869.1) 为外群基因对不同品系 (包括本研究得到的分离株) 进行了贝叶斯法建树。标尺值为0.6,病原菌与C. cassiicola聚于一个分支上,因此,可以从系统发育学上确定病原菌SD18-5和SD18-8为C. cassiicola(图2)。
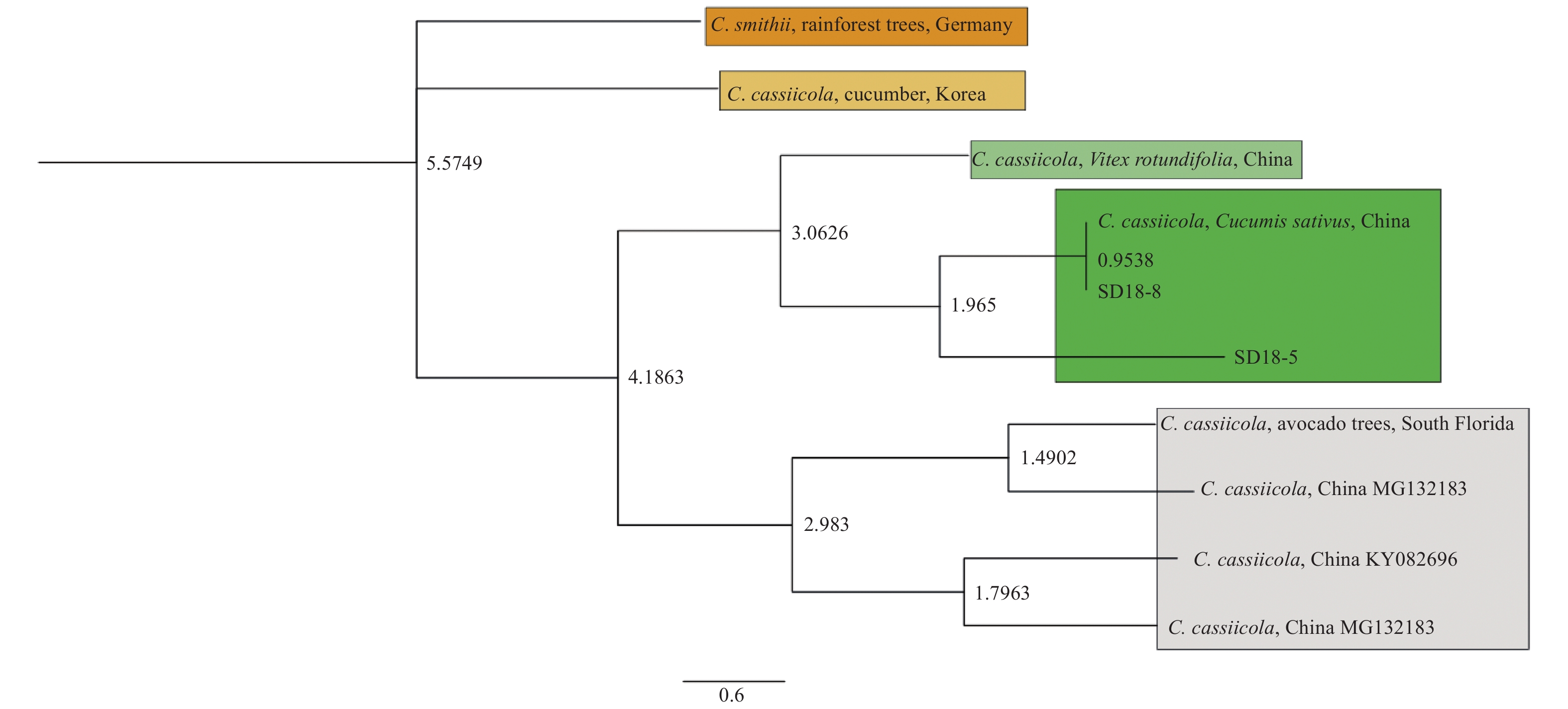
|
图 2 基于rDNA-ITS序列构建C. cassiicola系统发育树 Fig. 2 Construction of C. cassiicola phylogenetic tree based on rDNA-ITS sequences of C. cassiicola strains SD18-5, SD18-8 and their related species |
2.3 供试杀菌剂对多主棒孢霉的毒力
结果(表 3)表明:在供试的9种杀菌剂中,双苯菌胺对菌株SD18-5和SD18-8的毒力最强,平均EC50值为 (0.27 ± 0.18) μg/mL;其次为氟环唑、腈菌唑、咪鲜胺和苯醚甲环唑,平均EC50值在0.66~1.8 μg/mL之间;嘧菌酯和戊唑醇的毒力一般,百菌清与代森锰锌的毒力较低。
|
|
表 3 9种杀菌剂对多主棒孢霉菌株SD18-5和SD18-8 的毒力 Table 3 Toxicities of nine fungicides to C. cassiicola strains SD18-5 and SD18-8 |
3 结论与讨论
2016年在河南省郑州市首次发现由多主棒孢霉C. cassiicola引起的草莓棒孢叶斑病,也是中国草莓 Fragaria × ananassa上发现的一种新病害[1]。较之已报道的草莓棒孢叶斑病病菌的鉴定方法[1],本研究采用系统发育分析的方法,结合致病性测定和形态学分析,确定了采自山东省诸城市的菌株SD18-5和SD18-8为多主棒孢霉C. cassiicola。该病原菌寄主广泛,给防治带来困难。该病的田间发病症状与草莓褐色叶斑病和炭疽病非常相似,易混淆,容易造成药不对症贻误防治适期,从而导致防治效果不理想。此外,中国草莓的种植面积和年产量均位居世界首位,为了提高经济效益,生产中会将草莓与其他作物进行间作、套种及轮作,如草莓与果树的间作,与蔬菜、中草药等作物的套种,与水稻、西瓜等水果的轮作等,因此防治由多主棒孢霉引起的草莓棒孢叶斑病在农业生产中具有重要意义。
目前中国已登记用于草莓真菌病害防治的药剂主要成分为甲氧基丙烯酸酯类的嘧菌酯和肟菌酯、三唑类的戊唑醇和苯醚甲环唑以及琥珀酸脱氢酶抑制剂类 (SDHIs) 的氟吡菌酰胺等,但尚无用于防治草莓棒孢叶斑病的药剂,也未见相关的报道。因此,本研究选择了几种登记药剂和常用杀菌剂以及新型杀菌剂双苯菌胺为供试药剂,来比较其对草莓棒孢叶斑病的毒力。室内毒力测定结果表明,在所选取的9种供试杀菌剂中,双苯菌胺对多主棒孢霉的菌丝生长具有很强的抑制作用,可作为草莓棒孢叶斑病化学防治的首选药剂。双苯菌胺是由沈阳化工研究院创制的新型杀菌剂,具有低毒、高效、广谱的特点[22],其作用机制主要为解偶联作用[23],作用方式主要为保护作用,不具有明显的治疗作用,持效期较短[24],建议在病害发生之前提前使用。目前,双苯菌胺对不同病害的防治研究已有报道,如其对黄瓜霜霉病、黄瓜炭疽病、油菜菌核病和桃褐腐病防治效果较好[24-26],显示出较好的市场前景。关于其抗性方面,侯燕华等采用室内药剂驯化的方法获得了辣椒疫霉对双苯菌胺的抗性突变体,但未发现田间抗性菌株[27]。考虑到单一农药长期大量施用,易使病原菌产生抗药性,因此建议其应该与多种作用机制不同的药剂轮换施用。
本研究结果表明,三唑类药剂腈菌唑、氟环唑、苯醚甲环唑以及咪唑类药剂咪鲜胺对多主棒孢霉C. cassiicola也具有很好的抑制活性,其作用机制是抑制麦角甾醇生物合成,兼具保护和治疗作用[28],由于它们与双苯菌胺具有不同的作用机制和作用方式,故均可作为草莓棒孢叶斑病防治的备选药剂,并与双苯菌胺轮换使用。值得注意的是,由于本研究仅进行了室内毒力测定,所得结果并不能代表药剂在田间的实际应用效果,而药剂的作用方式和内吸传导活性等因素均会影响其在田间的实际应用效果,因此,本研究结果还需进一步通过田间试验加以验证,以更准确地指导草莓病害的实际防控。
| [1] |
ZHANG M, MA Q Z, ZHAI N P, et al. Occurrence of outbreak of leaf spot caused by Corynespora cassiicola in strawberry in China
[J]. Plant Dis, 2018, 102(10): 2037. |
| [2] |
DIXON L J, SCHLUB R L, PERNEZNY K, et al. Host specialization and phylogenetic diversity of Corynespora cassiicola
[J]. Phytopathology, 2009, 99(9): 1015-1027. DOI:10.1094/PHYTO-99-9-1015 |
| [3] |
李长松, 张眉, 李林, 等. 山东省黄瓜棒孢叶斑病(褐斑病)病原菌鉴定和防治[J]. 中国蔬菜, 2009, 1(18): 29-33. LI C S, ZHANG M, LI L, et al. Identification of cucumber target leaf spot (brown spot) pathogen and its control[J]. China Vegetables, 2009, 1(18): 29-33. |
| [4] |
禾丽菲, 李晓旭, 朱佳美, 等. 不同杀菌剂对黄瓜靶斑病菌的毒力作用特性比较[J]. 农药学学报, 2018, 20(1): 25-32. HE L F, LI X X, ZHU J M, et al. Comparison of toxicity properties of different types of fungicides against Corynespora cassiicola on cucumber [J]. Chin J Pestic Sci, 2018, 20(1): 25-32. |
| [5] |
KWON M K, KANG B R, CHO B H, et al. Occurrence of target leaf spot disease caused by Corynespora cassicola on cucumber in Korea
[J]. Plant Pathol, 2003, 52(3): 424. DOI:10.1046/j.1365-3059.2003.00846.x |
| [6] |
蓝国兵, 谭耀华, 何自福, 等. 黄瓜褐斑病(Corynespora cassiicola)在广东首次报道
[J]. 植物保护, 2012, 38(5): 197-200. LAN G B, TAN Y H, HE Z F, et al. First report of Cucumis sativus brown spot disease infected by Corynespora cassiicola in Guangdong Province [J]. Plant Prot, 2012, 38(5): 197-200. DOI:10.3969/j.issn.0529-1542.2012.05.043 |
| [7] |
杜玉宁, 查仙芳, 杨金凤, 等. 宁夏温室黄瓜新病害靶斑病的药剂筛选[J]. 江苏农业科学, 2013, 41(1): 132-133. DU Y N, ZHA X F, YANG J F, et al. Screening of Corynespora cassiicola on cucumber in greenhouse of Ningxia [J]. Jiangsu Agricultural Sciences, 2013, 41(1): 132-133. DOI:10.3969/j.issn.1002-1302.2013.01.050 |
| [8] |
杨双娟, 顾兴芳, 张圣平, 等. 黄瓜棒孢叶斑病(Corynespora cassiicola)的研究概况
[J]. 中国蔬菜, 2012, 1(4): 1-9. YANG S J, GU X F, ZHANG S P, et al. Research progress on cucumber target leaf spot (Corynespora cassiicola) [J]. China Vegetables, 2012, 1(4): 1-9. |
| [9] |
张乃楼, 李亚美, 康文强, 等. 辽宁省黄瓜靶斑病菌对苯醚甲环唑和戊唑醇的敏感性[J]. 农药学学报, 2014, 16(4): 452-456. ZHANG N L, LI Y M, KANG W Q, et al. Sensitivity of Corynespora cassiicola to difenoconazole and tebuconazole in Liaoning Province [J]. Chin J Pestic Sci, 2014, 16(4): 452-456. DOI:10.3969/j.issn.1008-7303.2014.04.13 |
| [10] |
张中义, 李继新, 关国经, 等. 烤烟棒孢霉叶斑病病原菌鉴定[J]. 中国烟草学报, 2008, 14(6): 44-47. ZHANG Z Y, LI J X, GUAN G J, et al. Identification of fungal pathogen of corynespora leaf spot in flue-cured tobacco [J]. Acta Tabacaria Sinica, 2008, 14(6): 44-47. DOI:10.3321/j.issn:1004-5708.2008.06.009 |
| [11] |
XUE L H, LIU Y, LI C J. First report of leaf spot caused by Corynespora cassiicola on Ixeris polycephala in China
[J]. Plant Dis, 2017, 101(8): 1552. |
| [12] |
YEH Y H, KIRSCHNER R. First report of Corynespora leaf spot on Vitex rotundifolia caused by Corynespora cassiicola in Taiwan
[J]. Plant Dis, 2017, 101(8): 1550. |
| [13] |
BAIYEE B, PORNSURIYA C, ITO S I, et al. Trichoderma spirale T76-1 displays biocontrol activity against leaf spot on lettuce (Lactuca sativa L.) caused by Corynespora cassiicola or Curvularia aeria
[J]. Biol Control, 2019, 129: 195-200. DOI:10.1016/j.biocontrol.2018.10.018 |
| [14] |
BUTLER S, YOUNG-KELLY H, RAPER T, et al. First report of target spot caused by Corynespora cassiicola on cotton in Tennessee
[J]. Plant Dis, 2016, 100(2): 535. |
| [15] |
HUANG X, ZHENG X, XU J, et al. First report of brown leaf spot on honeysuckle caused by Corynespora cassiicola in China
[J]. Plant Dis, 2016, 100(11): 2326. |
| [16] |
XU J, QI X, ZHENG X. First report of Corynespora leaf spot on sweet potato caused by Corynespora cassiicola in China
[J]. Australasian Plant Disease Notes, 2016, 100(10): 2163. |
| [17] |
ONOFRE R B, MERTELY J C, AGUIAR F M, et al. First report of target spot caused by Corynespora cassiicola on blueberry in North America
[J]. Plant Dis, 2016, 100(2): 528-529. |
| [18] |
方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 427. FANG Z D. Plant disease research methods[M]. Beijing: China Agriculture Press, 1998: 427. |
| [19] |
宋玉. 拟盘多毛孢属(Pestalotiopsis)真菌系统学研究及条形码基因的评价[D]. 贵阳: 贵州大学, 2015. SONG Y. Taxonomy of the genus Pestalotiopsis and evaluation of its DNA barcoding[D]. Guiyang: Guizhou University, 2015. |
| [20] |
WHITE T J, BRUNS T, LEE S, et al. 38 amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J]. Pcr Protoc, 1990, 315-322. |
| [21] |
慕立义. 植物化学保护研究方法[M]. 北京: 中国农业出版社, 1994: 76-81. MU L Y. Research methods of chemical plant protection[M]. Beijing: China Agriculture Press, 1994: 76-81. |
| [22] |
倪笑霞. 双苯菌胺的抑菌谱及其对辣椒疫霉的作用机制研究[D]. 北京: 中国农业大学, 2013. NI X X. Study on the antifungal spectrum and the mode of action of the novel fungicide SYP-14288 to Phytophthora capsici [D]. Beijing: China Agricultural University, 2013. |
| [23] |
WANG Z W, NI X X, PENG Q, et al. The novel fungicide SYP-14288 acts as an uncoupler against Phytophthora capsici
[J]. Pestic Biochem Physiol, 2018, 147: 83-89. DOI:10.1016/j.pestbp.2018.01.014 |
| [24] |
兰杰, 司乃国, 李志念, 等. SYP-14288与百菌清、代森锰锌生物活性的比较[J]. 农药, 2012, 51(12): 927-928. LAN J, SI N G, LI Z N, et al. Comparative of the biological activities of SYP-14288, chlorothalonil and mancozeb[J]. Agrochemicals, 2012, 51(12): 927-928. |
| [25] |
兰杰, 陈宣明, 司乃国, 等. 双苯菌胺对菌核病生物活性及田间应用技术研究[M]//中国植物病害化学防治研究: 第9卷, 2014: 51-57. LAN J, CHEN X M, SI N G, et al. The lab and field efficacy of SYP-14288 against cucumber downy mildew[M]//Chemical control of plant diseases in China: Vol. 9, 2014: 51-57. |
| [26] |
兰杰, 李志念, 司乃国, 等. SYP-14288 室内生物活性对黄瓜霜霉田间药效研究[C]//中国化工学会农药专业委员会第十五届年会论文集, 2012: 391-397. LAN J, LI Z N, SI N G, et al. The lab and field efficacy of SYP-14288 against cucumber downy mildew[C]//Proceedings of the 15th annual meeting of the pesticide professional committee of the Chinese chemical society, 2012: 391-397. |
| [27] |
侯燕华, 彭钦, 方媛, 等. 辣椒疫霉对双苯菌胺抗性风险评估[C]. 中国植物病理学会 2015 年学术年会论文集. 北京: 中国农业科学技术出版社, 2015: 122. HOU Y H, PENG Q, FANG Y, et al. The resistance risk of Phytophthora capsici to SYP-14288[C]//Proceedings of the annual meeting of Chinese Society of Plant Pathology in 2011. Beijing: China Agricultural Science and Technology Press, 2015: 122. |
| [28] |
王佳韵, 张一宾. 全球三唑类杀菌剂的市场概况及发展趋势[J]. 农药, 2017, 56(2): 86-87. WANG J Y, ZHANG Y B. Market and development tendency of global triazole fungicides[J]. Agrochemicals, 2017, 56(2): 86-87. |
 2019, Vol. 21
2019, Vol. 21


