三七Panax notoginseng为中国名贵的中药材,属于典型的多年阴生植物,其生长环境的特殊性导致其在整个栽培过程中极易爆发多种病害[1]。其中,由槭菌刺孢Mycocentrospora acerina (R. Hartig) Deighton引起的三七圆斑病是三七栽培过程中严重发生的叶部病害之一,如遇连续阴雨天气,槭菌刺孢会随雨水传播,可造成三七园大面积的损失,甚至毁园[2-3]。目前生产上对三七圆斑病仍以化学防治为主,主要防治药剂有氟硅唑、代森锰锌、碱式硫酸铜、咪鲜胺和嘧菌酯等[4]。杀菌剂能够快速有效地防治病害,但是长期不合理使用将会影响三七的品质及使药剂防病效果下降。近年来,随着三七种植产区的扩大,三七圆斑病也受到越来越多的关注[5-6],但至今尚未见有关槭菌刺孢对常用防治药剂敏感性的研究报道。
鉴于此,笔者采用菌丝生长速率法测定了从云南省5个三七主要产区采集的34个槭菌刺孢菌株对生产上常用的嘧菌酯、咪鲜胺和苯醚甲环唑的敏感性,并对菌株敏感性频率分布及生存适合度进行了分析。
1 材料及方法 1.1 供试菌株的采集与分离于2017年8月从云南省5个三七主要产区红河州、澜沧县、昆明市、曲靖市及文山州部分乡镇(表1)的三七栽培大棚中随机摘取具有典型圆斑病症状的病叶,选择病、健交界部位,用自来水清洗后于75%的酒精中浸泡2~3 min,并以无菌水冲洗3次,置于灭菌滤纸上吸干水分。将其置于马铃薯葡萄糖琼脂(PDA)培养基平板上于20 ℃下全光照培养[7]。参照龙月娟等的方法对病原菌进行纯化鉴定[8-9],共分离到34个菌株,于4 ℃冰箱保存,备用。
|
|
表 1 槭菌刺孢菌株来源 Table 1 Strain origins of Mycocentrospora acerina |
1.2 供试杀菌剂
97%咪鲜胺(prochloraz)、96%苯醚甲环唑(difenoconazole)和95%嘧菌酯(azoxystrobin)原药由中国农业大学植物保护学院杀菌剂药理学和抗药性实验室提供,采用丙酮配制成1 × 102 mg/L的母液,备用。
1.3 槭菌刺孢对3种杀菌剂的敏感性测定采用菌丝生长速率法[10]。使用时根据培养基体积换算后加入相应体积的母液,分别得到质量浓度为0.5、1.0、1.5、2.0和3.0 mg/L的带药平板。以加入等浓度丙酮的PDA平板作为空白对照。于菌落边缘打取5 mm菌饼,置于带药平板中央,并于20 ℃、全光照条件下培养,4 d后测量菌落直径。以药剂质量浓度的对数为横坐标、抑制率的几率值为纵坐标,计算得到毒力回归方程及有效抑制中浓度(EC50)值。
1.4 不同地区槭菌刺孢对3种杀菌剂的敏感性分布分析根据药剂对不同菌株的EC50值将菌株分为5个区间:EC50值在0~0.5 mg/L、> 0.5~1.0 mg/L、> 1.0~1.5 mg/L、> 1.5~2.0 mg/L、> 2.0~2.5 mg/L,测定来自不同产区的槭菌刺孢菌株在不同区间的分布频率,比较各地槭菌刺孢对不同杀菌剂的敏感性差异。
1.5 供试菌株生长速率测定于纯化后的供试菌株菌落边缘打取直径5 mm的菌饼,置于PDA平板上,于20 ℃、全光照条件下培养5 d。每24 h测定一次菌落直径,按公式(1)和(2)计算菌株生长速率(R)[9],每个菌株4次重复。进而分析菌丝生长速率(R)与药剂敏感性之间的相关性。
| $ G = {d_1} - {d_2} $ | (1) |
| $ R = G/(2 \times N) $ | (2) |
式中:G为菌丝纯生长量,mm;d1为菌落平均直径,mm;d2为菌饼直径,mm;R为菌丝生长速率,mm/d;N为培养天数。
1.6 槭菌刺孢致病力差异比较选取长势一致的一年生三七叶片,于75%的酒精中浸泡1~2 min,用无菌水冲洗2次,置于铺有湿润滤纸的培养皿中。在纯化后的菌落边缘打取5 mm的菌饼,倒扣于已消毒的三七叶片上,置于20 ℃、全光照、相对湿度75%条件下培养。每个菌株接种10片三七叶片,重复3次。5 d后观察发病情况,采用十字交叉法测量病斑直径(d)。根据病斑直径对发病情况进行定级[9, 11]:d = 0 cm为0级;0 cm < d ≤ 0.5 cm为1级;0.5 cm < d ≤ 1 cm为2级;1 cm < d ≤ 1.5 cm为3级;1.5 cm < d ≤ 2 cm为4级;d > 2 cm为5级,按(3)式计算病情指数( I)。数据用于分析菌株致病力与菌丝生长速率、药剂敏感性之间的关系。
| $ I = 100 \times \sum \left( {{N_1} \times S} \right)/\left( {{N_2} \times {S_1}} \right) $ | (3) |
式(3)中:N1为各级病叶数,S为各定级代表值,N2为调查总叶数,S1为最高级代表值。
1.7 数据处理数据均采用SPSS18.00及Excel 2007进行分析。
2 结果与分析 2.1 34株槭菌刺孢对3种杀菌剂的敏感性频率分布从云南省的三七主要产区共采集分离到34株槭菌刺孢菌株。敏感性测定结果表明:嘧菌酯、咪鲜胺和苯醚甲环唑对34株槭菌刺孢菌株的EC50值分别介于0.18~2.36、0.03~1.91和0.45~2.15 mg/L之间。供试菌株对嘧菌酯的敏感性主要分布于EC50值0.4~1.2 mg/L之间,其中EC50值在0.4~0.6和1.0~1.2 mg/L两个区间的菌株分布频率分别达到29.41%和17.64%(图1A);大多数菌株对咪鲜胺具有较高的敏感性,EC50值在0.03~0.45 mg/L之间,占供试菌株的91%(图1B)。供试菌株对苯醚甲环唑较为敏感,其EC50值主要分布于0.5~1.05 mg/L之间,菌株分布频率达91.17%,其中EC50值在0.95~1.05 mg/L间的菌株分布出现峰值,占26.47%(图1C)。综合分析可知,供试34株槭菌刺孢菌株对咪鲜胺的敏感性高于对嘧菌酯和苯醚甲环唑。
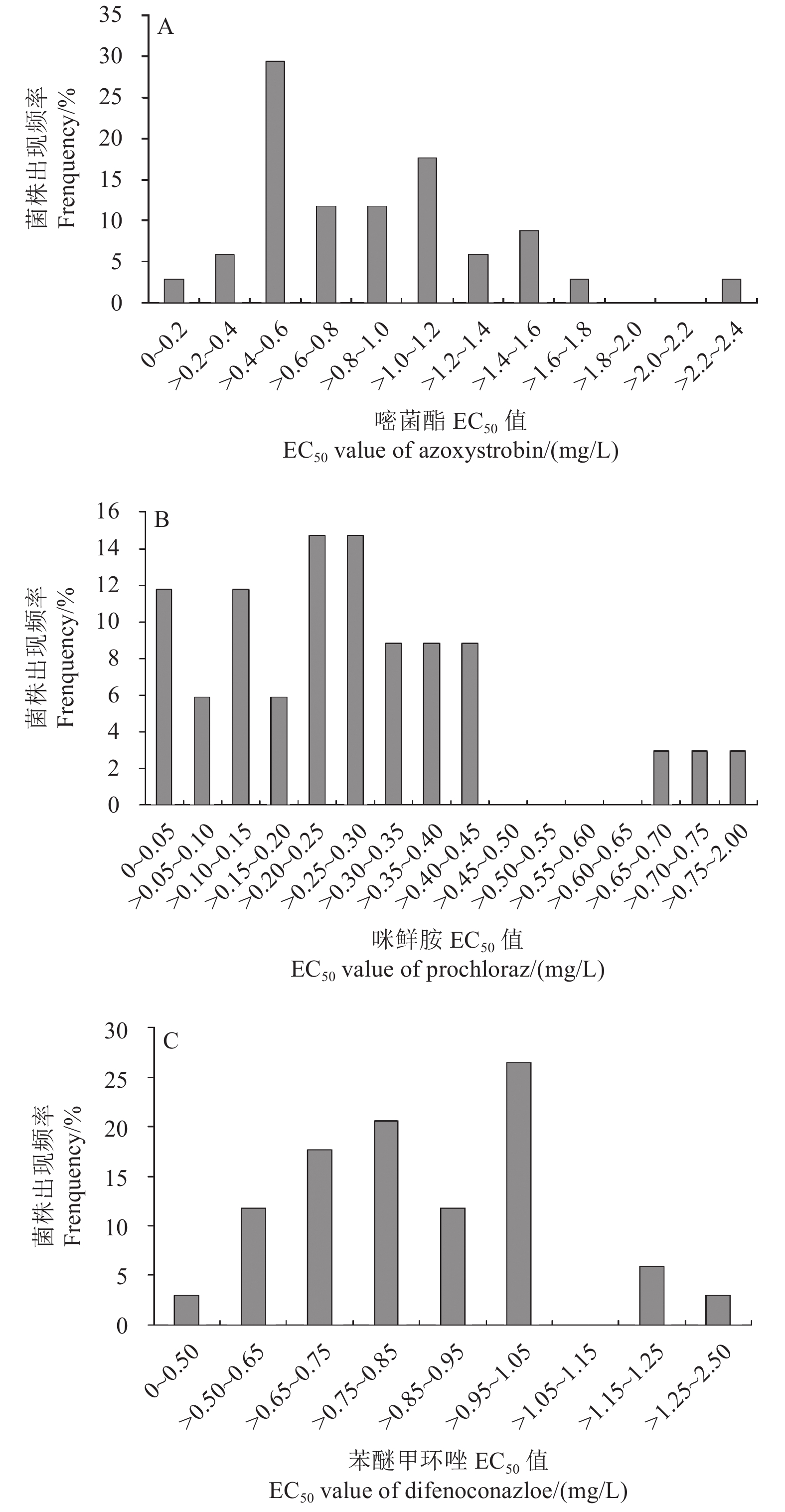
|
图 1 槭菌刺孢对嘧菌酯(A)、咪鲜胺(B)和苯醚甲环唑(C)的敏感性频率分布 Fig. 1 Frequency distribution of EC50 values of azoxystrobin (A), prochloraz (B) and difenoconazole (C) to M. acerina |
2.2 不同三七产区槭菌刺孢菌株对3种杀菌剂的敏感性分布
采集自不同地区的槭菌刺孢菌株对3种杀菌剂的敏感性分布存在较大差异(表2),其中对嘧菌酯的敏感性分布范围较广:由云南文山和澜沧采集的菌株对嘧菌酯最为敏感,EC50值均集中在0~0.5 mg/L之间;红河的菌株对嘧菌酯的敏感性较低,EC50值在2.0~2.5 mg/L之间的菌株为50%。供试菌株对咪鲜胺的敏感性较高,EC50值集中在0~2.0 mg/L之间。昆明采集的菌株对咪鲜胺的敏感性存在分化现象,50%菌株EC50值分布在2.0~2.5 mg/L之间。苯醚甲环唑对所有供试菌株的EC50值均低于2.0 mg/L,其中红河的菌株对苯醚甲环唑表现出极高的敏感性,EC50值均低于0.5 mg/L。
|
|
表 2 不同三七产区槭菌刺孢对嘧菌酯、咪鲜胺和苯醚甲环唑的敏感性分布 Table 2 Frequency distribution of EC50 values of azoxystrobin, prochloraz and difenoconazole toM. acerina isolated from different producing areas of Panax notoginseng |
2.3 供试菌株生长速率与其对药剂敏感性的关系
菌株生长速率测定结果(图2)表明,在PDA培养基上培养5 d后槭菌刺孢各菌株菌落的生长速率间存在显著性差异(P < 0.05),分布在2.29~5.62 mm/d之间。菌株生长速率与其对嘧菌酯( R2 = 0.057 9)、咪鲜胺(R2 = 0.026 2)和苯醚甲环唑(R2 < 0.001)的敏感性之间无显著相关性( P > 0.05)。
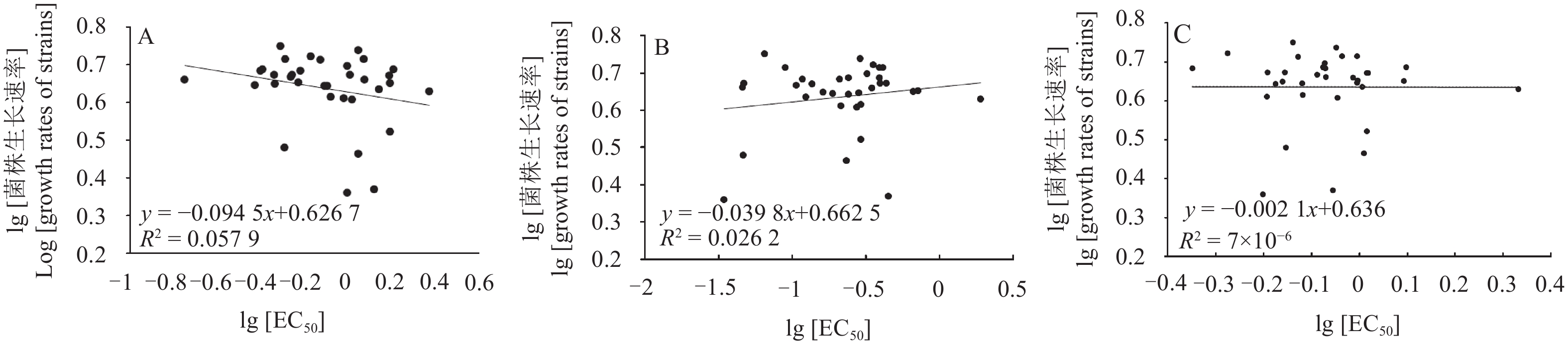
|
图 2 槭菌刺孢对嘧菌酯(A)、咪鲜胺(B)和苯醚甲环唑(C)的敏感性与菌落生长速率相关性分析 Fig. 2 The correlation analysis of colony growth rate of M. acerina and fungicide sensitivities to azoxystrobin (A), prochloraz (B) and difenoconazole (C) |
2.4 供试菌株致病力与其对药剂敏感性的关系
菌株致病性测定结果(图3)表明,供试菌株均为致病菌株,但致病能力存在显著差异(P < 0.05)。叶片接种病原菌7 d后,三七圆斑病病情指数可高达80%~99.33%。供试菌株的致病力与其对嘧菌酯( R2 = 0.004 5)、咪鲜胺(R2 = 0.002 6)和苯醚甲环唑(R2 = 0.003 9)的敏感性之间无显著相关性。

|
图 3 槭菌刺孢对嘧菌酯(A)、咪鲜胺(B)和苯醚甲环唑(C)的敏感性与菌株致病力相关性分析 Fig. 3 The correlation analysis of disease index of M. acerina and fungicide sensitivityies to azoxystrobin (A), prochloraz (B) and difenoconazole (C) |
2.5 供试菌株生长速率与致病力之间的关系
不同供试菌株的生长速率与致病力分别表现出显著性差异(P < 0.05),但生长速率与致病力之间并无显著相关性( R2 = 0.143 2)(图4)。
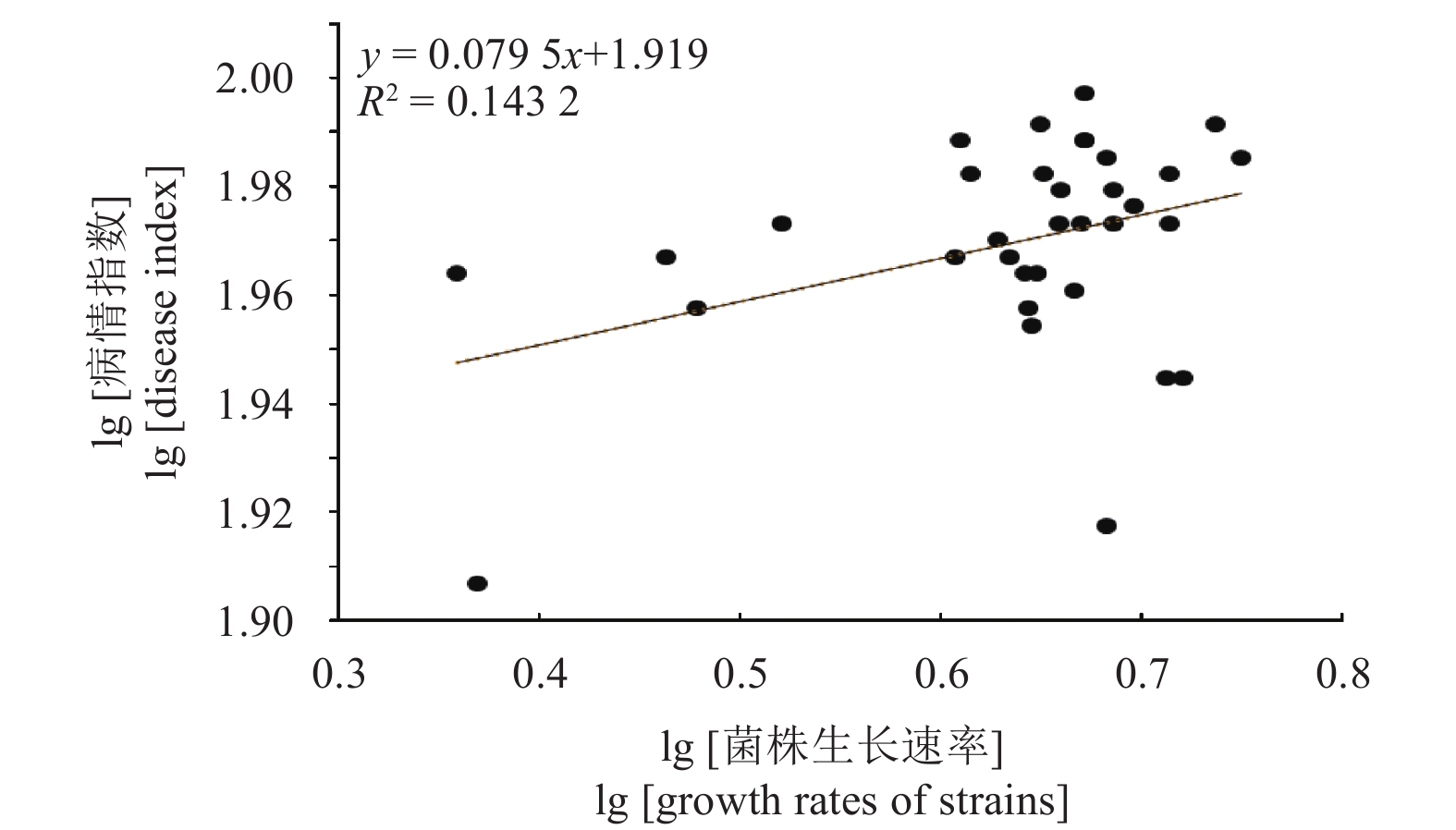
|
图 4 槭菌刺孢菌株生长速率与致病力相关性分析 Fig. 4 The correlation analysis of pathogenicity and growth rate of M. acerina strain |
3 结论与讨论
嘧菌酯、咪鲜胺和苯醚甲环唑均为高效、广谱性的杀菌剂,能够有效抑制植物病原菌的侵染及病害的发展蔓延,对由子囊菌、担子菌、半知菌等引起的叶部病害具有优异的防效[12-14]。杀菌剂的不合理使用极易使病原菌产生抗药性。生产上已经发现系列病原菌,如葡萄霜霉菌Plasmopara viticola、马铃薯晚疫病菌Phytophthora infestans、黄瓜霜霉病菌Pseudoperonospora cubensis及小麦白粉病菌Blumeria graminis f. sp. tritici等植物病原菌对嘧菌酯产生了中等或较高水平的抗药性[15-18];栗疫病菌Endothia parasitica及番茄灰霉病菌Botrytis cinera对苯醚甲环唑产生了低水平抗性[19-20]。咪鲜胺在田间使用时鲜见出现抗性菌株,但是在防治芒果炭疽病Colletotrichum gloeosporioides和黄瓜枯萎病Fusarium oxysporum f.sp.cucumerinum时却存在潜在的抗药性风险[21]。本研究发现,槭菌刺孢对嘧菌酯、咪鲜胺和苯醚甲环唑的敏感性不同。虽然供试菌株中未发现对这3种药剂产生中、高抗药性的菌株,但是在云南红河、昆明产区已出现对嘧菌酯和咪鲜胺敏感性降低的菌株,预示着抗药性风险的存在。
本研究通过比较云南不同三七产区槭菌刺孢菌株对3种杀菌剂的敏感性分布发现,不同地区槭菌刺孢菌株对3种药剂的敏感程度存在差异,其中曲靖的菌株在药剂各浓度区间均有分布,而昆明等其余4个产区的菌株对3种药剂均表现出较低的敏感性。值得注意的是,尽管大多数供试菌株对咪鲜胺最为敏感,但是也有部分菌株对其的敏感性降低,说明不同地区用药水平不同可引起病原菌对杀菌剂的敏感性发生变化。生产上应密切监测不同地区槭菌刺孢菌株对这3种药剂的敏感性变异情况。本研究结果还表明,供试菌株的致病力与菌丝生长速率之间并无显著相关性,其原因可能是菌丝生长的调控基因与致病性基因并不相同或二者间不存在协同作用[22-23],同时说明菌株具有较高的生存适合度。
综上所述,嘧菌酯、咪鲜胺和苯醚甲环唑可作为生产上三七圆斑病的高效防治药剂,但应科学合理轮换或交替使用这3种杀菌剂,以延长杀菌剂的使用年限,避免抗药性菌株的产生。
| [1] |
张连娟, 高月, 董林林, 等. 三七主要病害及其防治策略[J]. 世界科学技术-中医药现代化, 2017, 19(10): 1635-1640. ZHANG L J, GAO Y, DONG L L, et al. Major diseases of Panax notoginseng and their control strategies [J]. Mod Tradit Chin Med Materia Medical-World Sci Technol, 2017, 19(10): 1635-1640. |
| [2] |
蒋妮, 覃柳燕, 叶云峰. 三七病害研究进展[J]. 南方农业学报, 2011, 42(9): 1070-1074. JIANG N, QIN L Y, YE Y F. Research advances in diseases of Panax notoginseng [J]. J Southern Agric, 2011, 42(9): 1070-1074. DOI:10.3969/j.issn.2095-1191.2011.09.010 |
| [3] |
陆宁, 陈昱君, 鲁海菊, 等. 三七圆斑病病原菌生物学特性研究[J]. 云南农业大学学报, 2005(2): 193-195. LU N, CHEN Y J, LU H J, et al. Biological characterization of round spot pathogen on Panax notoginseng [J]. J Yunnan Agric Univ, 2005(2): 193-195. DOI:10.3969/j.issn.1004-390X.2005.02.009 |
| [4] |
张燕, 马娇, 荣建文, 等. 400 g/L 氟硅唑乳油对三七圆斑病的田间药效及安全性试验[J]. 农药科学与管理, 2017, 38(3): 58-62. ZHANG Y, MA J, RONG J W, et al. Efficacy and crop safety of 400 g/L fluorosilazole EC against round spot of Panax notoginseng [J]. Pestic Sci Admin, 2017, 38(3): 58-62. DOI:10.3969/j.issn.1002-5480.2017.03.011 |
| [5] |
毛忠顺, 魏富刚, 陈中坚, 等. 云南省三七圆斑病发生情况调查[J]. 文山学院学报, 2017, 30(3): 1-5. MAO Z S, WEI F G, CHEN Z J, et al. Field investigation of round spot on sanqi (Panax notoginseng) in Yunnan Province [J]. J Wenshan Univ, 2017, 30(3): 1-5. DOI:10.3969/j.issn.1674-9200.2017.03.001 |
| [6] |
凌春耀, 林伟国, 余生, 等. 三七侵染性病害防治工作的研究进展[J]. 绿色科技, 2017(7): 144-146. LING C Y, LIN W G, YU S, et al. Research advances on prevention and control work of infectious diseases of Panax notoginseng [J]. J Green Sci Technol, 2017(7): 144-146. |
| [7] |
戴蕾, 徐玉龙, 龙月娟, 等. 槭菌刺孢菌丝及分生孢子的生长习性研究[J]. 云南农业大学学报 (自然科学版), 2017, 32(1): 27-35. DAI L, XU Y L, LONG Y J, et al. The growth characteristic of mycelia and conidia for Mycocentrospora acerina [J]. J Yunnan Agric Univ (Nat Sci Ed), 2017, 32(1): 27-35. |
| [8] |
ELLIS M B. More Dematiaceous hyphomycetes[J]. Mycologia, 1977, 69(2): 439. |
| [9] |
龙月娟. 三七圆斑病的病原菌致病机制及避雨栽培对其控制效果与原理[D]. 云南农业大学, 2016. LONG Y J. Pathogenic mechanism of Mycocentrospora acerina, and the efficacy and principles of rain-proof cultivation on Panax notoginseng round spot disease control[D]. Yunnan Agric Univ, 2016. |
| [10] |
QUIROGA E N, SAMPIETRO A R, VATTUONE M A. Screening antifungal activities of selected medicinal plants[J]. J Ethnopharm, 2001, 74(1): 89-96. DOI:10.1016/S0378-8741(00)00350-0 |
| [11] |
杨婷, 杨宽, 何迟, 等. 三七黑斑病病原菌Alternaria alternata Keissl. 生物学特性研究
[J]. 中药材, 2018, 41(4): 763-770. YANG T, YANG K, HE C, et al. Biological characteristics of Alternaria alternata Keissl. causing dark speckle of Panax notoginseng [J]. J Chinese Med Mat, 2018, 41(4): 763-770. |
| [12] |
董克锋, 岳清华, 高勇, 等. 蓝莓拟茎点霉枝枯病药剂防治试验[J]. 中国森林病虫, 2015, 34(06): 44-46. DONG K F, YUE Q H, GAO Y, et al. Fungicidal test against Phomopsis twig blight of blueberry [J]. Forest Pest Dis, 2015, 34(06): 44-46. DOI:10.3969/j.issn.1671-0886.2015.06.012 |
| [13] |
ZHANG X, CHEN Y, ZHANG Y J, et al. Occurrence and molecular characterization of azoxystrobin resistance in cucumber downy mildew in Shandong Province of China[J]. Phytoparasitica, 2008, 36(2): 136-143. DOI:10.1007/BF02981326 |
| [14] |
黄云霄, 李敏, 潘学军, 等. 几种杀菌剂对葡萄霜霉病的防治效果[J]. 农药, 2018, 57(11): 836-839. HUANG Y X, LI M, PAN X J, et al. Control effect of several fungicides on grape downy mildew[J]. Agrochemicals, 2018, 57(11): 836-839. |
| [15] |
王喜娜. 我国主要葡萄产区霜霉菌对烯酰吗啉和嘧菌酯的抗药性分析[D]. 中国农业科学院, 2017. WANG X N. Dctection of dimethomorph and azoxystrobin resistance isolates of Plasmopara viticlola from main grapevine areas in China[D]. Chinese Academy of Agricultural Sciences, 2017. |
| [16] |
张亚璨, 毕秋艳, 韩秀英, 等. 小麦白粉病菌对嘧菌酯和三唑酮的敏感性反应[J]. 麦类作物学报, 2015, 35(12): 1746-1750. ZHANG Y C, BI Q Y, HAN X Y, et al. Sensitivity and activity of Blumeria graminis f. sp. tritici to azoxystrobin and triadimefon [J]. J Triticeae Crops, 2015, 35(12): 1746-1750. DOI:10.7606/j.issn.1009-1041.2015.12.20 |
| [17] |
李成斌, 张红霞, 李岩, 等. 2015—2017 年北方 5 省 (区) 致病疫霉抗药性监测及与嘧菌酯交互抗性[J]. 河北农业大学学报, 2018, 41(6): 75-79. LI C B, ZHANG H X, LI Y, et al. Metalaxyl resistance monitoring and cross-resistance to azoxystrobin on Phytophthora infestans in five northern provinces of China from 2015 to 2017 [J]. J Hebei Agric Univ, 2018, 41(6): 75-79. |
| [18] |
孟润杰, 韩秀英, 吴杰, 等. 河北省黄瓜霜霉病菌对甲霜灵和嘧菌酯的抗性动态及七种药剂的田间防效[J]. 植物保护学报, 2017, 44(5): 849-855. MENG R J, HAN X Y, WU J, et al. Resistance dynamics of Pseudoperonospora cubensis to metalaxyl and azoxystrobin and control efficacy of seven fungicides against cucumber downy mildew in Hebei Province [J]. J Plant Prot, 2017, 44(5): 849-855. |
| [19] |
何秀娟, 徐育海, 邱文明. 栗疫病菌对苯醚甲环唑和氟硅唑的敏感性分析[J]. 湖北农业科学, 2015, 54(23): 5915-5917. HE X J, XU Y H, QIU W M. The Sensitivity of chestnut blight to difenoconazole and flusilazole[J]. Hubei Agric Sci, 2015, 54(23): 5915-5917. |
| [20] |
赵建江, 韩秀英, 张小风, 等. 灰葡萄孢 (Botrytis cinerea) 对苯醚甲环唑的敏感性及其对不同杀菌剂的交互抗药性
[J]. 中国农学通报, 2010, 26(22): 282-286. ZHAO J J, HAN X Y, ZHANG X F, et al. The sensitivity of Botrytis cinerea to difenoconazole and cross-resistance against diverse fungicides [J]. Chin Agric Sci Bull, 2010, 26(22): 282-286. |
| [21] |
覃丽萍, 史国英, 谢玲, 等. 芒果炭疽病菌对咪鲜胺的敏感性检测[J]. 南方农业学报, 2013, 44(4): 594-597. QIN L P, SHI G Y, XIE L, et al. Sensitivity detection of anthracnose pathogen in mango to prochloraz[J]. J Southern Agric, 2013, 44(4): 594-597. DOI:10.3969/j:issn.2095-1191.2013.4.594 |
| [22] |
盖晓彤. 玉米茎腐病与穗腐病致病镰孢菌侵染途径及其致病力差异研究[D]. 沈阳农业大学, 2018. GAI X T. Studies on the infection pathway and pathogenic difference of Fusarium from stalk rot and ear rot on maize[D]. Shenyang Agricultural University, 2018. |
| [23] |
王娟, 王树桐, 任佳慧, 等. 河北省苹果树腐烂病菌不同分离株生物学性状及致病性研究[J]. 河南农业科学, 2013, 42(7): 72-75. WANG J, WANG S T, REN J H, et al. Biological characteristics and pathogenicity of different isolates of Cytospora spp. isolated from apple trees in Hebei Province [J]. J Henan Agric Sci, 2013, 42(7): 72-75. DOI:10.3969/j.issn.1004-3268.2013.07.017 |
 2019, Vol. 21
2019, Vol. 21


