传统的杀虫剂虽然曾在防治害虫、保障农作物丰收等方面做出了卓越贡献,但是,由于长期不合理使用以及某些杀虫剂本身固有的缺点,导致出现害虫抗药性、环境污染以及对人畜、天敌和非靶标生物不安全等诸多问题。因此,以环境友好为前提,寻找结构新颖、作用机制独特、高效和生态安全的杀虫剂显得尤为迫切。
多肽是由多种氨基酸以肽键形式构成的物质,作为蛋白质水解的中间产物,在生命过程中具有重要作用,如调节细胞的功能活动、作为神经递质传递信息、作为营养物质的运输工具输送营养等。近年来,多肽类化合物以其结构独特、性能优异以及安全等特点引起人们的关注,在医药、化妆品、保健品及农业等领域得到广泛应用[1]。在农业领域,具有活性的多肽如抗菌肽、植物活性多肽、昆虫神经肽等已在作物品质改良、病虫害防治、饲料和食品加工等方面得到一定应用并取得较好效果[2-6]。笔者自2006年开始,以昆虫体内的一类多肽类物质——天然昆虫神经肽抑咽侧体素 (Allatostatins,简称ASTs) 为先导,开展模拟肽类农药的探索性研究,期望发现新的生态友好型农药,为绿色植保提供高效安全的新策略。本文结合课题组近年来的研究工作和国内外相关研究进展,对昆虫神经肽抑咽侧体素及其类似物的研究情况进行简要综述。
1 昆虫神经肽及其在害虫防治中的应用昆虫神经肽 (insect neuropeptide,简称IN) 是由昆虫脑内特异性的神经内分泌系统周期性地合成、分泌并通过神经或借助于体液在昆虫体内传递、流动的生理活性肽。目前已经有数百种神经肽被分离、鉴定及合成,其生理功能也逐渐被揭示[7-8]。昆虫神经肽主要分为以下几类[8]:促前胸腺素 (prothoracicotropic hormone,PTTH)[9]和抑前胸腺素 (prothoracicostatic hormone,PTSH)[10]、促咽侧体素 (allatotropins,ATs) 和抑咽侧体素 (allatostatins,ASTs)[11]、羽化激素 (eclosion hormone,EH)[12]、滞育激素 (diapause hormone,DH)[13]、性信息素合成激活肽 (pheromone biosynthesis activating neuropeptides,PBANs)[14-15]、利尿激素 (diuretic hormone,DH) 和抗利尿激素 (antidiuretic hormone,ADH)[16]、激脂激素肽 (adipokinetic hormone,AKH)[17]、直肠肽 (proctolin)[18]、昆虫激肽 (insect kinins,IKs) 或称为肌动肽 (myokinins)[19-20]以及速激肽 (tachykinins)[21]等。昆虫神经肽以非常低 (微摩尔级) 的量即可控制和调节昆虫某些器官或腺体的活动,影响昆虫的生长、发育和变态等重要的生理过程,具有活性高的特点;此外,昆虫神经肽分子一般由几个到十几个氨基酸组成,易降解生成氨基酸,不会造成环境污染,具有环境安全的优点。因此,将昆虫神经肽的特殊生理功能用于靶标害虫防治,探索并发现与现有杀虫剂作用机制不同的新化合物,可为害虫的安全防治开辟新途径[22-23],在害虫防治中具有良好的应用前景[24]。
昆虫神经肽是小肽分子,几乎参与昆虫的所有生理过程,如生长发育、利尿、蜕皮、消化、信号传导、信息素的生物合成和肌肉活动等[25]。这些小肽及其受体有望成为有害生物防治和开发新一代选择性、非神经毒性杀虫剂的靶点[22, 26]。然而,天然昆虫神经肽易降解,生物稳定性低,缺乏活体活性,工业制备困难。因此,运用模拟肽学将天然昆虫神经肽进行结构简化和改造,是开发新型杀虫剂的可行途径[27]。
有研究者已逐渐开始研究昆虫神经肽的生物活性,期望开发出基于神经肽或基于神经肽模拟物的新型杀虫剂,并有一些具有杀虫活性的昆虫神经肽及其类似物已被报道[14, 28-35]。例如,Gilon等[29]研究了性信息素合成激活肽 (PBAN),发现由PBAN氨基酸序列片段组成的骨架环肽及其类似物具有杀虫活性,这些主链环肽可用作杀虫剂。Schwarz[30]从昆虫神经肽中提取到了可用于昆虫防治的短肽,发现从具有至少一个Phe残基的PBAN家族神经肽中提取的肽或类似肽,对害虫具有很好的杀虫活性。这些短肽在很低的剂量 (1~100 pmol) 下即可对害虫显示出较好的生物活性,可以控制和/或预防虫害。Choi等[31]发现了一种新型的生物活性肽,其可作为一种火蚁体内PBAN受体的拮抗剂,阻断PBAN与其受体的结合,导致火蚁不能正常发育,从而达到害虫防治的目的。Seinsche等[32]将一种昆虫激肽——螺旋激素注射到烟蚜夜娥Heliothis virescens幼虫中,发现其抑制幼虫生长并且增加死亡率。Ma等[33]将一种利尿激素——Manse-DP-II涂在烟叶上,喂给烟草天蛾Manduca sexta的1龄幼虫,发现其可减少幼虫食物消耗,阻碍幼虫生长并导致高死亡率。Matthews等[34]发现,在海灰翅夜蛾Spodoptera littoralis和番茄夜蛾Lacanobia oleracea的幼虫中注射PISCF型AST,可阻碍幼虫生长并增加死亡率。Smagghe[35]发现,昆虫激肽类似物对豌豆蚜Acyrthosiphon pisum具有明显杀蚜活性,可作为防治蚜虫的新方法进行深入研究。
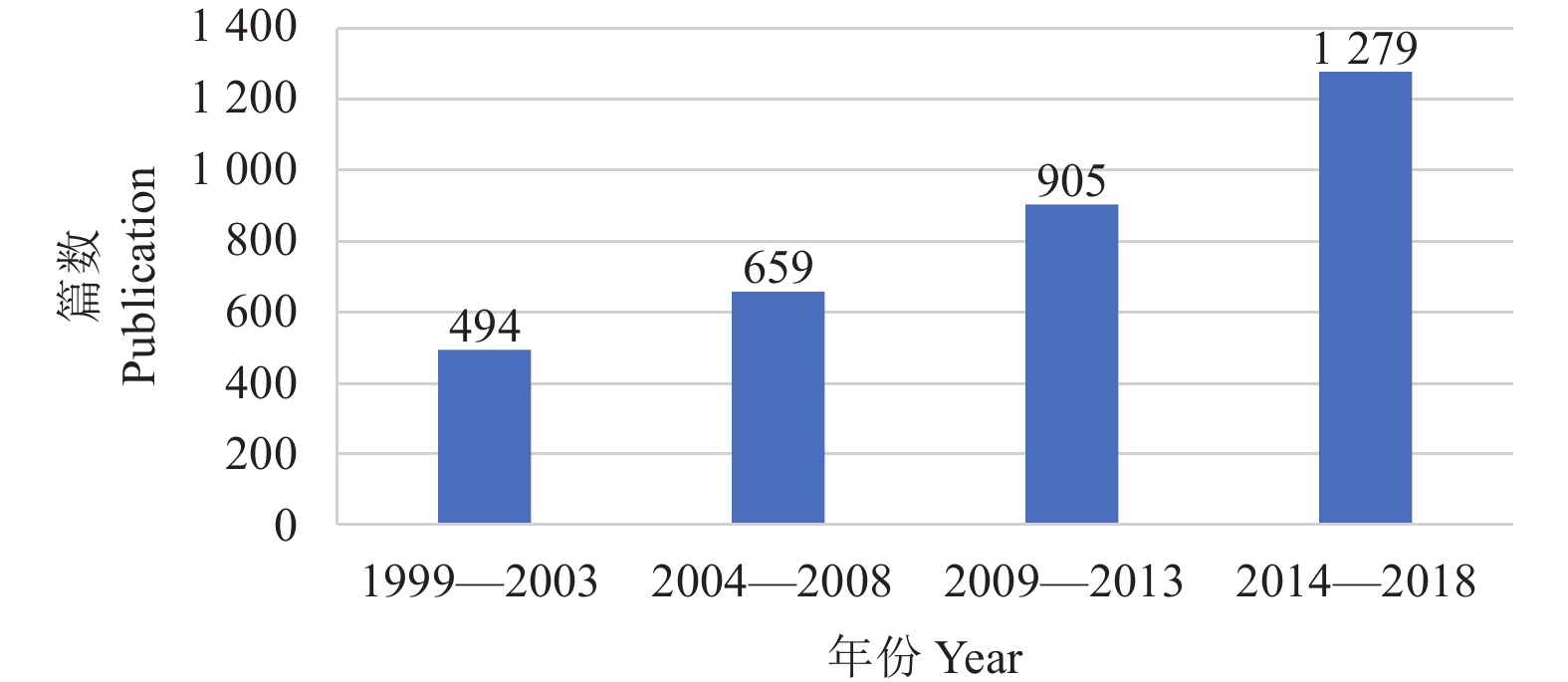
笔者通过Scifinder数据库,以‘peptide’和‘insecticide’作为检索词进行统计分析。结果 (图1) 发现:在1999—2018年的20 年时间内,按每5 年一个时间段统计,多肽类杀虫剂的相关研究呈明显上升趋势,尤其是近5 年就有1 279篇相关报道!可见,将多肽作为农药用于害虫防治正成为越来越热门的研究方向之一。
|
图 1 多肽类杀虫剂的研究趋势 (数据源自Scifinder数据库) Fig. 1 Research trends in peptide insecticides (data from Scifinder database) |
2 昆虫抑咽侧体素 (ASTs) 的类别及功能
抑咽侧体素 (Allatostatins,简称ASTs) 是众多昆虫神经肽中的一种,是一类具有抑制咽侧体 (corpora allata,简称CA) 合成和释放保幼激素(JH)的功能,从而影响昆虫生长发育,最终导致昆虫死亡的昆虫神经肽,因此,ASTs被认为是一类潜在的害虫控制剂[36-38]。与其他具有生物活性的物质相比,ASTs具有明显的优点[24]:1) 活性高;2) 选择性强,对靶标昆虫的咽侧体有很强的抑制作用;3) 环境友好,ASTs降解主要生成氨基酸,安全性好,对人畜低毒;4) 与其他活性肽相比,ASTs结构简单,易于改造。因此,人们对ASTs进行了大量的研究。ASTs最早从太平洋折翅蠊Diploptera punctata中分离得到,后经研究发现其广泛存在于各类昆虫中,如蜚蠊、果蝇、粘虫、蝗虫和蟋蟀等[39]。到目前为止,已从各类昆虫中分离出数百种ASTs[40-41],它们一般由6~18个氨基酸组成。
2.1 抑咽侧体素的发现及类别1989年,Woodhead等[36]从未交配雌性太平洋折翅蠊D. punctata的大脑提取物中分离到4条AST,对其C末端肽链结构初步分析,得出Phe-Gly-Leu-NH2是其特征序列。1991年,Pratt等[37-38]又从太平洋折翅蠊中分离得到了ASA1和ASB2两条AST,并同时认为其C末端的五肽序列 (Tyr-Xaa-Phe-Gly-Leu-NH2) 是保持其活性所必需的片段。Donly等[42]鉴别出太平洋折翅蠊的AST氨基酸序列,推测太平洋折翅蠊存在13条AST小肽。随后,Ding等[43]对比了美洲大蠊Periplaneta americana (L.)和太平洋折翅蠊的AST前体,推测美洲大蠊AST前体含14条小肽,在C末端具有共同的 (Tyr/Phe)-Xaa-Phe-Gly-(leu/Ile)-NH2片段;同时发现,美洲大蠊的allatostatin-1、2、3、6、14分别与太平洋折翅蠊的allatostatin-1、2、3、6、13结构相同。1999年,Predel等[44]通过基质辅助激光解析/电离飞行时间质谱 (Matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF MS) 手段,从美洲大蠊后脑复合体 (retrocerebral complex) 和触角搏动器官中检测到了除Pea-AST-13外的13个AST族肽。Lorenz等[45]从蟋蟀Gryllus bimaculatus中分离得到4条AST,此类ASTs具有C-末端序列为W(X)6W-NH2的特征结构。
ASTs广泛存在于各种昆虫或节肢动物中,如在蜚蠊[36]、果蝇[46-47]、粘虫[48-49]、蝗虫[50]、蟋蟀[45]、丽绳[51]、小龙虾[52]和老虎虾[53]等动物中都发现了ASTs。这些肽从蛋白质的化学结构来讲可以分为3种类型:从太平洋折翅蠊D. puncata分离得到的蜚蠊型ASTs;从蟋蟀G. bimaculatus中分离得到的蟋蟀型ASTs;从鳞翅目烟草天蛾M. Sexta及黑腹果蝇Drosophila melanogaster中分离得到的蛾型ASTs。
目前,昆虫生理学家对ASTs的分类有了新的观点,将早期归为B类的蟋蟀型ASTs重新归属为Myoinhibitory peptide (MIP) 家族[54]。因此,目前主要存在两大类ASTs[55]:1) 蜚蠊型 (A型) ASTs,其C末端有一共同经酰胺化的氨基酸序列:Y/FXFGLa;2) 蛾型 (C型) ASTs,最初是从烟草天蛾M. sexta中分离纯化出来,其C末端氨基酸未经酰胺化,结构序列有所不同。在已经鉴定的ASTs中,蜚蠊型 (A型) ASTs最为常见,蛾型(C型)较少。
2.2 抑咽侧体素的分布和功能ASTs广泛分布于昆虫的各个组织中,现已从脑、咽侧体、血淋巴[56]、消化道[57]及神经节[58]中分离出了ASTs。免疫化学研究结果证明,蜚蠊脑部分泌ASTs后,通过侧神经分泌细胞传递到咽侧体,血淋巴中ASTs免疫反应物质的存在说明这些物质可以通过血淋巴途径传递到咽侧体,产生抑制保幼激素合成和释放的作用[59]。电生理研究表明,用电刺激连接咽侧体的轴突束,咽侧体细胞会产生超极化,说明体外咽侧体可释放ASTs。在不同的发育周期,咽侧体的保幼激素合成可受2种传递途径调节[60]。
Stay等[59]用免疫细胞化学的方法证明了A型ASTs遍布太平洋折翅蠊的神经系统,如脑、心侧体-咽侧体 (CC-CA) 复合体、触角搏动器的神经等。Yu等[58]通过酶联免疫法 (ELISA) 测定了交配后太平洋折翅蠊雌虫的脑、咽侧体、血淋巴及中肠和后肠ASTs的含量变化,发现脑中ASTs量的变化与雌虫生殖周期密切相关,表明ASTs与雌虫生殖周期对保幼激素的合成起到重要调节作用;体外检测其咽侧体和血淋巴中ASTs变化表明,卵黄发生期和抱卵期雌虫中咽侧体中的ASTs含量少,在卵黄发生后随即增加。此外,AST-1单抗免疫化学反应显示,触角神经节中有很强的免疫活性。Hernández-Martínez等[61]利用共焦激光扫描显微镜 (confocal laser scanning microscopy, CLSM) 对比了A型ASTs和C型ASTs在埃及伊蚊Aedes aegypti和一种疟蚊Anophyeles albimanus的免疫染色结果,发现在其脑部、神经节、神经突触及腹部都能观察到单抗免疫化学反应,而中肠却只有A型ASTs单抗反应。表明不同种类的ASTs分布范围不同,其功能也有差别。
ASTs的广泛分布反映了其功能的多样性。在昆虫体内,ASTs具有抑制咽侧体合成保幼激素的功能[59, 62-63],抑制作用发生在保幼激素生物合成的第1步[37]。Tobe等[64]比较了13条Dippu-AST在太平洋折翅蠊中抑制保幼激素的生物活性,发现抑制活性随结构的不同而发生变化,Dippu-AST 2、Dippu-AST 5和Dippu-AST 7具有很好的抑制活性 (IC50值分别为0.41、0.11及0.43 nmol/L)。
除了抑制保幼激素的生物合成功能外,ASTs还具有多种其他的生理功能,例如抑制前肠、中肠、后肠肌肉的收缩[57, 65-66],抑制直翅目昆虫卵巢的发育[67]和交配[68],以及抑制心脏、背血管和输卵管等器官中的肌肉收缩[68-69]等。
3 ASTs类似物的研究进展ASTs在昆虫体内广泛分布,能以皮摩尔级的量高效地抑制保幼激素的生物合成,从而调控昆虫的生长发育[62],具有高活性、高选择性和对环境安全的优点,因此,被认为是潜在的害虫生长调节剂先导。但是,天然ASTs所固有的缺陷限制了其直接作为农药进行害虫防治的可能。在诸多缺点中,最突出的是ASTs易被昆虫体内的各种特异性和非特异性的肽酶迅速降解,使其代谢失活而无法发挥药效;其次,部分ASTs运输功能差,不易到达作用靶点;再者,天然ASTs分子结构较复杂,生产成本高。这些缺点,妨碍了ASTs直接作为药剂防治害虫[70]。
为了克服天然ASTs的种种缺陷,研究者希望通过对ASTs的结构进行修饰、简化或改造来克服这些缺点,同时期望保留或提高其活性,以获得具有实际应用价值的候选化合物[70]。在对ASTs的结构改造中,人们大多采用模拟肽学的方法获得相应的类似物,主要方法有3种[71]:1) 对肽链骨架的模拟,即运用酰胺键的电子等排体,用吡咯啉或一小段β转折的模拟物等模拟整条肽链的局部特征。这些模拟物通常是模拟了肽链骨架,并保留了肽链与受体结合部位的特征结构;2) 对肽的功能模拟,即设计合成一个能与天然肽受体结合的非肽小分子;3) 设计崭新的模拟肽,即摆脱母体肽链的束缚,在全新的非肽骨架中包含必需的功能片段特征。
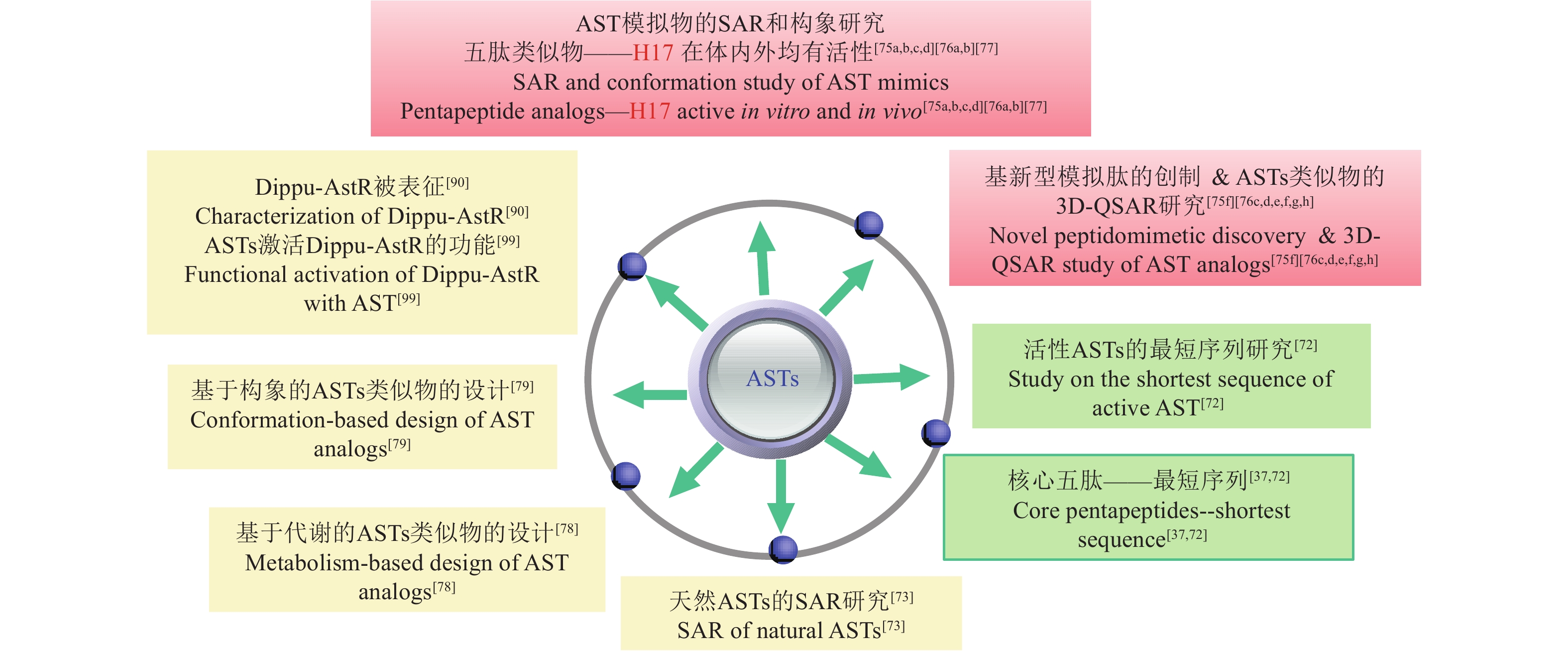
迄今为止,国内外许多研究者从结构简化、生物稳定性、活性提高等角度出发,通过模拟肽学的方法对ASTs的结构进行了修饰和改造,获得了很多ASTs类似物并进行了构效关系研究,部分类似物表现出改进了的药效学性质和药代动力学性质,包括生物学活性、代谢稳定性及吸收性质的提高等。笔者将近年来ASTs的结构改造及其类似物的构效关系研究进展进行了总结,具体如图2所示。
|
图 2 ASTs的结构改造及构效关系研究进展示意图 Fig. 2 ASTs structure modification and SAR research progress |
下面将分别从ASTs及其类似物的结构改造、活性构象和构效关系研究3个方面进行简要介绍。
3.1 ASTs的结构改造 3.1.1 “核心五肽”功能区域的确定及五肽类似物的研究 3.1.1.1 “核心五肽”功能区域的确定ASTs是由6~18个氨基酸残基组成的多肽,为了确定其与受体结合的活性部分,科学家们采用缩短肽链的方法确定了AST类似物的功能区域——“核心五肽 (YXFGLa)”。1991年,Stay等[72]以Dippu-AST 4 (DRLYSFGL-NH2) 为先导设计了2个片段肽4A (LYSFGL-NH2) 和4B (YSFGL-NH2),生物活性测试结果表明,虽然4A和4B抑制保幼激素的能力比Dippu-AST 4分别降低了1个和2个数量级,其IC50值分别为10–8 mol/L和10–7 mol/L,但仍然保持很好的抑制活性,推测片段Tyr-Ser-Phe-Gly-Leu-NH2是具有抑制保幼激素生物合成活性的最短序列。同年,Pratt等[37]以ASB 2 (即Dippu-AST 2,AYSYVSEYKRLPVYNFGLa) 为先导设计了一系列的片段肽,发现保留ASB 2的C-端部分 (YNFGLa) 能维持较好地抑制保幼激素生物合成的活性,若缺失该区域或C端Leu-NH2去酰胺化,则失去抑制活性。这进一步说明五肽片段 (YXFGLa) 是ASTs活性所必需的功能区,且C端需要保持酰胺化。
在此基础上,Hayes等[73]利用氨基酸替换的方法确定保守氨基酸残基,将L-Ala和D-氨基酸逐一取代核心五肽中的每个氨基酸,确定了核心五肽中的Tyr4、Phe6、Gly7及Leu8的侧链对生物活性有较大影响,其中Leu8的侧链取代基最为重要,其次是Phe6的侧链基团;同时,用D构型氨基酸取代后,发现Ser5、Phe6和Leu8的手性与Dippu-AST 4的生物活性有着密切的联系。Matthews等[34, 74]研究了Manse-AST中各氨基酸残基的重要性,利用Ala取代Manse-AST中7~14位的氨基酸残基,结果发现,C7及C14部位二硫键的破坏,可导致ASTs活性消失,说明ASTs构象对活性具有很重要的作用。
随后Lange等[65]在研究13种Dippu-AST抑制蟑螂后肠收缩活性时发现,当Callatostatin 5 (GPPYDFGMa) 和Dippu-AST 1、Dippu-AST 13在“核心区域”具有相同的YDFG序列,而仅观察核心五肽中C端的Met、Leu和Ile的区别时,Callatostatin 5抑制后肠的活性强于Dippu-AST 1和Dippu-AST 13,认为C末端氨基酸残基对生物活性有很大影响。
杨新玲课题组[75a, b]首次合成了蜚蠊型AST的核心五肽片段 (Y/FXFGLa),并进行生物活性测试,证实该五肽具有抑制保幼激素合成的活性 (IC50 = 130 nmol/L),是创制新型IGRs的理想先导化合物。
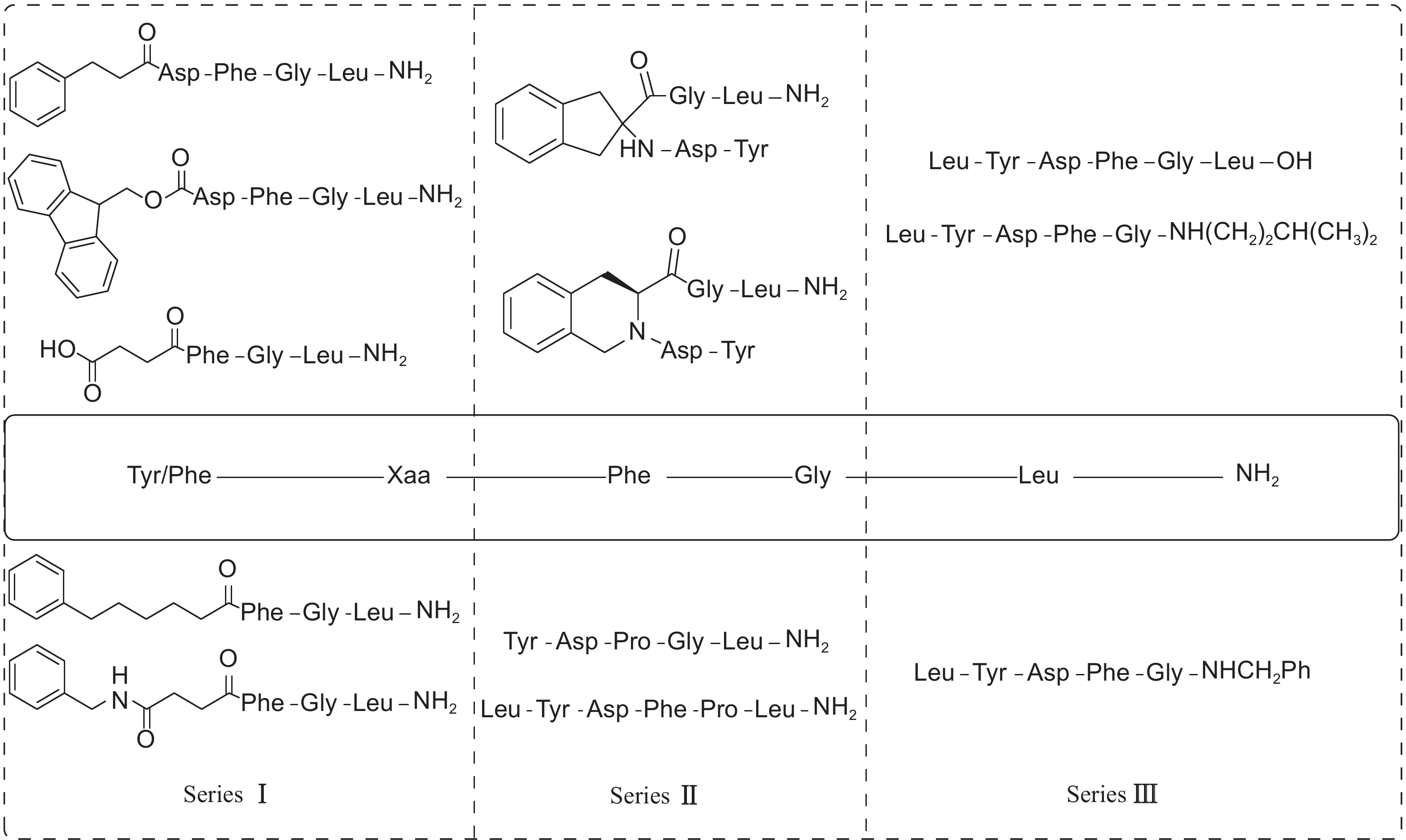
3.1.1.2 五肽类似物的研究开振鹏[75a]以该核心五肽为先导,采用模拟肽学的研究策略,将核心五肽分为3个区域对其进行结构改造 (图式1),通过采用不同种类的有机酸和非天然氨基酸逐一取代该核心五肽的每一个氨基酸残基,设计并合成了15个五肽类似物并初步研究了它们的构效关系,验证了AST结构简化的可能性。
|
图式1 ASTs核心五肽结构改造 Scheme1 Structure modification of ASTs core pentapeptide Y/FXFGLa |
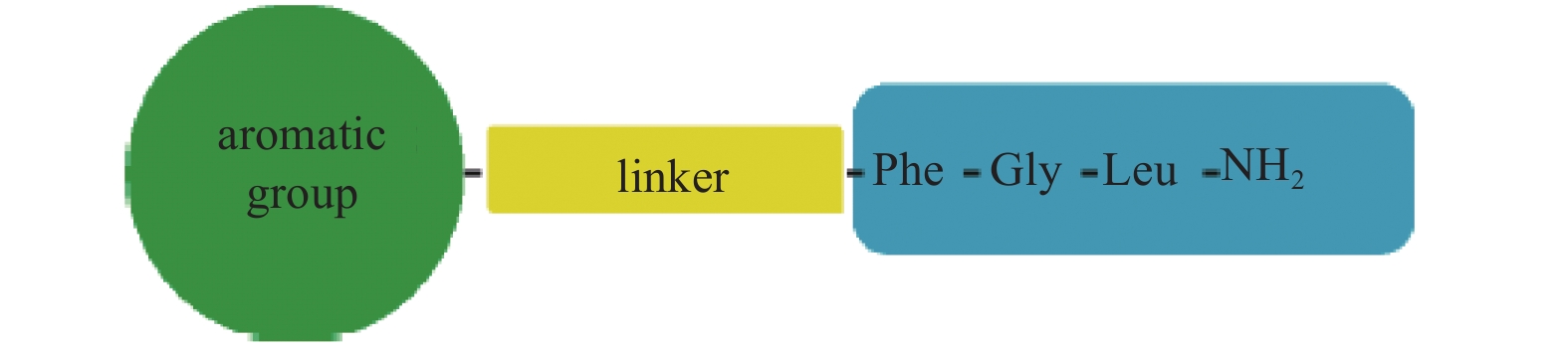
初步结构-活性关系分析表明:高活性的ASTs类似物需要包含1个芳香环 (aromatic group)、1个FGLa片段,以及连接它们的长度适中的“桥”(linker),并由此提出了活性AST类似物所需要满足的结构通式 (图3)。其中,FGLa为保守区域,应是保持高活性的重要部分,Linker部分可进行适当修饰, 而N末端的芳香性对活性也有贡献[76a]。
|
图 3 高活性ASTs类似物结构通式 Fig. 3 General structure of highly active ASTs analogs |
笔者在图3所示的结构通式基础上,设计合成了26个全新的ASTs类似物。生物测定结果发现9个类似物 (K14、K15、K17、K18、K19、K23、K24、K25和H17)的活性优于先导化合物核心五肽;更加令人鼓舞的是,五肽类似物K15和K24的抑制保幼激素活性 (IC50值分别为1.8 nmol/L和5.3 nmol/L) 甚至优于天然AST的活性 (例如六肽Dippu-AST 1,IC50 = 8 nmol/L)[75a]。进一步的活体活性测试发现,H17表现出明显的活体活性 (IC50 = 33 nmol/L),是笔者课题组发现的第1个兼有较高离体和活体活性的化合物,被认为是潜在的害虫控制剂先导化合物 (图式2)[77b]。
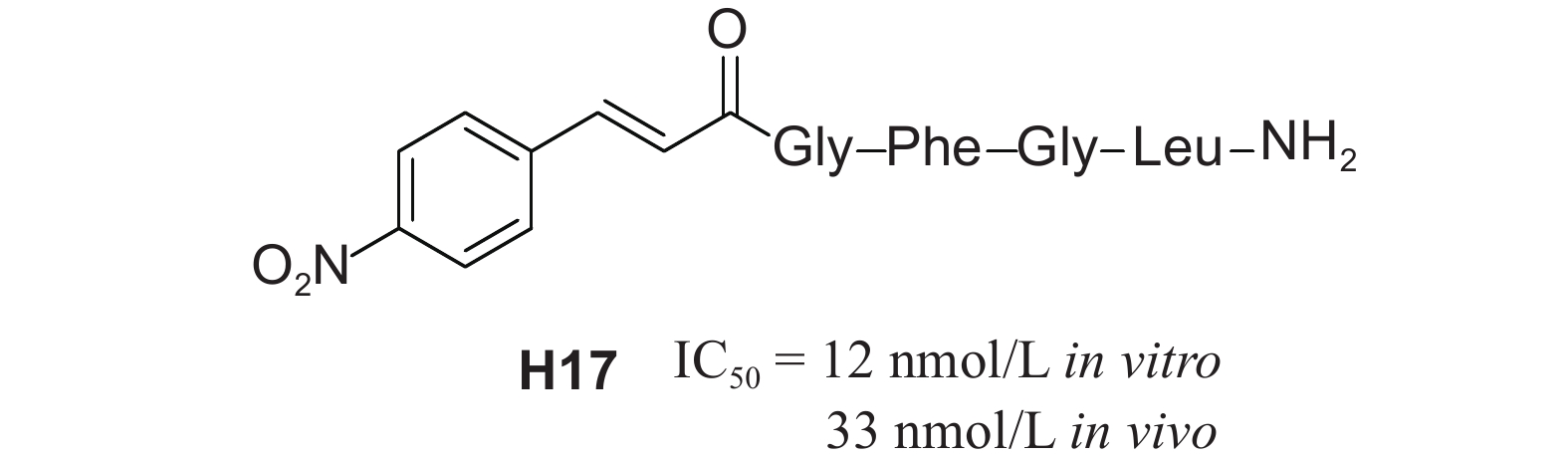
|
图式2 H17的结构及抑制保幼激素生物合成活性 Scheme2 Structure of H17 and its inhibition activity of JH biosynthetic |
综上所述,核心五肽区域 (YXFGLa) 是ASTs保持抑制保幼激素生物活性所必须的功能区,C端 (FGLa) 片段是抑制保幼激素活性的保守区域,化合物的空间构象对生物活性也有一定的影响。
3.1.2 酶解位点的改造核心五肽(YXFGLa) 会在咽侧体、脑、后肠、中肠被酶解,主要易酶解位点在C末端Gly-Leu部位。因此,为了阻止多肽酶解的发生,在多肽类似物设计时,其易酶解位点通常是考虑被修饰的重点部位之一。
Piulachs等[78]以德国小蠊Blattella germanica BLAST 2 (DRLYSFGLamide,即Dippu-AST 5) 为先导化合物,根据Dippu-AST 5的酶解位点Leu3-Tyr4,设计了亚甲氨 (–CH2NH–) 和亚甲基酮 (–COCH2–) 取代类似物PTMA和PTMB (图式3),生物活性测试结果显示:类似物PTMA和PTMB在离体条件下抑制德国小蠊咽侧体合成保幼激素活性略低于天然肽BLAST 2,但活体活性却远高于天然肽BLAST 2。这说明通过修饰酶解位点,能够提高化合物的抗酶解能力,提高化合物的活体活性。
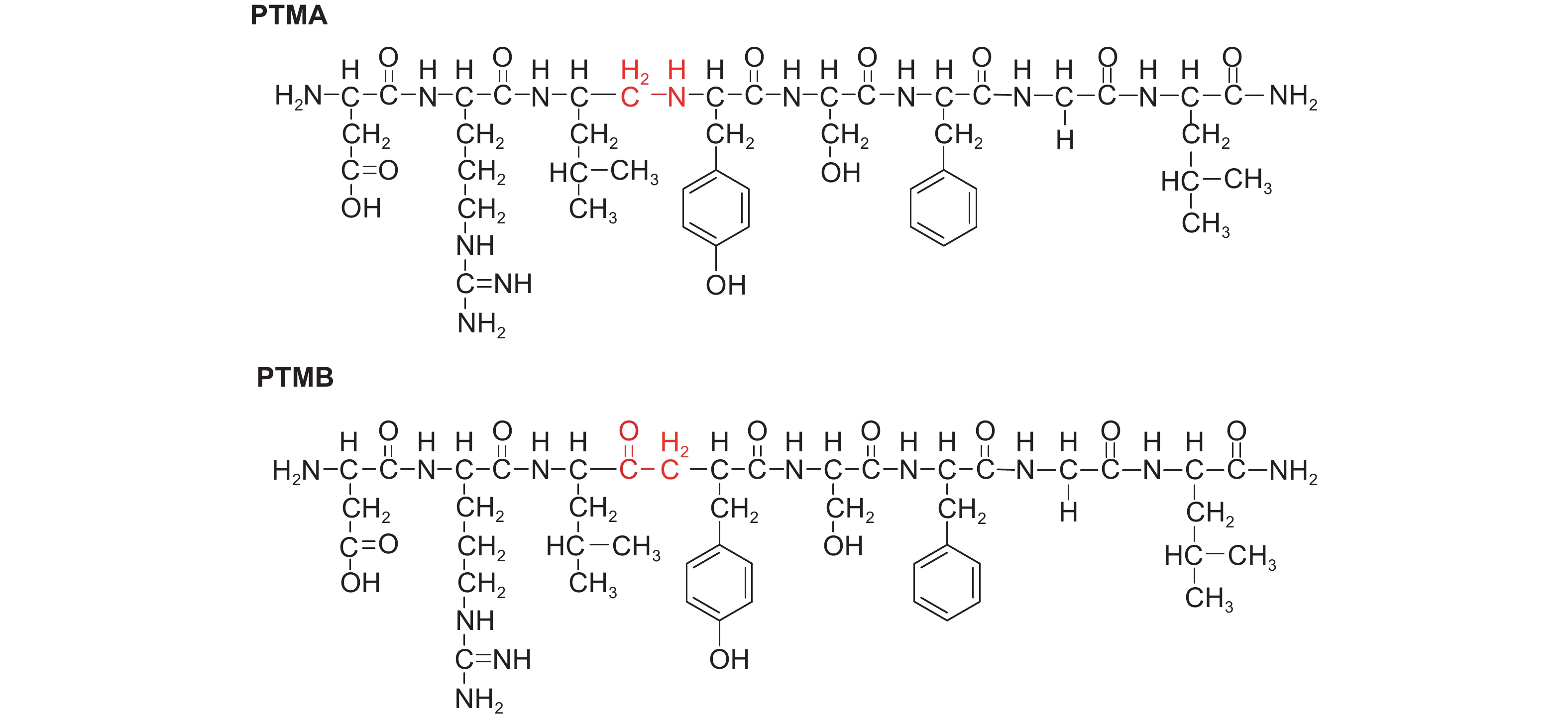
|
图式3 PTMA和PTMB的结构式 Scheme3 Structural formula of PTMA and PTMB |
3.1.3 引入非天然氨基酸
Nachman等[70, 79-80]在Hayes的研究基础上,以非天然氨基酸Aic、Cpa和Bzd替换Dippu-AST 6的Phe6、Gly7氨基酸残基,设计了5个类似物 (图式4)。
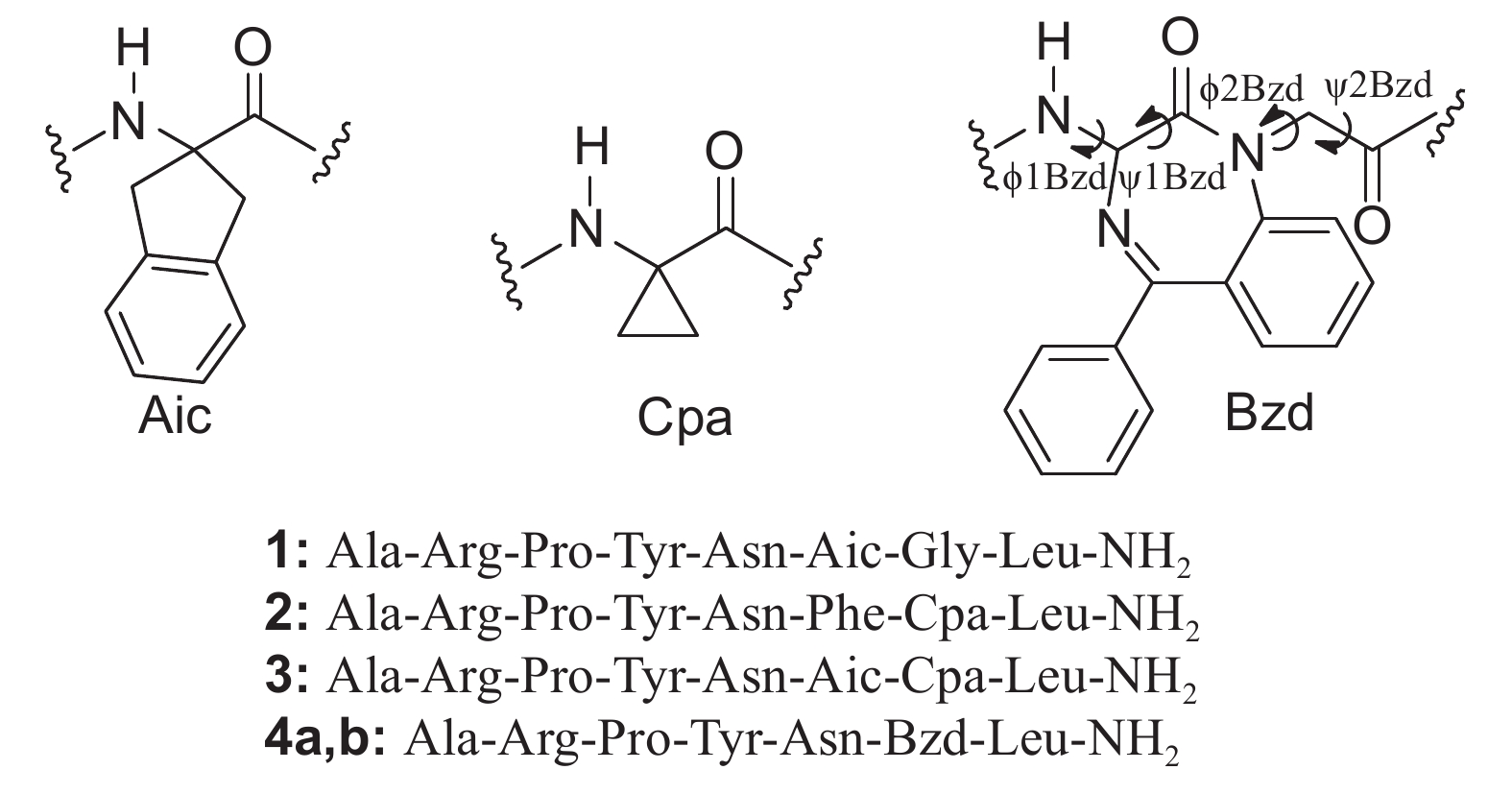
|
图式4 Dippu-AST 6类似物的结构式 Scheme4 Structural formula of the analogues of Dippu-AST 6 |
生物活性结果显示:类似物1 (ED50 = 3.2 nmol/L) 的活性与先导化合物Dippu-AST 6 (ED50 = 2.3 nmol/L) 的活性相当,说明利用非天然氨基酸Aic替换Phe6可以保持ASTs的活性,同时能够提高抗酶解能力。而类似物2 (ED50 = 0.16 μmol/L)、类似物3 (ED50 = 0.80 μmol/L)、类似物4a (ED50= 10 μmol/L) 和其非对映异构体4b (ED50 = 0.1~10 μmol/L) 的活性降低了几个数量级,引入Cpa和Bzd增加了空间位阻,增大了分子的刚性,生物活性大大降低,推测Gly7位点空间在设计合成过程中需保持一定的分子柔性,同时不易引入较大的基团。
Nachman等[70]还将苯丙酸引入到核心五肽中,合成了类似物AST(b)ϕ2 (图式5),离体活性测试结果显示,AST(b)ϕ2活性较天然Dippu-AST 5相比降低了3个数量级,但其在血淋巴、脑部和后肠中的代谢稳定性有大幅度的提高。非天然氨基酸的引入为后续类似物的设计开辟了一条新途径。
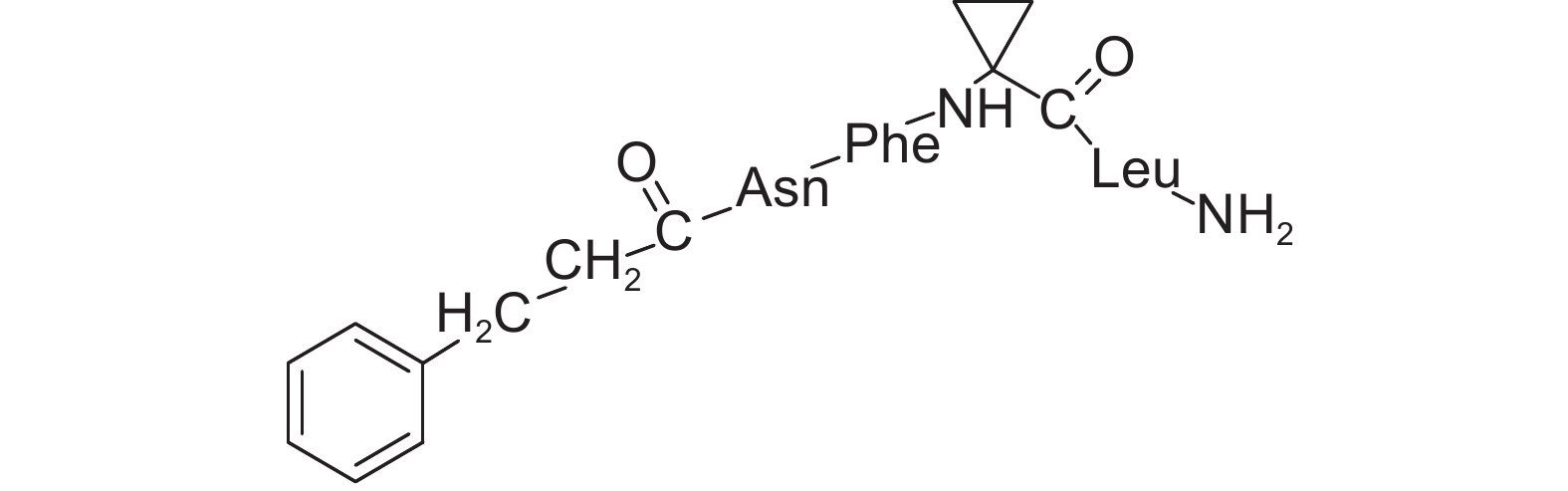
|
图式5 类似物AST(b)ϕ2的结构式 Scheme5 Structural formula of AST(b)ϕ2 |
3.1.4 ASTs类似物H17的结构优化
笔者课题组经过对ASTs核心五肽的结构优化,首次发现核心五肽类似物H17是一个兼有较高的离体和活体活性、且结构简单的模拟肽,是一个潜在的害虫控制剂先导化合物,随后,笔者课题组以H17为二级先导开展了深入的结构优化研究。
谢勇等[75c, 76c]通过在H17的肽键中引入N-甲基的方法,限定该ASTs模拟物的空间构型,设计合成了系列N-甲基化的H17类似物C (图式6)。结果发现,类似物C1活性略优于H17,其中单取代N-甲基类似物的活性普遍优于双取代N-甲基类似物。然而,类似物的总体活性低于天然ASTs,推测N-甲基化取代限定了ASTs的空间构象,增加了分子的刚性,不利于分子进入结合腔。
|
图式6 ASTs类似物H17的结构优化 Scheme6 The optimization of ASTs analog H17 |
谢勇[75c]还采用非天然氨基酸替换的方法,在Gly2、Phe3、Gly4位引入不同效应的非天然氨基酸获得相应的类似物D、E和F (图式6),结果发现,有4个类似物 (D1、E3、E11和E13) 具有比H17更高抑制保幼激素生物合成的活性。构效关系分析认为,Gly2位点引入亲水性的基团有利于提高活性,引入疏水性的基团则对活性不利;Phe3残基的芳香性对活性有很重要的作用,保留六元芳香性有利于类似物的活性提高;Gly4位点用非天然氨基酸替换对活性不利。
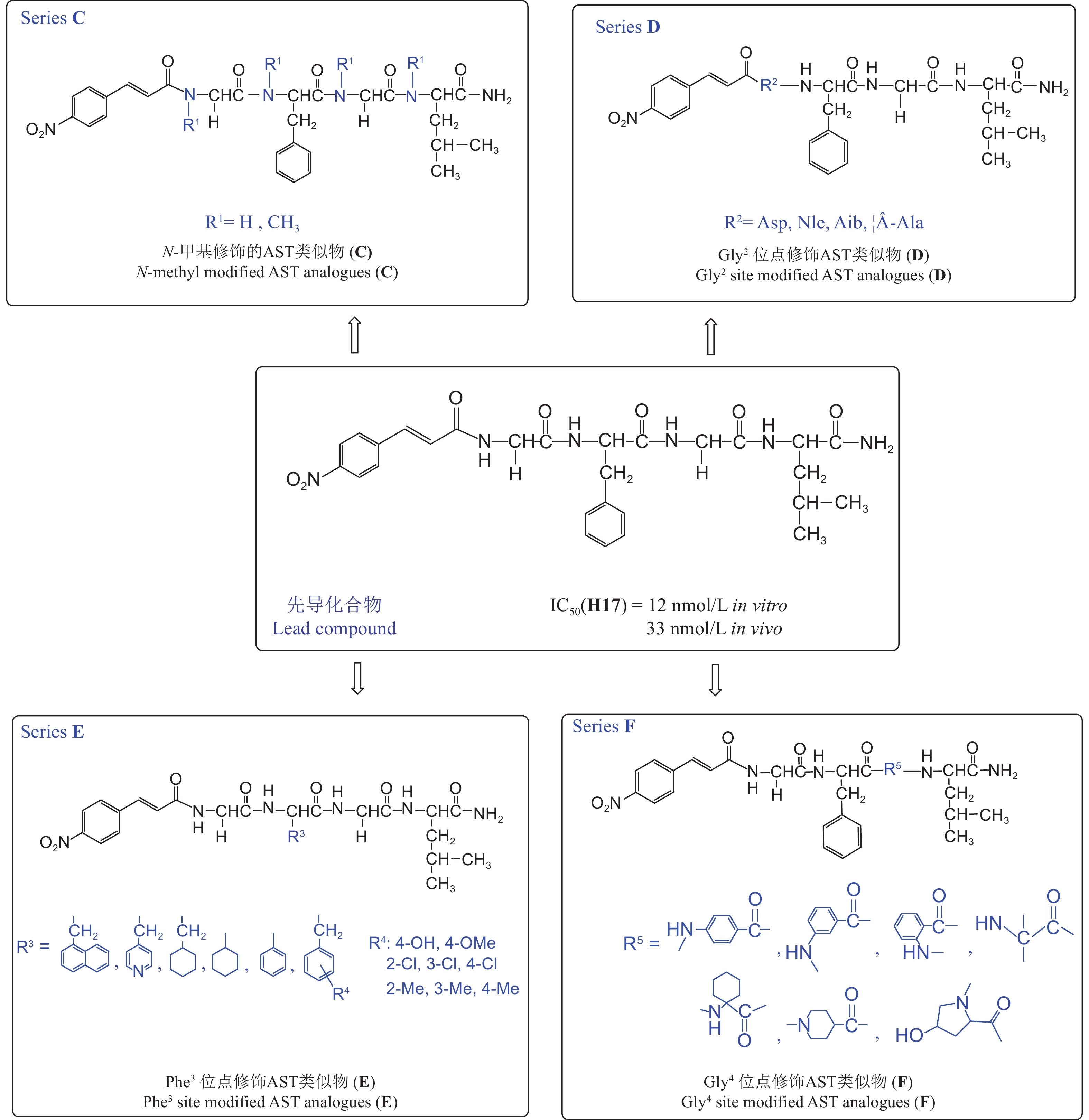
基于开振鹏提出的具有活性的ASTs类似物结构通式[75a](图3),吴小庆[76e]针对H17的linker部分展开研究,设计合成了不同链长的L系列类似物 (图式7)。生物活性测试结果显示:链长最长的类似物L6 (n = 5) 在离体条件下表现出较好抑制保幼激素生物合成的活性 (表1)。构效关系研究表明:随着链长增加,类似物活性同步提高。
|
|
表 1 系列L类似物的离体生物活性 Table 1 The in vitro activity of series L |
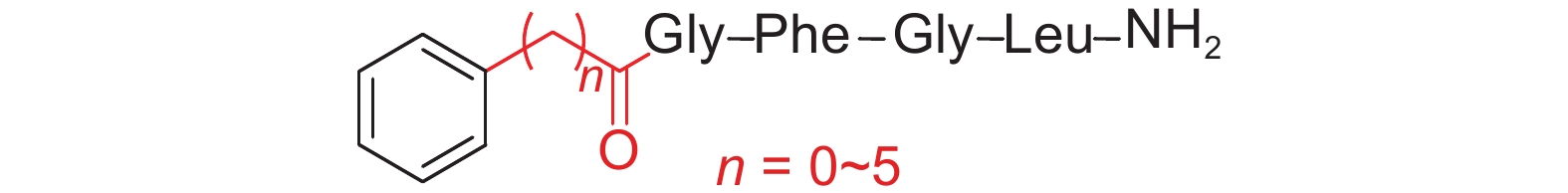
|
图式7 系列L类似物的结构通式 Scheme7 Structural formula of series L |
为了进一步研究N端苯环上的取代基对活性的影响,吴小庆等[76f]以H17为先导,设计合成了系列化合物M (图式8),并开展生物活性评价,结果发现:4-Br取代的类似物M11 (图式8) 活性较H17有显著提高。取代基效应研究表明:肉桂酸苯环上取代位置不同导致活性差异,4位取代对活性最为重要。
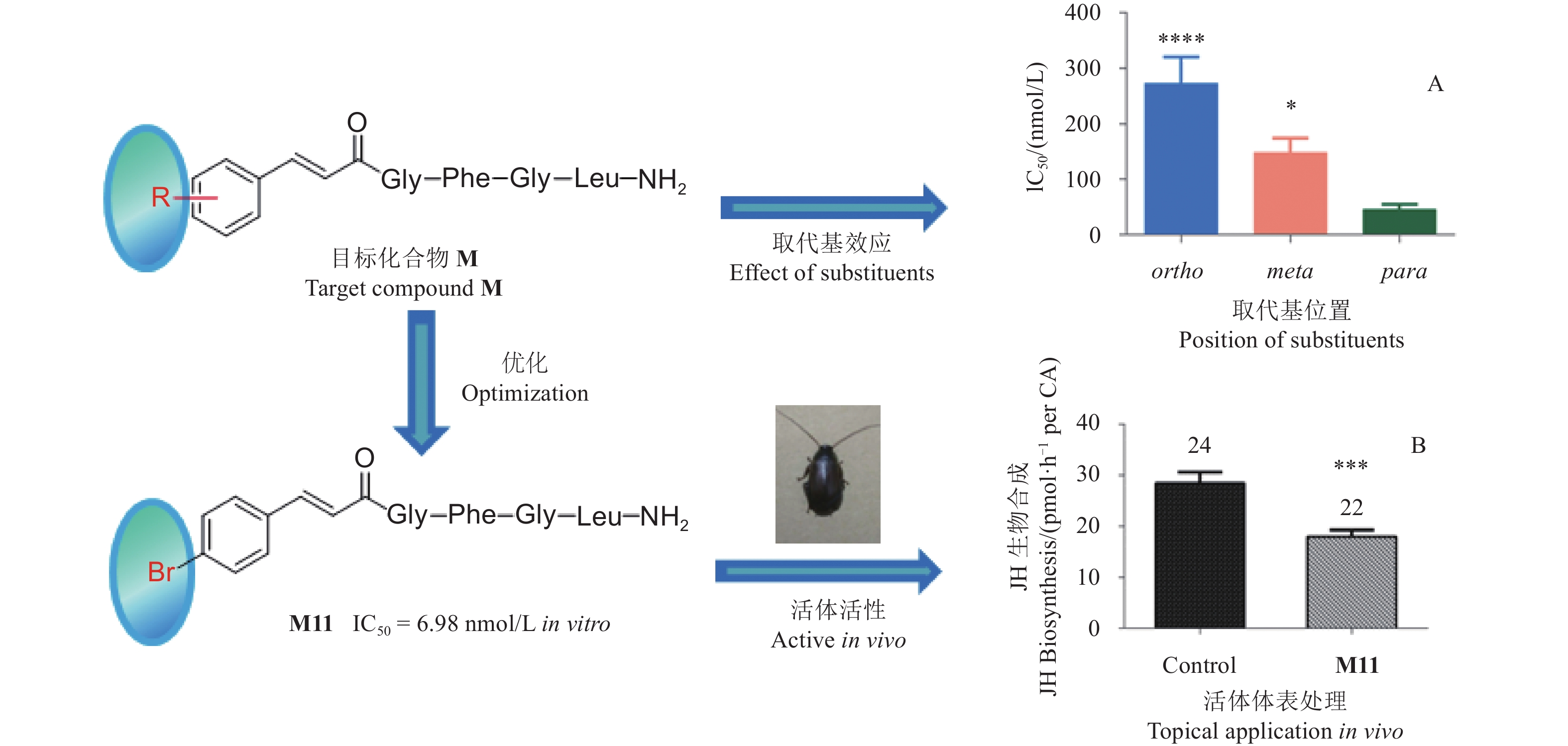
|
注:A. 用Dunnett-t 验法单因素方差分析取代基位置效应差异性[与对位取代基相比,*表示有显著差异(P<0.05),****表示有极显著差异P<0.000 1];B. 用t检验法进行类似物和溶剂处理的试虫反应差异性分析(与溶剂对照相比,***表示有很显著差异P = 0.000 1)。 Note: A. Significance calculated using one way ANOVA (F=13.67, P = 0.000 1) with Dunnett’s test (*P<0.05, ****P<0.000 1 vs para-substituents). B. Asterisks indicate significant differences between peptide-treated and solvent-treated groups of animals as determined by t-test (***P = 0.000 1). 图式8 M11的结构及活性 Scheme8 Structure and bioactivity of M11 |
H17中Gly2是一个可变的氨基酸位点,谢勇[75c]发现该位点引入亲水残基可能对活性有利。因此,吴小庆等[75f]进一步在该位点分别引入亲水性残基和疏水性残基,设计合成了P系列类似物,结果发现,该位点含有亲水性残基取代的类似物普遍表现出优异的活性,而疏水性残基修饰对活性不利,尤其是含有亲水性残基的类似物P5 (图式9),无论是离体活性还是活体活性均优于先导H17,这为后续的新型ASTs类似物的设计、合成工作进一步奠定了良好基础。
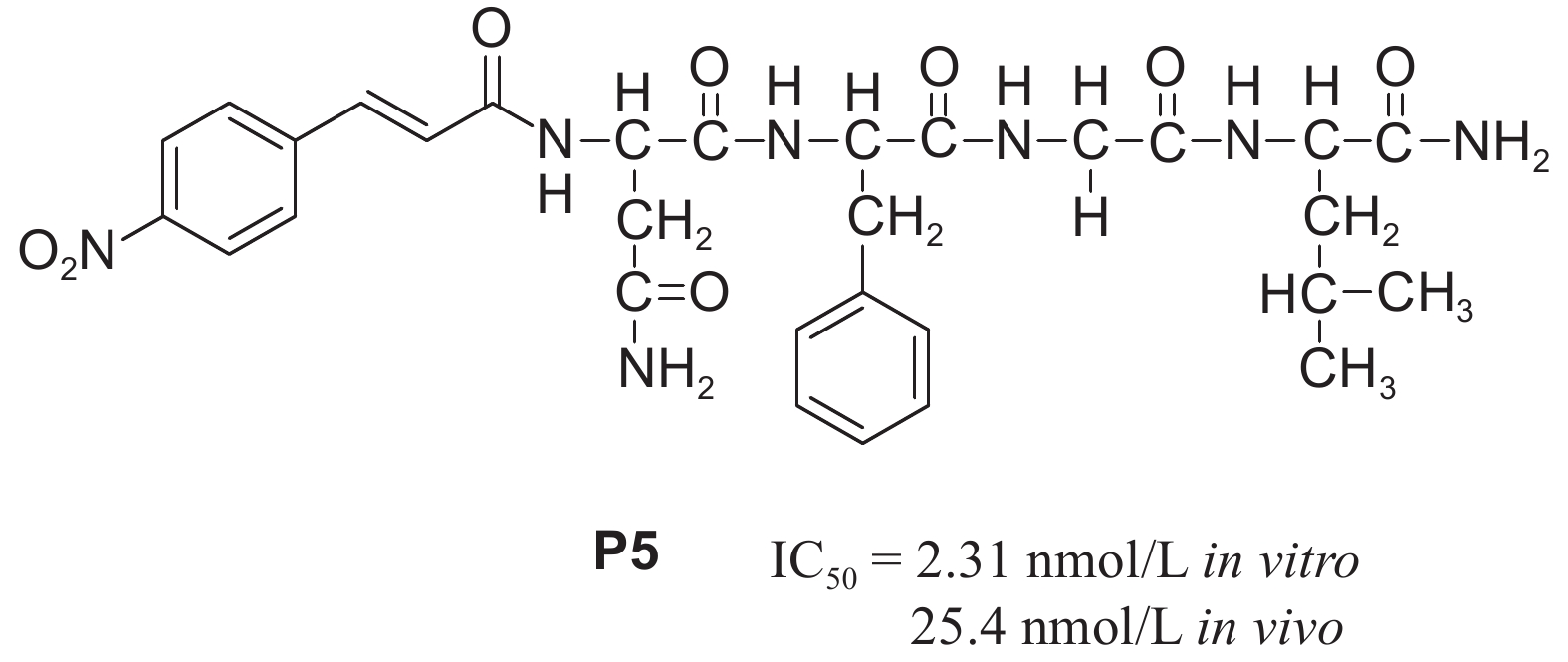
|
图式9 类似物P5的结构及活性 Scheme9 Structure and bioactivity of analog P5 |
3.1.5 非肽化的改造
以昆虫神经肽为先导,设计昆虫神经肽的非肽化合物也是近年来的研究热点。谢勇等[75c, 77c]以核心五肽为先导,采用模拟肽学的手段,设计合成了系列非肽类化合物,其中非肽模拟物B1(图式10) 的离体抑制保幼激素生物合成的活性 (IC50 = 0.09 μmol/L) 优于核心五肽,这为ASTs的非肽化改造提供了新思路。王献伟等[75d, 77e]在谢勇的基础上,对N末端芳香性进行探讨,发现N末端结构简化后的模拟物I22 (图式10) 活性 (IC50 = 0.08 μmol/L) 与先导B1相当。
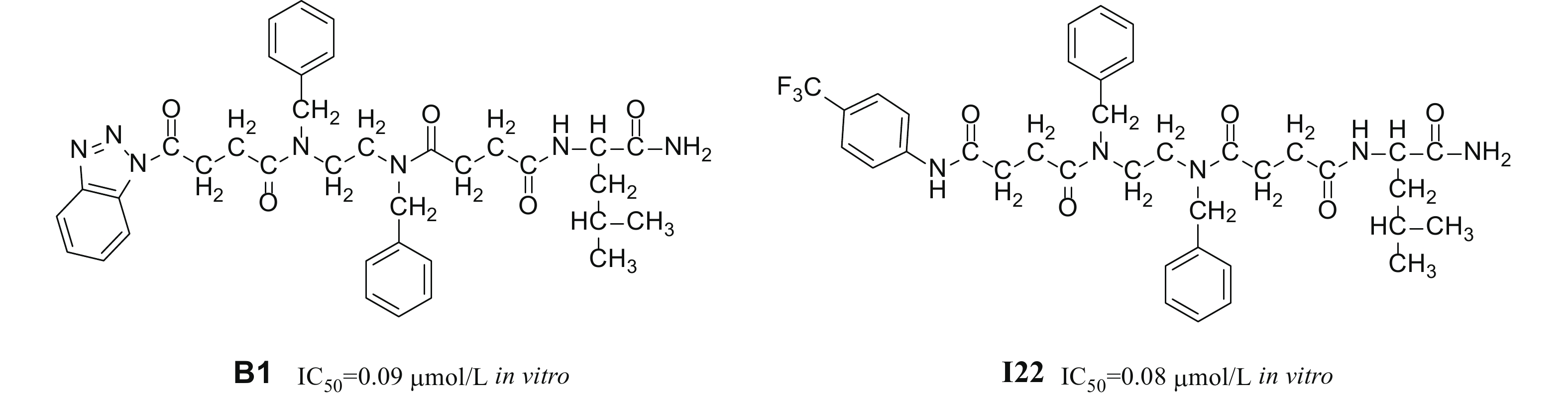
|
图式10 非肽类似物B1和I22的结构及活性 Scheme10 Structures and bioactivities of non-peptide analogs B1 and I22 |
开振鹏[75a]以ASTs的C端FGLa片段为模拟对象,通过保留C末端的La片段,着重研究FG片段的模拟子。在保留模拟物的构象柔性前提下,通过用丁二酸和γ-氨基丁酸模拟FG片段的主链、用苄胺模拟苯丙氨酸的侧链苯环,设计了X和Y系列非肽类ASTs模拟物,在设计X系列的同时,还设计了一个非肽类的三肽 (FGLa) 模拟物H35 (图式11)。初步生物活性测定结果表明,模拟物H35和X1a能显著地抑制蟑螂保幼激素的生物合成 (其IC50值分别是0.48 μmol/L和0.09 μmol/L)。非肽模拟物H35的活性比三肽FGLa的活性 (IC50=2.06 μmol/L) 高4倍左右,而X1a的活性比三肽FGLa的活性高22倍左右。进一步的体表活体活性测试发现,H35对蟑螂卵的发育具有抑制作用,这是首次基于ASTs的C端三肽发现的对蟑螂具有很好的抑制保幼激素合成活性的非肽类ASTs模拟物。
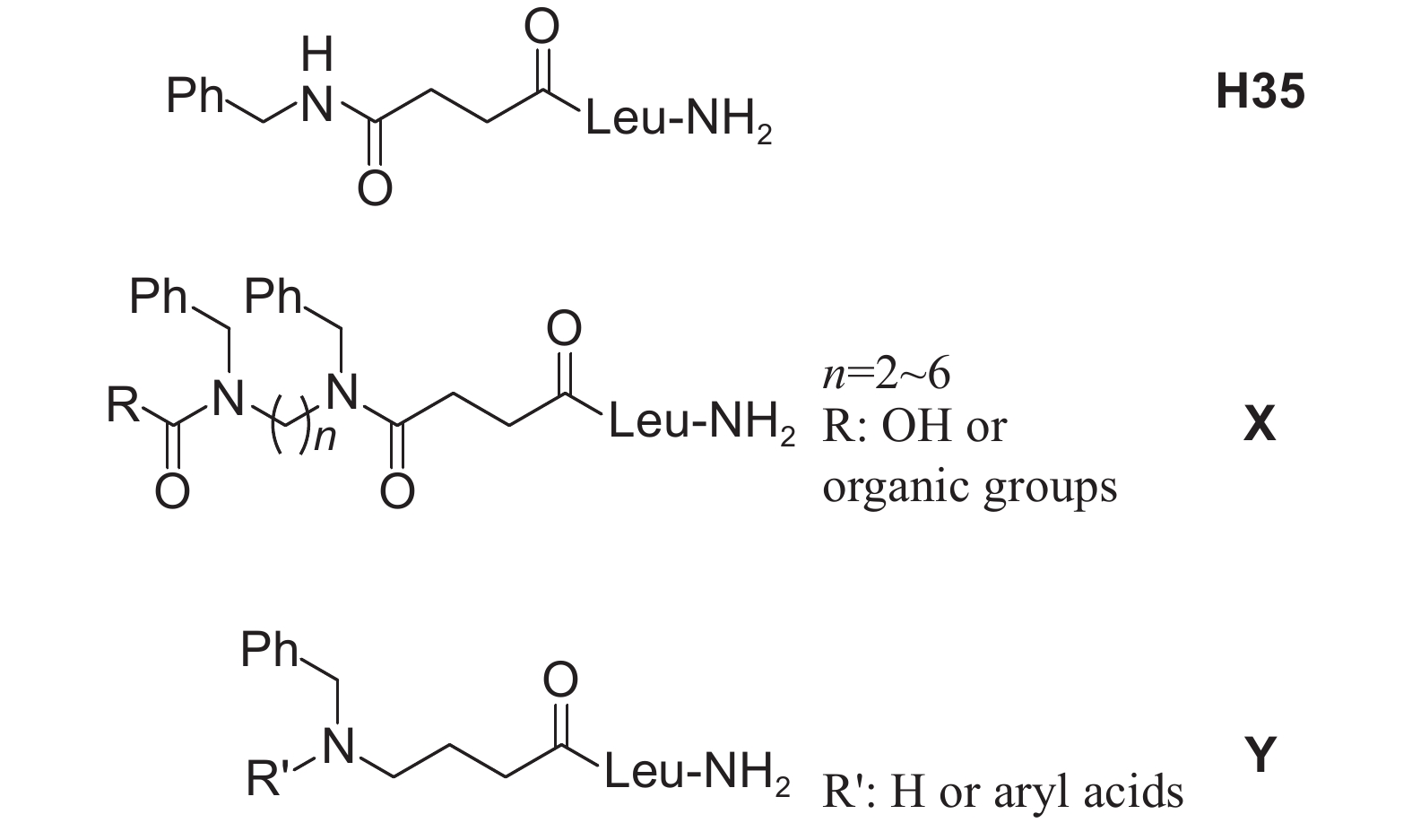
|
图式11 非肽类抑咽侧体素模拟物H35、X和Y的结构通式 Scheme11 The general formulas of non-peptide ASTs mimics H35, X and Y |
最近,开振鹏研究团队[81]以C端三肽 (FGLa) 为先导,设计合成了吡啶鎓盐类ASTs非肽模拟物 (图式12),生物活性测定结果表明,所有的非肽类似物 (S1~S5) 注射到成年雌性D. punctata体内后,显著抑制了保幼激素的生物合成;此外,S1 (IC50 = 0.020 mg/g) 和S3 (IC50 = 0.001 6 mg/g) 具有较高的胃毒活性,在害虫防治方面具有很大的潜力。这为ASTs类似物最终实现害虫防治的应用推动了一大步。
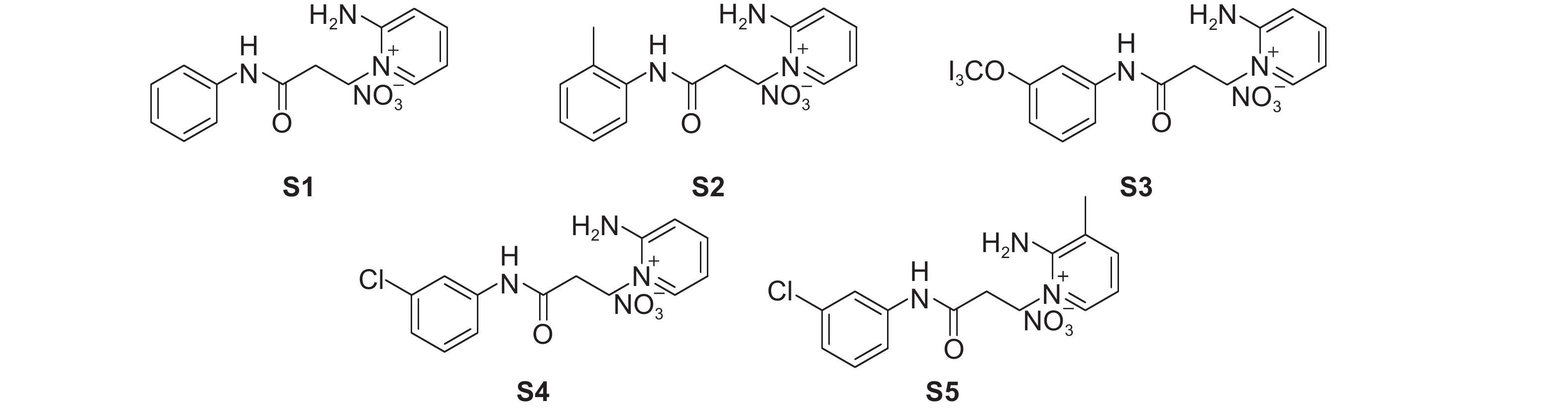
|
图式12 非肽类似物S1~S5的结构式 Scheme12 Structural formula of non-peptide analogues S1-S5 |
ASTs类似物的结构优化及初步构效关系对于设计、合成新型高活性化合物具有指导意义,然而伴随着ASTs及其类似物的深入研究,人们需要对ASTs及其类似物的活性构象和定量构效关系进行进一步的探索。
3.2 ASTs活性构象研究进展由于生物活性肽分子中存在许多单键,导致在不同的介质中可能同时存在多种不同的构象。不同的构象之间存在着平衡,所测得的构象常常是多种构象的平均状态,但生物活性肽必须通过特定的构象与受体相互作用才能控制生物体特定的生理生化过程。ASTs作为生物活性肽分子,其二级结构同样具有多样性,因此,有必要探索其与受体相互作用的生物活性构象。
Hayes等[73]采用分子动力学模拟的方法预测:Dippu-AST 4的核心五肽中“SFGL”之间存在II型β-转角构象,并认为该构象对活性有重要影响。之后,Nachman等[79]利用2D-NMR技术研究了ASTs类似物 (图式4) 在DMSO中的构象,认为β-转角构象是其最低能量构象,类似物1是Ⅰ′型β-转角,类似物2是Ⅱ型β-转角,类似物3是Ⅱ′型β-转角,类似物4a是II型β-转角 (图4)。类似物之间活性差别是由于非天然氨基酸空间大小和构象自由度的差别引起的,并推测β-转角构象可能是ASTs的活性构象。
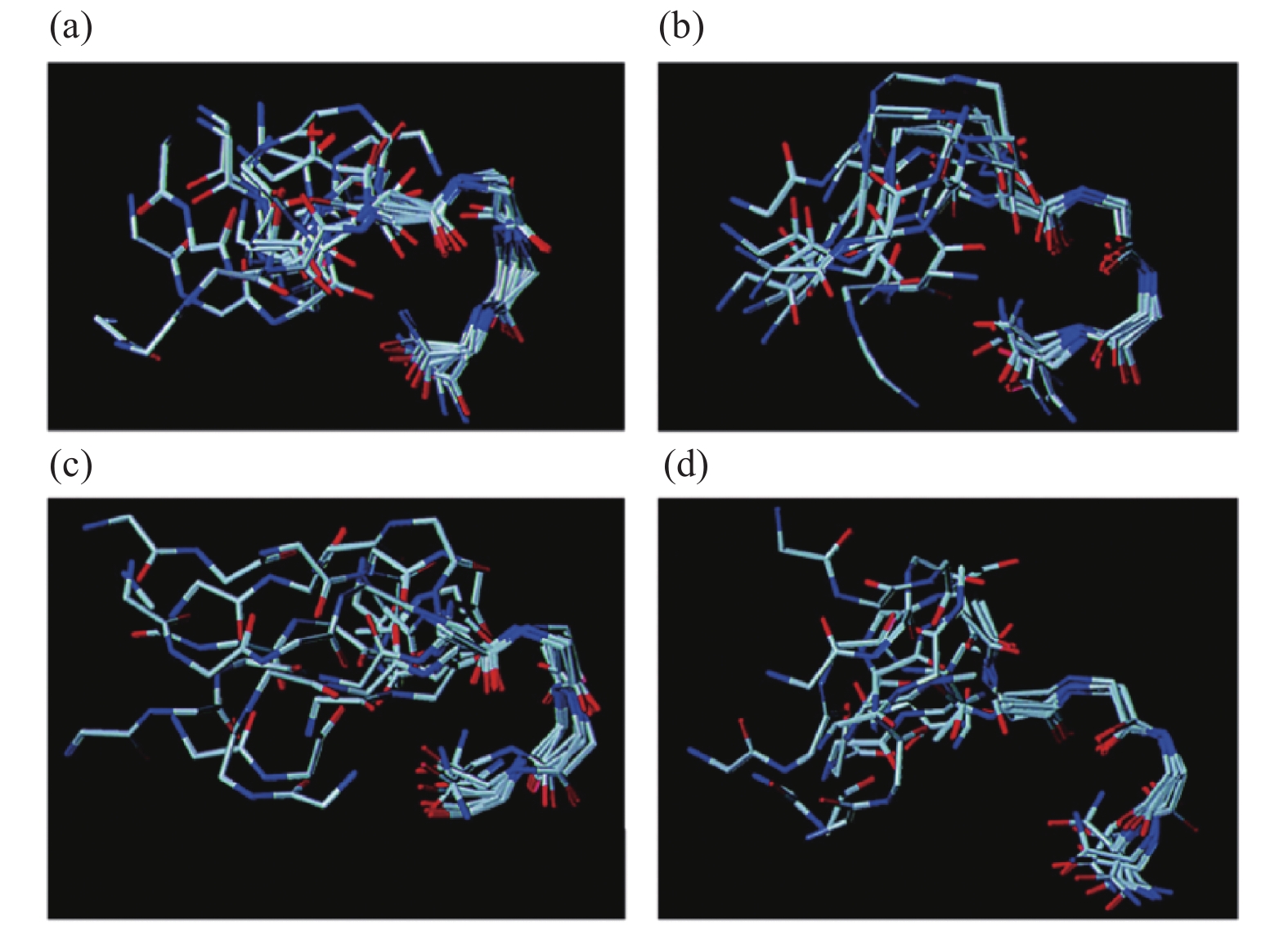
|
图 4 Dippu-AST 6类似物的最低能量构象,类似物1、2、3、4a分别对应图(a)、(b)、(c)和(d) (摘自Nachman等[79],1998) Fig. 4 The lowest energy conformation of Dippu-AST 6 analogues, (a) analogues 1, (b) analogues 2, (c) analogues 3 and (d) analogues 4a (quoted from Nachman et al[79], 1998) |
Yang等[82-83]利用NMR和分子动力学模拟的方法,分别研究了Dippu-AST 5、Dippu-AST 7、Dippu-AST 8 和Dippu-AST 9在水、三氟乙醇/水两种体系中的构象,认为4种AST在这两种体系中都具有类似的柔性构象。另外,他们还研究了Dippu-AST 2在70%三氟乙酸/30%重水混和溶液中的构象,认为在Ser3和Lys9之间存在螺旋构象,Val13处存在一个转角,Arg10和Leu18之间氨基酸侧链朝内,Arg10和Leu18侧链朝外。
2006年,杨新玲课题组的Kai等[77a]利用2D-NMR方法证实了天然Dippu-AST在DMSO溶液中以β-转角形式存在。利用分子动力学模型,选择7个天然AST分子研究了在水中的构象。结果表明,β-转角普遍存在于天然Dippu-AST结构中,大多数Dippu-AST的核心五肽中XFGLa片段可以形成β-转角,构象细微差别主要由X和N端序列引起。
Banerjee等[84]采用CD、NMR、分子动力学方法探索Dipppu-AST 5和Dipppu-AST 8在膜环境中的构象,用十二烷基磺酸钠盐模拟天然细胞膜环境,并没有发现其他研究者所认为的Dipppu-AST 5会形成β-转角构象,而是发现具有高抑制保幼激素生物合成活性的Dipppu-AST 5在膜环境下,核心区域存在γ-转角和310螺旋,Dipppu-AST 8在该条件下核心五肽区域存在π-转角 (图5)。
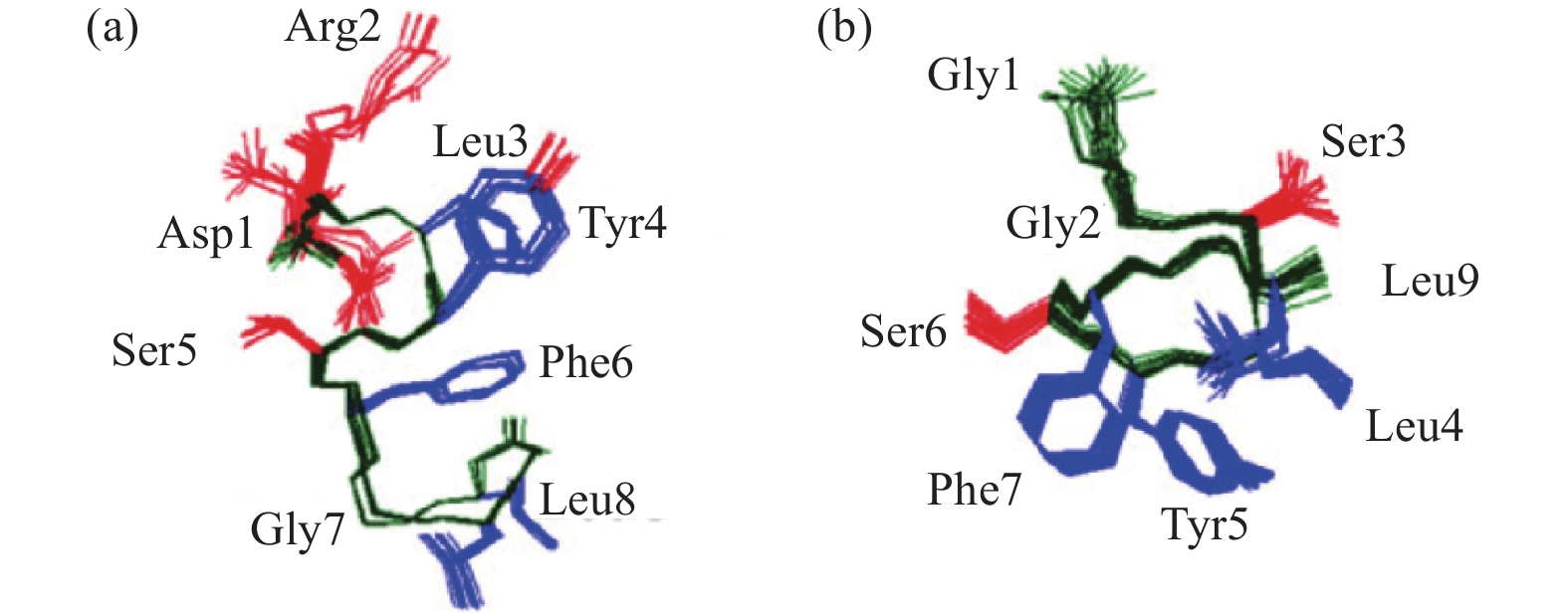
|
图 5 Dippu-AST 5 (a) 和Dippu-AST 8 (b) 的最低能量构象 (摘自Banerjee等[84],2008) Fig. 5 Minimum energy conformation of (a) Dippu-AST 5 and (b) Dippu-AST 8 (quoted from Banerjee et al[84], 2008) |
杨新玲课题组的谢勇[75c, 76d]和吴小庆[75f]报道了通过2D NMR和MD的方法,推测高活性的五肽类似物 (C1、C4) 活性构象可能是“线性”构象,并分析了N-甲基化修饰的ASTs类似物在溶液中的构象 (图6),结果初步证实了高活性的类似物保持了“线性”构象,而低活性的类似物 (C2、C3) 形成了β转角构象,并推测β转角构象可能不是活性构象。“线性”构象可能是ASTs类似物活性构象的假设,从而丰富了ASTs的理论研究。
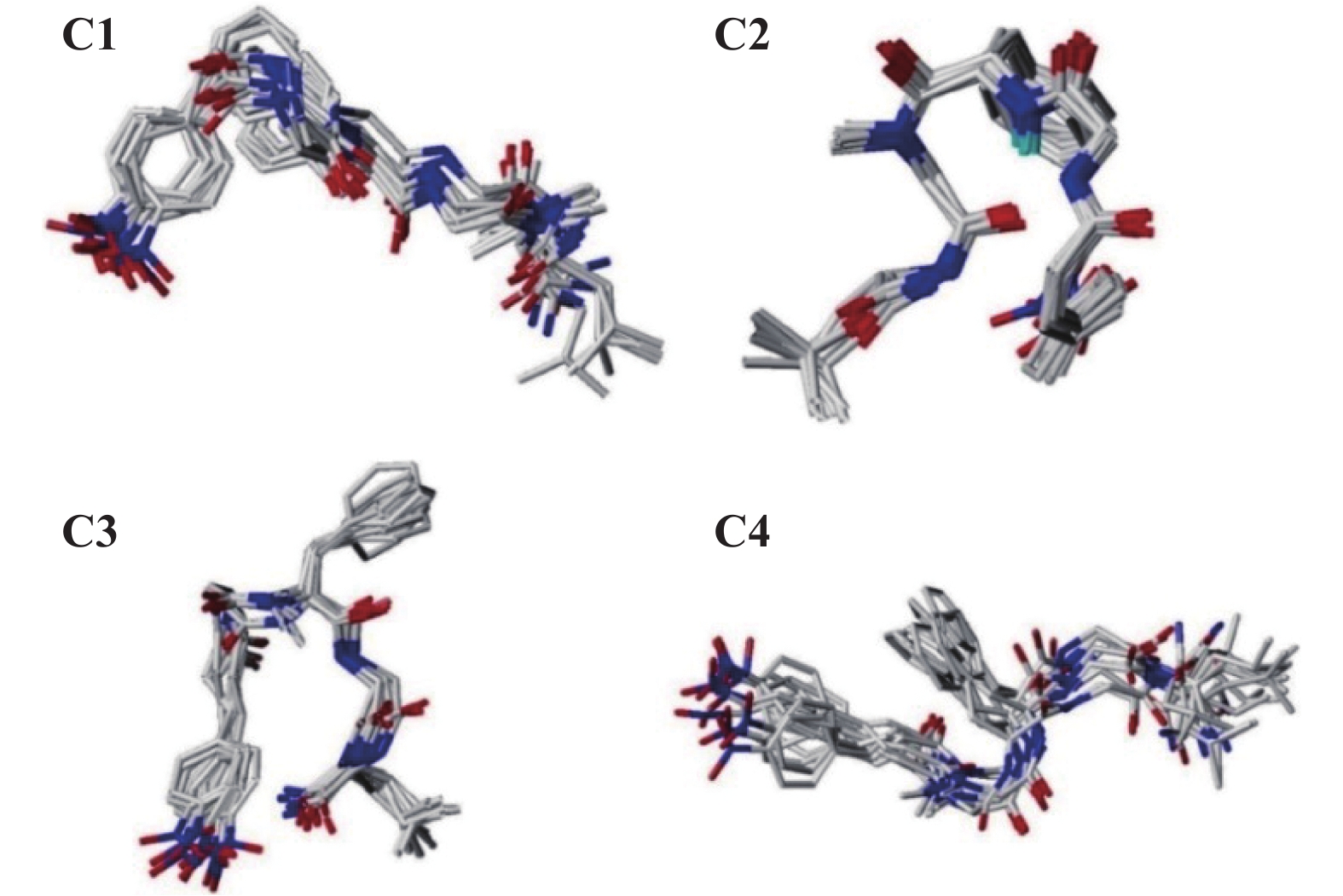
|
图 6 五肽类似物C1~C4的最低能量态 Fig. 6 The lowest energy state of pentapeptide analogues C1-C4 |
由于目前尚未获得ASTs与其受体相互作用的三维结构,研究者只能间接推测ASTs的生物活性构象。因此,探索ASTs生物活性构象将成为该研究领域的热点和难点。
3.3 ASTs类似物的构效关系研究进展在蟑螂体内,蜚蠊型ASTs在皮摩尔级剂量下即可高效地抑制保幼激素的合成,从而起到调控蟑螂生长发育的功能。尽管ASTs具有很高的体外抑制保幼激素合成的生物活性,但是由于天然多肽固有的一些缺点,如易于被肽酶降解而失活、运输功能差而不易到达作用靶点等等,限制了ASTs直接作为农药进行害虫防治的可能。为了克服天然ASTs的缺陷,许多研究者对其结构进行了修饰改造,探索ASTs结构与活性关系。例如:Nachman等[79]得到的ASTs类似物不仅部分保留了天然ASTs的离体活性,而且具备一定的活体活性;Piulachs等[78]采用酰胺键电子等排体 -COCH2-和-CH2NH-合成了ASTs的伪肽,不仅可以抑制蟑螂保幼激素的合成,还可以阻碍雌性蟑螂卵黄的生成。前人的工作尝试探索了ASTs类似物应用到害虫防治的可行性,但是上述类似物的活体活性不太显著,且类似物结构只是在ASTs上的细微改变,结构仍比较复杂 (至少6个以上的肽),合成成本高,离实际应用还有较大差距,因此仍然需要进一步的探索研究。
杨新玲课题组[75-77]采用模拟肽学的方法,对ASTs进行了结构简化和改造,获得了多个系列200余个ASTs类似物并进行了初步构效关系研究。通过试验证实C末端五肽是ASTs的核心区域,而其中的FGLa终端是保守部位[75a],并以核心五肽为先导发现了兼具离体和活体活性的小肽类化合物H17 (含4个氨基酸)[75a,b];紧接着又以H17为先导开展初步结构优化研究,发现2位氨基酸用亲水性基团替代、以及4位氨基酸上N甲基化对活性有利。值得欣喜的是,随着结构优化的进一步深入,还发现了具有较好活性的小分子非肽类化合物B1和I22(仅含1个氨基酸片段)(图式10)[75c,d]。同时明确了小分子模拟肽的活性构象是在XFGL区域形成了“linear”构象[75c,f]。
为了进一步研究ASTs类似物与生物活性之间的关系,本研究组选取32个核心五肽模拟物进行了分子全息定量构效关系的研究 (HQSAR,hologram quantitative structure-activity relationship),获得了具有较好预测能力的HQSAR模型 (q2为0.638,r2为0,878)[76a]。该模型表明,FGLa对保持类似物的生物活性非常重要,N末端的芳香性对活性也有一定贡献,中间Linker部分可能与受体产生氢键作用,可基于此进行适当修饰[76a]。该项工作为新的ASTs类似物的设计奠定了良好基础。
由于HQSAR是针对化合物的二维结构进行的构效关系研究,而生命体中化合物是以特定的三维活性构象与受体分子进行作用的,所以,进行ASTs类似物3D-QSAR的研究对深入探索构效关系具有重要意义。最近,杨新玲课题组[76h]以实验室前期合成的48个ASTs类似物为对象,首次将它们与同源模建的Dippu-AstR受体进行分子对接,获得类似物与受体结合的活性构象,并基于活性构象进行了3D-QSAR研究,获得了具有较好预测能力的3D-QSAR模型。3D-QSAR研究结果表明:1) N末端引入较大基团有利于活性提高;2) N末端引入电负性基团有利于活性提高;3) N末端4位点引入氢键受体有利于活性提高;4) 2位氨基酸侧链引入亲水性基团有利于活性提高;5) Phe苯环上均匀的电子云密度有利于活性提高。在此基础上,该课题组提出了ASTs类似物结构改造策略 (图7),分别在N末端苯环上的4位引入较大基团、2位氨基酸引入亲水性基团、3位氨基酸的苯环部分引入芳香环等进行了化合物的设计与合成,获得了离体活性优于先导H17的化合物A6 (图式13)[76h],进一步更系统的研究正在进行中。
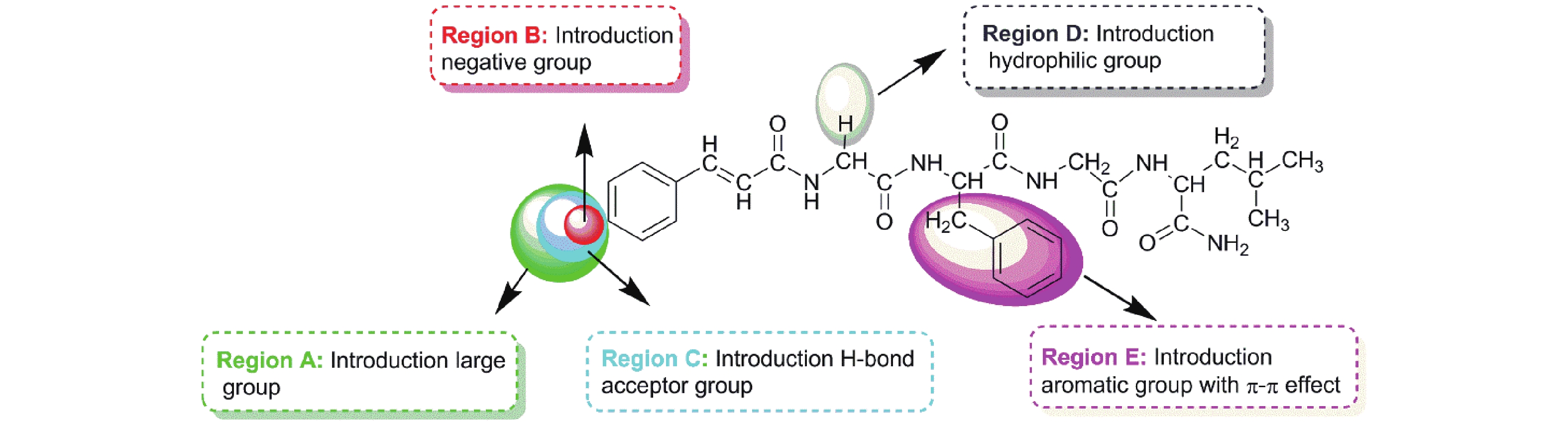
|
图 7 基于3D-QSAR的ASTs类似物结构改造策略 Fig. 7 General approach for the design of AST analogues based on 3D-QSAR |
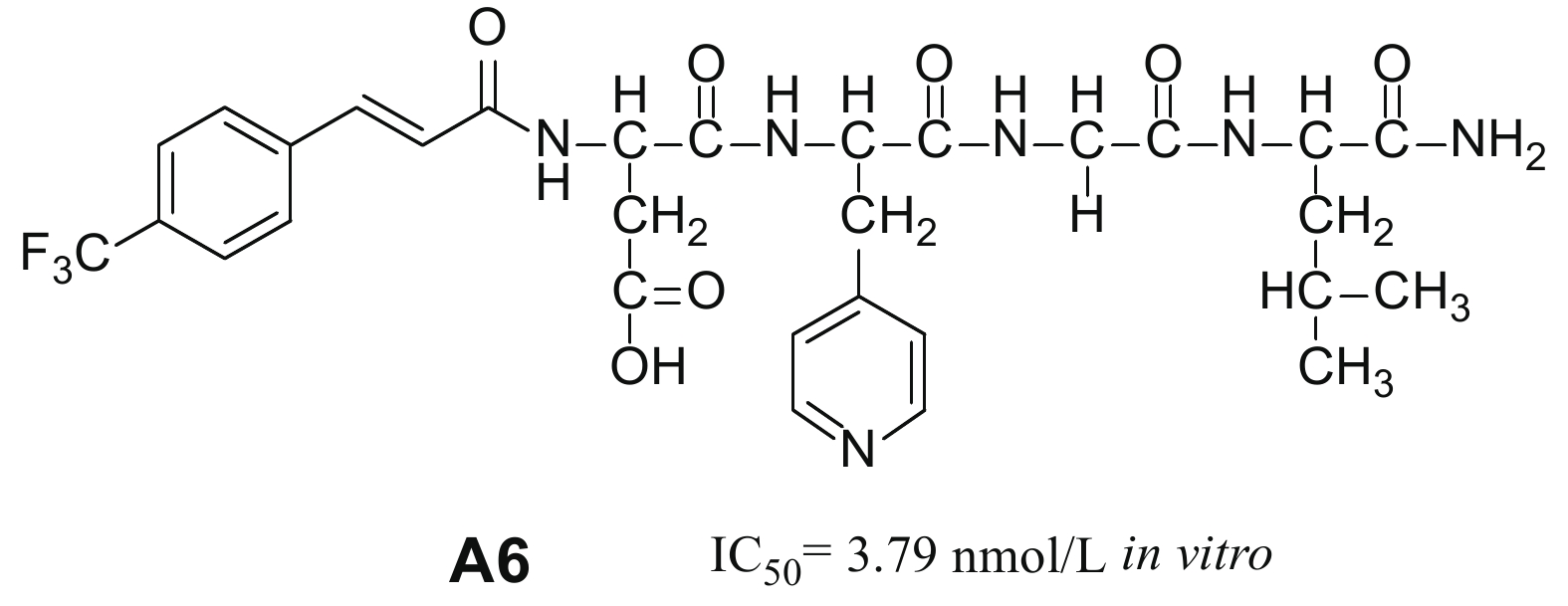
|
图式13 类似物A6的结构及活性 Scheme13 Structure and bioactivity of analog A6 |
此外,对实验室前期合成的25个非肽类化合物进行了3D-QASR研究[76g],构效关系分析表明:1) N末端引入较大基团有利于活性的提高;2) 2位氨基酸支链引入亲水性基团有利于活性的提高;3) 2位氨基酸引入氢键受体有利于活性的提高。该模型能够很好地解释并预测非肽类化合物的生物活性,可用于指导非肽类化合物的设计。
4 ASTs及其类似物的作用机制研究进展 4.1 昆虫ASTs受体研究进展昆虫中的ASTs受体属于G蛋白偶联受体 (GPCR),目前已有5个序列被表达,分别是来自黑腹果蝇Drosophila melanogaster中的2个AST受体,简写为DAR-1[85-86]和DAR-2[87];美洲大蠊P. americana中的ASTs受体,简写为PAR[88];家蚕Bombyx moriLinnaeus中的ASTs受体,简写为BAR[89]以及太平洋折翅蠊Diploptera punctata中的ASTs受体,简写为Dippu-AstR[90]。研究表明,Dippu-AstR和其他4个昆虫AST受体的序列有很大的相似性,其中,Dippu-AstR与DAR-1的序列相似性为52%,与DAR-2的序列相似性为44%[90]。而且,细胞试验表明,黑腹果蝇中的两个AST受体DAR-1和DAR-2与蜚蠊型天然AST-5、AST-7、AST-8、AST-9的作用不同[91]。这些研究结果表明,具有FGL-NH2类型的蜚蠊型ASTs除了对Dippu-AstR有较高活性外,对DAR-1和DAR-2也可能具有不同程度的活性,可能是一类更具普适性的先导化合物。
因为GPCR是跨膜蛋白,不易得到晶体,早期仅有牛视紫质蛋白 (pdb ID:1U19)[92]和人体β2-肾上腺素受体 (pdb ID:2RH1)[93]的GPCR晶体三维结构被报道,但迄今尚未见关于昆虫中的ASTs受体三维晶体结构的报道。为此,笔者在前期研究[94]中,以已知的牛视紫质蛋白 (pdb ID:1U19) 和人体内β2-肾上腺素受体 (pdb ID:2RH1) 的晶体结构为模板,采用Modeler方法构建了Dippu-AstR三维模拟结构,但因选取的模板蛋白与Dippu-AstR受体的同源性很低 (< 20%),所模建的ASTs受体结构的可靠性并不理想。随后,我们发现2012年Manglik[95]和Thompson[96]所报道的几个肽受体晶体结构与昆虫ASTs受体的序列相似性有一定提高,于是,又以鼠μ-肽受体 (pdb ID:4DKL) 和人肽受体 (pdb ID:4EA3) 作为新的模板蛋白,采用MOE软件分别构建了Dippu-AstR、DAR-1和DAR-2的三维结构,并进行了模型验证。近年来,Huang等[81]选择痛敏肽/孤啡肽FQ受体 (PDB ID:4EA3)(与Dippu-AstR序列有37%相似性) 进行模建,进而获得同源模建的Dippu-AstR。笔者[75g]以48个ASTs类似物与同源模建的Dippu-AstR受体进行分子对接,发现该受体中的Tyr253与ASTs类似物之间形成的氢键对活性至关重要,同时进行了基于受体的3D-QSAR及结构优化研究,获得了更高活性的ASTs类似物,这些工作为ASTs受体的进一步研究奠定了良好基础。
4.2 ASTs及其类似物的作用机制研究如前所述,天然ASTs是一类具有抑制咽侧体合成和释放保幼激素功能,从而影响昆虫生长发育的昆虫神经肽,最早从蜚蠊中分离得到。在蟑螂体内,蜚蠊型ASTs以皮摩尔级的剂量即可高效地抑制保幼激素的合成,从而起到调控蟑螂生长发育的功能。天然ASTs是如何抑制保幼激素合成进而调控昆虫生长发育的?近年来,一些科学家对此进行了初步的研究。
昆虫保幼激素是昆虫生长和发育的一个关键调节因子,保幼激素的生物合成涉及13个独立的酶促反应。以乙酰辅酶A为起始原料,经过甲羟戊酸途径得到法尼醇,再经氧化和甲基化得到[97]。Tobe课题组[98]研究了太平洋折翅蠊中保幼激素合成通路,并对外源的保幼激素前体物对合成通路的影响进行了分析。通过RNA干扰技术下调了HMG-CoA还原酶 (HMGR) 和保幼激素酸甲基转移酶 (JHAMT) 基因的转录,来研究对雌性蟑螂成虫保幼激素通路关闭的影响,结果表明,沉默HMGR和JHAMT基因导致保幼激素生物合成的下降,从而使卵母细胞发育缓慢。卵母细胞的长度、脂肪体Vg基因的转录水平和卵黄原蛋白的含量都显著下降,此外也会导致该通路上的其他基因转录水平下降。Tobe课题组[99]还通过荧光定量PCR和RNA干扰技术,初步研究了FGLamide ASTs的作用机制。首先确定了太平洋折翅蠊受体 (Dippu-AstR) 的组织分布,然后进行了ASTs与受体的结合活性研究。结果显示,13个天然的ASTs均能在不同剂量下与受体相互作用。通过AstR的功能性试验发现,FGLamide ASTs是通过提升细胞钙离子和cAMP水平,降低保幼激素合成原料乙酰辅酶A的量,最终抑制保幼激素的生物合成。该研究表明,ASTs影响保幼激素的生物合成是在乙酰辅酶A进入保幼激素生物合成通路之前,ASTs可能是抑制了咽侧体细胞中线粒体乙酰辅酶A生成所需酶或转运蛋白的表达。Fernando课题组[100]在埃及伊蚊保幼激素生物合成途径的研究中,提出了PISCF-ASTs可能是通过抑制线粒体柠檬酸转运蛋白的表达发挥抑制保幼激素合成的功能。
本课题组也初步探索了部分ASTs类似物与受体结合的研究。结果发现,ASTs类似物均能激活太平洋折翅蠊Dippu-AstR,部分类似物 (L5、L6和M11) 与Dippu-AstR作用活性在纳摩尔级别,但均不及天然AST6的活性高[75f, 76d]。关于ASTs类似物抑制保幼激素合成的作用机制如何?其是否与天然ASTs相同?这些问题迄今尚未见报道,值得进行深入的探索和研究。
5 展望ASTs能以皮摩尔级的剂量高效地抑制昆虫保幼激素的生物合成,从而调控昆虫生长发育的功能,具有高效、生态安全的特点,因此,被认为是潜在的害虫控制剂,但其易酶解、环境不稳定性及成本高的缺陷限制了其实际应用。人们以ASTs为先导,进行作用靶标和结构均新颖的昆虫生长调节剂创制探索研究,已经取得比较好的阶段性成果。例如,获得了结构与活性之间的初步关系规律,建立了具有较好预测能力的3D-QSAR模型,发现了结构比天然ASTs简单、且具有活体活性的小分子模拟肽化合物等,这为将来发现具有实用开发价值的可作为IGRs的ASTs类似物奠定了良好基础。但是,能否解决化合物结构更加简单高效、且作用谱更广的成药性要求,以及高活性化合物是如何调控保幼激素合成的作用机制等,将是昆虫神经肽杀虫剂创制所面临的主要问题。相信随着分子生物学、药物分子设计、模拟肽学等技术的不断发展,将为这些问题的解决提供更多的途径和方法,也为以ASTs类似物为代表的新型模拟肽类昆虫生长调节剂的研发带来曙光。
| [1] |
AHMAD V, KHAN M S, JAMAL Q M S, et al. Antimicrobial potential of bacteriocins: in therapy, agriculture and food preservation[J]. Int J Antimicrob Agents, 2017, 49(1): 1-11. DOI:10.1016/j.ijantimicag.2016.08.016 |
| [2] |
燕晓翠, 杨春蕾, 姚大为, 等. 抗菌肽的国内外研究进展[J]. 天津农业科学, 2017, 23(5): 35-41. YAN X C, YANG C L, YAO D W, et al. Research progress on domestic and abroad of antibacterial peptides[J]. Tianjin Agric Sci, 2017, 23(5): 35-41. DOI:10.3969/j.issn.1006-6500.2017.05.008 |
| [3] |
严沁, 张传强, 智达夫, 等. 抗菌肽在动物生产上的应用[J]. 畜牧与饲料科学, 2015, 36(12): 92-94. YAN Q, ZHANG C Q, ZHI D F, et al. Application of antimicrobial peptides in animal production[J]. Animal Husb Feed Sci, 2015, 36(12): 92-94. DOI:10.3969/j.issn.1672-5190.2015.12.034 |
| [4] |
WANG S, ZENG X F, YANG Q, et al. Antimicrobial peptides as potential alternatives to antibiotics in food animal industry[J]. IJMS, 2016, 17(5): 603. DOI:10.3390/ijms17050603 |
| [5] |
蒋细兵, 余迪求. 植物多肽激素研究概况[J]. 云南植物研究, 2008, 30(3): 333-339. JIANG X B, YU D Q. Peptide hormones in plants[J]. Acta Bot Yunnanica, 2008, 30(3): 333-339. DOI:10.3969/j.issn.2095-0845.2008.03.007 |
| [6] |
王莲存, 朱大权, 刘德能, 等. 多肽保对病害防控及其增产效果初探[J]. 云南农业, 2014(5): 20-22. WANG L C, ZHU D Q, LIU D N, et al. Preliminary study on disease control and yield increase effect of DUOTAIBAO[J]. Yunnan Agriculture, 2014(5): 20-22. DOI:10.3969/j.issn.1000-0488.2014.05.007 |
| [7] |
何正春, 刘光明, 王晓雨, 等. 美洲大蠊神经肽的研究进展[J]. 天然产物研究与开发, 2008, 20(1): 180-186. HE Z C, LIU G M, WANG X Y, et al. Research advance on neuropeptides from Periplaneta americana [J]. Nat Prod Res Dev, 2008, 20(1): 180-186. DOI:10.3969/j.issn.1001-6880.2008.01.044 |
| [8] |
GADE G, HOFFMANN K H. Neuropeptides regulating development and reproduction in insects[J]. Physiol Entomol, 2005, 30(2): 103-121. DOI:10.1111/pen.2005.30.issue-2 |
| [9] |
KATAOKA H, NAGASAWA H, ISOGAI A, et al. Prothoracicotropic hormone of the silkworm, Bombyx Mori: Amino acid sequence and dimeric structure
[J]. Agric Biol Chem, 1991, 55(1): 73-86. |
| [10] |
HUA Y J, TANAKA Y, NAKAMURA K, et al. Identification of a prothoracicostatic peptide in the larval brain of the silkworm, Bombyx Mori
[J]. J Biol Chem, 1999, 274(44): 31169-31173. DOI:10.1074/jbc.274.44.31169 |
| [11] |
STAY B. A review of the role of neurosecretion in the control of juvenile hormone synthesis: a tribute to Berta Scharrer[J]. Insect Biochem Mol Biol, 2000, 30(8-9): 653-662. DOI:10.1016/S0965-1748(00)00036-9 |
| [12] |
KATAOKA H, TROETSCHLER R G, KRAMER S J, et al. Isolation and primary structure of the eclosion hormone of the tobacco hornworm, Manduca sexta
[J]. Biochem Biophys Res Commun, 1987, 146(2): 746-750. DOI:10.1016/0006-291X(87)90592-4 |
| [13] |
GIRARDIE J, RICHARD O, HUET J C, et al. Physical characterization and sequence identification of the ovary maturating parsin[J]. European Journal of Biochemistry, 1991, 202(3): 1121-1126. DOI:10.1111/ejb.1991.202.issue-3 |
| [14] |
NACHMAN R J, HOLMAN G M, HADDON W F. Leads for insect neuropeptide mimetic development[J]. Arch Insect Biochem Physiol, 1993, 22(1-2): 181-197. DOI:10.1002/arch.940220115 |
| [15] |
PREDEL R, NACHMAN R J. The FXPRLamide (pyrokinin/PBAN) peptide family[M/OL]//Handbook of biologically active peptides, elsevier, 2006: 207-212. DOI: 10.1016/b978-012369442-3/50035-0
|
| [16] |
COAST G M, ORCHARD I, PHILLIPS J E, et al. Insect diuretic and antidiuretic hormones[M/OL]//Advances in insect physiology. Elsevier, 2002: 279-409. DOI: 10.1016/s0065-2806(02)29004-9
|
| [17] |
STONE J V, MORDUE W, BATLEY K E, et al. Structure of locust adipokinetic hormone, a neurohormone that regulates lipid utilisation during flight[J]. Nature, 1976, 263(5574): 207-211. DOI:10.1038/263207a0 |
| [18] |
BROWN B E. Proctolin: A peptide transmitter candidate in insects[J]. Life Sci, 1975, 17(8): 1241-1252. DOI:10.1016/0024-3205(75)90133-2 |
| [19] |
HOLMAN G M, NACHMAN R J, COAST G M. Isolation, characterization and biological activity of a diuretic myokinin neuropeptide from the housefly, Musca domestica
[J]. Peptides, 1999, 20(1): 1-10. DOI:10.1016/S0196-9781(98)00150-8 |
| [20] |
NACHMAN R J, HOLMAN G M. Myotropic insect neuropeptide families from the cockroach Leucophaea maderae[M]//ACS symposium series. Washington, DC: American Chemical Society, 1991: 194-214. DOI: 10.1021/bk-1991-0453.ch018
|
| [21] |
MAGGIO E. Tachykinins[J]. Annu Rev Neurosci, 1988, 11(1): 13-28. DOI:10.1146/annurev.ne.11.030188.000305 |
| [22] |
EVANS P D, ROBB S, CUTHBERT B A. Insect neuropeptides-identification, establishment of functional roles and novel target sites for pesticides[J]. Pestic Sci, 1989, 25(1): 71-83. DOI:10.1002/ps.v25:1 |
| [23] |
a) MASLER E P, KELLY T J, MENN J J. Insect neuropeptides: Discovery and application in insect management[J]. Arch Insect Biochem Physiol, 1993, 22(1-2): 87-111.b) BLAND J M, EDWARD J W, EATON S R, et al. Potential of natural peptidic compounds as leads for novel pesticides[J]. Pestic Sci, 1993, 39(4): 331-340.
|
| [24] |
GÄDE G, GOLDSWORTHY G J. Insect peptide hormones: a selective review of their physiology and potential application for pest control[J]. Pest Manag Sci, 2003, 59(10): 1063-1075. DOI:10.1002/ps.v59:10 |
| [25] |
SCHOOFS L, DE LOOF A, VAN HIEL M B. Neuropeptides as regulators of behavior in insects[J]. Annu Rev Entomol, 2017, 62(1): 35-52. DOI:10.1146/annurev-ento-031616-035500 |
| [26] |
NACHMAN R J. Neuropeptides and receptors as targets for bioinsecticides. Abstracts of Papers[C]// 246th ACS National Meeting & Exposition, Indianapolis, IN, United States, September 8-12, 2013, AGRO-137.
|
| [27] |
SCHERKENBECK J, ZDOBINSKY T. Insect neuropeptides: Structures, chemical modifications and potential for insect control[J]. Bioorg Med Chem, 2009, 17(12): 4071-4084. DOI:10.1016/j.bmc.2008.12.061 |
| [28] |
SCHWARTZ E F, MOURÃO C B, MOREIRA K G, et al. Arthropod venoms: a vast arsenal of insecticidal neuropeptides[J]. Biopolymers, 2012, 98(4): 385-405. DOI:10.1002/bip.v98.4 |
| [29] |
GILON C, ALTSTEIN M. Backbone cyclic peptide fragments derived from pheromone biosynthesis activating neuropeptide PBAN and their use as insecticides: WO 9928339[P]. 1999-06-10.
|
| [30] |
SCHWARZ M A. Novel neuropeptides useful as insecticides: WO 2015052701[P]. 2015-04-16.
|
| [31] |
CHOI M Y, VANDER M, ROBERT K. Bioactive peptides having insecticide activity: US 20160262388[P]. 2016-09-15.
|
| [32] |
SEINSCHE A, DYKER H, LOSEL P, et al. Effect of helicokinins and ACE inhibitors on water balance and development of Heliothis virescens larvae
[J]. Journal of Insect Physiology, 2000, 46(11): 1423-1431. DOI:10.1016/S0022-1910(00)00065-2 |
| [33] |
MA M, EMERY S B, WONG W K R, et al. Effects of Manduca diuresin on neonates of the tobacco hornworm, Manduca sexta
[J]. Gen Comp Endocrinol, 2000, 118: 1-7. DOI:10.1006/gcen.1999.7435 |
| [34] |
MATTHEWS H J, AUDSLEY N, WEAVER R J. In vitro and in vivo effects of myo-active peptides on larvae of the tomato moth Lacanobia oleraceaand the Cotton leafworm Spodoptera littoralis (Lepidoptera; Noctuidae)
[J]. Arch Insect Biochem Physiol, 2008, 69(2): 60-69. DOI:10.1002/arch.v69:2 |
| [35] |
SMAGGHE G, MAHDIAN K, ZUBRZAK P, et al. Antifeedant activity and high mortality in the pea aphid Acyrthosiphon Pisum (Hemiptera: Aphidae) induced by biostable insect kinin analogs
[J]. Peptides, 2010, 31(3): 498-505. DOI:10.1016/j.peptides.2009.07.001 |
| [36] |
a) WOODHEAD A P, STAY B, SEIDEL S L, et al. Primary structure of four allatostatins: neuropeptide inhibitors of juvenile hormone synthesis[J]. Proc Natl Acad Sci, 1989, 86(15): 5997-6001. b) WOODHEAD A P, STAY B. Neural inhibition of corpora allata in protein-deprived Diploptera punctata[J]. J Insect Physiol, 1989, 35(5): 415-421.
|
| [37] |
PRATT G E, FARNSWORTH D E, FOK K F, et al. Identity of a second type of allatostatin from cockroach brains: an octadecapeptide amide with a tyrosine-rich address sequence[J]. Proc Natl Acad Sci, 1991, 88(6): 2412-2416. DOI:10.1073/pnas.88.6.2412 |
| [38] |
PRATT G E, FARNSWORTH D E, SIEGEL N R, et al. Identification of an allatostatin from adult Diploptera punctata
[J]. Biochem Biophys Res Commun, 1989, 163(3): 1243-1247. DOI:10.1016/0006-291X(89)91111-X |
| [39] |
曾辉明, 黄俊生. 昆虫神经肽allatostatin的研究进展[J]. 生命科学, 2003, 15(3): 168-172, 191. ZENG H M, HUANG J S. Advances of research on insect neuropeptide allatostatin[J]. Chin Bull Life Sci, 2003, 15(3): 168-172, 191. DOI:10.3969/j.issn.1004-0374.2003.03.010 |
| [40] |
NATHOO A N, MOELLER R A, WESTLUND B A, et al. Identification of neuropeptide-like protein gene families in Caenorhabditis elegans and other species[J]. Proc Natl Acad Sci USA, 2001, 98(24): 14000-14005. DOI:10.1073/pnas.241231298 |
| [41] |
HULT E F, WEADICK C J, CHANG B S W, et al. Reconstruction of ancestral FGLamide-type insect allatostatins: A novel approach to the study of allatostatin function and evolution[J]. J Insect Physiol, 2008, 54(6): 959-968. DOI:10.1016/j.jinsphys.2008.04.007 |
| [42] |
DONLY B C, DING Q, TOBE S S, et al. Molecular cloning of the gene for the allatostatin family of neuropeptides from the cockroach Diploptera punctata
[J]. Proc Natl Acad Sci, 1993, 90(19): 8807-8811. DOI:10.1073/pnas.90.19.8807 |
| [43] |
DING Q, DONLY B C, TOBE S S, et al. Comparison of the allatostatin neuropeptide precursors in the distantly related cockroaches, Periplaneta americana and Diploptera punctata
[J]. Eur J Biochem, 1995, 234(3): 737-746. DOI:10.1111/ejb.1995.234.issue-3 |
| [44] |
PREDEL R, KELLNER R, RAPUS J, et al. Allatostatins from the retrocerebral complex and antennal pulsatile organ of the American cockroach: structural elucidation aided by matrix-assisted laser desorption/ionization-time-of-flight mass spectrometry[J]. Regul Pept, 1999, 82(1-3): 81-89. DOI:10.1016/S0167-0115(99)00045-2 |
| [45] |
LORENZ M W, KELLNER R, HOFFMANN K H. Identification of two allatostatins from the cricket, Gryllus bimaculatus de Geer (Ensifera, Gryllidae): additional members of a family of neuropeptides inhibiting juvenile hormone biosynthesis
[J]. Regul Pept, 1995, 57(3): 227-236. DOI:10.1016/0167-0115(95)00036-B |
| [46] |
YOON J G, STAY B. Immunocytochemical localization of Diploptera punctata allatostatin-like peptide in Drosophila melanogaster
[J]. J Comp Neurol, 1995, 363(3): 475-488. DOI:10.1002/(ISSN)1096-9861 |
| [47] |
ALTARATZ M, APPLEBAUM S W, RICHARD D S, et al. Regulation of juvenile hormone synthesis in wild-type and apterous mutant Drosophila[J]. Mol Cell Endocrinol, 1991, 81(1-3): 205-216. DOI:10.1016/0303-7207(91)90219-I |
| [48] |
ABDEL-LATIEF M, MEYERING-VOS M, HOFFMANN K H. Type-A allatostatins from the fall armyworm, Spodoptera frugiperda: Molecular cloning, expression and tissue-specific localization
[J]. Arch Insect Biochem Physiol, 2004, 56(3): 120-132. DOI:10.1002/(ISSN)1520-6327 |
| [49] |
ABDEL-LATIEF M, MEYERING-VOS M, HOFFMANN K H. Molecular characterisation of cDNAs from the fall armyworm Spodoptera frugiperda encoding Manduca sexta allatotropin and allatostatin preprohormone peptides
[J]. Insect Biochem Mol Biol, 2003, 33(5): 467-476. DOI:10.1016/S0965-1748(03)00005-5 |
| [50] |
CLARK L, LANGE A B, ZHANG J R, et al. The roles of Dippu-allatostatin in the modulation of hormone release in Locusta migratoria[J]. J Insect Physiol, 2008, 54(6): 949-958. DOI:10.1016/j.jinsphys.2008.03.007 |
| [51] |
DUVE H, JOHNSEN A H, SCOTT A G, et al. Callatostatins: neuropeptides from the blowfly Calliphora vomitoria with sequence homology to cockroach allatostatins
[J]. Proc Natl Acad Sci, 1993, 90(6): 2456-2460. DOI:10.1073/pnas.90.6.2456 |
| [52] |
KWOK R, JIN R Z, TOBE S S. Regulation of methyl farnesoate production by mandibular organs in the crayfish, Procambarus clarkii: A possible role for allatostatins
[J]. J Insect Physiol, 2005, 51(4): 367-378. DOI:10.1016/j.jinsphys.2004.12.010 |
| [53] |
DUVE H, JOHNSEN A H, SCOTT A G, et al. Allatostatins of the tiger prawn, Penaeus monodon (Crustacea: Penaeidea)
[J]. Peptides, 2002, 23(6): 1039-1051. DOI:10.1016/S0196-9781(02)00035-9 |
| [54] |
KASTIN A. Handbook of biologically active peptides (second edition)[M]. Burlington: Academic Press, 2013.
|
| [55] |
STAY B, TOBE S S, BENDENA W G. Allatostatins: identification, primary structures, functions and distribution[M/OL]//Advances in insect physiology. Elsevier, 1995: 267-337. DOI: 10.1016/s0065-2806(08)60066-1
|
| [56] |
WOODHEAD A P, ASANO W Y, STAY B. Allatostatins in the haemolymph of Diploptera punctata and their effect in vivo
[J]. J Insect Physiol, 1993, 39(12): 1001-1005. DOI:10.1016/0022-1910(93)90124-A |
| [57] |
FUSÉ M, ZHANG J R, PARTRIDGE E, et al. Effects of an allatostatin and a myosuppressin on midgut carbohydrate enzyme activity in the cockroach Diploptera punctata
[J]. Peptides, 1999, 20(11): 1285-1293. DOI:10.1016/S0196-9781(99)00133-3 |
| [58] |
YU C G, HAYES T K, STREY A, et al. Identification and partial characterization of receptors for allatostatins in brain and corpora allata of the cockroach Diploptera punctata using a binding assay and photoaffinity labeling
[J]. Regul Pept, 1995, 57(3): 347-358. DOI:10.1016/0167-0115(95)00048-G |
| [59] |
STAY B, SEREG BACHMANN J A, STOLTZMAN C A, et al. Factors affecting allatostatin release in a cockroach (Diploptera punctata): Nerve section, juvenile hormone analog and ovary
[J]. J Insect Physiol, 1994, 40(5): 365-372. DOI:10.1016/0022-1910(94)90154-6 |
| [60] |
关雪辰. 昆虫神经肽allatostatin与allatotropin的研究新近展[J]. 昆虫学报, 1996, 39(2): 214-218. GUAN X C. Recent advances in research on insect neuropeptides allatostatin and allatotropin[J]. Acta Entomol Sin, 1996, 39(2): 214-218. |
| [61] |
HERNÁNDEZ-MARTÍNEZ S, LI Y P, LANZ-MENDOZA H, et al. Immunostaining for allatotropin and allatostatin-A and -C in the mosquitoes Aedes aegypti and Anopheles albimanus
[J]. Cell Tissue Res, 2005, 321(1): 105-113. DOI:10.1007/s00441-005-1133-5 |
| [62] |
a) STAY B, FAIRBAIRN S, YU C G. Role of allatostatins in the regulation of juvenile hormone synthesis[J]. Arch Insect Biochem Physiol, 1996, 32(3-4): 287-297. b) STAY B, TOBE S S. The role of allatostatins in juvenile hormone synthesis in insects and crustaceans[J]. Annu Rev Entomol, 2007, 52(1): 277-299. |
| [63] |
MAESTRO J L, PASCUAL N, TREIBLMAYR K, et al. Juvenile hormone and allatostatins in the German cockroach embryo
[J]. Insect Biochem Mol Biol, 2010, 40(9): 660-665. DOI:10.1016/j.ibmb.2010.06.006 |
| [64] |
TOBE S S, ZHANG J R, BOWSER P R F, et al. Biological activities of the allatostatin family of peptides in the cockroach, Diploptera punctata, and potential interactions with receptors
[J]. J Insect Physiol, 2000, 46(3): 231-242. DOI:10.1016/S0022-1910(99)00175-4 |
| [65] |
LANGE A B, BENDENA W G, TOBE S S. The effect of the thirteen Dip-allatostatins on myogenic and induced contractions of the cockroach (Diploptera punctata) hindgut
[J]. J Insect Physiol, 1995, 41(7): 581-588. DOI:10.1016/0022-1910(95)00008-I |
| [66] |
AUDSLEY N, MATTHEWS J, NACHMAN R J, et al. Transepithelial flux of an allatostatin and analogs across the anterior midgut of Manduca sexta larvae in vitro
[J]. Peptides, 2008, 29(2): 286-294. DOI:10.1016/j.peptides.2007.07.033 |
| [67] |
MARTÍN D, PIULACHS M D, BELLÉS X. Inhibition of vitellogenin production by allatostatin in the German cockroach
[J]. Mol Cell Endocrinol, 1996, 121(2): 191-196. DOI:10.1016/0303-7207(96)03864-6 |
| [68] |
JOHNSON G D, STAY B, CHAN K K. Structure-activity relationships in corpora allata of the cockroach Diploptera punctata: roles of mating and the ovary
[J]. Cell Tissue Res, 1993, 274(2): 279-293. DOI:10.1007/BF00318747 |
| [69] |
VILAPLANA L, MAESTRO J L, PIULACHS M D, et al. Modulation of cardiac rhythm by allatostatins in the cockroach Blattella germanica (L.) (Dictyoptera, Blattellidae)
[J]. J Insect Physiol, 1999, 45(12): 1057-1064. DOI:10.1016/S0022-1910(99)00089-X |
| [70] |
NACHMAN R J, GARSIDEB C S, TOBEB S S. Hemolymph and tissue-bound peptidase-resistant analogs of the insect allatostatins[J]. Peptides, 1999, 20(1): 23-29. DOI:10.1016/S0196-9781(98)00149-1 |
| [71] |
周家驹, 王亭. 药物设计中的分子模型化方法[M]. 科学出版社, 2001. ZHOU J J, WANG T. Molecular modoling in drug design[M]. Science Press, 2001. |
| [72] |
STAY B, WOODHEAD A P, JOSHI S, TOBE S S, et al. Allatostatins. Neuropeptide inhibitors of juvenile hormone synthesis in brain and corpora allata of the cockroach Diploptera punctata
[J]. ACS Symp Ser, 1991, 453(Insect Neuropept.): 164-176. |
| [73] |
HAYES T K, GUAN X C, JOHNSON V, et al. Structure-activity studies of allatostatin 4 on the inhibition of juvenile hormone biosynthesis by corpora allata: the importance of individual side chains and stereochemistry[J]. Peptides, 1994, 15(7): 1165-1171. DOI:10.1016/0196-9781(94)90138-4 |
| [74] |
MATTHEWS H J, AUDSLEY N, WEAVER R J. Alanine substitution and deletion analogues of Manduca sexta allatostatin: Structure-activity relationship on the spontaneous contractions of the foregut of larval Lacanobia oleracea
[J]. J Insect Physiol, 2006, 52(2): 128-135. DOI:10.1016/j.jinsphys.2005.07.006 |
| [75] |
a)开振鹏. 运用模拟肽学创制新型昆虫生长调节剂: 抑咽侧体素类似物的设计、合成与生物活性研究[D]. 北京: 中国农业大学, 2009. KAI Z P. Discovery of new insect growth regulators with peptidomimetics: design, synthesis and bioactivity of allatostatin analogs[D]. Beijing: China Agricultural University, 2009.b)黄娟. 蜚蠊型抑咽侧体素核心五肽类似物的设计与合成[D]. 北京: 中国农业大学, 2010.HUANG J. Design and synthesis of pentapeptide analogs of cockroach allatostatin[D]. Beijing: China Agricultural University, 2010.c)谢勇. 抑咽侧体素类似物的设计、合成、生物活性及构象研究[D]. 北京: 中国农业大学, 2012.XIE Y. Design, synthesis, biological activity and conformation of allatostatin analogs[D]. Beijing: China Agricultural University, 2012.d)王献伟. 抑咽侧体素类似物B1的结构优化[D]. 北京: 中国农业大学, 2014.WANG X W. Structural optimization of B1, an AST analog[D]. Beijing: China Agricultural University, 2014.e)张传亮. 运用模拟肽学创制新型生态杀虫剂: 昆虫激肽类似物的设计、合成与生物活性研究[D]. 北京: 中国农业大学, 2015. ZHANG C L. Discovery of novel eco-insecticide via peptidomimetics: design, synthesis and bioactivity of insect kinin analogs[D]. Beijing: China Agricultural University, 2015.f)吴小庆. 抑咽侧体素类似物的设计、合成、生物活性及与构效关系的研究[D]. 北京: 中国农业大学, 2016.WU X Q. Design, synthesis, bioactivity and structure-activity relationship of allatostatin analogs[D]. Beijing: China Agricultural University, 2016.g)汪梅子. 基于3D-QSAR的抑咽侧体素类似物的设计、合成及生物活性研究[D]. 北京: 中国农业大学, 2019.WANG M Z. Design, synthesis and bioactivity of allatostatin analogs based on 3D-QSAR research[D]. Beijing: China Agricultural University, 2019.
|
| [76] |
a) KAI Z P, HUANG J, XIE Y, et al. Synthesis, biological activity, and hologram quantitative structure-activity relationships of novel allatostatin analogues[J]. J Agric Food Chem, 2010, 58(5): 2652-2658. b) KAI Z P, XIE Y, HUANG J, et al. Peptidomimetics in the discovery of new insect growth regulators: studies on the structure-activity relationships of the core Pentapeptide region of allatostatins[J]. J Agric Food Chem, 2011, 59(6): 2478-2485. c) XIE Y, ZHANG L, ZHANG C L, et al. Synthesis, biological activity, and conformational study of N-methylated allatostatin analogues inhibiting juvenile hormone biosynthesis[J]. J Agric Food Chem, 2015, 63(11): 2870-2876. d) XIE Y, ZHANG L, WU X Q, et al. Probing the active conformation of FGLamide allatostatin analogs with N-terminal modifications using NMR spectroscopy and molecular modeling[J]. Peptides, 2015, 68: 214-218. e) WU X Q, HUANG J, WANG M Z, et al. Synthesis, bioactivity and functional evaluation of linker-modified allatostatin analogs as potential insect growth regulators[J]. Chin Chem Lett, 2016, 27(4): 559-562. f) WU X Q, WANG M Z, HUANG J, et al. A potential insect growth regulator for cockroach control: Design, synthesis and bioactivity of N-terminal-modified allatostatin analogues[J]. Pest Manag Sci, 2017, 73(3): 500-505. g) WANG M Z, ZHANG L, WANG X W, et al. Exploring the N-terminus region: Synthesis, bioactivity and 3D-QSAR of allatostatin analogs as novel insect growth regulators[J]. Chin Chem Lett, 2018, 29(9): 1375-1378. h) WANG M Z, LI X L, CHEN M T, et al. 3D-QSAR based optimization of insect neuropeptide allatostatin analogs[J]. Bioorg Med Chem Lett, 2019, 29(7): 890-895. |
| [77] |
a) KAI Z P, LING Y, LIU W J, et al. The study of solution conformation of allatostatins by 2-D NMR and molecular modeling[J]. Biochim Biophys Acta, Proteins Proteomics, 2006, 1764(1): 70-75. b) KAI Z P, HUANG J, TOBE S S, et al. A potential insect growth regulator: synthesis and bioactivity of an allatostatin mimic[J]. Peptides, 2009, 30(7): 1249-1253. c) XIE Y, KAI Z P, TOBE S S, et al. Design, synthesis and biological activity of peptidomimetic analogs of insect allatostatins[J]. Peptides, 2011, 32(3): 581-586. d) XIE Y, WANG M Z, ZHANG L, et al. Synthesis and biological activity of FGLamide allatostatin analogs with Phe3 residue modifications[J]. J Pept Sci, 2016, 22(9): 600-606. e)汪梅子, 王献伟, 吴小庆, 等. N端结构改造的抑咽侧体素拟肽类化合物的设计、合成及生物活性研究[J]. 中国科学: 化学. 2016, 46(11): 1235-1241. WANG M Z, WANG X W, WU X Q, et al. Design, synthesis and biological activity of peptidomimetic analogs with allatostatin at N-terminus[J]. Scientia Sinica (Chimica), 2016, 46(11): 1235-1241. |
| [78] |
PIULACHS M D, VILAPLANA L, BARTOLOMÉ J M, et al. Ketomethylene and methyleneamino pseudopeptide analogues of insect allatostatins inhibit juvenile hormone and vitellogenin production in the cockroach Blattella germanica
[J]. Insect Biochem Mol Biol, 1997, 27(10): 851-858. DOI:10.1016/S0965-1748(97)00067-2 |
| [79] |
NACHMAN R J, MOYNA G, WILLIAMS H J, et al. Synthesis, biological activity, and conformational studies of insect allatostatin neuropeptide analogues incorporating turn-promoting moieties[J]. Bioorg Med Chem, 1998, 6(8): 1379-1388. DOI:10.1016/S0968-0896(98)00129-1 |
| [80] |
GARSIDE C S, NACHMAN R J, TOBE S S. Injection of Dip-allatostatin or Dip-allatostatin pseudopeptides into mated female Diploptera punctata inhibits endogenous rates of JH biosynthesis and basal oocyte growth
[J]. Insect Biochem Mol Biol, 2000, 30(8-9): 703-710. DOI:10.1016/S0965-1748(00)00041-2 |
| [81] |
HUANG S S, CHEN S S, KAI Z P, et al. Structure-based discovery of non-peptide allatostatin analogs for pest control[J]. J Agric Food Chem, 2018, 66(14): 3644-3650. DOI:10.1021/acs.jafc.8b00197 |
| [82] |
YANG H J, YOUNG J M, LEE E J, et al. Structure in solution of Diploptera punctata allatostatin-2
[J]. J Appl Biol, 2006, 49(4): 186-188. |
| [83] |
YANG H J, LIM Y. Solution structure determination of four Diploptera punctata allatostatins by NMR spectroscopy and molecular modeling
[J]. Bull Korean Chem Soc, 2005, 26(5): 845-848. DOI:10.5012/bkcs.2005.26.5.845 |
| [84] |
BANERJEE M, MEYEROWITZ E, HUANG C D, et al. Probing the conformation and dynamics of allatostatin neuropeptides: a structural model for functional differences[J]. Peptides, 2008, 29(3): 375-385. DOI:10.1016/j.peptides.2007.11.016 |
| [85] |
BIRGUL N. Reverse physiology in Drosophila: identification of a novel allatostatin-like neuropeptide and its cognate receptor structurally related to the mammalian somatostatin/galanin/opioid receptor family[J]. Embo J, 1999, 18(21): 5892-5900. DOI:10.1093/emboj/18.21.5892 |
| [86] |
LENZ C, SØNDERGAARD L, GRIMMELIKHUIJZEN C J P. Molecular cloning and genomic organization of a novel receptor from Drosophila melanogaster structurally related to mammalian galanin receptors
[J]. Biochem Biophys Res Commun, 2000, 269(1): 91-96. DOI:10.1006/bbrc.2000.2251 |
| [87] |
LENZ C, WILLIAMSON M, GRIMMELIKHUIJZEN C J P. Molecular cloning and genomic organization of a second probable allatostatin receptor from Drosophila melanogaster
[J]. Biochem Biophys Res Commun, 2000, 273(2): 571-577. DOI:10.1006/bbrc.2000.2964 |
| [88] |
AUERSWALD L, BIRGÜL N, GÄDE G, et al. Structural, functional, and evolutionary characterization of novel members of the allatostatin receptor family from insects[J]. Biochem Biophys Res Commun, 2001, 282(4): 904-909. DOI:10.1006/bbrc.2001.4659 |
| [89] |
SECHER T, LENZ C, CAZZAMALI G, et al. Molecular cloning of a functional allatostatin gut/brain receptor and an allatostatin preprohormone from the Silkworm Bombyx Mori
[J]. J Biol Chem, 2001, 276(50): 47052-47060. DOI:10.1074/jbc.M106675200 |
| [90] |
LUNGCHUKIET P, DONLY B C, ZHANG J R, et al. Molecular cloning and characterization of an allatostatin-like receptor in the cockroach Diploptera punctata
[J]. Peptides, 2008, 29(2): 276-285. DOI:10.1016/j.peptides.2007.10.029 |
| [91] |
LARSEN M J, BURTON K J, ZANTELLO M R, et al. Type A allatostatins from Drosophila melanogaster and Diplotera puncata activate two drosophila allatostatin receptors, DAR-1 and DAR-2, expressed in CHO cells
[J]. Biochem Biophys Res Commun, 2001, 286(5): 895-901. DOI:10.1006/bbrc.2001.5476 |
| [92] |
PALCZEWSKI K. Crystal structure of rhodopsin: A G protein-coupled receptor[J]. Science, 2000, 289(5480): 739-745. DOI:10.1126/science.289.5480.739 |
| [93] |
CHEREZOV V, ROSENBAUM D M, HANSON M A, et al. High-resolution crystal structure of an engineered human 2-adrenergic G protein-coupled receptor[J]. Science, 2007, 318(5854): 1258-1265. DOI:10.1126/science.1150577 |
| [94] |
张莉, 开振鹏, 谢勇, 等. 抑咽侧体素受体结构的同源模建及与Allastostain类似物的分子对接研究.[C]//第十届全国农药学科教学科研研讨会, 中国: 青岛, 2008. ZHANG L, KAI Z P, XIE Y, et al. Homologous modeling of the allastostain receptor structure and molecular docking with allastostain analogs.[C]// The 10th national meeting of pesticide teaching and research, Qingdao, China, 2008. |
| [95] |
MANGLIK A, KRUSE A C, KOBILKA T S, et al. Crystal structure of the μ-opioid receptor bound to a morphinan antagonist[J]. Nature, 2012, 485(7398): 321-326. DOI:10.1038/nature10954 |
| [96] |
THOMPSON A A, LIU W, CHUN E, et al. Structure of the nociceptin/orphanin FQ receptor in complex with a peptide mimetic[J]. Nature, 2012, 485(7398): 395-399. DOI:10.1038/nature11085 |
| [97] |
刘影, 胜振涛, 李胜. 保幼激素的分子作用机制[J]. 昆虫学报, 2008, 51(9): 974-978. LIU Y, SHENG Z T, LI S. Molecular mechanisms of juvenile hormone action[J]. Acta Entomol Sin, 2008, 51(9): 974-978. DOI:10.3321/j.issn:0454-6296.2008.09.012 |
| [98] |
HUANG J, MARCHAL E, HULT E F, et al. Characterization of the juvenile hormone pathway in the viviparous cockroach, Diploptera punctata
[J]. PLoS One, 2015, 10(2): e0117291. DOI:10.1371/journal.pone.0117291 |
| [99] |
HUANG J, MARCHAL E, HULT E F, et al. Mode of action of allatostatins in the regulation of juvenile hormone biosynthesis in the cockroach, Diploptera punctata
[J]. Insect Biochem Mol Biol, 2014, 54: 61-68. DOI:10.1016/j.ibmb.2014.09.001 |
| [100] |
NOUZOVA M, RIVERA-PEREZ C, NORIEGA F G. Allatostatin-C reversibly blocks the transport of citrate out of the mitochondria and inhibits juvenile hormone synthesis in mosquitoes[J]. Insect Biochem Mol Biol, 2015, 57: 20-26. DOI:10.1016/j.ibmb.2014.12.003 |
 2019, Vol. 21
2019, Vol. 21


