薏米Coix chinensis Tod是一种营养丰富的谷类作物,也是中国传统的中药材[1-2]。福建省是中国重要的薏米产区之一,全省薏米种植面积约7 000 hm2,年产量约2.0 × 107 kg[3]。由于当前薏米栽培主要采用粗放型栽培模式[1],因而造成其叶部病害发病十分严重。由Curvularia coicis Castellani侵染薏米叶片引起的薏米叶斑病 (Coix leaf blight, CLB) 是薏米产区重要的真菌病害,田块病株率普遍高达80%以上[3],加之福建全省气候温暖潮湿更适宜该病的流行,薏米叶斑病已成为制约薏米生产的主要因素。
化学防治是薏米叶斑病防治最有效的措施之一,田间用于防治该类病害的杀菌剂主要有多菌灵、代森锰锌、甲基硫菌灵以及以丙环唑、苯醚甲环唑和烯唑醇等为代表的麦角甾醇抑制类 (sterol demethylation inhibitors,DMIs) 杀菌剂[4-5]。由于DMIs杀菌剂作用位点单一,病原菌易对其产生抗药性[6],而常规杀菌剂的防治效果又不甚理想,在种植品种单一和缺乏有效田间管理的条件下,筛选新型高效杀菌剂对防治薏米叶斑病具有重要的实践意义。以吡唑醚菌酯为代表的甲氧基丙烯酸酯类杀菌剂 (quinone outside inhibitors;QoIs) 是高效、广谱的线粒体呼吸抑制剂,其作用机理是抑制植物病原菌细胞呼吸电子传递链中的复合物III,从而破坏电子在cytb和C1间的传递,扰乱真菌呼吸代谢所需ATP的合成[7-8]。前期研究表明,吡唑醚菌酯对Curvularia属及其近缘属的植物病原菌的菌丝生长和孢子萌发具有较好的抑制作用[9-10],但是,根据杀菌剂抗性行动委员会 (Fungicide Resistance Action Committee,FRAC) 的分类,吡唑醚菌酯等高风险性杀菌剂,表明植物病原菌对其极易产生抗药性[6]。已有研究报道表明,草莓灰霉病菌Botrytis cinerea[11]、鹰嘴豆褐斑病菌Ascochyta rabiei[12]、开心果晚疫病菌Alternaria alternata[13]、葫芦白粉病菌Podosphaera fusca[14]、葡萄霜霉病菌Plasmopara viticola[15]和甜菜褐斑病菌Cercospora beticola[16]对吡唑醚菌酯已产生了抗药性。因此,在利用吡唑醚菌酯防治薏米叶斑病之前,建立薏米叶斑病菌对吡唑醚菌酯的敏感基线是合理选用杀菌剂防治薏米叶斑病的基础。
有关植物病原菌对吡唑醚菌酯的抗药性分子机理[7]、敏感性测定和敏感基线[17-18]以及对小麦白粉病和玉米小斑病的田间防效已有相关报道[19-20],而关于薏米叶斑病菌对吡唑醚菌酯的敏感性研究尚未见报道。为此,本研究测定了分离自闽南地区未接触吡唑醚菌酯的72株薏米叶斑病菌对吡唑醚菌酯的敏感性,建立了薏米叶斑病菌对吡唑醚菌酯的敏感基线,同时评价了其对薏米叶斑病的盆栽防治效果,以期为薏米叶斑病化学防治有效药剂的筛选以及薏米叶斑病菌田间抗药性监测提供科学依据。
1 材料与方法 1.1 供试菌株2017年于闽南地区的南靖、书洋、云水谣和梅林等4个未施用吡唑醚菌酯的薏米产区采集感病薏米叶片,采用单孢分离法共获得72株薏米叶斑病菌C. coicis单孢菌株。供试菌株经形态学和核糖体DNA转录间隔区 (ribosomal DNA internal transcribed spacer;rDNA-ITS) 序列分析鉴定后,采用试管斜面法保存于4 ℃冰箱中。
1.2 供试杀菌剂和试剂吡唑醚菌酯 (pyraclostrobin) 原药 (纯度95.4%,青岛瀚生生物科技有限公司);25%吡唑醚菌酯乳油 (pyraclostrobin EC) (德国巴斯夫公司,农药登记号:PD20152385);50%异菌脲悬浮剂 (iprodione SC) [拜耳作物科学 (中国) 有限公司,农药登记号:PD20070395];80%代森锰锌可湿性粉剂 (mancozeb WP) (美国陶氏益农公司,农药登记号:PD220-97)。二甲亚砜,分析纯 (国药集团化学试剂有限公司)。
1.3 薏米叶斑病菌对吡唑醚菌酯的敏感性测定参考Dai等[21]方法。将吡唑醚菌酯制成质量浓度分别为0.08、0.24、0.40、1.20、2.00和6.00 μg/mL的含药马铃薯葡萄糖琼脂 (PDA) 培养基平板。每皿中央接种一片直径5 mm菌碟,以不含药平板作对照 (培养基中二甲亚砜浓度与处理组一致)。每浓度3次重复。25 ℃黑暗培养7 d后,十字交叉法测量处理组和对照组菌落直径。采用公式 (1) 计算菌丝生长抑制率 (I,%)。
| $I/{\text{%}}=\left[ \left( {{D_{\rm{c}}} - {D_{\rm{t}}}} \right)/\left( {{D_{\rm{c}}} - 5} \right)\right] \times 100$ | (1) |
式中:Dc为对照组菌落直径平均值;Dt为药剂处理组菌落直径平均值。
通过DPS (v7.05) 软件生物测定法中的数量型数据机值分析计算吡唑醚菌酯对薏米叶斑病菌菌丝生长的抑制中浓度 (EC50)。利用公式 (2) 计算菌株间变异系数 (Variation Factor;VF) [20]。
| ${\rm{VF}} = {\rm{E}}{{\rm{C}}_{50\left( {{\rm{max}}} \right)}}/{\rm{E}}{{\rm{C}}_{50\left( {{\rm{min}}} \right)}}$ | (2) |
式中:EC50 (max) 为供试菌株中EC50最大值;EC50 (min) 为供试菌株中EC50最小值。
1.4 薏米叶斑病菌对吡唑醚菌酯敏感基线的建立以1.0 μg/mL为间隔将吡唑醚菌酯对72株薏米叶斑病菌的EC50值分成5个区间,分别统计5个区间内的菌株频率 (%)。以5个区间为横坐标,相应的菌株在各区间的频率 (%) 为纵坐标,绘制72株薏米叶斑病菌对吡唑醚菌酯的敏感性频率分布图。采用DPS软件中的Shapiro-Wilk法检验薏米叶斑病菌对吡唑醚菌酯的敏感性频率分布是否符合正态分布。若符合正态分布,则可将吡唑醚菌酯对薏米叶斑病菌的EC50平均值作为闽南地区薏米叶斑病菌对吡唑醚菌酯的敏感基线。将各供试菌株的EC50值与本研究建立的薏米叶斑病菌对吡唑醚菌酯的敏感基线相比较,得到抗性倍数 (R),当R ≤ 2时,说明薏米叶斑病菌对吡唑醚菌酯敏感,无抗药性菌株产生[22-23]。
1.5 吡唑醚菌酯对薏米叶斑病的盆栽防治效果薏米的室内种植方法及病菌分生孢子悬浮液的制备参考Dai等[3] 方法。将闽南当地种植的薏米品种的种子播种于装有苔藓泥炭土 (品氏公司,丹麦) 的塑料盆 (直径21 cm) 中,每盆播种4粒种子,于22~28 ℃、14 h光照/10 h黑暗和相对湿度 ≥ 85%的温室中培养,待薏米苗长至3~4叶时,每盆保留3株大小一致的薏米苗,继续培养至7~8叶期备用。
选取生长快、产孢量大的薏米叶斑病菌3株分别接种于PDA培养基上,在25 ℃黑暗条件下培养7 d后,用无菌水和灭菌毛笔刷刷洗菌落表面,经双层无菌纱布过滤后,将3个菌株的孢子悬浮液混合,再用血球计数板调节孢子浓度至5 × 105个/mL,制得孢子悬浮液,备用 (不超过2 h)。
杀菌剂盆栽防效试验共设5个处理:25%吡唑醚菌酯EC按推荐剂量 (有效成分) 250 μg/mL及其推荐剂量减量50%即125 μg/mL,对照药剂50%异菌脲SC和80%代森锰锌WP按推荐剂量 (有效成分) 即分别为500 μg/mL和800 μg/mL,以清水为空白对照。每处理重复3次,每处理15~16盆。将上述各浓度的供试药液及空白对照用手提式压力喷雾器均匀喷施于薏米叶面上,施液量均为500 mL (可见叶面滴水)。自然晾干2 h后,将5 × 105 个/mL的孢子悬浮液均匀喷施于薏米植株表面,直至叶面滴水为宜。接种后用塑料薄膜覆盖保湿,48 h后揭去薄膜,逐日观察病斑发生及扩展情况。30 d后调查各处理发病情况。病叶分级标准参考章霜红[5] 方法,病情指数及不同药剂的防效计算方法参考Dai等[21] 方法。数据调查结束后,各处理仍在上述培养条件、正常肥水管理下继续培养直至薏米开花、抽穗。
1.6 数据统计分析不同地区间薏米叶斑病菌对吡唑醚菌酯的敏感性方差分析、不同药剂以及同一药剂不同浓度对薏米叶斑病的盆栽防效间的差异显著性分析均采用DPS (v7.05) 软件和Duncan’s新复极差法进行分析。
2 结果与分析 2.1 薏米叶斑病菌对吡唑醚菌酯的敏感性及敏感基线敏感性测定结果 (表1)表明:吡唑醚菌酯对分离自闽南4个地区的72株薏米叶斑病菌的EC50值在1.11~5.06 μg/mL之间,平均值为 (3.44 ± 0.98) μg/mL,表明闽南地区薏米叶斑病菌自然群体对吡唑醚菌酯比较敏感,无敏感性下降或抗药性菌株产生。
|
|
表 1 闽南4个地区薏米叶斑病菌对吡唑醚菌酯的敏感性 Table 1 Sensitivities of Curvularia coicis isolates to pyraclostrobin in four regions of South Fujian |
来自闽南4个地区的72株薏米叶斑病菌对吡唑醚菌酯的敏感性频率分布图为连续单峰曲线 (图1),Shapiro-Wilk正态性检验表明,供试菌株对吡唑醚菌酯 (W = 0.921 8;P = 0.541 5 > 0.05) 的敏感性频率分布符合正态分布。因此,可将吡唑醚菌酯对闽南地区72株薏米叶斑病菌的EC 50平均值 (3.44 ± 0.98) μg/mL作为闽南地区薏米叶斑病菌对吡唑醚菌酯的敏感基线。
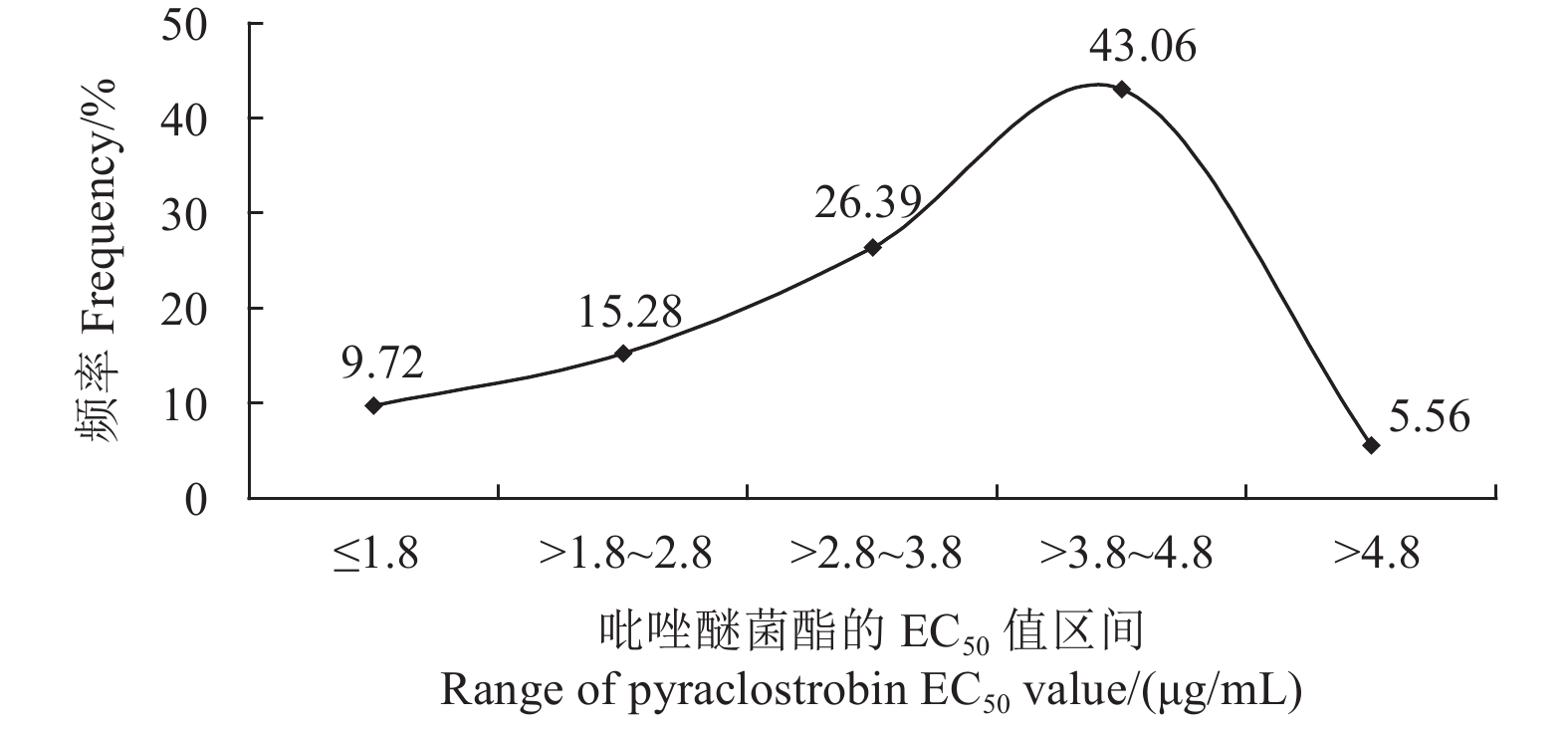
|
图 1 闽南地区薏米叶斑病菌对吡唑醚菌酯的敏感性频率分布 Fig. 1 Sensitivity frequency of Curvularia coicis to pyraclostrobin in South Fujian |
2.2 不同地区薏米叶斑病菌对吡唑醚菌酯的敏感性水平
来源于闽南南靖、书洋、云水谣和梅林4个采集点的薏米叶斑病菌不同菌株间的差异不明显,其变异系数分别为3.78、2.48、3.41和4.41 (表1)。Duncan’s方差分析表明,4个采集点的薏米叶斑病菌群体对吡唑醚菌酯的敏感性无显著性差异 (P > 0.05) ( 表1)。
2.3 吡唑醚菌酯对薏米叶斑病的盆栽防治效果盆栽防治效果 (表2)表明,喷施有效剂量为250 μg/mL及其减量50%剂量的25%吡唑醚菌酯EC对薏米叶斑病均有较好的防治效果,其防效分别为78.2%~79.7%和67.3%~72.0%。喷施有效成分为250 μg/mL的25%吡唑醚菌酯EC的盆栽防效与喷施500 μg/mL的50%异菌脲SC的防效相当,但显著高于喷施800 μg/mL的80%代森锰锌WP的防治效果。试验期间各供试药剂在推荐剂量范围内,对薏米苗期生长、花期发育及抽穗均未产生药害。综上所述,吡唑醚菌酯具有田间防治薏米叶斑病的潜能。
|
|
表 2 吡唑醚菌酯对薏米叶斑病的盆栽防治效果 Table 2 Efficacy of pyraclostrobin in the control of Coix leaf blight |
3 小结与讨论
本研究在含药平板上测定了闽南地区未施用吡唑醚菌酯的4个薏米产区的72株薏米叶斑病菌对吡唑醚菌酯的敏感性,并建立病菌群体对吡唑醚菌酯的敏感基线。结果表明,闽南地区薏米叶斑病菌群体对吡唑醚菌酯比较敏感,且闽南地区薏米叶斑病菌田间种群对吡唑醚菌酯的敏感性频率分布呈正态分布,薏米叶斑病菌田间种群中未出现对吡唑醚菌酯敏感性下降的亚群体,因此可将病菌群体EC50平均值 (3.44 ± 0.98) μg/mL作为闽南地区薏米叶斑病菌对吡唑醚菌酯的敏感基线。
林婷等[24]建立的浙江省草莓炭疽菌Colletotrichum gloeosporioides对吡唑醚菌酯的敏感基线为6.65 μg/mL。代玉立等[20]建立的福建省玉米小斑病菌Bipolaris maydis和高杨杨等[18]建立的山东省辣椒尖孢炭疽复合种C. acutatum species complex对吡唑醚菌酯的敏感基线分别为1.44 μg/mL和0.27 μg/mL,说明不同地区的不同病原菌群体对吡唑醚菌酯的敏感性存在一定差异。本研究中,不同地理来源的薏米叶斑病菌田间种群对吡唑醚菌酯的敏感性差异不显著,4个地区菌株个体间对吡唑醚菌酯的敏感性差异也不显著,其变异系数范围为2.48~4.41,表明闽南地区薏米叶斑病菌田间种群中未出现对吡唑醚菌酯敏感性下降的亚群体。因此,本研究建立的薏米叶斑病菌对吡唑醚菌酯的敏感基线可为闽南地区薏米叶斑病菌田间抗药性监测提供理论参考。
由于薏米叶斑病菌对吡唑醚菌酯具有较高的敏感性,因此,吡唑醚菌酯在防治薏米叶斑病中具有良好的应用前景。盆栽防效也表明,喷施减量50%剂量的25%吡唑醚菌酯EC对薏米叶斑病仍具有较好的防治效果 (> 67%)。推荐剂量的吡唑醚菌酯的盆栽防效和异菌脲的盆栽防效差异不显著,但是明显高于对照杀菌剂代森锰锌。
本研究仅在盆栽条件下进行了杀菌剂防效试验,相关的田间防效试验还有待进一步研究。由于吡唑醚菌酯作用位点单一且被FRAC认定为高抗药性风险类杀菌剂[6],为延缓薏米叶斑病菌对吡唑醚菌酯的抗药性发展,在田间使用过程中可考虑将吡唑醚菌酯与DMIs类或二甲酰亚胺类 (如异菌脲) 杀菌剂进行复配或轮换使用,并注重对吡唑醚菌酯的抗药性监测。
| [1] |
李发耀, 石明, 秦礼康. 薏仁米产业蓝皮书: 中国薏仁米产业发展报告No.1[M]. 北京: 社会科学文献出版社, 2017: 7-82. LI F Y, SHI M, QIN L K. Blue book of coix seed industry: The development report of Chinese coix seed industry No.1[J]. Beijing: Social Sciences Academic Press, 2017: 7-82. |
| [2] |
李祥栋, 潘虹, 陆秀娟, 等. 薏苡种质的主要营养组分特征及综合评价[J]. 中国农业科学, 2018, 51(5): 835-842. LI X D, PAN H, LU X J, et al. Characteristics and comprehensive assessment of principal nutritional components in adlay landraces[J]. Scientia Agricultura Sinica, 2018, 51(5): 835-842. |
| [3] |
DAI Y L, GAN L, CHEN F R, et al. Leaf blight caused by Curvularia coicis on Chinese pearl barley (Coix chinensis) in Fujian Province, China[J/OL]. Can J Plant Pathol, 2019, 41(2)[2019-01-09]. https://doi.org/10.1080/07060661.2019.1567591.
|
| [4] |
徐春金. 薏苡主要病虫害的发生与防治[J]. 福建农业科技, 2014(5): 37-38. XU C J. Prevention and control for main pests and diseases in coix[J]. Fujian Agric Sci Technol, 2014(5): 37-38. DOI:10.3969/j.issn.0253-2301.2014.05.017 |
| [5] |
章霜红. 薏苡叶枯病和叶斑病调查与病原鉴定[J]. 中国植保导刊, 2012, 32(6): 5-7. ZHANG S H. Occurrence and identification of coix leaf blotch and coix leaf spot[J]. China Plant Prot, 2012, 32(6): 5-7. DOI:10.3969/j.issn.1672-6820.2012.06.001 |
| [6] |
Fungicide Resistance Action Committee (FRAC). Pathogen risk list[EB/OL].[2017-03-15] . http://www.frac.info/publications/downloads.
|
| [7] |
FISHER N, MEUNIER B. Molecular basis of resistance to cytochrome bc1 inhibitors[J]. FEMS Yeast Res, 2008, 8(2): 183-192. DOI:10.1111/fyr.2008.8.issue-2 |
| [8] |
BIRLA K, RIVERA-VARAS V, SECOR G A, et al. Characterization of cytochrome b from European field isolates of Cercospora beticola with quinone outside inhibitor resistance
[J]. Eur J Plant Pathol, 2012, 134(3): 475-488. DOI:10.1007/s10658-012-0029-y |
| [9] |
甘林, 代玉立, 杨秀娟, 等. 13 种杀菌剂对玉米大斑病菌和弯孢霉叶斑病菌的毒力测定[J]. 武夷科学, 2017, 33: 88-93. GAN L, DAI Y L, YANG X J, et al. Toxicity determination of 13 fungicides to Exserohilum turcicum and Curvularia lunata [J]. Wuyi Sci J, 2017, 33: 88-93. |
| [10] |
甘林, 王志纯, 代玉立, 等. 不同杀菌剂对玉米小斑病菌的抑制作用及其防治效果[J]. 福建农业学报, 2015, 30(12): 1160-1165. GAN L, WANG Z C, DAI Y L, et al. Inhibition on Bipolaria maydis and disease control on southern corn leaf blight of various fungicides [J]. Fujian J Agric Sci, 2015, 30(12): 1160-1165. DOI:10.3969/j.issn.1008-0384.2015.12.006 |
| [11] |
FERNÁNDEZ-ORTUÑO D, CHEN F, SCHNABEL G. Resistance to pyraclostrobin and boscalid in Botrytis cinerea isolates from strawberry fields in the Carolinas
[J]. Plant Dis, 2012, 96(8): 1198-1203. DOI:10.1094/PDIS-12-11-1049-RE |
| [12] |
WISE K A, BRADLEY C A, PASCHE J S, et al. Resistance to QoI fungicides in Ascochyta rabiei from chickpea in the Northern Great Plains
[J]. Plant Dis, 2009, 93(5): 528-536. DOI:10.1094/PDIS-93-5-0528 |
| [13] |
AVENOT H, MORGAN D P, MICHAILIDES T J. Resistance to pyraclostrobin, boscalid and multiple resistance to Pristine® (pyraclostrobin + boscalid) fungicide in Alternaria alternate causing alternaria late blight of pistachios in California
[J]. Plant Pathol, 2008, 57(1): 135-140. DOI:10.1111/ppa.2008.57.issue-1 |
| [14] |
FERNÁNDEZ-ORTUÑO D, PÉREZ-GARCÍA A, LÓPEZ-RUIZ F, et al. Occurrence and distribution of resistance to QoI fungicides in populations of Podosphaera fusca in south central Spain
[J]. Eur J Plant Pathol, 2006, 115(2): 215-222. DOI:10.1007/s10658-006-9014-7 |
| [15] |
FURUYA S, MOCHIZUKI M, SAITO S, et al. Monitoring of QoI fungicide resistance in Plasmopara viticola populations in Japan
[J]. Pest Manag Sci, 2010, 66(11): 1268-1272. DOI:10.1002/ps.v66:11 |
| [16] |
BOLTON M D, RIVERA V, SECOR G. Identification of the G143A mutation associated with QoI resistance in Cercospora beticola field isolates from Michigan, United States
[J]. Pest Manag Sci, 2013, 69(1): 35-39. DOI:10.1002/ps.2013.69.issue-1 |
| [17] |
PATEL J S, GUDMESTAD N C, MEINHARDT S, et al. Pyraclostrobin sensitivity of baseline and fungicide exposed isolates of Pyrenophora tritici-repentis
[J]. Crop Prot, 2012, 34: 37-41. DOI:10.1016/j.cropro.2011.10.015 |
| [18] |
高杨杨, 禾丽菲, 李北兴, 等. 山东省辣椒上尖孢炭疽复合种对吡唑醚菌酯的敏感基线及吡唑醚菌酯增效配方筛选[J]. 农药学学报, 2017, 19(6): 701-707. GAO Y Y, HE L F, LI B X, et al. Baseline sensitivity to pyraclostrobin of Colletotrichum acutatum species complex collected from chili in Shandong Province and the screening of synergistic formula [J]. Chin J Pestic Sci, 2017, 19(6): 701-707. |
| [19] |
毕秋艳, 马志强, 韩秀英, 等. 不同机制杀菌剂对小麦白粉病的敏感性及与三唑酮的交互抗性[J]. 植物保护学报, 2017, 44(2): 331-336. BI Q Y, MA Z Q, HAN X Y, et al. Sensitivity of diverse fungicides on powdery mildew of wheat and cross resistance with triadimefon[J]. J Plant Prot, 2017, 44(2): 331-336. |
| [20] |
代玉立, 甘林, 阮宏椿, 等. 福建省玉米小斑病菌对异菌脲和吡唑醚菌酯的敏感性及其田间防效[J]. 农药学学报, 2017, 19(4): 434-440. DAI Y L, GAN L, RUAN H C, et al. Sensitivity of Bipolaris maydis to iprodione and pyraclostrobin and their control efficacy against southern corn leaf blight in Fujian province [J]. Chin J Pestic Sci, 2017, 19(4): 434-440. |
| [21] |
DAI Y L, GAN L, RUAN H C, et al. Sensitivity of Cochliobolus heterostrophus to three demethylation inhibitor fungicides, propiconazole, diniconazole and prochloraz, and their efficacy against southern corn leaf blight in Fujian Province, China
[J]. Eur J Plant Pathol, 2018, 152(2): 447-459. DOI:10.1007/s10658-018-1490-z |
| [22] |
马志强, 李红霞, 袁章虎, 等. 苹果轮纹病菌对多菌灵抗药性监测初报[J]. 农药学学报, 2000, 2(3): 94-96. MA Z Q, LI H X, YUAN Z H, et al. Preliminary research on detection of resistance of apple ring rot (Macrophoma kawatsukai) to carbendazim [J]. Chin J Pestic Sci, 2000, 2(3): 94-96. DOI:10.3321/j.issn:1008-7303.2000.03.020 |
| [23] |
甘林, 代玉立, 滕振勇, 等. 福建省玉米小斑病菌对丙环唑、烯唑醇和咪鲜胺的敏感性[J]. 农药学学报, 2016, 18(2): 194-200. GAN L, DAI Y L, TENG Z Y, et al. Sensitivity of Bipolaris maydis to propiconazole, diniconazole and prochloraz in Fujian Province [J]. Chin J Pestic Sci, 2016, 18(2): 194-200. |
| [24] |
林婷, 时浩杰, 戴德江, 等. 草莓炭疽病菌对吡唑醚菌酯的敏感性及旁路氧化在胶孢炭疽菌对 QoIs 敏感性中的作用[J]. 农药学学报, 2015, 17(5): 530-537. LIN T, SHI H J, DAI D J, et al. Characterization of sensitivity of Colletotrichum gloeosporioides from strawberry to pyraclostrobin and involvement of alternative respiration in the regulation of sensitivity [J]. Chin J Pestic Sci, 2015, 17(5): 530-537. DOI:10.3969/j.issn.1008-7303.2015.05.05 |
 2019, Vol. 21
2019, Vol. 21


