氟唑磺隆(flucarbazone-sodium)和甲基二磺隆(mesosulfuron-methyl)(图式1)属磺酰脲类除草剂。氟唑磺隆在野燕麦中具有双向传导的能力[1],其在土壤中的半衰期随土壤中有机碳含量的含量升高而延长[2]。甲基二磺隆在土壤中残效期较短,几乎不会影响后茬作物[3]。炔草酯(clodinafop-propargyl)属苯氧羧酸类除草剂,在小麦中可代谢为有毒代谢物炔草酸(clodinafop)(图式1)。炔草酯对鱼类高毒,美国环保局认为其可能对人类有致癌作用[4]。
目前,在JMPR报告中尚未查询到关于氟唑磺隆、甲基二磺隆及炔草酯等残留物的定义。中国国家标准 (GB2763—2016) 中规定:氟唑磺隆在小麦中的残留物定义为氟唑磺隆,最大残留限量 (MRL) 为0.01 mg/kg;甲基二磺隆在小麦中的残留物定义为甲基二磺隆,MRL值为0.02 mg/kg;炔草酯在小麦中的残留物定义为炔草酸与炔草酯之和,MRL值为0.1 mg/kg[5]。

|
图式1 氟唑磺隆 (a)、甲基二磺隆 (b)、炔草酯 (c)和炔草酸 (d)的结构式 Scheme1 Structural formula of flucarbazone-sodium (a), mesosulfuron-methyl (b), clodinafop-propargyl (c) and clodinafop (d) |
将不同作用机理的除草剂混用可达到提高药效、减少用药量、高毒农药低毒化及延缓抗药性发展的目的,但同时也增加了同时测定作物中多种农药残留的难度,对残留检测方法提出了更高的要求。目前,关于氟唑磺隆、甲基二磺隆、炔草酯及其代谢物炔草酸残留的测定方法主要有高效液相色谱-紫外检测法[6-7]、液相色谱-串联质谱法[8-9]、液相色谱-紫外检测法[10]以及高效液相色谱-串联质谱法[11]等,前处理方法主要为固相萃取[6-7, 10]、分散固相萃取[8-9, 11]、液-液萃取[10]和柱层析[7](表1),但尚未见同时检测这4种化合物在小麦中残留的报道,且已有的方法存在定量限较高、操作步骤较繁琐及有机试剂用量大等不足。鉴于此,本研究采用QuEChERS前处理方法[12],结合高效液相色谱-串联质谱 (HPLC-MS/MS) 法进行检测,拟建立同时检测小麦中氟唑磺隆、甲基二磺隆、炔草酯及其代谢物炔草酸残留量的分析方法。
|
|
表 1 四种化合物已有残留分析方法 Table 1 Existing residue analysis methods for four compounds |
1 材料与方法 1.1 药剂与试剂
氟唑磺隆标准品(flucarbazone-sodium,纯度98.6%),北京北纳创联生物技术研究院商城分院;甲基二磺隆(mesosulfuron-methyl,纯度99.0%)、炔草酯(clodinafop-propargyl,纯度97.0%)和炔草酸(clodinafop,纯度99.0%)标准品,均购自Dr. Ehrenstorfer GmbH。乙腈为色谱纯,Fisher Chemicals公司;甲酸及氯化钠均为分析纯;无水硫酸镁(使用前在110℃下烘干8 h)。
1.2 仪器与设备SHIMADZU LC-MS 8045高效液相色谱-三重四极杆串联质谱联用仪,配电喷雾(ESI)离子源(日本岛津有限公司);AL204型万分之一天平(上海梅特勒-托利多仪器有限公司);JA2003型千分之一天平(上海舜宇恒平科学仪器有限公司);JY2002型天平(上海精密科学仪器有限公司);DFY-500型植物粉碎机(浙江温岭市林大机械有限公司);HZQ-C型空气浴振荡器(哈尔滨市东联电子技术开发有限公司);QL-861型涡旋仪(江苏海门其林贝尔仪器制造有限公司);RJ-TDL-40B低速台式大容量离心机(无锡市瑞江分析仪器有限公司);HC-2517超高速离心机(安徽中科中佳科学仪器有限公司);0.22 µm聚四氟乙烯(PTFE)有机滤膜(北京锐锋同创分析仪器有限公司)。
1.3 样品前处理方法 1.3.1 麦粒准确称取5 g粉碎后的麦粒样品于50 mL聚四氟乙烯离心管中,加入5 mL 2%的甲酸水溶液、10 mL乙腈和3 g氯化钠,振荡30 min,于3 800 r/min下离心5 min;准确移取1 mL上清液于装有100 mg无水硫酸镁和50 mg C18的2 mL具塞离心管中,涡旋30 s,于10 000 r/min下离心1 min;取上清液过0.22 µm有机滤膜,待HPLC-MS/MS测定。
1.3.2 麦秆准确称取2 g粉碎后的麦秆样品于50 mL聚四氟乙烯离心管中,加入10 mL 0.1%的甲酸水溶液、10 mL乙腈和3 g氯化钠,振荡30 min,于3 800 r/min下离心5 min;准确移取1 mL上清液于装有200 mg无水硫酸镁和100 mg C18的2 mL具塞离心管中,涡旋30 s,于10 000 r/min下离心1 min;取上清液过0.22 µm有机滤膜,待HPLC-MS/MS测定。
1.4 标准溶液配制及标准曲线绘制分别称取氟唑磺隆、甲基二磺隆、炔草酯和炔草酸标准品各0.01 g(精确至0.01 mg),用乙腈溶解并定容至10 mL,配制成1 000 mg/L的标准储备液,置于 −20℃冰箱中保存,备用(有效期为0.5 a)。
准确移取适量4种标准储备液,以麦粒和麦秆空白提取溶液分别逐级稀释,配制得不同浓度的混合基质匹配标准溶液。麦粒基质标准溶液中氟唑磺隆的质量浓度为0.075、0.05、0.01、0.005、0.002 5和0.001 mg/L,甲基二磺隆的质量浓度为0.15、0.1、0.02、0.01、0.005和0.002 mg/L,炔草酯和炔草酸的质量浓度分别为0.75、0.5、0.1、0.05、0.025和0.01 mg/L;麦秆基质标准溶液中氟唑磺隆的质量浓度为0.1、0.05、0.01、0.005、0.002、0.001和0.000 5 mg/L,甲基二磺隆的质量浓度为0.2、0.1、0.02、0.01、0.004、0.002和0.001 mg/L,炔草酯和炔草酸的质量浓度分别为1、0.5、0.1、0.05、0.02、0.01和0.005 mg/L。分别以氟唑磺隆、甲基二磺隆、炔草酯和炔草酸的基质匹配标准溶液质量浓度对应其峰面积作图,制作标准曲线。
1.5 检测条件 1.5.1 液相色谱条件Athena C18-WP液相色谱柱(2.1 mm × 50 mm,3.0 µm);进样量:麦粒样品提取液为1 µL,麦秆样品提取液为2 µL;流速0.3 mL/min;流动相为V(乙腈):V(水) = 60:40混合溶液;运行时间4 min;柱温35℃。
在此条件下,氟唑磺隆、甲基二磺隆、炔草酯及炔草酸在麦秆样品中的保留时间分别为0.65、0.80、3.25和0.73 min,在麦粒样品中的保留时间分别为0.61、0.80、3.25和0.81 min。
1.5.2 质谱条件电喷雾离子源;氟唑磺隆和炔草酯为正离子扫描模式,甲基二磺隆和炔草酸为负离子扫描模式;离子源温度300℃;干燥气流速8 L/min;雾化气压力241 kPa;多反应监测模式(MRM)。4种化合物的质谱检测参数见表2。
|
|
表 2 四种目标化合物的质谱检测参数 Table 2 MS parameters for the analysis of four target compounds |
1.6 添加回收试验
根据1.4节的前处理方法,分别对麦粒和麦秆样品进行3个水平的添加回收试验。每个水平重复5次,同时作空白对照。采用基质匹配标准溶液进行定量,计算添加回收率和相对标准偏差(RSD)。
2 结果与讨论 2.1 进样量的优化以麦粒和麦秆空白基质分别配制质量浓度为0.05和0.02 mg/L的基质匹配标准溶液,分别考察了进样量 (1、2和5 μL)对样品提取效果的影响。结果表明:当麦粒基质匹配标准溶液的进样量为1 μL时,既可保证不超过仪器线性范围,又可实现定量分析,因此确定麦粒样品提取液进样量为1 μL。当麦秆基质匹配标准溶液的进样量为2 μL时RSD最小,此时既有利于仪器养护,又可进行定量分析,因此确定麦秆样品提取液进样量为2 μL。
2.2 提取溶剂的优化考虑到甲基二磺隆在酸性水溶液中易分解,其DT50 = 3.5 d(pH = 5,25℃)[13],在提取溶剂均为10 mL乙腈的条件下,分别考察了体积分数为0.1%、1%和2%的甲酸水溶液不同用量下对样品提取效果的影响。结果见图1。从中可以看出:在麦粒基质中,随着溶剂酸度增加,4种化合物的提取效果均有所改善,而随着甲酸水溶液用量的增加,提取效果反而下降。当使用5 mL 2%甲酸水溶液 + 10 mL乙腈提取时,回收率满足70%~110%的要求,因此,选用5 mL 2%的甲酸水溶液调节麦粒基质的酸度。在麦秆基质中,随着溶剂酸度增加,对4种化合物的提取效果逐渐下降,而随着甲酸水溶液体积增多,提取效果有所改善,因此,最终选用10 mL 0.1%的甲酸水溶液调节麦秆基质的酸度。

|
图 1 不同溶剂对麦粒和麦秆中4种化合物提取效果的影响 Fig. 1 Extraction effect of four compounds in wheat kernel and wheat straw treated with different solvents |
2.3 净化剂的优化
本研究中,氟唑磺隆、甲基二磺隆和炔草酸均呈酸性,C18可有效吸附基质中的长链脂肪化合物而不吸附目标农药。因此,本研究采用C18作为净化剂。在无水硫酸镁用量为100 mg的条件下,考察了C18用量分别为50、100、150和200 mg对提取效果的影响。结果(图2)表明:不同C18用量下,4种化合物在麦粒中的添加回收率均可满足农药残留分析的要求[14]。综合考虑,最终确定其C18用量为50 mg;当C18用量为50和100 mg时,4种化合物在麦秆中的添加回收率(70%~110%)和RSD (< 15%)虽能满足农药残留分析的要求,但使用50 mg C18时所得结果不能够定量(S/N < 10),因此最终选用100 mg C 18净化麦秆基质。

|
图 2 净化剂用量对麦粒和麦秆中4种化合物的净化效果 Fig. 2 Cleanup effect of the amount of the cleanup absorbent for 4 compounds in wheat kernel and wheat straw matrix |
确定了净化剂C18的用量后,考虑到在处理麦秆基质时加入了10 mL 0.1%的甲酸水溶液,在振荡离心后,上层乙腈中可能残留有较多水分,而4种化合物均为非水溶性,过多的水分会影响前处理中的提取效率。因此在保持C18用量为100 mg不变的条件下,考察了无水硫酸镁用量分别为100、150、200和250 mg时对麦秆基质提取效果的影响。结果(图3)表明:当无水硫酸镁用量为200 mg时,4种化合物的回收率均接近100%,RSD也普遍更小,说明200 mg无水硫酸镁能更好地去除有机层中残留的水分。因此,确定麦秆基质提取中无水硫酸镁的用量为200 mg。
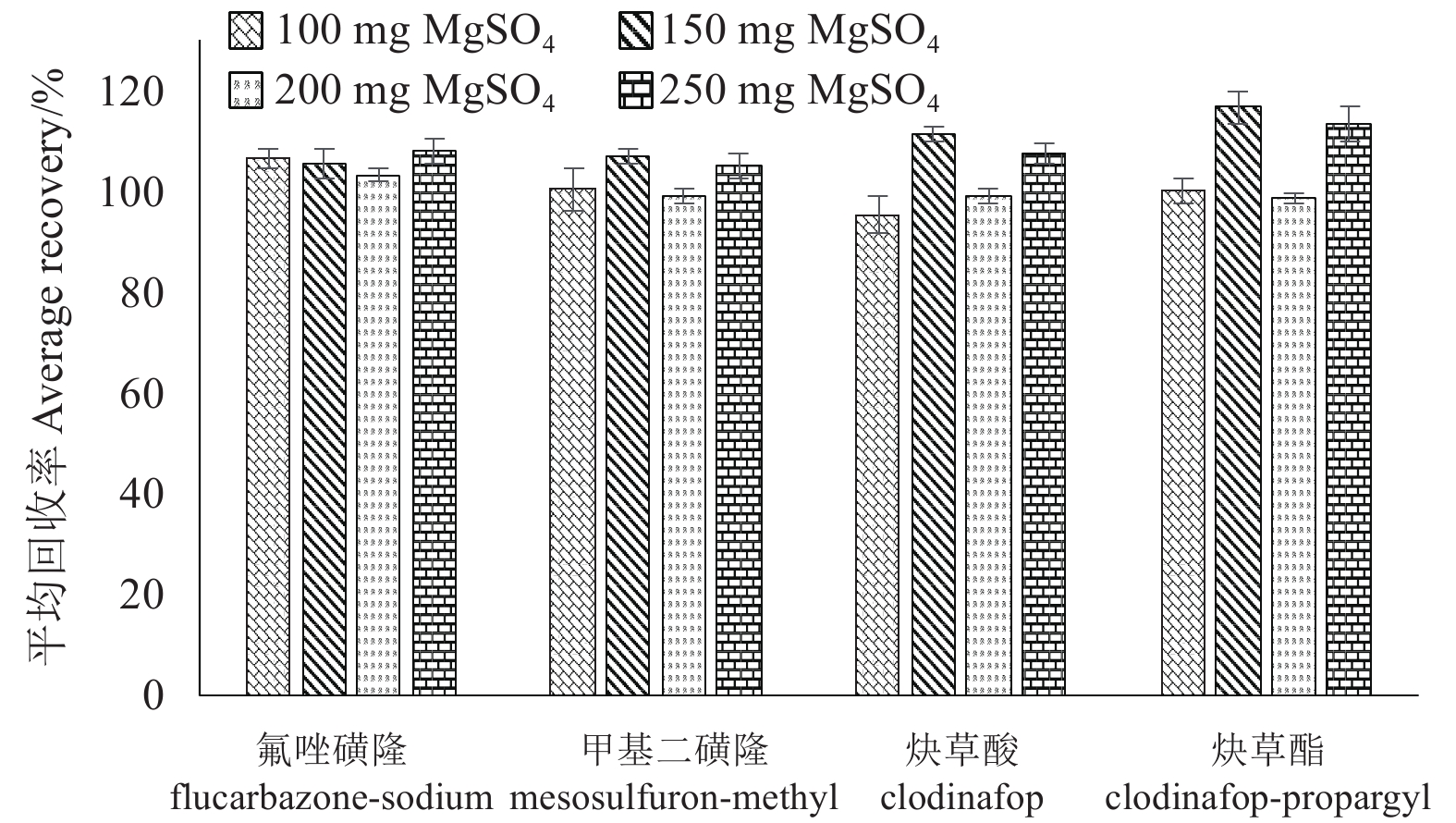
|
图 3 无水硫酸镁用量对麦秆基质中4种化合物提取效果的影响 Fig. 3 Extraction effect of the amount of MgSO4 for 4 compounds in wheat straw matrix |
综上所述,确定麦粒基质样品溶液进样量为1 μL,提取溶剂为5 mL 2%甲酸水溶液 + 10 mL乙腈,净化剂为50 mg C18,脱水剂为100 mg无水硫酸镁;确定麦秆基质样品溶液进样量为2 μL,提取溶剂为10 mL 0.1%甲酸水溶液 + 10 mL乙腈,净化剂为100 mg C18,脱水剂为200 mg无水硫酸镁。
2.4 添加回收试验结果如表3所示,4种化合物在麦粒和麦秆基质中的平均回收率在76%~102%之间,RSD在1.2%~9.1%之间,可满足农药残留分析的要求[14]。
|
|
表 3 麦粒和麦秆中4种化合物的添加回收率和相对标准偏差 Table 3 Spiked recoveries and RSDs of four compounds in wheat kernel and wheat straw (n = 5) |
2.5 方法的线性范围和定量限
结果(表4)表明:4种化合物在设定的麦粒和麦秆基质匹配标准溶液浓度范围内均具有较好的线性相关性,R2 ≥ 0.996。以最小添加水平分别作为其定量限。
|
|
表 4 麦粒和麦秆基质中4种化合物的线性范围和定量限 Table 4 Matrix standard curves of four compounds in wheat kernel and wheat straw |
3 结论
本研究以QuEChERS方法为基础,建立了同时测定氟唑磺隆、甲基二磺隆、炔草酯及其代谢物炔草酸在小麦中残留的分析方法。麦粒和麦秆样品经乙腈和甲酸水溶液提取,C18与无水硫酸镁净化后,添加回收率在76%~102%之间,RSD小于9.12%。在本研究线性范围内,R2 ≥ 0.996,定量限分别为:氟唑磺隆0.005 mg/kg,甲基二磺隆0.01 mg/kg,炔草酯及其代谢物炔草酸0.05 mg/kg。与传统的检测方法相比,该方法的前处理步骤更简单,有机溶剂用量大大减少,省时、高效的同时亦能够满足农药残留分析的要求。
| [1] |
范添乐, 魏芩杰, 陈小军, 等. 氟唑磺隆在野燕麦中的内吸传导特性[J]. 农药学学报, 2018, 20(6): 1-5. FAN T L, WEI Q J, CHEN X J, et al. Uptake and translocation of flucarbazone-sodium in Avena fatua [J]. Chin J Pestic Sci, 2018, 20(6): 1-5. |
| [2] |
ELIASON R, SCHOENAU J J, SZMIGIELSKI A M, et al. Phytotoxicity and persistence of flucarbazone-sodium in soil[J]. Weed Sci, 2004, 52(5): 857-862. DOI:10.1614/WS-03-047R2 |
| [3] |
VAZAN S, OVEISI M, BAZIAR S. Efficiency of mesosulfuron-methyl and clodinafop-propargyl dose for the control of Lolium perenne in wheat
[J]. Crop Prot, 2011, 30(6): 592-597. DOI:10.1016/j.cropro.2011.01.004 |
| [4] |
GUI W J, DONG Q X, ZHOU S L, et al. Waterborne exposure to clodinafop-propargyl disrupts the posterior and ventral development of zebrafish embryos[J]. Environ Toxicol Chem, 2011, 30(7): 1576-1581. DOI:10.1002/etc.v30.7 |
| [5] |
食品中农药最大残留限量: GB 2763—2016[S]. 北京: 中国标准出版社, 2017. Maximum residue limits for pesticides in food: GB 2763—2016[S]. Beijing: Standards Press of China, 2017. |
| [6] |
侯红敏, 乔琳, 刘惠敏, 等. 高效液相色谱法测定小麦中氟唑磺隆残留量[J]. 现代农药, 2015, 14(1): 35-36, 43. HOU H M, QIAO L, LIU H M, et al. Determination offlucarbazone-sodium residue in wheat by HPLC[J]. Mod Agrochem, 2015, 14(1): 35-36, 43. DOI:10.3969/j.issn.1671-5284.2015.01.011 |
| [7] |
段劲生, 王梅, 孙明娜, 等. 高效液相色谱法测定小麦和土壤中炔草酯及其代谢物炔草酸的残留量[J]. 农药学学报, 2013, 15(1): 121-124. DUAN J S, WANG M, SUN M N, et al. Determination of clodinafop-propargyl and its metabolite clodinafop in wheat and soil by high performance liquid chromatography[J]. Chin J Pestic Sci, 2013, 15(1): 121-124. DOI:10.3969/j.issn.1008-7303.2013.01.19 |
| [8] |
XUE J, LI H, LIU F, et al. Determination and dissipation of flucarbazone-sodium and its metabolite in wheat and soils by LC-MS/MS[J]. Inter J Environ Anal Chem, 2014, 94(5): 479-492. DOI:10.1080/03067319.2013.841153 |
| [9] |
NI Y X, YANG H, ZHANG H T, et al. Analysis of four sulfonylurea herbicides in cereals using modified Quick, Easy, Cheap, Effective, Rugged, and Safe sample preparation method coupled with liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2018, 1537: 27-34. DOI:10.1016/j.chroma.2018.01.017 |
| [10] |
张少军, 杨更亮, 郑振山, 等. 甲基二磺隆在小麦和土壤中的残留动态研究[J]. 河北农业大学学报, 2009, 32(3): 12-16. ZHANG S J, YANG G L, ZHENG Z S, et al. Study on the residue dynamics of mesosulfuron-methyl in wheat and soil[J]. J Agric Univ Hebei, 2009, 32(3): 12-16. DOI:10.3969/j.issn.1000-1573.2009.03.003 |
| [11] |
GUAN W B, MA Y Q, ZHANG H Y. Dissipation of clodinafop-propargyl and its metabolite in wheat field ecosystem[J]. Bull Environ Contam Toxicol, 2013, 90(6): 750-755. DOI:10.1007/s00128-013-0997-4 |
| [12] |
ANASTASSIADES M, LEHOTAY S J, ŠTAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and " dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. J AOAC Inter, 2003, 86(2): 412-431. |
| [13] |
International Union of Pure and Applied Chemistry[DB/OL].[2018-09-13]. http://sitem.herts.ac.uk/aeru/iupac/Reports/441.htm.
|
| [14] |
农作物中农药残留试验准则: NY/T 788—2018[S]. 北京: 中国农业出版社, 2018. Guideline for the testing of pesticide residues in crops: NY/T 788—2018[S]. Beijing: China Agriculture Press, 2018. |
 2019, Vol. 21
2019, Vol. 21


