高效氯氰菊酯 (beta-cypermethrin,β-CP,图式1) 是人工合成的第二代拟除虫菊酯类杀虫剂,其活性比氯氰菊酯高1倍,具有作用迅速、杀虫谱广、持效期长、光热稳定以及对眼睛和皮肤无刺激等优点[1],已被广泛用于农林业棉铃虫、菜蚜等害虫的控制[2-4],也常作为卫生杀虫剂应用于人类生活环境中[5-6]。
已有研究表明,氯氰菊酯等拟除虫菊酯类杀虫剂可导致哺乳动物大脑、肝脏、肾脏和睾丸等组织和细胞的脂质过氧化,抑制组织和细胞抗氧化酶的活性[7-8],影响神经、免疫及生殖等系统的发育,促使认知障碍的发生等[9-11],即其同时具有神经毒性、肝脏毒性、免疫毒性、生殖毒性和基因毒性[12-14]。β-CP可在动物的脂肪、皮肤、肝脏、肾脏、肾上腺、卵巢和脑等组织中蓄积[15]。Hughes等研究证明其具有类雌激素作用,广泛使用及其残留会对动物及人类健康造成危害[8, 16-17]。目前对于β-CP毒性的研究多集中在肝肾组织、免疫系统和雄性生殖系统方面。研究表明,β-CP可导致多种水生无脊椎动物和爬行类动物发生氧化应激,引发肝脏损伤[18-20]。Wang等[7]及Huang等[21]发现,β-CP能够引起小鼠巨噬细胞的氧化应激,降低其生存和吞噬能力,促进细胞的凋亡。Wang等发现,灌胃20 mg/kg的β-CP可明显影响雄性大鼠睾丸、精囊及副性腺的发育,以及影响生精细胞和精子的生成[22]。Hocine等发现,氯氰菊酯也可引起妊娠期母鼠及新生仔鼠发生氧化应激[23]。维生素E (vitamin E, VE,图式1) 是一种常见的抗氧化剂,已明确其可有效缓解氯氰菊酯对大鼠大脑和肝脏造成的损伤[24]。本研究拟通过探讨β-CP对小鼠卵巢的影响,进而探明β-CP对雌性动物生殖系统的毒性作用,并以VE为保护剂,探究VE能否干预β-CP对小鼠卵巢的影响。

|
图式1 β-CP和VE的结构式 Scheme1 The structural formula of β-CP and VE |
1 材料与方法 1.1 供试材料 1.1.1 小鼠分组及处理
共用80 只40 日龄的雌性昆白小鼠,平均体重约30 g,由重庆中药研究所提供。小鼠经适应性饲养7 d后随机分为6组:空白对照组 (花生油处理,Control),3个β-CP处理组 (剂量分别为10、20及40 mg/kg),VE保护组 (20 mg/kg β-CP + 20 mg/kg VE) 以及VE组 (20 mg/kg VE)。每组10~15 只小鼠,VE保护组用VE灌胃后1.0 h再用β-CP灌胃,其他组用生理盐水灌胃后1.0 h再用β-CP灌胃。连续灌胃处理10 d后,采用颈椎脱臼法处死各组小鼠,无菌条件下采集卵巢。
1.1.2 主要试剂和仪器高效氯氰菊酯 (beta-cypermethrin, β-CP) 原药 (南京盼丰生化有限公司,纯度 > 99%);维生素E (VE)、多聚甲醛及染色剂伊红 (成都市科龙化工试剂厂,分析纯);市售金龙鱼牌花生油 (用于溶解 β-CP);冰乙酸 (成都市科龙化工试剂厂,分析纯);苏木精染液 (南昌雨露实验器材有限公司);磷酸盐缓冲液 (PBS) (中国鼎国生物公司,BF-0011);二氨基联苯胺 (DAB,纯度 > 97%) (梯希爱上海化成工业发展有限公司);RIPA裂解液 (P0013C)、苯甲磺酰氟 (PMSF,纯度 > 99%)、5 × SDS-PAGE蛋白上样缓冲液 (P0015)、cDNA第一链合成试剂盒 (D7166) (碧云天生物技术有限公司);Lowry法蛋白浓度测定试剂盒 (PC0030)、乙二胺四乙酸 (EDTA,纯度 > 99.5%) (北京索莱宝科技有限公司);TRNzol总RNA提取试剂 (天根生化科技有限公司,DP405);0.45 μm聚偏二氟乙烯膜 (PVDF) (Immobilon-P,美国密理博公司)。
MDF-382ECN超低温冰箱 (日本SANYO公司);CT15RE冷冻离心机 (日本日立公司);Direct-Q™ 5超纯水制作系统 (美国密理博公司);LDZX-40BI立式自动电热压力蒸汽灭菌器 (上海申安医疗器械厂);1/1 000 RS-232II精密电子天平 (上海精天电子仪器厂,JT201N);XSZ-4GR电子光学生物显微镜 (重庆光电仪器有限公司);RM2235B轮转组织切片机 (德国莱卡公司);PowerPac™电泳及转移设备 (美国Bio-Rad公司)。
1.2 试验方法 1.2.1 小鼠卵巢组织结构观察将小鼠卵巢组织放入体积分数为10%的中性福尔马林中固定,冲洗后在70%、80%和90%的乙醇中分别脱水1.0 h,再经无水乙醇脱水2.0 h;置于二甲苯中进行透明化处理,最后将组织块浸蜡、包埋、切片后进行HE染色。用显微镜 (200倍) 观察卵巢组织结构的变化。
1.2.2 免疫组化法石蜡切片经常规脱蜡及抗原热修复 (1 mmoL/L的EDTA,pH = 8.0,95 ℃,15 min) 后,用冷水迅速冷却至室温,正常山羊血清封闭;加入抗StAR蛋白抗体 (按体积比 1 : 500加入PBS稀释后使用),于4 ℃孵育过夜;加入生物素二抗工作液,于37 ℃孵育30 min;用DAB显色,经苏木精复染后脱水、透明化和封片,进行显微镜观察。
1.2.3 蛋白免疫印迹试验取约1 g卵巢组织,加入3 mL RIPA裂解液及30 μL PMSF并充分匀浆,提取组织总蛋白,用Lowry法[25]测定蛋白浓度并定量。取约100 μg总蛋白样品,加入SDS-PAGE凝胶中电泳,分别用5%的SDS-PAGE浓缩胶及12%的SDS-PAGE分离胶进行蛋白的分离;切取所需部分凝胶,将凝胶上的蛋白恒流转至PVDF膜,用5%脱脂牛奶封闭后经PBST洗膜;抗孵育 (抗StAR抗体按体积比1 : 1 000 稀释) 4 ℃过夜,37 ℃孵育二抗 (按体积比1 : 1 000稀释) 1 h;常规PBST洗膜后用10 mL 0.5% 的DAB溶液染色,拍照记录结果。
1.2.4 RT-PCR扩增按照TRNzol总RNA提取试剂 (TIANGEN) 说明书提取卵巢的总RNA,测定其浓度及A260 nm/A280 nm值,保存于 –80 ℃。按照反转录试剂盒步骤合成cDNA,使用Taq酶对内参基因和目的基因进行比对分析。反应体系为:10 × Taq Buffer 5 μL,DNA模板1 μL,dNTPs (10 mmol/L) 1 μL,上下游引物各0.5 μL,Taq酶1 μL,以ddH 2O补齐至50 μL。扩增条件为:95 ℃ 3 min;95 ℃ 30 s,65~67 ℃ 45 s,72 ℃ 10 s,30个循环;72 ℃ 5 min。所得产物直接用于聚丙烯酰胺凝胶电泳分辨RT-PCR扩增片段。引物由上海生工生物技术服务公司合成,序列见表1。
|
|
表 1 RT-PCR引物 Table 1 RT-PCR primers |
1.3 统计方法
采用SPSS 22.0软件分析数据间差异的显著性 (P < 0.05);并采用Global one-way ANOVAS分析各组处理间的相关性,经由LSD法分析不同组间的差异。试验数据均为 X (平均数) ± SE (标准误) (n = 10)。
2 结果与分析 2.1 小鼠β-CP中毒临床症状灌胃1 d后,3个剂量β-CP处理组小鼠均出现精神沉郁,采食量、活动量下降,少数出现神经症状;3 d后症状有所减轻;7 d后症状再次出现,小鼠表现出精神萎靡、活动减少、共济失调、震颤、嗜睡及消瘦等症状,尤以40 mg/kg处理组最为明显。
40 mg/kg β-CP处理组小鼠在灌胃1 h后出现明显中毒症状,主要表现为对外界刺激反应过敏、流涎、竖毛、乱窜乱抓,进一步出现侧卧扭曲翻滚、呼吸困难及四肢抽搐等症状,中毒严重者出现死亡,死亡一般发生在灌胃24 h内。随处理剂量的降低,中毒症状出现时间延长,程度减轻。
2.2 不同浓度β-CP对小鼠卵巢结构的影响取小鼠卵巢制作石蜡切片后进行HE染色,显微镜观察结果见图1。与对照组相比,不同剂量β-CP处理组卵巢细胞胞浆嗜酸性均增强,卵巢空泡状结构明显,其中尤以40 mg/kg处理组最为明显。

|
A. 空白对照 (Control);B. 10 mg/kg β-CP;C. 20 mg/kg β-CP;D. 40 mg/kg β-CP;E. 20 mg/kg β-CP + 20 mg/kg VE;F. 20 mg/kg VE。 图 1 高效氯氰菊酯处理后小鼠卵巢组织结构的变化 Fig. 1 Changes of the ovaries histologic structure in mice after β-CP treatment |
2.3 不同浓度β-CP对StAR蛋白合成的影响 2.3.1 StAR蛋白免疫组化
StAR蛋白免疫组化切片的显微观察结果见图2。在空白对照及各处理组的卵泡和黄体细胞中都可看到染色颗粒的存在,且与对照组相比,40 mg/kg β-CP处理组中含有染色颗粒的细胞较少,并且颗粒较小,颜色较浅。

|
A. 空白对照 (Control);B. 10 mg/kg β-CP;C. 20 mg/kg β-CP;D. 40 mg/kg β-CP;E. 20 mg/kg β-CP + 20 mg/kg VE;F. 20 mg/kg VE。 图 2 高效氯氰菊酯处理后小鼠卵巢中StAR蛋白含量的变化 Fig. 2 Changes of StAR protein content in mice ovaries after β-CP treatment |
2.3.2 StAR蛋白浓度
采用蛋白免疫印迹法测定。以β-actin蛋白为内参,使用Image J软件分析蛋白的灰度值,以灰度值的大小代表蛋白的相对表达水平。测得空白对照组,10、20和40 mg/kg β-CP处理组,VE保护组和VE组的StAR蛋白灰度值分别为0.650 7 ± 0.025 7、0.528 2 ± 0.012 3、0.414 8 ± 0.019 8、0.388 5 ± 0.011 8、0.535 3 ± 0.024 9和0.681 1 ± 0.024 6。如图3所示:10、20和40 mg/kg β-CP处理组的StAR蛋白浓度均显著低于空白对照组 (P < 0.05),分别降低了18.8%、36.3%和40.3%;VE组和对照组差异不显著 ( P > 0.05),VE保护组则显著高于20 mg/kg β-CP处理组 (P < 0.05)。

|
注:柱上字母不同者表示差异显著 (P < 0.05)。 Note:The different labels indicate that the differences are significant (P < 0.05). 图 3 高效氯氰菊酯处理后小鼠卵巢中StAR蛋白表达量的变化 Fig. 3 Changes of StAR protein expression in mice ovaries after β-CP treatment |
2.4 β-CP对小鼠细胞凋亡基因转录的影响 2.4.1 对casp-3转录的影响
空白对照组、3个剂量 β-CP处理组、VE保护组和VE组的casp-3 PCR电泳条带见图4A,mRNA表达量灰度值分别是1.259 0 ± 0.107 0、1.460 0 ± 0.224 0、1.595 1 ± 0.154 7、1.924 4 ± 0.178 4、1.553 3 ± 0.232 4和1.339 3 ± 0.107 4。如图4C所示:随β-CP剂量增加,casp-3 mRNA的表达显著升高 (P < 0.05),10、20和40 mg/kg处理组分别升高了16.0%、26.7%和52.9%;VE组和对照组差异不显著 ( P > 0.05),VE保护组和20 mg/kg β-CP处理组差异不显著 (P > 0.05)。
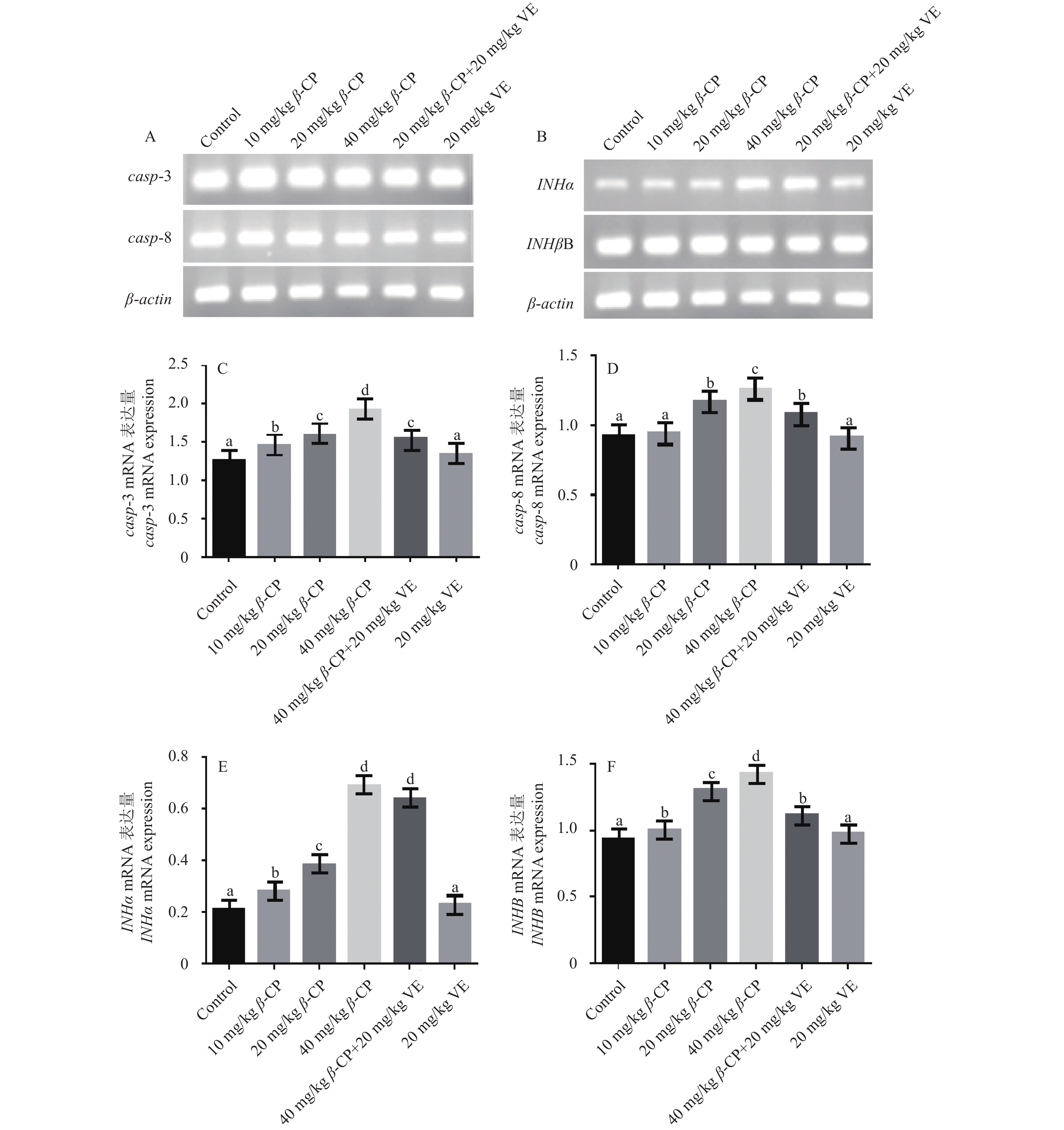
|
A. casp-3、casp-8及内参β-actin PCR电泳条带;B. INHα、INHβB 及内参β-actin PCR电泳条带;C. casp-3 mRNA表达量变化;D. casp-8 mRNA表达量变化;E. INHα mRNA表达量变化;F. INHβB mRNA表达量变化。 A. PCR electrophoretic strips of casp-3, casp-8 and β-actin (reference gene); B. PCR electrophoretic strips of INHα, INHβB and β-actin (reference gene); C. Changes of casp-3 mRNA expression; D. Changes of casp-8 mRNA expression; E. Changes of INHα mRNA expression; F. Changes of INHβB mRNA expression. 注:柱上字母不同者表示差异显著 (P < 0.05)。Note:The different labels indicate that the differences are significant (P < 0.05). 图 4 高效氯氰菊酯处理后小鼠卵巢组织中casp-3、casp-8、INHα及INHβB mRNA表达的变化 Fig. 4 Changes of the expression of casp-3, casp-8, INHα |
2.4.2 对casp-8转录的影响
空白对照组、3个剂量 β-CP处理组、VE保护组及VE组的casp-8 PCR电泳条带见图4A,mRNA表达量灰度值分别为0.919 1 ± 0.003 1、0.947 1 ± 0.001 3、1.168 5 ± 0.001 9、1.256 8 ± 0.002 3、1.084 0 ± 0.000 9和0.912 3 ± 0.003 7。如图4D所示:随β-CP剂量升高,casp-8 mRNA的表达升高,除10 mg/kg组与对照组差异不显著外 (P > 0.05),其余2组均显著高于对照 ( P < 0.05),分别升高了27.1%和36.7%;VE组和对照组差异不显著 ( P > 0.05),VE保护组和20 mg/kg β-CP处理组差异不显著 (P > 0.05)。
2.5 β-CP对小鼠抑制素基因转录的影响 2.5.1 对小鼠INHαmRNA转录的影响空白对照组、3个剂量 β-CP处理组、VE保护组及VE组的INHα PCR电泳条带见图4B,mRNA表达量灰度值分别为0.209 0 ± 0.001 9、0.281 1 ± 0.002 3、0.383 8 ± 0.004 1、0.687 0 ± 0.000 4、0.636 4 ± 0.003 3和0.228 4 ± 0.003 8。如图4E所示:随β-CP剂量增加,INHα mRNA的表达显著升高 (P < 0.05),10、20和40 mg/kg处理组分别升高了34.5%、83.6%和228.7%;VE组和对照组差异不显著 ( P > 0.05),VE保护组显著高于20 mg/kg β-CP处理组 (P < 0.05)。
2.5.2 对小鼠INHβBmRNA转录的影响空白对照组、3个剂量 β-CP处理组、VE保护组及VE组的INHβB PCR电泳条带见图4B,mRNA表达量灰度值分别为0.934 3 ± 0.006 3、1.004 2 ± 0.003 4、1.300 2 ± 0.001 8、1.426 6 ± 0.004 2、1.117 8 ± 0.006 0和0.976 6 ± 0.003 3。如图4F所示:随β-CP剂量升高,INHBB mRNA的表达显著升高 (P < 0.05),10、20和40 mg/kg处理组分别升高了7.5%、39.2%和52.7%;VE组和对照组差异不显著 ( P > 0.05),VE保护组显著低于20 mg/kg β-CP处理组 (P < 0.05)。
3 讨论与结论由于β-CP微溶于水而易溶于油,因此本研究以花生油作为其溶剂对小鼠进行灌胃处理。结果表明,经不同剂量的β-CP处理后小鼠均表现出了一定的中毒症状,其中20 mg/kg的β-CP即可使小鼠产生明显的毒性反应,而40 mg/kg组甚至能够引起小鼠的死亡,因此本研究所设VE保护组为20 mg/kg β-CP + 20 mg/kg VE,以期通过对可造成小鼠明显毒性损伤的中等剂量β-CP的干预,探究VE对β-CP造成的机体损伤是否具有预防保护作用。
Zhou等的研究表明,β-CP可影响小鼠卵巢的质量[26],但本研究发现,各剂量β-CP处理组小鼠卵巢质量与对照组并无显著差异,这可能与本研究采用的急性毒性试验方法处理周期短有关。通过制作石蜡切片和HE染色,在显微镜下观察小鼠卵巢组织结构的变化,发现不同剂量处理组与对照相比,卵巢细胞胞浆嗜酸性均增强,卵巢空泡状结构明显,其中40 mg/kg β-CP处理组尤为明显,说明β-CP对小鼠卵巢组织结构造成了损伤,即β-CP对雌性小鼠生殖系统具有毒性作用。
为探究β-CP对雌性生殖系统的影响机制及VE的干预作用,本研究进一步从分子水平检测了β-CP对与生殖相关的StAR蛋白、细胞凋亡相关基因和抑制素基因表达的影响。有研究表明,β-CP能够干扰雌性小鼠雌激素与孕激素的平衡,干扰妊娠周期、胚胎着床率以及子代的发育[26-27]。甾体类前体物转移至线粒体是性激素等类固醇激素合成过程中的限速步骤,而StAR蛋白是这一步骤中的关键调节因子[28],对类固醇激素的生成速率具有重要影响[29]。通过免疫组化和蛋白免疫印迹试验发现,β-CP可抑制卵巢组织中StAR蛋白的合成,而VE可减弱此抑制作用,表明β-CP可能通过抑制StAR蛋白的合成,进而影响类固醇激素的合成,最终影响卵巢的生殖功能,而VE可通过减弱β-CP对StAR蛋白的影响,从而对卵巢的生殖功能起到一定的保护作用。卵巢颗粒细胞的凋亡是卵泡闭锁的基本机制,Marettove的研究表明,拟除虫菊酯类农药可影响雌性小鼠的正常排卵,导致卵泡闭锁,减少卵泡细胞、卵母细胞和黄体的数量[30]。通过对小鼠卵巢中细胞凋亡基因casp-3和casp-8表达的检测,发现β-CP可促进casp-3和casp-8的表达,表明β-CP可能通过对细胞凋亡相关基因的上调,影响卵巢卵泡的正常发育,促进卵泡发生闭锁,从而对卵巢的生殖功能造成影响;而添加VE对casp-3和casp-8的表达无明显影响。抑制素由卵巢颗粒细胞合成并分泌,直接影响优势卵泡的发育和数量,与卵泡发育和继续成熟密切相关[31]。通过对抑制素相关基因INHα和INHβB表达的检测,发现β-CP可促进INHα和INHβB的表达,表明β-CP可能还会通过对抑制素基因的上调,限制优势卵泡的发育和数量,进而影响卵巢的生殖功能。
综上可见,β-CP对雌性小鼠的生殖系统具有毒性作用,可对小鼠卵巢组织结构造成损伤,这与经β-CP处理后小鼠卵巢组织中StAR蛋白的合成减少,以及casp-3、casp-8、INHα和INHβB基因表达的上调有关;而VE可通过减弱β-CP对StAR蛋白的影响,从而对卵巢起到一定的保护作用。
| [1] |
YAN Y L, FAN J, LAI Y C, et al. Efficient preparative separation of β-cypermethrin stereoisomers by supercritical fluid chromatography with a two-step combined strategy
[J]. J Sep Sci, 2018, 41(6): 1442-1449. DOI:10.1002/jssc.201701138 |
| [2] |
JIN T, LIN Y Y, JIN Q A, et al. Population susceptibility to insecticides and the development of resistance in Bactrocera cucurbitae (Diptera:Tephritidae)
[J]. J Econ Entomol, 2016, 109(2): 837-846. DOI:10.1093/jee/tov349 |
| [3] |
FRANCO A A, ZANARDI O Z, JACOB C R O, et al. Susceptibility of Euseius concordis (Mesostigmata: Phytoseiidae) to pesticides used in citrus production systems
[J]. Exp Appl Acarol, 2017, 73(1): 61-77. DOI:10.1007/s10493-017-0176-0 |
| [4] |
QU Y Y, XIAO D, LIU J J, et al. Sublethal and hormesis effects of beta-cypermethrin on the biology, life table parameters and reproductive potential of soybean aphid Aphis glycines
[J]. Ecotoxicology, 2017, 26(7): 1002-1009. DOI:10.1007/s10646-017-1828-x |
| [5] |
LENG G, BERGER-PREIβ E, LEVSEN K, et al. Pyrethroids used indoor-ambient monitoring of pyrethroids following a pest control operation[J]. Int J Hyg Environ Health, 2005, 208(3): 193-199. DOI:10.1016/j.ijheh.2005.01.016 |
| [6] |
SCOTT J G, YOSHIMIZU M H, KASAI S. Pyrethroid resistance in Culex pipiens mosquitoes
[J]. Pestic Biochem Physiol, 2015, 120: 68-76. DOI:10.1016/j.pestbp.2014.12.018 |
| [7] |
WANG X, HE B N, KONG B D, et al. β-Cypermethrin and its metabolite 3-phenoxybenzoic acid exhibit immunotoxicity in murine macrophages
[J]. Acta Biochimica Biophysica Sinica (Shanghai), 2017, 49(12): 1083-1091. DOI:10.1093/abbs/gmx111 |
| [8] |
HUGHES M F, ROSS D G, STARR J M, et al. Environmentally relevant pyrethroid mixtures: a study on the correlation of blood and brain concentrations of a mixture of pyrethroid insecticides to motor activity in the rat[J]. Toxicology, 2016, 359-360: 19-28. DOI:10.1016/j.tox.2016.06.013 |
| [9] |
MAURYA S K, MISHRA J, ABBAS S, et al. Cypermethrin stimulates GSK3β-dependent Aβ and p-tau proteins and cognitive loss in young rats: reduced HB-EGF signaling and downstream neuroinflammation as critical regulators
[J]. Mol Neurobiol, 2016, 53(2): 968-982. DOI:10.1007/s12035-014-9061-6 |
| [10] |
BASKAR M K, MURTHY P B. Acute in vitro neurotoxicity of some pyrethroids using microelectrode arrays
[J]. ToXicology in Vitro, 2018, 47: 165-177. DOI:10.1016/j.tiv.2017.11.010 |
| [11] |
AL-HAMDANI N M H, NARASINHACHARY Y H. Endocrine disruptive action of cypermethrin in male mice[J]. Toxicol Environ Health Sci, 2011, 3(2): 69-79. DOI:10.1007/s13530-011-0080-7 |
| [12] |
CALDERÓN-SEGURA M E, GÓMEZ-ARROYO S, CORTÉS-ESLAVA J, et al. In vitro cytotoxicity and genotoxicity of Furia®180 SC (zeta-cypermethrin) and Bulldock 125®SC (β-cyfluthrin) pyrethroid insecticides in human peripheral blood lymphocytes
[J]. Toxicol Mech Methods, 2018, 28(4): 268-278. DOI:10.1080/15376516.2017.1402977 |
| [13] |
HUSSIEN H M, ABDOU H M, YOUSEF M I. Cypermethrin induced damage in genomic DNA and histopathological changes in brain and haematotoxicity in rats: the protective effect of sesame oil[J]. Brain Res Bull, 2013, 92: 76-83. DOI:10.1016/j.brainresbull.2011.10.020 |
| [14] |
SEIFERTOVÁ M, ČECHOVÁ E, LLANSOLA M, et al. Determination of selected neurotoxic insecticides in small amounts of animal tissue utilizing a newly constructed mini-extractor[J]. Anal Bioanal Chem, 2017, 409(25): 6015-6026. DOI:10.1007/s00216-017-0533-1 |
| [15] |
YUN X M, HUANG Q C, RAO W B, et al. A comparative assessment of cytotoxicity of commonly used agricultural insecticides to human and insect cells[J]. Ecotoxicol Environ Saf, 2017, 137: 179-185. DOI:10.1016/j.ecoenv.2016.12.002 |
| [16] |
WANG Q, XU L F, ZHOU J L, et al. Antagonism effects of cypermethrin on interleukin-6-induced androgen receptor activation[J]. Environ Toxicol Pharmacol, 2015, 40(1): 172-174. DOI:10.1016/j.etap.2015.06.008 |
| [17] |
MANNA S, BHATTACHARYYA D, MANDAL T K, et al. Repeated dose toxicity of alfa-cypermethrin in rats
[J]. J Vet Sci, 2004, 5(3): 241-245. DOI:10.4142/jvs.2004.5.3.241 |
| [18] |
WEI K Q, YANG J X. Oxidative damage induced by copper and beta-cypermethrin in gill of the freshwater crayfish Procambarus clarkii
[J]. Ecotoxicol Environ Saf, 2015, 113: 446-453. DOI:10.1016/j.ecoenv.2014.12.032 |
| [19] |
ZHANG J Y, LIU L L, REN L, et al. The single and joint toxicity effects of chlorpyrifos and beta-cypermethrin in zebrafish (Danio rerio) early life stages
[J]. J Hazard Mater, 2017, 334: 121-131. DOI:10.1016/j.jhazmat.2017.03.055 |
| [20] |
CHEN L, XU P, DIAO J L, et al. Distribution, metabolism and toxic effects of beta-cypermethrin in lizards (Eremias argus) following oral administration
[J]. J Hazard Mater, 2016, 306: 87-94. DOI:10.1016/j.jhazmat.2015.11.053 |
| [21] |
HUANG F, LIU Q Y, XIE S J, et al. Cypermethrin induces macrophages death through cell cycle arrest and oxidative stress-mediated JNK/ERK signaling regulated apoptosis[J]. Int J Mol Sci, 2016, 17(6): 885. DOI:10.3390/ijms17060885 |
| [22] |
WANG X Z, LIU S S, SUN Y, et al. Beta-Cypermethrin impairs reproductive function in male mice by inducing oxidative stress
[J]. Theriogenology, 2009, 72(5): 599-611. DOI:10.1016/j.theriogenology.2009.04.016 |
| [23] |
HOCINE L, MERZOUK H, MERZOUK S A, et al. The effects of alpha-cypermethrin exposure on biochemical and redox parameters in pregnant rats and their newborns
[J]. Pestic Biochem Physiol, 2016, 134: 49-54. DOI:10.1016/j.pestbp.2016.04.007 |
| [24] |
GIRAY B, GÜRBAY A, HINCAL F. Cypermethrin-induced oxidative stress in rat brain and liver is prevented by vitamin E or allopurinol[J]. Toxicol Lett, 2001, 118(3): 139-146. DOI:10.1016/S0378-4274(00)00277-0 |
| [25] |
PETERSON G L. A simplification of the protein assay method of Lowry, et al. which is more generally applicable[J]. Anal Biochem, 1977, 83(2): 346-356. DOI:10.1016/0003-2697(77)90043-4 |
| [26] |
ZHOU Y J, WANG X D, XIAO S, et al. Exposure to beta-cypermethrin impairs the reproductive function of female mice
[J]. Regul Toxicol Pharmacol, 2018, 95: 385-394. DOI:10.1016/j.yrtph.2018.04.015 |
| [27] |
ZHOU Y J, WANG J H, WANG L Q, et al. Effect of beta-cypermethrin exposure on embryo implantation in mice
[J]. Reprod Toxicol, 2018, 76: 1-11. DOI:10.1016/j.reprotox.2017.12.001 |
| [28] |
SOCCIO R E, BRESLOW J L. Intracellular cholesterol transport[J]. Arterioscler Thromb Vasc Biol, 2004, 24(7): 1150-1160. DOI:10.1161/01.ATV.0000131264.66417.d5 |
| [29] |
TSUCHIYA M, INOUE K, MATSUDA H, et al. Expression of steroidogenic acute regulatory protein (StAR) and LH receptor in MA-10 cells[J]. Life Sci, 2003, 73(22): 2855-2863. DOI:10.1016/S0024-3205(03)00698-2 |
| [30] |
MARETTOVA E, MARETTA M, LEGÁTH J. Effect of pyrethroids on female genital system[J]. Anim Reprod Sci, 2017, 184: 132-138. DOI:10.1016/j.anireprosci.2017.07.007 |
| [31] |
DE JONG F H. Inhibin[J]. Physiol Rev, 1988, 68(2): 555-607. DOI:10.1152/physrev.1988.68.2.555 |
 2019, Vol. 21
2019, Vol. 21


