许多昆虫如蟋蟀和有翅蚜等存在翅二型现象,即长翅型 (扩散) 与短翅型 (留居) [1-4]。昆虫翅二型的变化,能更好地实现其繁殖与迁飞的相互转换,从而及时地适应外界环境条件的变化,获得种群的繁衍与延续[5]。翅二型昆虫不仅在形态上存在差异,且其在寿命、繁殖力及对饥饿耐受力等生理方面也存在差异[6]。一些杀虫剂对昆虫的翅型分化会产生一定的影响,如亚致死剂量的吡虫啉能显著提高棉蚜和桃蚜后代中有翅个体的比例[7]。
褐飞虱 Nilaparvata lugens (Stål) 属半翅目飞虱科 (Hemiptera: Delphacidae),是水稻主要害虫之一[8-10],且具有爆发性强、繁殖力快等特点,目前主要采用化学防治[11]。褐飞虱存在翅二型现象,且一些杀虫剂对其翅型的形成有明显的诱导作用[12-13]。然而,在防治过程中,长、短翅型褐飞虱对药剂的敏感性是否存在差异常常被忽略。笔者通过多代纯化降低种群杂合度,得到2种不同翅型的褐飞虱品系,并测定了其对12种常见杀虫剂的敏感性,同时对其体内解毒酶活力进行了比较分析,以期为更好地进行褐飞虱的科学防控提供理论依据。
1 材料与方法 1.1 供试虫源褐飞虱长、短翅型品系为2015年11月由华中农业大学农业昆虫与害虫防治实验室华红霞老师课题组提供,并在该校农药毒理学实验室用未接触任何药剂的TN1水稻苗饲养,成虫后将长翅型与短翅型个体分开饲养,此后每一代均剔除不同翅型的个体,保留所需要的翅型个体。长、短翅型褐飞虱品系的纯合率分别为80%和100%。试虫在(28 ± 1) ℃,相对湿度80% ± 1%,光暗周期为L : D = 16 h : 8 h的人工气候培养箱中饲养。
1.2 药剂、试剂及主要仪器95.8%烯啶虫胺 (nitenpyram) 原药,江苏维尤纳特精细化工有限公司;97.6%环氧虫啶 (cycloxaprid) 原药,如东众意化工有限公司;91%呋虫胺 (dinotefuran) 原药,山东海利尔化工有限公司;95%噻虫嗪 (thiamethoxam) 原药、95.8%吡虫啉 (imidacloprid)原药和95%敌敌畏 (dichlorvos) 原药,山东潍坊润丰化工股份有限公司;96%噻虫胺 (clothianidin) 原药,日本住友化学株式会社;98%毒死蜱 (chlorpyrifos) 原药,江苏宝灵化工有限公司;98.6%噻嗪酮 (buprofezin) 原药,江苏常隆农化有限公司;97.3%异丙威 (isoprocarb) 原药,安徽广信农化股份有限公司;96%吡蚜酮 (pymetrozine) 原药,江苏省南通施壮化工有限公司;95%醚菊酯 (etofenprox) 原药,江苏百灵农化有限公司。
乙酸-α-萘酯 (α-NA)、2, 4-二硝基氯苯 (CDNB)、还原型谷胱甘肽 (GSH)、苯基硫脲 (PTU)、苯甲基磺酰氟 (PMSF)、二硫苏糖醇 (DTT)、还原辅酶Ⅱ四钠盐 (β-NADPH) 和固蓝B盐均购自Aladdin公司;十二烷基硫酸钠 (SDS) 和Triton X-100购自美国Sigma公司;牛血清白蛋白 (BSA)、Quick StartTM Bradford 1 × Dye Reagent和Tris-HCl购自Takara公司;三氯乙酸 (TCA) 和7-乙氧香豆素购自东京化成工业株式会所。所有试剂均为分析纯。
UV-1800型紫外分光光度计 (日本岛津公司);iMarkTM酶标仪 (美国BIO-RAD公司);NP80超微量分光光度计 (德国IMPLEN公司);5804R型台式冷冻离心机 (德国Eppendorf公司)。
1.3 褐飞虱对不同杀虫剂的敏感性测定根据Zhang等的方法[14]采用稻苗浸渍法测定长、短翅型褐飞虱品系对不同杀虫剂的敏感性。将TN1水稻苗 (约10 cm高) 洗净,15根为1组,放于阴凉处晾至稻苗表面无水痕。将其浸渍于以0.1%Triton X-100为溶剂经等比稀释5~7个浓度梯度的各杀虫剂药液中约30 s,晾干。用脱脂棉包住稻苗根部,并将脱脂棉浸水后放入一次性塑料杯 (500 mL PP杯) 中,接入标准一致的褐飞虱3龄若虫,每杯接入15头,每浓度重复3次。以含0.1% Triton X-100的清水为对照。接入试虫后用纱布封口,置于28 ℃ ± 1 ℃,相对湿度80% ± 1%,光暗周期为L : D = 16 h : 8 h的人工气候培养箱中培养。对于毒死蜱、敌敌畏、醚菊酯和异丙威,于处理后72 h检查结果;对于烯啶虫胺、环氧虫啶、呋虫胺、噻虫嗪、噻虫胺和吡虫啉,于处理后96 h检查结果;对于噻嗪酮和吡蚜酮,则分别于处理后120 h和168 h检查结果。用毛笔轻触虫体,若试虫不能正常爬行,则视为死亡。以致死中浓度 (LC50值) 验证试虫对杀虫剂的敏感性差异。以不同杀虫剂对短翅型褐飞虱若虫的LC50值为测试质量浓度,测定在同一质量浓度下长、短翅型3龄若虫褐飞虱的死亡率差异。每浓度重复3次。
1.4 褐飞虱解毒酶活力测定 1.4.1 试虫预处理挑取3龄褐飞虱若虫于离心管中,于 –80 ℃保存,供3种解毒酶活力测定。每种酶的活性测定均设3次独立取样重复,每个重复平行测定3次。
1.4.2 蛋白含量测定取待测样品100 μL,加入Quick StartTM Bradford 1 × Dye Reagent 900 μL,混匀,静置5 min,在595 nm处测定吸光度值。用牛血清蛋白制作蛋白标准曲线。根据蛋白标准曲线计算酶源蛋白含量。
1.4.3 酯酶活性测定称取褐飞虱3龄若虫0.02 g,加入1 mL冷冻的0.04 mol/L、pH 7.0的磷酸盐缓冲液,用预冷过的匀浆器充分匀浆,于14 000 × g、4 ℃下离心20 min,取上清作为粗酶液。
采用Asperen等[15]方法并加以改进。取1 mL 3 × 10–4 mol/L的乙酸-α-萘酯底物溶液,于37 ℃水浴中预热3 min后加入粗酶液0.2 mL,混匀,再置于37 ℃水浴锅中反应15 min,加入0.2 mL显色剂终止反应并显色,稳定30 min后在600 nm处测定吸光度值。以热灭活酶源为对照。用α-萘酚制作标准曲线。根据标准曲线计算每毫升酶液生成的α-萘酚量,计算酶比活力。
1.4.4 谷胱甘肽S-转移酶活力测定称取褐飞虱3龄若虫0.05 g,加入1 mL冷冻的0.1 mol/L、pH 6.5的磷酸盐缓冲液,用预冷过的匀浆器充分匀浆,于14 000 × g 4 ℃下离心20 min,取上清作为粗酶液。
采用Han等[16]的方法并加以改进。反应体系按顺序加入740 μL缓冲液、30 μL CDNB、100 μL酶液和30 μL GSH,混匀,在340 nm处测定2 min内吸光度的变化值,根据公式 (1) 计算酶的比活力。
| ${R_{{\rm{GSTs}}}} = \left[ {\left( {\Delta {\rm{OD}} \times V} \right)/\left( {\varepsilon \times L} \right)} \right]/{m_{{\rm{pro}}}}$ | (1) |
式中:RGSTs 为GSTs比活力 (μmol/(mg · min)),ΔOD为每分钟光吸收的变化值 (OD340 · min–1),V为酶促反应体积 (0.9 mL),ε为产物的消光系数[0.009 6 L/ (μmol·cm)],L为比色杯的光程 (1 cm),mpro为蛋白含量 (mg)。
1.4.5 7-乙氧香豆素-O-脱乙基酶 (7-ECOD) 测定称取褐飞虱3龄若虫0.2 g,加入600 μL的 0.1 mol/L、pH 7.5的磷酸缓冲液 (含10%甘油、1 mmol/L DTT、1 mmol/L PMSF和1 mmol/L EDTA),用预冷过的匀浆器匀浆,于14 000×g 4 ℃下离心10 min,取上清液相同条件下再次离心5 min,取上清作为粗酶液。
采用Li等[17]的方法并加以改进。以7-ECOD为底物测定细胞色素P450的7-ECOD活性。向反应体系依次加入365 μL 0.1 mol/L、pH 7.8 的Tris-HCl缓冲液,5 μL 40 mmol/L的 7-乙氧香豆素,10 μL 10 mmol/L的NADPH和125 μL粗酶液。在摇床内于30 ℃下振荡反应30 min后,立即将离心管置于冰浴中,加入150 μL 15% 的TCA终止反应。将反应后的混合物于10 000 × g下离心2 min,取100 μL上清液,加入45 μL 1.6 mol/L、pH 10.5的甘氨酸-氢氧化钠溶液,使上清液最终pH值为10。采用荧光酶标仪测定产物7-羟基香豆素的含量。激发波长358 nm,发射波长456 nm。用7-羟基香豆素标准品制作标准曲线。将荧光强度值转换为7-羟基香豆素的摩尔质量 [nmol/ (min·mg)],根据公式 (2) 计算酶比活力。
| ${R_{{\rm{7 {\text -} ECOD}}}} = \left( {C \times V} \right)/\left( {t \times {m_{{\rm{pro}}}}} \right)$ | (2) |
式中:R7-ECOD为 7-ECOD比活力,nmol/(mg · min);C为产物浓度,nmol;V为反应总体积,μL;t为反应时间,min;mpro为蛋白含量,mg。
1.5 试验结果统计分析采用DPS对数据进行处理分析,计算致死中浓度 (LC50)、95%置信区间、卡方值和自由度。采用Polo软件对杀虫剂对长、短翅型毒力进行差异性分析[18]。以长翅品系解毒酶的比活力为1,计算短翅品系酶的相对比活力。通过t检验对死亡率以及酶相对比活力进行差异性分析,其中P < 0.05表示差异显著。
2 结果与分析 2.1 长、短翅型褐飞虱对不同药剂的敏感性分析采用稻苗浸渍法测定12种药剂对长、短翅型褐飞虱若虫 (3龄) 的LC50值,结果见表1。对于新烟碱类杀虫剂,通过Polo分析后可知,长、短翅型褐飞虱对其中4种杀虫剂吡虫啉、噻虫嗪、噻虫胺和呋虫胺的敏感性存在显著差异,表现为长翅型褐飞虱的敏感性高于短翅型,而对于有机磷类杀虫剂毒死蜱,则表现为长翅型褐飞虱的敏感性显著低于短翅型低;噻嗪酮、异丙威、吡蚜酮和醚菊酯,4种杀虫剂的LC50值间皆不存在显著差异。
|
|
表 1 不同杀虫剂对长、短翅型褐飞虱的毒力 Table 1 Toxicity of insecticides to the macropterous and brachypterous N. lugens |
以上结果表明,长、短翅型褐飞虱若虫对呋虫胺、噻虫胺、噻虫嗪、吡虫啉和毒死蜱的敏感性存在差异。
以不同杀虫剂对短翅型褐飞虱的LC50值为处理浓度,测定长、短型褐飞虱的死亡率。结果 (图1)表明,经呋虫胺、噻虫胺、噻虫嗪和吡虫啉处理,长翅型褐飞虱的死亡率分别为88.9%、91.1%、80.0%和80.0%,短翅型褐飞虱的死亡率为62.2%、53.3%、46.7%和53.3%,长翅型的死亡率显著高于短翅型的;但毒死蜱对长翅型褐飞虱的死亡率 (31.1%) 显著低于短翅型死亡率 (68.9%)。该结果进一步验证了长、短翅型褐飞虱对部分杀虫剂的敏感性存在差异。
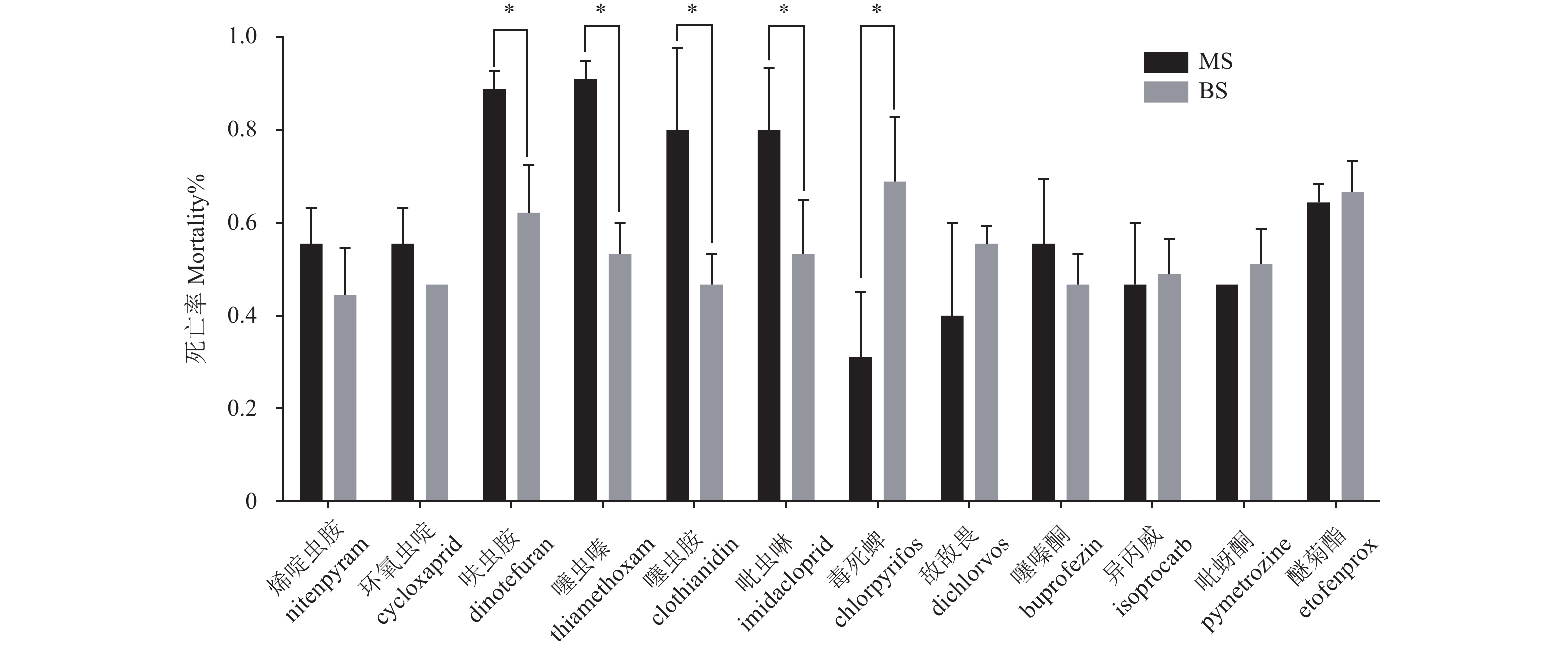
|
图中 * 表示差异显著 (t检验, P < 0.05),MS表示长翅型褐飞虱,BS表示短翅型褐飞虱。 * Indicates significantly different at 0.05 level by t test. MS indicate macropterous N. lugens. BS indicate brachypterous N. lugens. 图 1 不同杀虫剂的短翅型致死中浓度处理后长、短翅型褐飞虱的死亡率 Fig. 1 Mortality of the macropterous and brachypterous N. lugens after treatment with insecticides in LC50 of brachpterous strain |
2.2 长、短翅型褐飞虱的酶活力差异分析
图2结果显示:长翅型褐飞虱的酯酶相对比活力是短翅型褐飞虱的1.21倍,长翅型显著高于短翅型;而长翅型褐飞虱细胞色素P450单加氧酶7-ECOD相对比活力是短翅型的0.933倍,显著低于短翅型,谷胱甘肽S-转移酶的相对比活力无显著差异。
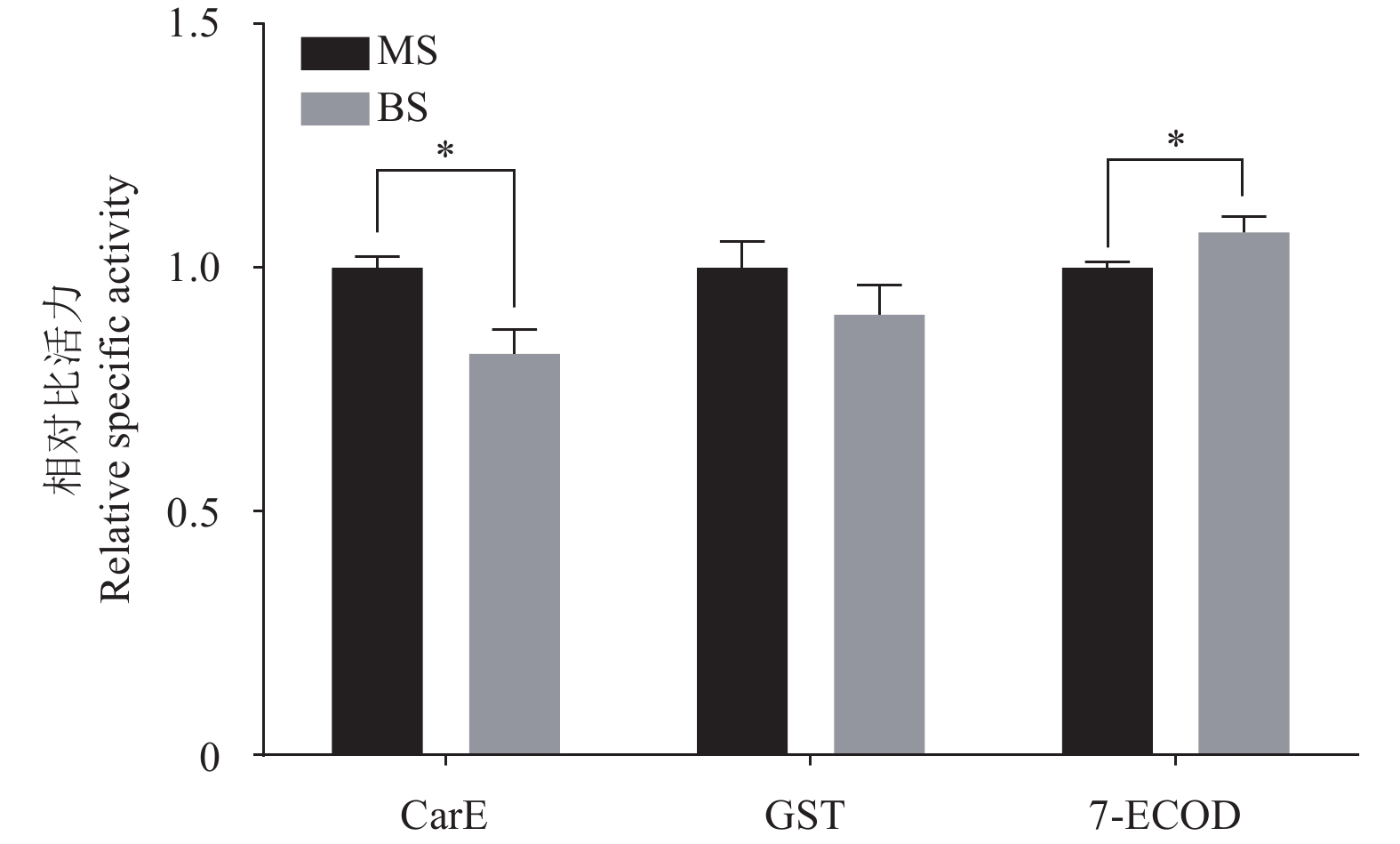
|
图中 * 表示差异显著 (t检验, P < 0.05),MS表示长翅型褐飞虱,BS表示短翅型褐飞虱。 * Indicates significantly different at 0.05 level by t test, MS indicate macropterous N. lugens. BS indicate brachypterous N. lugens. 图 2 长短翅型褐飞虱的解毒酶相对比活力 Fig. 2 Relative specific activities of detoxifying enzymes the macropterous and brachypterous N. lugens |
3 结论与讨论
环境因素的刺激会影响褐飞虱的翅型分化。当寄主环境恶劣时,褐飞虱为了更好地适应环境会进行长距离迁移,此时后代多为长翅型;而当寄主环境营养充足时后代多为短翅型,具有较强的繁殖能力[19]。褐飞虱为适应外部环境的改变而进行翅型的交替现象,为预防和控制虫害提供了新思路。本研究中迁飞的长翅型褐飞虱对新烟碱类杀虫剂吡虫啉、噻虫嗪、噻虫胺和呋虫胺的敏感性显著高于居留的短翅型,与臧连生等[20]发现的烟粉虱当地种群比入侵种群对5%吡虫啉乳油和5%吡丙醚乳油更为敏感的结论一致。本研究中长翅型褐飞虱对有机磷类杀虫剂毒死蜱的敏感性显著低于短翅型,类似的报道如吴向军等发现,短翅型褐飞虱雌成虫对乐果、敌敌畏和甲胺磷的抗药性比长翅型雌成虫有不同程度的提高[21],苗建忠等测定的有翅蚁对辛硫磷的毒力高于工蚁9.0倍[22]。为进一步验证长、短翅型褐飞虱对杀虫剂敏感性的差异性,以不同杀虫剂对短翅型褐飞虱的LC50值为处理浓度,比较了不同杀虫剂对长、短翅型褐飞虱的死亡率,其结果与Polo分析相符。本研究结果表明,不同翅型褐飞虱对同种药剂的敏感性不同。
昆虫对杀虫剂的敏感性与昆虫解毒酶活力有关,如酯酶、谷胱甘肽S-转移酶和细胞色素P450单加氧酶[23]。研究表明,酯酶可将有机磷类杀虫剂水解为毒性较低的水解产物[24-25],细胞色素P450单加氧酶可催化新烟碱类杀虫剂的代谢反应[26-28],也可将毒死蜱氧化成毒力更高的氧化毒死蜱 (CPO) [29]。本研究中长翅型褐飞虱的酯酶活力显著低于短翅型褐飞虱,而细胞色素P450单加氧酶活力则显著高于短翅型褐飞虱,这两种解毒酶活力的不同可能是导致长、短翅型褐飞虱对新烟碱类杀虫剂和毒死蜱敏感性不同的原因。
近年来,由于化学药剂的不合理使用导致褐飞虱敏感性降低[30],而其翅二型现象进一步加剧了防治难度[31]。一般来说,褐飞虱的防治适期为2、3龄若虫高峰期,应重点防治短翅褐飞虱的产卵,但在害虫大发生年份及常年重发区,宜注重采用合适的药剂防治长翅型成虫的迁入[32]。根据当地繁殖代和迁入代田间褐飞虱主要翅型的不同,使用不同杀虫剂的防治策略为褐飞虱防治提供新角度。
| [1] |
LIN X D, YAO Y, WANG B, et al. FOXO links wing form polyphenism and wound healing in the brown planthopper, Nilaparvata lugens
[J]. Insect Biochem Mol Biol, 2016, 70: 24-31. DOI:10.1016/j.ibmb.2015.12.002 |
| [2] |
DENNO R F. The evolution of dispersal polymorphisms in insects: The influence of habitats, host plants and mates[J]. Res Popul Ecol, 1994, 36(2): 127-135. DOI:10.1007/BF02514927 |
| [3] |
ROFF D A. The cost of being able to fly: a study of wing polymorphism in two species of crickets[J]. Oecologia, 1984, 63(1): 30-37. DOI:10.1007/BF00379781 |
| [4] |
MACKAY P A, WELLINGTON W G. A comparison of the reproductive patterns of apterous and alate virginoparous Acyrthosiphon pisum (Homoptera: Aphididae)
[J]. Can Entomol, 1975, 107(11): 1161-1166. DOI:10.4039/Ent1071161-11 |
| [5] |
BRISSON J A, ISHIKAWA A, MIURA T. Wing development genes of the pea aphid and differential gene expression between winged and unwinged morphs[J]. Insect Mol Biol, 2010, 19(Suppl 2): 63-73. |
| [6] |
XUE J, ZHANG X Q, XU H J, et al. Molecular characterization of the flightin gene in the wing-dimorphic planthopper, Nilaparvata lugens, and its evolution in Pancrustacea
[J]. Insect Biochem Mol Biol, 2013, 43(5): 433-443. DOI:10.1016/j.ibmb.2013.02.006 |
| [7] |
WANG X Y, YANG Z Q, SHEN Z R, et al. Sublethal effects of selected insecticides on fecundity and wing dimorphism of green peach aphid (Hom., Aphididae)[J]. J Appl Entomology, 2008, 132(2): 135-142. DOI:10.1111/jen.2008.132.issue-2 |
| [8] |
张小磊, 廖逊, 毛凯凯, 等. 湖北稻区褐飞虱田间种群对常用杀虫剂抗药性监测[J]. 昆虫学报, 2016, 59(11): 1222-1231. ZHANG X L, LIAO X, MAO K K, et al. Resistance monitoring of the field populations of the brown planthopper, Nilaparvata lugens (Hemiptera: Delphacidae) to common insecticides in rice production areas of Hubei Province, central China [J]. Acta Entomologica Sinica, 2016, 59(11): 1222-1231. |
| [9] |
高希武, 彭丽年, 梁帝允. 对 2005 年水稻褐飞虱大发生的思考[J]. 植物保护, 2006, 32(2): 23-25. GAO X W, PENG L N, LIANG D Y. Factors causing the outbreak of brown planthopper (BHP), Nilapavata lugens Stål in China in 2005 [J]. Plant Prot, 2006, 32(2): 23-25. DOI:10.3969/j.issn.0529-1542.2006.02.006 |
| [10] |
夏敬源. 我国重大农业生物灾害暴发现状与防控成效[J]. 中国植保导刊, 2008, 28(1): 5-9. XIA J Y. Outbreaks of major agricultural pests and the control achievements in China[J]. China Plant Protection, 2008, 28(1): 5-9. DOI:10.3969/j.issn.1672-6820.2008.01.001 |
| [11] |
ZHANG X L, MAO K K, LIAO X, et al. Fitness cost of nitenpyram resistance in the brown planthopper Nilaparvata lugens
[J]. J Pest Sci, 2018, 91(3): 1145-1151. DOI:10.1007/s10340-018-0972-2 |
| [12] |
XU H J, XUE J, LU B, et al. Two insulin receptors determine alternative wing morphs in planthoppers[J]. Nature, 2015, 519(7544): 464-467. DOI:10.1038/nature14286 |
| [13] |
BAO H B, LIU S H, GU J H, et al. Sublethal effects of four insecticides on the reproduction and wing formation of brown planthopper, Nilaparvata lugens
[J]. Pest Manag Sci, 2009, 65(2): 170-174. DOI:10.1002/ps.v65:2 |
| [14] |
ZHANG X L, LIAO X, MAO K K, et al. Insecticide resistance monitoring and correlation analysis of insecticides in field populations of the brown planthopper Nilaparvata lugens (stål) in China 2012-2014
[J]. Pestic Biochem Physiol, 2016, 132: 13-20. DOI:10.1016/j.pestbp.2015.10.003 |
| [15] |
VAN ASPEREN K. A study of housefly esterases by means of a sensitive colorimetric method[J]. Journal of Insect Physiology, 1962, 8(4): 401-416. DOI:10.1016/0022-1910(62)90074-4 |
| [16] |
HAN Y C, YU W T, ZHANG W Q, et al. Variation in P450-mediated fenvalerate resistance levels is not correlated with CYP337B3 genotype in Chinese populations of Helicoverpa armigera
[J]. Pestic Biochem Physiol, 2015, 121: 129-135. DOI:10.1016/j.pestbp.2014.12.004 |
| [17] |
LI X X, LI R, ZHU B, et al. Overexpression of cytochrome P450 CYP6BG1 may contribute to chlorantraniliprole resistance in Plutella xylostella (L.)
[J]. Pest Manag Sci, 2018, 74(6): 1386-1393. DOI:10.1002/ps.2018.74.issue-6 |
| [18] |
常菊花, 何月平. 应用 Polo 软件进行农药毒力数据的比较分析[J]. 浙江农业学报, 2014, 26(6): 1552-1557. CHANG J H, HE Y P. The analysis for comparing the pesticide toxicity data using the Polo software[J]. Acta Agriculturae Zhejiangensis, 2014, 26(6): 1552-1557. DOI:10.3969/j.issn.1004-1524.2014.06.26 |
| [19] |
朱道弘. 昆虫翅型分化的调控及翅多型性的进化[J]. 昆虫知识, 2009, 46(1): 11-16. ZHU D H. Regulatory mechanism and evolution of insect wing polymorphism[J]. Chinese Bull Entomol, 2009, 46(1): 11-16. DOI:10.3969/j.issn.0452-8255.2009.01.003 |
| [20] |
臧连生, 傅荣幸, 刘树生, 等. B 型与浙江非 B 型烟粉虱药剂敏感性的比较[J]. 昆虫知识, 2006, 43(2): 207-210. ZANG L S, FU R X, LIU S S, et al. Comparison of susceptibility to insecticides between the B biotype and a non-B biotype of Bemisia tabaci in Zhejiang [J]. Chinese Bull Entomol, 2006, 43(2): 207-210. DOI:10.3969/j.issn.0452-8255.2006.02.016 |
| [21] |
吴向军, 黄彰欣. 不同虫态的褐稻虱对杀虫剂的毒力及毒理研究[J]. 广东农业科学, 1996, 23(1): 34-36. WU X J, HUANG Z X. Study on toxicity and toxicology of different stages and instars of Nilaparvata lugens to insecticides [J]. Guangdong Agric Sci, 1996, 23(1): 34-36. |
| [22] |
苗建忠, 马伏宁, 曾鑫年. 红火蚁不同虫态个体对杀虫剂的敏感性研究[C]// 全国生物入侵学术研讨会. 2008. MIAO J Z, MA F N, ZENG X N. Study on the susceptibility of different stages and instars of Solenopsis invicta to insecticides[C]// National Biological Invasion Symposium. 2008. |
| [23] |
HECKEL D G. Ecology. insecticide resistance after silent spring[J]. Science, 2012, 337(6102): 1612-1614. DOI:10.1126/science.1226994 |
| [24] |
SCHARF M. Examination of esterases from insecticide resistant and susceptible strains of the German cockroach, Blattella germanica (L.)
[J]. Insect Biochemistry and Molecular Biology, 1997, 27(6): 489-497. DOI:10.1016/S0965-1748(97)00023-4 |
| [25] |
ZHAO G Y, LIU W, KNOWLES C O. Mechanisms associated with diazinon resistance in western flower thrips[J]. Pesticide Biochemistry and Physiology, 1994, 49(1): 13-23. DOI:10.1006/pest.1994.1030 |
| [26] |
BASS C, CARVALHO R A, OLIPHANT L, et al. Overexpression of a cytochrome P450 monooxygenase, CYP6ER1, is associated with resistance to imidacloprid in the brown planthopper, Nilaparvata lugens
[J]. Insect Mol Biol, 2011, 20(6): 763-773. DOI:10.1111/imb.2011.20.issue-6 |
| [27] |
DING Z P, WEN Y C, YANG B J, et al. Biochemical mechanisms of imidacloprid resistance in Nilaparvata lugens: over-expression of cytochrome P450 CYP6AY1
[J]. Insect Biochem Mol Biol, 2013, 43(11): 1021-1027. DOI:10.1016/j.ibmb.2013.08.005 |
| [28] |
GARROOD W T, ZIMMER C T, GORMAN K J, et al. Field-evolved resistance to imidacloprid and ethiprole in populations of brown planthopper Nilaparvata lugens collected from across South and East Asia[J]. Pest Manag Sci, 2016, 72(1): 140-149. DOI:10.1002/ps.3980 |
| [29] |
王志超, 康志娇, 史雪岩, 等. 有机磷类杀虫剂代谢机制研究进展[J]. 农药学学报, 2015, 17(1): 1-14. WANG Z C, KANG Z J, SHI X Y, et al. Research progresses on the metabolic mechanisms of organophosphate insecticides[J]. Chin J Pestic Sci, 2015, 17(1): 1-14. DOI:10.3969/j.issn.1008-7303.2015.01.01 |
| [30] |
LIAO X, MAO K K, ALI E, et al. Temporal variability and resistance correlation of sulfoxaflor susceptibility among Chinese populations of the brown planthopper Nilaparvata lugens (Stål)
[J]. Crop Protection, 2017, 102: 141-146. DOI:10.1016/j.cropro.2017.08.024 |
| [31] |
SARKAR M, BHATTACHARYYA I K, BORKOTOKI A, et al. Insecticide resistance and detoxifying enzyme activity in the principal bancroftian filariasis vector, Culex quinquefasciatus, in northeastern India
[J]. Med Vet Entomol, 2009, 23(2): 122-131. DOI:10.1111/mve.2009.23.issue-2 |
| [32] |
王彦华, 苍涛, 赵学平, 等. 褐飞虱和白背飞虱对几类杀虫剂的敏感性[J]. 昆虫学报, 2009, 52(10): 1090-1096. WANG Y H, CANG T, ZHAO X P, et al. Susceptibility to several types of insecticides in the rice planthoppers Nilaparvata lugens(Stål) and Sogatella furcifera(Horváth)(Homoptera: Delphacidae) [J]. Acta Entomologica Sinica, 2009, 52(10): 1090-1096. DOI:10.3321/j.issn:0454-6296.2009.10.005 |
 2019, Vol. 21
2019, Vol. 21


