稻绿核菌是水稻穗部病害稻曲病的致病菌,有性态为Villosiclava virens,无性态为Ustilaginoidea virens[1]。随着水稻品种、氮肥施用量及全球气候的变化,稻曲病已成为继稻瘟病、纹枯病和条纹叶枯病之后水稻上的又一主要病害[2-3]。稻曲病不仅危害稻米产量,由其产生的真菌毒素还会污染稻米,降低品质,进而对人和动物的安全带来风险[4-5]。目前化学药剂仍是防控稻曲病的主要手段,其中应用最为广泛的是抑制稻绿核菌细胞膜中麦角甾醇生物合成的脱甲基抑制剂类杀菌剂(DMIs),主要有戊唑醇及氟环唑等。已有研究表明,对DMIs产生抗性的稻曲病菌株对环境具有很好的适应性,可能会在田间出现和流行[6]。植物源杀菌剂因其植物来源丰富,大多数产品具有毒性较低、在环境中易降解、作用靶点多样以及不易产生抗药性等优点,被视为“环境和谐农药”和“生物合理性农药”的重要一部分[7],而目前登记用于防控稻曲病的植物源杀菌剂仅有蛇床子素一种,因此,亟待开发有独特作用机制、可用于稻曲病防控的植物源杀菌剂。
反式肉桂醛(trans-cinnamaldehyde,TC),化学名称为(E)-3-苯基-2-丙烯醛,是樟科植物肉桂Cinnamomum cassia Presl中的一种天然苯丙烯类含醛化合物,具有广谱的杀菌、防腐及抗肿瘤等功效,同时也被用作香料和食品的添加剂[8]。TC对大鼠的急性经口毒性(LD50)为2 220 mg/kg[9],按中国农药急性毒性分级标准[10]属于低毒农药。申素霞等采用标准肉汤稀释法研究发现,TC对大肠杆菌、金黄色葡萄球菌及阴沟肠杆菌等11种食品源致病菌和腐败菌均具有较好的抑制作用,最小抑菌质量浓度为310 μg/mL[11]。Marei等采用菌丝生长速率法测定了TC对指状青霉及立枯丝核菌等8种植物病原真菌的离体抑制活性,发现其对8种病原菌的抑制活性强于多菌灵,有效中浓度(EC50)值分布在0.75~3.19 μg/mL之间[12]。此外,TC对青霉属[13]、链格孢属[14]、曲霉属[15] 及镰刀菌属[16]产毒真菌,食品中的细菌[17] 以及人体致病真菌[18]等均具有一定的抑制效果。
肉桂醛的抑菌机理主要包括两方面:一是抑制细胞结构的形成,破坏细胞壁、细胞膜结构及功能的完整性,造成菌体细胞不能正常生长[19-23];二是干扰细胞内的能量代谢和物质合成,导致菌体代谢异常,生长受到抑制[24-25]。通常采用透射电子显微镜观察细胞超微结构的形态变化[26],采用山梨糖醇保护试验评价药剂对细胞壁完整性的影响[27]。山梨糖醇是细胞原生质体的渗透保护物质,能稳定细胞的原生质体,适度减轻外界不良因素破坏细胞壁后引起的细胞内结构和功能的损伤[28]。菌体细胞中能量代谢和物质合成主要依赖细胞的有氧呼吸作用提供能量,而该过程涉及参与三羧酸循环、电子传递链及氧化磷酸化过程中的多种酶类,如苹果酸脱氢酶(MDHase)、琥珀酸脱氢酶(SDHase)、三磷酸腺苷酶(ATPase)等[29]。
笔者等前期研究发现,TC能有效抑制稻绿核菌菌丝的生长(未发表),但目前尚未见关于TC对稻绿核菌抑菌机理的研究报道。为此,本研究选取2、4、8、15及30 μg/mL系列浓度的TC分别处理稻绿核菌菌丝,考察了TC对稻绿核菌细胞超微结构,以及对能量代谢中3种重要呼吸酶—烟酰胺腺嘌呤二核苷酸-苹果酸脱氢酶(NAD-MDHase)、SDHase和ATPase(离子通道Na+-K+-ATPase、Ca2+-Mg2+-ATPase、Ca2+-ATPase及Mg2+-ATPase)活力的影响,初步探讨了反式肉桂醛对稻绿核菌的抑菌机理。
1 材料与方法 1.1 供试材料病原真菌:稻绿核菌Villosiclava virens购自中国工业微生物菌种保藏管理中心,以马铃薯葡萄糖培养基(PDA)转接培养,斜面保存于4 ℃冰箱,试验时再在PDA培养基上连续转接2次,以确保菌种纯度和活力。
培养基:PDA培养基购自美国BD公司;马铃薯蔗糖(PS)培养液:马铃薯200 g,蔗糖20 g,蒸馏水1 000 mL,并于121 ℃下、高压蒸汽灭菌30 min。
药剂:98.3%的反式肉桂醛(trans-cinnamaldehyde,TC,纯度98.3%),购自江西雪松天然药用油有限公司,以丙酮(分析纯)配成1 × 104 μg/mL的母液;D-山梨糖醇购自阿拉丁试剂有限公司,以无菌水配成8 mol/L的母液,过0.22 μm的水相滤膜。
试剂盒:NAD-MDHase活性检测试剂盒及SDHase活性检测试剂盒购自Solarib生化试剂盒事业部;ATPase测试盒(非高速)购自南京建成生物工程研究所。
主要仪器设备:Memmert IN 110PLUS培养箱(德国 Memmert公司);BXM-50K-C立式压力蒸汽灭菌锅(上海博讯实业有限公司);ZQPL-500立式大容量振荡培养箱(宁波赛福实验仪器有限公司);DL-CJ-1ND超净工作台(北京东联哈尔仪器制造有限公司);S-7500日立透射电子显微镜(日本 日立公司);Leica Uc6i型切片机(德国 徕卡公司);Centrifuge 5417R低温高速离心机(德国 Eppendorf公司);Infinite M200 pro酶标仪(瑞士 Tecan公司)。
1.2 试验方法 1.2.1 反式肉桂醛对稻绿核菌细胞超微结构的影响 1.2.1.1 透射电镜下观察菌丝变化参照何玲等的方法[30],并对具体实验条件进行了改进。取TC母液加入PS培养液中,在250 mL三角瓶中制成最终质量浓度分别为0、2和4 μg/mL的含药培养液。取直径5 mm的稻绿核菌菌饼4个,接种于150 mL含药PS培养液中,每处理设3次重复;在28 ℃、150 r/min及黑暗条件下培养7 d,取少量菌丝,以无菌水漂洗3次,用吸水纸吸干表面液体,放入体积分数为3%的戊二醛固定液(pH = 7.2)中,于室温(28 ℃)、黑暗条件下固定48 h;以0.1 mol/L、pH = 7.2的PBS缓冲液冲洗4次,用体积分数为1%的锇酸固定,经PBS缓冲液冲洗后,依次以体积分数分别为30%、50%、70%、80%、90%及100%的乙醇脱水,再用丙酮置换,Spurr环氧树脂包埋,经聚合、切片机超薄切片及醋酸双氧铀和柠檬酸铅染色后,在透射电子显微镜下观察TC对稻绿核菌细胞超微结构的影响。
1.2.1.2 对细胞壁完整性的影响参照Ma等的方法[27] 并进行了改进。取一定量的山梨糖醇母液加入到约50 ℃的PDA培养基中,充分混匀,配成山梨糖醇终浓度为0.04 mol/L的培养基,再加入适量TC,配成TC质量浓度分别为2、4、8、15及30 μg/mL的含药培养基,以丙酮为对照;倒入直径60 mm的一次性塑料培养皿中,制成含药平板。接入稻绿核菌菌饼(直径5 mm),每处理重复3次,28 ℃、黑暗条件下培养7 d。采用十字交叉法测量菌落直径,求其平均值,计算菌丝生长抑制率[30]。同时设不加山梨糖醇溶液的处理,比较加入0.04 mol/L山梨糖醇溶液前后TC对稻绿核菌菌丝生长抑制作用的差别。
1.2.2 反式肉桂醛对稻绿核菌能量代谢相关酶活性的影响 1.2.2.1 NAD-MDHase活力测定取经系列浓度TC处理的稻绿核菌菌丝样品0.05 g,依照Solarbio公司的NAD-MDHase活力检测试剂盒说明书进行测定。NAD-MDHase活力单位定义:将每克菌丝在反应体系中每分钟消耗1 nmol的还原型烟酰胺腺嘌呤二核苷酸(NADH)定义为1个酶活力单位(U/g)。
1.2.2.2 SDHase活力测定取经系列浓度TC处理的菌丝0.05 g,依Solarbio公司的SDHase活力检测试剂盒说明书进行测定。SDHase活力单位定义:将每克菌丝在反应体系中每分钟消耗1 nmol 的2,6-二氯酚靛酚定义为1个酶活力单位(U/g)。
1.2.2.3 ATPase活力测定取经系列浓度TC处理的菌丝0.05 g,加入500 μL、0.88%的生理盐水,冰浴匀浆,于2 500 r/min离心10 min;取0.1 mL上清液,加入0.9 mL生理盐水,稀释配制成体积分数为1%的匀浆液,采用考马斯亮蓝法测定样品中蛋白浓度。依照Trans gen公司的Easy Protein Quantitative Kit (Bradford)方法测定标准曲线,根据标准曲线计算样本中蛋白浓度,并确定合适的取样量。依照南京建成生物工程研究所的ATPase测试盒说明书测定ATPase活力。
ATPase活力定义:以每小时、每毫克蛋白组织中ATPase分解ATP产生1 μmol无机磷的量为1个酶活力单位(μmol · mg–1 pro. · h–1)。
1.2.3 数据统计分析采用SPSS 22.0软件进行单因素方差分析,选用LSD和Duncan氏检验法,在P < 0.05水平进行组间的差异显著性分析。按公式(1)计算酶活力的相对抑制率( IR,%)。
| $ {I_R}/{\text{%}}= \frac{{{A_{\rm c}} - {A_{\rm t}}}}{{{A_{\rm c}}}} \times 100 $ | (1) |
式中:Ac和At分别为对照组和处理组的酶活力(U/g或μmol · mg–1 pro. · h–1)。
2 结果与分析 2.1 反式肉桂醛对稻绿核菌细胞结构的影响 2.1.1 对细胞超微结构的影响在透射电镜下观察发现:正常状态稻绿核菌菌丝细胞的细胞壁、质膜、线粒体、液泡和脂质体的超微结构清晰,分布有序(图1,A1和A2);经2 μg/mL的TC处理后,菌丝体细胞内线粒体结构变紊乱,脂质体分散且有增多趋势(图1,B1和B2);而在含有4 μg/mL TC的培养液中生长的菌丝,其脂质体排列零乱且含量明显增多,线粒体结构紊乱(图1,C1和C2)。
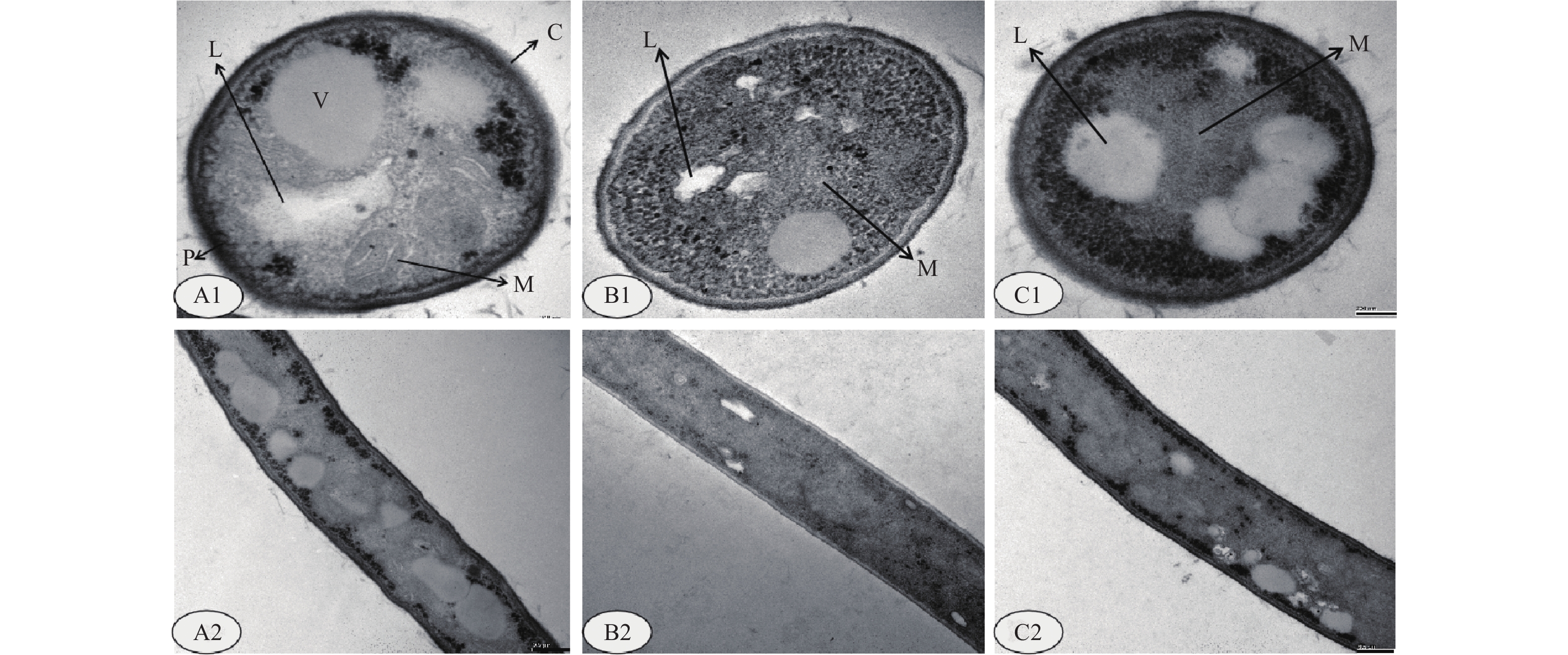
|
注:A1和A2,空白对照;B1和B2,反式肉桂醛2 μg/mL;C1和C2,反式肉桂醛4 μg/mL。第1组为横切细胞剖面图,放大倍数为70 000 ×;第2组为纵切细胞剖面图,放大倍数为25 000 ×。C,细胞壁;P,质膜;L,脂质体;V,液泡;M,线粒体。 Note: A1 and A2, control; B1 and B2, 2 μg/mL TC; C1 and C2, 4 μg/mL TC. The first group showed the cross-sectional view of cell with the magnification of 70 000; the second group exhibited the longitudinal view of the cell with the magnification of 25 000. C, cell wall; P, plasma membrane; L, liposome; M, mitochondrion. 图 1 透射电子显微镜下观察反式肉桂醛对稻绿核菌细胞超微结构的影响 Fig. 1 Effect of TC on the cell ultrastructure of V. virens determined by transmission electron micrographs |
2.1.2 对菌丝细胞壁完整性的影响
结果见图2。加入保护剂山梨糖醇溶液后,TC的抑菌活性明显降低,且随着TC质量浓度升高,加入山梨糖醇所起的保护作用减小,表明TC可能破坏了稻绿核菌菌丝细胞壁的完整性,且随着TC质量浓度的升高,菌丝细胞壁被破坏的程度加剧。

|
注:山梨糖醇浓度为0.04 mol/L。 Note: The concentration of sorbitol is 0.04 mol/L. 图 2 加入山梨糖醇对反式肉桂醛抑制稻绿核菌菌丝生长活性的影响 Fig. 2 Effect on the mycelial growth of trans-cinnamaldehyde in the presence and absence of sorbitol in V. virens |
2.2 反式肉桂醛对稻绿核菌细胞中能量代谢相关酶活力的影响 2.2.1 对NAD-MDHase及SDHase活力的影响
如表1所示,随着TC质量浓度的升高,稻绿核菌细胞中NAD-MDHase活力显著降低,且抑制作用与剂量呈正相关性。其中,当TC质量浓度为30 μg/mL时,NAD-MDHase活力仅是对照组的55.7%,相对抑制率达44.3%。
|
|
表 1 反式肉桂醛对稻绿核菌NAD-MDHase和SDHase活力的影响 Table 1 Effect of trans-cinnamaldehyde on the activities of NAD-MDHase and SDHase in V. virens |
此外,TC对稻绿核菌细胞中SDHase活力同样具有抑制作用,且抑制作用亦随TC质量浓度的升高而增强,当TC质量浓度升至30 μg/mL时,SDHase活力降低至对照组的23.3%,相对抑制率达76.7%(表1)。
2.2.2 对ATPase活力的影响如表2所示,与对照组相比,在TC质量浓度为0~4 μg/mL时,Na+-K+-ATPase、Ca2+-Mg2+-ATPase、Ca2+-ATPase及Mg2+-ATPase的活力均逐渐降低,表现为受到抑制;但随着TC质量浓度从8升高至30 μg/mL,Na+-K+-ATPase和Mg2+-ATPase的活力逐渐升高,直至高于对照组,Ca2+-Mg2+-ATPase的活力逐渐升高至与2 μg/mL TC处理时的酶活力相当;而Ca2+-ATPase活力在TC质量浓度为8~15 μg/mL时先升高,至30 μg/mL时则明显降低(图3)。表明:低浓度的TC可抑制ATPase的活力,而高浓度下则有可能因TC刺激了菌体细胞自身的防御机制而促进ATPase活力的升高。
|
|
表 2 反式肉桂醛对稻绿核菌ATPase活力的抑制效果 Table 2 Inhibitory effect of TC on ATPase in V. virens |
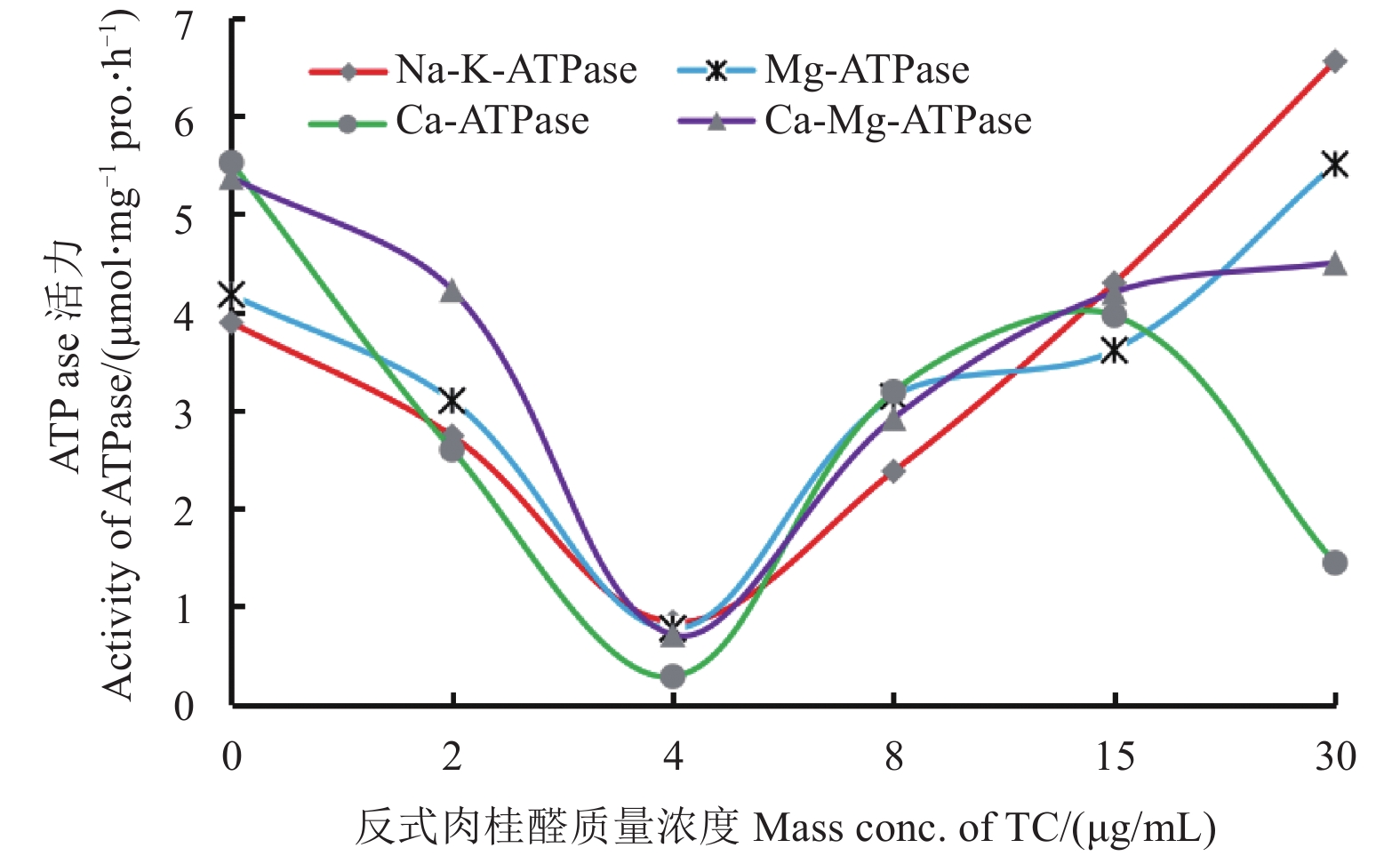
|
图 3 反式肉桂醛对稻绿核菌ATPase活力的影响 Fig. 3 Effect of TC on ATPase activities in V. virens |
3 结论与讨论
本研究对反式肉桂醛(TC)抑制稻绿核菌细胞超微结构及呼吸代谢的作用机制进行了探索。细胞超微结构观察发现,经不同浓度TC处理后,稻绿核菌细胞中脂质体增多,线粒体结构紊乱,与何玲等观察到的100 μg/mL的氟醚菌酰胺(fluopimomide)能引起辣椒疫霉细胞中脂质体增多的现象类似[30]。关于药剂引起菌体中脂质体数量变化的原因目前还未见报道,分析可能是由于脂质体是真菌体内的重要物质,其主要功能是为菌体提供碳源和能量,随着TC处理浓度的升高,菌体受到的胁迫增强,可能会促使菌体在前期产生更多的脂类物质以储存能量;但当药剂超过一定阈值后,由于菌体内结构破坏加剧,其脂质体数量是否会逐渐下降还有待进一步验证。生理生化试验显示,在质量浓度低于30 μg/mL时,TC可能会破坏细胞壁结构的完整性,为其进入菌体细胞、影响细胞内的结构及重要代谢提供条件,表明细胞壁可能是TC作用于稻绿核菌细胞的一个靶点。汪琨等通过山梨糖醇保护试验也发现,加入山梨糖醇能降低TC对酵母菌的抑制能力,说明山梨糖醇作为细胞原生质体的渗透保护物质,在细胞壁受损情况下发挥了保护细胞维持正常代谢的作用,同时也说明TC可能破坏了酵母菌细胞壁的完整性[31]。
进一步研究表明,TC对MDHase和SDHase的活力也有明显的抑制作用。曾红就莳萝子挥发油对红色毛癣菌Trichophyton rubrum线粒体MDHase和SDHase活力的影响进行了研究,发现莳萝子挥发油可降低这2种酶的活力,认为莳萝子挥发油可通过损伤菌体的线粒体、抑制线粒体上重要呼吸代谢酶的活力而抑制菌体的生长[32]。本研究结果与之相似,推测稻绿核菌的线粒体及其MDHase和SDHase可能也是TC的作用靶点。此外,TC还可抑制离子通道蛋白Na+-K+-ATPase、Ca2+-Mg2+-ATPase、Ca2+-ATPase及Mg2+-ATPase的活力,在其质量浓度为在4 μg/mL时抑制作用最强,表明TC可能引起了稻绿核菌菌丝细胞中线粒体膜两侧离子浓度的失衡[25],进而干扰了发生在线粒体上的呼吸代谢及氧化磷酸化,影响菌体的能量代谢[33]。而4 μg/mL < TC ≤ 30 μg/mL时,TC对ATPase的抑制活性逐渐减弱,甚至还促进了Na +-K+-ATPase、Ca2+-Mg2+-ATPase以及Mg2+-ATPase活力的升高,但在质量浓度高于15 μg/mL后,TC对Ca2+-ATPase的抑制活性又开始逐渐增强。这种现象可能是由于线粒体膜结构受损后,菌体启动了自我防御机制,使得ATPase的活力升高。而Ca2+-ATPase的活力最终表现为降低可能与其所受TC的伤害更强有关,该伤害使得Ca2+-ATPase未能在机体的自我修复机制中得到恢复,从而表现为酶活力下降。周智兴等也报道,黄岑苷能显著降低白色念珠菌Candida albicans线粒体中SDHase和Ca2+-Mg2+-ATPase的活力,损伤线粒体的膜结构,进而抑制菌株的生长[34]。
综上所述,推测反式肉桂醛(TC)抑制稻绿核菌菌丝生长的可能机制为:TC通过破坏菌体细胞壁进入细胞,损伤细胞中线粒体等含有Na+-K+-ATPase、Ca2+-Mg2+-ATPase、Ca2+-ATPase及Mg2+-ATPase离子通道的膜结构,干扰菌体细胞内的能量代谢,导致TC被运输到菌体内其他部位而破坏了菌体的正常代谢,其抑制活性应是上述因素综合作用的结果。
本研究首次报道了TC对稻绿核菌的作用机理,明确细胞壁及线粒体可能是TC抑制稻绿核菌菌丝生长的作用靶点,具有进一步研究的价值,而具体的靶标位点和田间防效等可作为下一步研究和验证的重点。
| [1] |
FAN J, YANG J, WANG Y Q, et al. Current understanding on Villosiclava virens, a unique flower-infecting fungus causing rice false smut disease
[J]. Mol Plant Pathol, 2016, 17(9): 1321-1330. DOI:10.1111/mpp.2016.17.issue-9 |
| [2] |
黄珊. 水稻稻曲病研究进展[J]. 福建农业学报, 2012, 27(4): 452-456. HUANG S. Advances on study of rice false smut (Ustilaginoidea virens) [J]. Fujian J Agric Sci, 2012, 27(4): 452-456. DOI:10.3969/j.issn.1008-0384.2012.04.025 |
| [3] |
陆明红, 刘万才, 朱凤. 稻曲病近年流行规律及治理对策探讨[J]. 中国植保导航, 2018, 38(5): 44-47. LU M H, LIU W C, ZHU F. Discussion on epidemic rule of rice false smut in recent years and its controlling strategy[J]. China Plant Prot, 2018, 38(5): 44-47. |
| [4] |
KOISO Y, LI Y, IWASAKI S, et al. Ustiloxins, antimitotic cyclic peptides from false smut balls on rice panicles caused by Ustilaginoidea virens
[J]. J Antibiot, 1994, 47(7): 765-773. DOI:10.7164/antibiotics.47.765 |
| [5] |
SUN W B, WANG A L, XU D, et al. New ustilaginoidins from rice false smut balls caused by Villosiclava virens and their phytotoxic and cytotoxic activities
[J]. J Agric Food Chem, 2017, 65(25): 5151-5160. DOI:10.1021/acs.jafc.7b01791 |
| [6] |
王菲. 水稻稻曲病菌遗传多样性及其抗 DMI 类杀菌剂分子机理的研究[D]. 武汉: 华中农业大学, 2015. WANG F. Study on genetic diversity and DMI fungicide resistance molecular mechanism of Villosiclava virens[D]. Wuhan: Huazhong Agric Univ, 2015. |
| [7] |
李晓菲, 徐政. 植物源杀菌剂研究进展[J]. 南方农业, 2018, 12(13): 40-45. LI X F, XU Z. Progress in research on botanical fungicides[J]. Southern Agric, 2018, 12(13): 40-45. |
| [8] |
宋宗辉, 张艺雯, 王玲洁, 等. 肉桂醛的药理活性及其研究进展[J]. 解放军药学学报, 2018, 34(6): 550-554. SONG Z H, ZHANG Y W, WANG L J, et al. Pharmacological activity of cinnamaldehyde and its research progress[J]. Pharm J Chin PLA, 2018, 34(6): 550-554. |
| [9] |
JAKHETIA V, PATEL R, KHATRI P, et al. Cinnamon: a pharmacological review[J]. J Adv Sci Res, 2010, 1(2): 19-23. |
| [10] |
农药登记毒理学试验方法: GB/T 15670. 4—2017[S]. 北京: 中国标准出版社, 2017. Toxicological test methods of pesticides for registration: GB/T 15670. 4—2017[S]. Beijing: China Standards Press, 2017. |
| [11] |
申素霞. 植物源食品防腐剂的筛选及肉桂醛的抑菌机制研究[D]. 长春: 吉林大学, 2015. SHEN S X. The screening of natural plant source food preservatives and the research of antimicrobial mechanism of cinnamaldehyde[D]. Changchun: Jilin University, 2015. |
| [12] |
MAREI G I K, ABDELGALEIL S A M. Antifungal potential and biochemical effects of monoterpenes and phenylpropenes on plant[J]. Plant Prot Sci, 2017, 54(1): 9-16. DOI:10.17221/PPS |
| [13] |
SCHLÖSSER I, PRANGE A. Antifungal activity of selected natural preservatives against the foodborne molds Penicillium verrucosum and Aspergillus westerdijkiae
[J]. FEMS Microbiol Lett, 2018, 365(13): 1-8. |
| [14] |
XU L C, TAO N G, YANG W H, et al. Cinnamaldehyde damaged the cell membrane of Alternaria alternata and induced the degradation of mycotoxins in vivo
[J]. Ind Crop Prod, 2018, 112: 427-433. DOI:10.1016/j.indcrop.2017.12.038 |
| [15] |
WANG H W, YANG Z X, YING G Y, et al. Antifungal evaluation of plant essential oils and their major components against toxigenic fungi[J]. Ind Crop Prod, 2018, 120: 180-186. DOI:10.1016/j.indcrop.2018.04.053 |
| [16] |
XIE Y J, HUANG Q Q, WANG Z J, et al. Structure-activity relationships of cinnamaldehyde and eugenol derivatives against plant pathogenic fungi[J]. Ind Crop Prod, 2017, 97: 388-394. DOI:10.1016/j.indcrop.2016.12.043 |
| [17] |
FRIEDMAN M. Chemistry, antimicrobial mechanisms, and antibiotic activities of cinnamaldehyde against pathogenic bacteria in animal feeds and human foods[J]. J Agric Food Chem, 2017, 65(48): 10406-10423. DOI:10.1021/acs.jafc.7b04344 |
| [18] |
SERRA E, HIDALGO-BASTIDA L A, VERRAN J, et al. Antifungal activity of commercial essential oils and biocides against Candida Albicans
[J]. Pathogens, 2018, 7(1): 15. DOI:10.3390/pathogens7010015 |
| [19] |
张文娟. 肉桂醛抗黄曲霉作用及超微结构观察的研究[J]. 北京医科大学学报, 1995, 27(5): 374. ZHANG W J. Sthudy on the antifungal effect of cinnamaldehyde against Aspergillus flavus and ultrastructure observation [J]. J Peking Univ (Health Sci), 1995, 27(5): 374. DOI:10.3321/j.issn:1671-167X.1995.05.001 |
| [20] |
TANG X, SHAO Y L, TANG Y J, et al. Antifungal activity of essential oil compounds (geraniol and citral) and inhibitory mechanisms on grain pathogens (Aspergillus flavus and Aspergillus ochraceus)
[J]. Molecules, 2018, 23(9): 2108-2125. DOI:10.3390/molecules23092108 |
| [21] |
PEREIRA F D E O, MENDES J M, LIMA I O, et al. Antifungal activity of geraniol and citronellol, two monoterpenes alcohols, against Trichophyton rubrum involves inhibition of ergosterol biosynthesis
[J]. Pharm Biol, 2015, 53(2): 228-234. DOI:10.3109/13880209.2014.913299 |
| [22] |
BANG K H, LEE D W, PARK H M, et al. Inhibition of fungal cell wall synthesizing enzymes by trans-cinnamaldehyde
[J]. Biosci Biotechnol Biochem, 2000, 64(5): 1061-1063. DOI:10.1271/bbb.64.1061 |
| [23] |
SHREAZ S, BHATIA R, KHAN N, et al. Influences of cinnamic aldehydes on H+ extrusion activity and ultrastructure of Candida
[J]. J Med Microbiol, 2013, 62(Pt 2): 232-240. |
| [24] |
USTA J, KREYDIYYEH S, BARNABE P, et al. Comparative study on the effect of cinnamon and clove extracts and their main components on different types of ATPases[J]. Hum Exp Toxicol, 2003, 22(7): 355-362. |
| [25] |
ZENG H, CHEN X P, LIANG J N. In vitro antifungal activity and mechanism of essential oil from fennel (Foeniculum vulgare L.) on dermatophyte species
[J]. J Med Microbiol, 2015, 64(Pt 1): 93-103. |
| [26] |
TIAN J, ZENG X B, FENG Z Z, et al. Zanthoxylum molle Rehd. essential oil as a potential natural preservative in management of Aspergillus flavus
[J]. Ind Crop Prod, 2014, 61(1): 151-159. |
| [27] |
MA M M, WEN X F, XIE Y T, et al. Antifungal activity and mechanism of monocaprin against food spoilage fungi[J]. Food Control, 2018, 84: 561-568. DOI:10.1016/j.foodcont.2017.07.022 |
| [28] |
FERREIRA M D O P, CARDOSO M F, DA SILVA F D E C, et al. Antifungal activity of synthetic naphthoquinones against dermatophytes and opportunistic fungi: preliminary mechanism-of-action tests[J]. Ann Clin Microbiol Antimicrob, 2014, 13(1): 26-31. DOI:10.1186/1476-0711-13-26 |
| [29] |
邢来君, 李明春, 魏东盛. 普通真菌学[M]. 北京: 高等教育出版社, 2010: 114-117. XING L J, LI M C, WEI D S. General mycology[M]. Advanced Education Press, 2010: 114-117. |
| [30] |
何玲, 袁会珠, 唐剑锋, 等. 新型杀菌剂氟醚菌酰胺对辣椒疫霉的作用机制初探[J]. 农药学学报, 2016, 18(2): 185-193. HE L, YUAN H Z, TANG J F, et al. Preliminary studies on the action mechanism of the novel fungicide LH-2010A against Phytophthora capsici [J]. Chin J Pestic Sci, 2016, 18(2): 185-193. |
| [31] |
汪琨, 徐峥, 汪倩雯, 等. 肉桂醛特异性抑制酵母细胞壁合成的作用机理[J]. 食品与发酵工业, 2012, 38(3): 68-72. WANG K, XU Z, WANG Q W, et al. Mechanism of yeast cell wall synthesis specifically inhibited by cinnamaldehyde[J]. Food Ferment Ind, 2012, 38(3): 68-72. |
| [32] |
曾红. 莳萝子挥发油抗真菌活性及其作用机制研究[D]. 武汉: 华中农业大学, 2011. ZENG H. Antifungal activity and mechanism of essential oil from the seeds of Anethum graveolens L.[D]. Wuhan: Huazhong Agricultural University, 2011. |
| [33] |
CHEN C, LONG L, ZHANG F, et al. Antifungal activity, main active components and mechanism of Curcuma longa extract against Fusarium graminearum
[J]. PloS One, 2018, 13(3): e0194284. DOI:10.1371/journal.pone.0194284 |
| [34] |
周智兴. 黄岑苷、IgY 抗白色念珠菌作用机制研究[D]. 南昌: 南昌大学, 2006. ZHOU Z X. Study of action mechanism of baicalin and IgY against Candida albicans[D]. Nanchang: Nanchang University, 2006. |
 2019, Vol. 21
2019, Vol. 21


