2. 陕西省植物源农药研究与开发重点实验室,陕西 杨凌 712100;
3. 陕西省植物化学重点实验室,陕西 宝鸡 721000
2. Shaanxi Province Key Laboratory Research & Development on Botanical Pesticides, Yangling 712100, Shaanxi Province, China;
3. Shaanxi Key Laboratory of Phytochemistry, Baoji 721000, Shaanxi Province, China
河朔荛花Wikstroemia chamaedaphne Meisn.,又名黄芫花、芫蒿、药鱼梢(北京)和黄闷头花(河北),是瑞香科荛花属一种有毒植物[1],其气微,味辛、涩,性寒,有刺激性,广泛分布于中国河北、山西、河南、陕西、甘肃、四川及湖北等地,其花、叶、籽、根和皮均可药用,也可用于防治多种瓜类害虫及食叶害虫[2]。
目前,有关河朔荛花的研究主要集中于花蕾的化学成分及其在临床医学上的应用。据报道,河朔荛花花蕾的次生代谢物主要有糖类、氨基酸、油脂、生物碱、酚类、苷类、黄酮类和萜类等[3],其中二萜类化合物为主要药理活性物质,具有抗肿瘤、抗乙肝病毒(HBV)及抑制HBsAg产生等作用,临床用于抗早孕、治疗急性、慢性肝炎及白血病等[4-7]。河朔荛花作为土农药的历史已久远[2],而根为非药用部位,其具有资源丰富、经济成本低等优点,其活性成分值得研究。鉴于此,本研究对河朔荛花根的活性成分进行了系统分离,从其甲醇提取物中分离鉴定出12个化合物,初步评价了其农用抑菌活性。
1 材料与方法 1.1 供试植物及药剂河朔荛花:2017年采集于山西省永济市,植物标本经西北农林科技大学李玉平教授鉴定为河朔荛花Wikstroemia chamaedaphne Meisn,现存于西北农林科技大学植物保护学院农药研究所,自然通风晾晒干燥后粉碎,备用。
对照药剂:98%嘧菌酯(azoxystrobin)原药,购于江苏瑞邦农药厂有限公司。
1.2 供试病原真菌马铃薯晚疫病菌Phytophthora infestans、苹果炭疽病菌Colletotrichum gloesporioides、玉米弯孢病菌Curvularia lunata、小麦赤霉病菌Fusarium graminearum和西瓜枯萎病菌Fusarium oxysporum,均由西北农林科技大学农药研究所保存并提供。
1.3 主要试剂和仪器提取用甲醇:工业级,重蒸处理后使用;萃取及分离试剂:国产分析纯;柱层析硅胶[38~48 μm (300~400目)]、薄层层析硅胶(GF254)均为青岛海洋化工厂生产。
WPR熔点仪(上海精科仪器有限公司);Shimadzu LC-6AD高效液相色谱仪(日本岛津公司);Bruker RPX 500MHz核磁共振波谱仪(德国布鲁克公司);Thermo LCQ Advantage MAX质谱仪(美国热电公司);Anton Paar MCP 300 旋光仪(德国Anton Paar Opto Tec股份有限公司)。
1.4 化学成分的提取与分离 1.4.1 化学成分的提取称取河朔荛花根4.0 kg,甲醇隔夜浸泡后加热超声提取3次(20 min/次),过滤,合并提取液,减压浓缩,得到甲醇浸膏(647 g),于4 ℃冰箱中保存备用。
1.4.2 化学成分的分离将全部甲醇粗提物浸膏用甲醇溶解,加入硅胶拌样,晾干研磨成粉,湿法装柱,干法上样,硅胶柱依次用石油醚,V(石油醚) : V(乙酸乙酯) = 10 : 1、5 : 2、1 : 1,乙酸乙酯,V(乙酸乙酯) : V(甲醇) = 10 : 1、5 : 2、1 : 1和甲醇梯度洗脱,收集馏分,减压浓缩后经TLC检测后合并相同组分,分别得到Fr.1(4.27 g)、Fr.2(35.24 g)、Fr.3(8.67 g)、Fr.4(16.74 g)、Fr.5(202.63 g)、Fr.6(124.12 g)和Fr.7(77.19 g)共7个组分。其中F3经硅胶柱梯度洗脱[洗脱溶剂为V(石油醚) : V(乙酸乙酯) = 100 : 1、50 : 1、20 : 1、10 : 1、5 : 1、1 : 1]共得到Fr.3-1(0.17 g)、Fr.3-2(0.63 g)、Fr.3-3(0.87 g)、Fr.3-4(1.24 g)、Fr.3-5(2.72 g)、Fr.3-6(0.85 g)和Fr.3-7(0.21 g) 7个部分:其中,Fr.3-2经硅胶柱纯化[V(石油醚) : V(乙酸乙酯) = 50 : 1]得化合物1(68 mg);Fr.3-4继续经硅胶柱梯度洗脱[V(石油醚) : V(乙酸乙酯) = 100 : 1、50 : 1、100 : 3、25 : 1、20 : 1]得化合物2 (149.3 mg)、3(8.5 mg)和4(12.4 mg);Fr.3-5有白色固体析出,用乙酸乙酯重结晶得到化合物5(156.4 mg);Fr.3-7经HPLC纯化后得化合物6(1.6 mg)和7(88.4 mg)。Fr.4经硅胶柱梯度洗脱[洗脱溶剂为V(石油醚) : V(乙酸乙酯) = 20 : 1、10 : 1、5 : 1、2 : 1、1 : 1]共得到7个部分:Fr.4-1(0.78 g)、Fr.4-2(0.96 g)、Fr.4-3(6.78 g)、Fr.4-4(1.30 g)、Fr.4-5(0.39 g)、Fr.4-6(1.08 g)和Fr.4-7(1.47 g)。其中Fr.4-2和Fr.4-3经HPLC纯化分别得化合物8(2.98 g)、9(1.87 g)和10(4 mg);Fr.4-6经反复硅胶柱层析[V(石油醚) : V(乙酸乙酯) = 10 : 1]纯化得化合物11(51.9 mg)和12(10 mg)。
1.4.3 结构鉴定根据化合物1~12的熔点、质谱、核磁共振氢谱及碳谱,并结合相关文献解析其结构。
1.5 抑菌活性测定 1.5.1 粗提物及所分离化合物对植物病原真菌菌丝生长的抑制作用采用菌丝生长速率法[8]分别测定了甲醇粗提物不同馏分及所分离12个化合物对5种供试病原菌的抑制作用。将粗提物不同馏分用含5%丙酮的无菌水溶液配制成质量浓度为1.00 × 104 μg/mL的样品溶液。取1 mL该样品溶液加入9 mL PDA培养基(马铃薯晚疫病原菌用黑麦培养基[9])中,制成质量浓度为1.00 × 103 μg/mL含药平板。所分离的化合物用含5%丙酮的无菌水溶液溶解并加入到PDA中制成质量浓度分别为200、100、50、25和12.5 μg/mL的含药平板。对照组均加入等量溶剂,每个处理3次重复。将供试病原真菌菌饼(直径5 mm)分别接种于含药平板上,于25 ℃ ± 0.5 ℃培养箱中培养2~7 d(马铃薯晚疫病菌于18 ℃恒温培养箱中黑暗培养7~10 d),待对照皿长满菌丝,用十字交叉法测量菌落直径,计算菌丝生长抑制率,并进行数据处理。
1.5.2 化合物对真菌孢子萌发的抑制作用采用孢子萌发法[10]。用适量无菌水冲洗培养基中的真菌菌落,并用纱布过滤去除菌丝,取上清液。用无菌水将孢子囊浓度调节至10 × 10倍显微镜下每视野每毫升180~200个孢子囊,制备孢子囊悬浮液。将供试药剂用含2‰丙酮的无菌水配制成系列浓度梯度的药液,分别与孢子囊悬浮液等体积混合,使药液最终质量浓度分别为0、3.75、7.5、15、30和60 μg/mL。对照组加入等量溶剂,每个处理3次重复。混合液在4 ℃下恒温培养4~6 h,释放完游动孢子仅剩空孢子囊壳即为萌发。当对照组孢子萌发率达到80%以上时检查结果。统计各处理组孢子萌发数,计算萌发率,并进行数据处理。
2 结果与分析 2.1 粗提物不同馏分对真菌菌丝生长的抑制作用菌丝生长抑制作用测定结果(表1)表明:在供试1.00 × 103 μg/mL浓度下,河朔荛花根甲醇粗提取物馏分Fr.4和Fr.5对马铃薯晚疫病原菌菌丝生长的抑制率达100%,其余馏分对供试5种病原真菌菌丝生长无明显抑制作用。
|
|
表 1 河朔荛花根甲醇粗提物不同馏分对5种病原菌菌丝生长的抑制作用 Table 1 Inhibitory effect of different fractions of methanol extract from Wikstroemia chamedaphne on the mycelia growth of five plant pathogenic fungi |
2.2 结构鉴定
采用1H NMR、13C NMR和ESI-MS对化合物1~12进行结构鉴定,并结合相关文献确定其结构,如图式1所示。
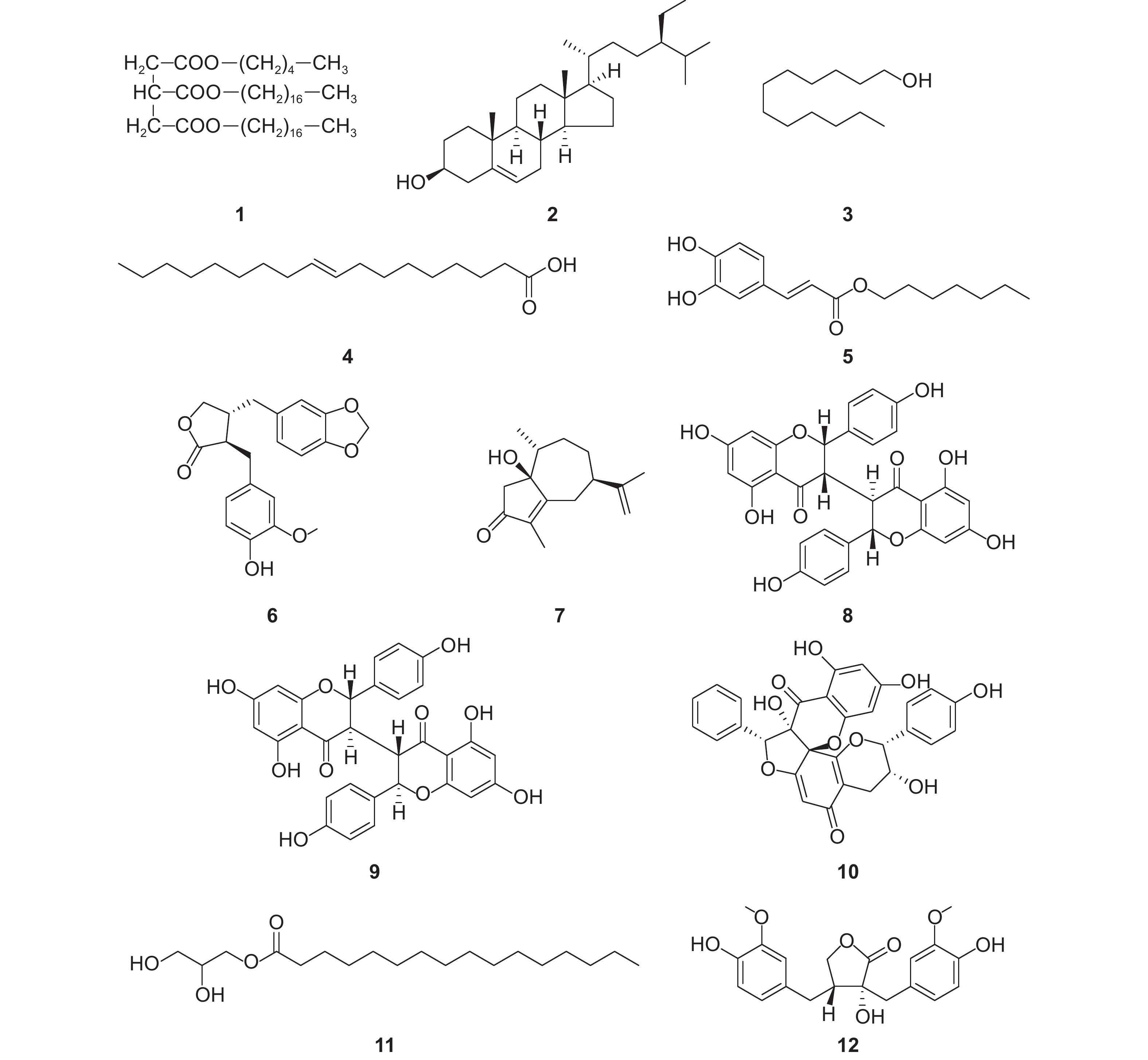
|
图式1 化合物1~12的化学结构 Scheme1 The structural formula of compounds 1-12 |
化合物1:淡黄色油状物,分子式C45H86O6;其1H NMR和13C NMR数据与文献[11]报道一致,故该化合物鉴定为1-己酸-2,3-硬脂酸甘油三酯(1-hexanoic acid-2,3-stearic acid triglyceride)。
化合物2:白色粉末,m.p. 134~135 ℃ (文献值[12] 134~136 ℃),分子式C29H50O;其1H NMR和13C NMR数据与文献[12]报道一致,故该化合物鉴定为β-谷甾醇(β-sitosterol)。
化合物3:白色固体,m.p. 75~79 ℃ (文献值[13] 76~78 ℃),分子式C12H26O;其 1H NMR和13C NMR数据与文献[13]报道一致,故该化合物鉴定为月桂醇(dodecanol)。
化合物4:淡黄色固体,m.p. 13~15 ℃ (文献值[14]12~14 ℃),分子式C18H34O2;其1H NMR和13C NMR数据与文献[14]报道一致,故该化合物鉴定为顺-十八碳-9-烯酸(cis-octadec-9-enoic acid)。
化合物5:白色粉末,m.p. 232~234 ℃(文献值[15] 230~235 ℃),分子式C18H23O4;其 1H NMR和13C NMR数据与文献[15]报道一致,故该化合物鉴定为(2E)-庚基-3-(3,4-二羟基苯基)丙烯酸酯((2E)-heptyl-3-(3,4-dihydroxyphenyl) acrylate)。
化合物6:浅棕色晶体,
化合物7:淡黄色油状物,
化合物8:棕黄色晶体,
化合物9:黄色晶体,
化合物10:黄色粉末,
化合物11:白色粉末,m.p. 68~70 ℃(文献值[19] 69~70 ℃),分子式C19H38O4;其 1H NMR和13C NMR数据与文献[19]报道一致,故该化合物鉴定为单棕榈酸甘油酯(glyceroyl monopalmitate)。
化合物12:白色粉末,
抑菌活性测定结果(表2)表明:化合物1~7和10~12对该马铃薯晚疫病菌菌丝生长无明显抑制作用,而化合物8(异狼毒素)和9(新狼毒素B)则对其有明显抑制作用,其EC50值分别为68.4和44.9 μg/mL;同时化合物8和9对马铃薯晚疫病原菌的孢子萌发亦有较好的抑制作用,其EC50值分别为25.1和14.0 μg/mL。
|
|
表 2 化合物8和9对马铃薯晚疫病菌菌丝生长和孢子萌发的抑制作用 Table 2 Inhibitory effect of compounds8 and9 on the mycelial growth and spore germination of P. infestans |
3 结论与讨论
本研究对河朔荛花根的抑菌活性成分进行了系统研究,从中分离鉴定出12个化合物,其中化合物3、4和6~12均为首次从该植物中分离得到。通过与已报道的其花蕾中的化学成分[3, 5-6, 21]对比,发现黄酮类化合物在花蕾和根中均有发现,但根中的双二氢黄酮化合物(化合物8和化合物9)为首次从该植物中分离得到,而花蕾中特征药理活性成分芫花酯乙[6]等二萜类化合物在根中暂未发现。抑菌活性测定结果表明,分离得到的化合物8(异狼毒素)和化合物9(新狼毒素B)对马铃薯晚疫病菌菌丝生长和孢子萌发均有一定的抑制作用,是河朔荛花根的主要抑菌活性成分。新狼毒素B是瑞香狼毒的特征组分,已有研究表明,新狼毒素B对水稻稻瘟病菌Pyricularia grisea及辣椒疫霉Phytophthora capsici Leonian等多种病原菌均有一定的抑制效果[22-23],但对马铃薯晚疫病菌的抑制作用为首次发现。河朔荛花根作为非药用部位,来源广、经济成本低,具有良好开发价值。
本研究仅对河朔荛花根甲醇粗提物的Fr.1~Fr.4的化学成分进行了初步研究,分离得到2个活性成分,而活性筛选结果表明Fr.5对马铃薯晚疫病原菌具有明显抑制作用,其中是否含有其他活性成分有待进一步研究。
| [1] |
中国科学院中国植物志编辑委员会. 中国植物志(五十二卷第一分册)[M]. 北京: 科学出版社, 1999. 322. Editorial Board of Flora of China, Chinese Academy of Sciences. Flora of China(Part 1, The fifty-two volume)[M]. Beijing: Science Press, 1999. 322. |
| [2] |
中国土农药志编辑委员会. 中国土农药志[M]. 北京: 科学出版社, 1959. 103-105. Editorial Board of Chinese Agrochemicals, Edited. Chinese agrochemicals[M]. Beijing: Science Press, 1959. 103-105. |
| [3] |
曹娟云, 郑宏春, 白重炎. 河蒴荛花花的化学成分的初步检测[J]. 延安大学学报(自然科学版), 2001, 20(2): 68-70. CAO J Y, ZHENG H C, BAI C Y. The chemical composition of the flower of Wikstroemia chamaedaphne Meisn. [J]. J Yanan Univ (Nat Sci Ed.), 2001, 20(2): 68-70. DOI:10.3969/j.issn.1004-602X.2001.02.023 |
| [4] |
赵莉蔺, 刘素琪, 曹挥, 等. 河朔荛花药理作用及临床应用的研究[J]. 山西医药杂志, 2004(3): 187-189. ZHAO L L, LIU S Q, CAO H, et al. Research progress of the plant Wikstroemia chamedaphne Meissn [J]. Shanxi Med J, 2004(3): 187-189. DOI:10.3969/j.issn.0253-9926.2004.03.001 |
| [5] |
张志强, 李石飞, 张立伟, 等. 黄芫花化学成分及其抗乙肝病毒作用[J]. 中草药, 2017, 48(7): 1292-1297. ZHANG Z Q, LI S F, ZHANG L W, et al. Chemical constituents from fowers of Wikstroemia chamaedaphne and their anti-hepatitis B virus activity [J]. Chinese Traditional Herbal Drugs, 2017, 48(7): 1292-1297. |
| [6] |
鱼爱和, 邓虹珠, 李瀛, 等. 黄芫花乙醇液抗早孕 312 例临床分析[J]. 中国中药杂志, 2000(2): 54-55. YU A H, DENG H Z, LI Y, et al. A clinical analysis of 312 cases of anti-early pregnancy with alcohol extract of Wikstroemia chamaedaphne [J]. China J Chinese Materia Medica, 2000(2): 54-55. |
| [7] |
YESILADA E, TANINAKA H, TAKAISHI Y, et al. In vitro inhibitory effects of Daphne oleoieds ssp. oleoides on inflammatory cytokines and activity-guided isolation of active constituents
[J]. Cytokine, 2001, 13(6): 359-364. DOI:10.1006/cyto.2001.0838 |
| [8] |
王静, 叶敏, 范黎明, 等. 菌丝生长速率法筛选纤维素降解菌的研究[J]. 中国农学通报, 2013, 29(33): 323-326. WANG J, YE M, FAN L M, et al. Screening of Cellulose degrading fungi by mycelium growth rate method[J]. Chinese Agric Sci Bull, 2013, 29(33): 323-326. DOI:10.3969/j.issn.1000-6850.2013.33.057 |
| [9] |
李惠霞, 刘永刚, 王蒂, 等. 马铃薯晚疫病菌培养条件的研究[J]. 中国马铃薯, 2007, 21(4): 203-205. LI H X, LIU Y G, WANG D, et al. Studies on suitable culture conditions of Phytophthora infestans [J]. Chinese Potato Journal, 2007, 21(4): 203-205. DOI:10.3969/j.issn.1672-3635.2007.04.004 |
| [10] |
朱丽丹, 徐进, 杨志辉, 等. 五种杀菌剂对马铃薯晚疫病菌孢子萌发的抑制作用[J]. 湖北农业科学, 2015, 54(5): 1097-1101. ZHU L D, XU J, YANG Z H, et al. Inhibition effect of five fungicides on spore germination of Phytophthora infestans [J]. Hubei Agric Sci, 2015, 54(5): 1097-1101. |
| [11] |
LIE KEN JIE M S F, LAM CC. 1H-Nuclear magnetic resonance spectroscopic studies of saturated, acetylenic and ethylenic triacylglycerols[J]. Chemistry and Physics of Lipids, 1995, 77(2): 155-171. DOI:10.1016/0009-3084(95)02463-S |
| [12] |
刘珊珊, 孙文, 杨红兵, 等. 角果藜的化学成分研究(英文)[J]. 天然产物研究与开发, 2012, 24(12): 1738-1742. LIU S S, SUN W, YANG H B, et al. Chemical Constituents of Ceratocarpus arenarius L. (in English) [J]. Nat Prod Res Devel, 2012, 24(12): 1738-1742. DOI:10.3969/j.issn.1001-6880.2012.12.010 |
| [13] |
周中林, 孙继燕, 潘利明, 等. 玉叶金花化学成分研究[J]. 广东药科大学学报, 2017, 33(2): 184-186. ZHOU Z L, SUN J Y, PAN L M, et al. Studies on chemical constituents from Mussaenda Pubescens Ait. f. [J]. J Guangdong Pharmaceu Univ, 2017, 33(2): 184-186. |
| [14] |
HAMID A A, AIYELAAGBE O O, NEGIA S, et al. Corrigendum: bioguided isolation and antiproliferative activity of constituents from Smilax korthalsii A. D. C. leaves
[J]. Journal of the Chinese Chemical Society, 2016, 63(8): 562-571. |
| [15] |
MADAN S, PANNAKAL S T, GANAPATY S, et al. Phenolic glucosides from Flacourtia indica
[J]. Natural Product Communications, 2009, 4(3): 381. |
| [16] |
ZHANG G, SHIMOKAWA S, MOCHIZUKI M, et al. Chemical constituents of Aristolochia constricta: antispasmodic effects of its constituents in guinea-pig ileum and isolation of a diterpeno-lignan hybrid
[J]. Journal of Natural Products, 2008, 71(7): 1167-1172. DOI:10.1021/np800041t |
| [17] |
孙文婷, 蔡由生, 杨升平. 芫花根的化学成分[J]. 中国实验方剂学杂志, 2016, 22(23): 49-54. SUN W T, CAI Y S, YANG S P. Chemical constituents from roots of Daphne genkwa [J]. Chinese Journal of Experimental Traditional Medical Formulae, 2016, 22(23): 49-54. |
| [18] |
CHEN Y Q, SU J, SHEN Y H, et al. Flavonoids from Daphne holosericea
[J]. Chem Nat Comp, 2009, 45(4): 542-544. DOI:10.1007/s10600-009-9359-1 |
| [19] |
吴少华, 吴大刚, 陈有为, 等. 紫牡丹的化学成分研究[J]. 中草药, 2005, 36(5): 648-651. WU S H, WU D G, CHEN Y W, et al. Chemical constituents of Paeonia delavayi [J]. Chinese Trad Herbal Drugs, 2005, 36(5): 648-651. DOI:10.3321/j.issn:0253-2670.2005.05.004 |
| [20] |
彭伟文, 何文生, 纪梦颖, 等. 黑面神药材 70% 乙醇提取部分的化学成分研究[J]. 中国药房, 2017, 28(36): 5144-5147. PENG W W, HE W S, JI M Y, et al. Study on chemical constituents of 70% ethanol extract of Breynia fruticosa [J]. China Pharmacy, 2017, 28(36): 5144-5147. DOI:10.6039/j.issn.1001-0408.2017.36.27 |
| [21] |
郭洁茹. 两种荛花属药用植物化学成分和生物活性研究[D]. 武汉: 华中科技大学, 2012. GUO J R. Study on the chemical constituents and biological activities of two Wikstroemia medicinal plants[D]. Wuhan: Huazhong University of Science and Technology, 2012. |
| [22] |
吴漫晔. 瑞香狼毒药材化学成分研究[D]. 广州: 广州中医药大学, 2010. WU M Y. Studies on chemical compositions of Stellerae chamaeiasmis L.[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2010. |
| [23] |
元超. 瑞香狼毒抑菌活性成分研究[D]. 杨凌: 西北农林科技大学, 2004. YUAN C. Study on antifungal compounds in Stellera chemaejasme L.[D]. Yangling: Northwest A&F University, 2004. |
 2019, Vol. 21
2019, Vol. 21


