化学杀虫剂是目前农业生产上害虫防治的重要手段,但杀虫剂的连续、重复使用会驱动害虫的微进化,进而产生抗药性种群,使防治效果下降,这反过来又刺激杀虫剂用量的增加,最终导致防治失败,只好停用该药剂而寻找开发新品种进行替代。目前对抗性害虫的治理严重依赖于新型杀虫剂的创制与推广应用,因此对杀虫剂新靶标的挖掘也已成为新农药研发的热点领域。然而,几十年来发展为杀虫剂靶标的蛋白种类非常有限,已明确的有乙酰胆碱酯酯、几丁质合成酶、烟碱型乙酰胆碱受体、γ-氨基丁酸受体、蜕皮激素受体、电压门控钠离子通道、谷氨酸门控氯离子通道及瞬时受体电位离子通道等几种[1]。从众多功能蛋白中寻找到可作为杀虫剂靶标的蛋白并不容易,即使发现某种功能蛋白(酶、离子通道或受体)能被小分子高亲和性地抑制,但出于对农药毒性、选择性及环境安全性等方面的考虑,最终能进行产业化应用的也很少[2-3]。目前生产上常用的杀虫剂中,截至2015年前后,对一些具有良好杀虫活性的品种其作用靶标仍未探明[4],如印楝素[5]、三氟甲吡醚[6] 等,而有关氟啶虫酰胺的作用靶标也直到2018年才初步得以明确。研究并确定化合物的作用靶标,并据此进行研发是创制新型农药的一条捷径,但目前尚未见针对氟啶虫酰胺作用靶标研究的相关综述性报道。鉴于此,笔者拟从氟啶虫酰胺的毒理机制、作用靶标发现以及基于靶标的小分子高通量筛选等方面研究进展进行概述,旨在为新型杀虫剂的研发提供思路。
1 氟啶虫酰胺的研发与应用情况氟啶虫酰胺(flonicamid,图式1)是日本石原产业株式会社创制的吡啶酰胺类杀虫剂品种,后由该公司与富美实公司(美国)联合进行商业开发[7],并于2005—2006年先后在美国、巴西、法国、韩国与日本上市[8],2007年在中国与意大利上市,2011年在加拿大获准登记,2012年被列入“欧盟农药指令附件1”(取得农药登记),目前已在全球40余个国家取得农药产品登记[9]。氟啶虫酰胺具有良好的内吸和渗透作用,可从植株根部向茎部及叶部传导,对各种刺吸式口器害虫有效,主要用于防治各类作物上的蚜虫、叶蝉、粉虱、飞虱和木虱等害虫[7, 9-14]。该杀虫剂对咀嚼式口器害虫没有毒力,对各类天敌昆虫,如蜜蜂[7, 15-16]、寄生蜂[17-22]、草蛉[23-24]、食蚜蝇[25]、瓢虫[26]及猎蝽[27]等均表现出良好的安全性,是典型的选择性杀虫剂[7, 28]。
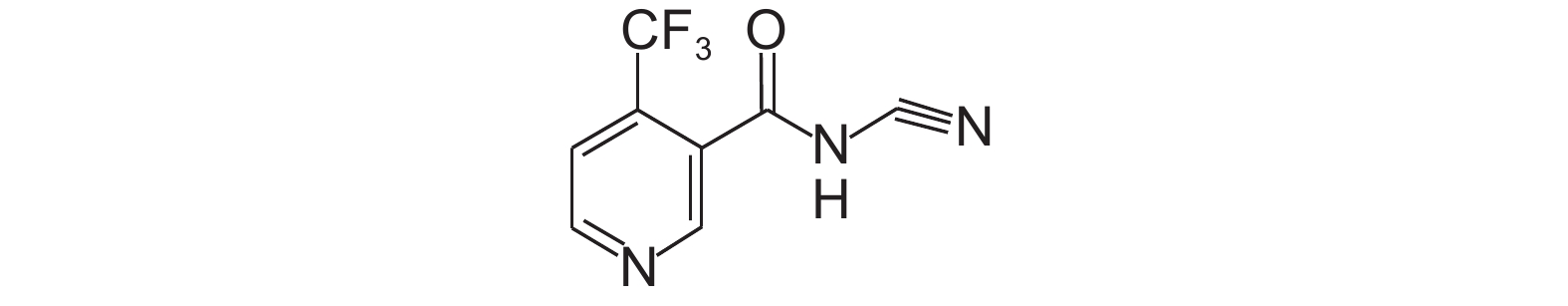
|
图式1 氟啶虫酰胺的化学结构式 Scheme1 The structural formula of flonicamid |
氟啶虫酰胺作为新化合物于1993年7月23日在中国获得专利保护,该专利已于2013年7月22日到期,至2017年3月24日,氟啶虫酰胺的原药正式登记保护期也已到期[9],这极大地激发了中国企业对该产品进行商业开发的兴趣,到2018年底,已有11家中国企业取得氟啶虫酰胺的原药登记,其剂型登记以水分散性粒剂为主,此外还有悬浮剂与可湿性粉剂等,其单剂在中国主要登记用于防治黄瓜、苹果、马铃薯及甘蓝上的蚜虫与水稻飞虱[29]。
2 氟啶虫酰胺的毒理学特性氟啶虫酰胺主要用于防治刺吸式口器害虫,尤其是对蚜虫,如棉蚜Aphis gossypii、桃蚜Myzus persicae、禾谷缢管蚜Rhopalosiphum padi、麦二叉蚜Schizaphis graminum以及萝卜蚜Lipaphis erysimi等均表现出较高的毒力,LC50值在0.64~2.01 mg/L之间,并且对成蚜、若蚜以及有翅、无翅蚜均表现出良好活性[8]。日本石原产业株式会社的Morita博士等采用电子记录技术,分析了经氟啶虫酰胺处理后无翅桃蚜的取食行为,发现其唾液分泌与吸食信号受到强烈抑制,甚至记录不到正常的分泌唾液信号与汁液吸食信号,说明氟啶虫酰胺可通过抑制蚜虫口针对植物组织的穿透而干扰其取食行为,且对取食的抑制作用非常迅速,0.5 h内桃蚜即停止蜜露分泌,并从取食叶面坠落[6]。Koo等发现,亚致死剂量的氟啶虫酰胺即能抑制棉蚜在黄瓜韧皮部吸食,并随处理浓度升高抑制作用增强,仅用50%推荐使用剂量即能完全中断棉蚜的取食行为[30]。Tariq等在记录棉叶蝉Empoasca biguttula取食的过程中,也观察到氟啶虫酰胺对害虫唾液分泌与主动吸食的强抑制活性,并且其抑制作用的大小呈现剂量依赖关系[31]。氟啶虫酰胺对昆虫取食的抑制效应是不可逆的,该抑制作用会导致蚜虫体重减轻,甚至饥饿而死[32]。但因氟啶虫酰胺中毒的昆虫并不会表现出典型神经毒剂(如有机磷类、拟除虫菊酯类以及新烟碱类杀虫剂等)中毒的症状(痉挛或击倒),比如因氟啶虫酰胺中毒的蚜虫往往表现为运动不协调,甚至步履蹒跚[8]。在埃及伊蚊Aedes aegypti与冈比亚按蚊Anopheles gambiae成虫被氟啶虫酰胺处理后也可观察到类似中毒症状,并且氟啶虫酰胺及其主要代谢物(三氟甲基烟酰胺,4-trifluoromethylnicotinamid)对这2种成虫均有一定的毒力,其代谢物在1 h时的毒力甚至高于母体,24 h后代谢物的毒力才低于母体[33]。为此,甚至有人认为氟啶虫酰胺是一种前药,经代谢转化为活性药物后而起作用[33]。具体还有待于通过电生理试验在其靶标上进行验证。
3 氟啶虫酰胺的作用靶标研究进展由于氟啶虫酰胺通过抑制取食而造成昆虫因饥饿死亡,其中毒症状与吡蚜酮(pymetrozine)类似,因此,在2015年前,杀虫剂抗性行动委员会(Insecticide Resistance Action Commision,IRAC)一直将该杀虫剂与吡蚜酮归为一类(第9组:弦音感受器调控剂)[4];但此后巴斯夫公司的Nesterov博士等报道,吡蚜酮的作用靶标是瞬时受体电位离子通道家族的Nanchung与Inactive 2个蛋白[34],而氟啶虫酰胺却不能激活这类离子通道,也不能与该通道的调控剂发生竞争性结合,说明该通道并不是氟啶虫酰胺的作用靶标[35]。因此,IRAC将吡蚜酮从第9组移出至第29组,而氟啶虫酰胺仍保留在第9组,作用靶标为未知类型。吡蚜酮作用于瞬时受体电位离子通道,影响昆虫的行为,蝗虫被注射吡蚜酮后,最典型的中毒症状是后足向后伸并上举[36],而同样作用于瞬时受体电位离子通道的双丙环虫酯(afidopyropen)也可使蝗虫产生类似症状[35]。笔者所在研究团队为了验证氟啶虫酰胺是否也作用于该通道,采用东亚飞蝗Locusta migratoria进行了类似的试验。结果发现:注射吡蚜酮后不仅会导致蝗虫的后足后伸及上举,其中足也同样后伸并上举,而用氟啶虫酰胺注射后,蝗虫并未表现出此类症状(图1),说明氟啶虫酰胺的作用靶标与吡蚜酮有所不同[37]。

|
图 1 用氟啶虫酰胺(B)与吡蚜酮(C)注射后蝗虫的中毒症状[37] Fig. 1 The poisoning symptom of locusts injected with flonicamid(B) or pymetrozine(C)[37] |
氟啶虫酰胺的作用靶标一直是昆虫学家与药理学家关注的研究内容。已有研究表明,该杀虫剂不能作用于γ-氨基丁酸受体、烟碱型乙酰碱胆受体、谷氨酸受体或多巴胺受体,也不能作用于电压门控钠离子通道和鱼尼丁受体,对乙酰胆碱酯酶也没有抑制作用,亦即上述传统的杀虫剂作用靶标均被排除,意味着该杀虫剂可能作用于某一类全新的靶标蛋白[38]。氟啶虫酰胺与目前使用的常规杀虫剂均没有交互抗性,也暗示其作用于不同以往的靶标[37]。最近,Taylor-Wells等发现,氟啶虫酰胺对冈比亚按蚊的Kv2钾离子通道电流有一定的抑制作用,但其抑制中浓度却非常高,IC50值在1 mmol/L左右,远远高于其使昆虫中毒的浓度,显然其致死作用并非源于对Kv2离子通道的阻断作用,而是另有其他未知的靶标[33]。
那么,氟啶虫酰胺是否作用于其他类型的钾离子通道就值得格外关注。动物体内有多种类型的钾离子通道,按结构与功能分为5个家族:1)内向整流钾离子通道(inwardly rectifying potassium channel,Kir);2)电压门控钾离子通道(voltage-gated potassium channels);3)双孔钾离子通道(two-pore potassium channels);4)钙激活钾离子通道(Ca2+ activated potassium channels);5)环核苷酸门控钾离子通道(cyclic nucleotide-gated channels)[39]。Kv2通道即属于电压门控钾离子通道,既然氟啶虫酰胺与Kv2的亲和性不高,对该通道电流的抑制作用不强,那是否作用于其他类型的钾离子通道呢?为此,笔者所在研究团队开展了针对水稻褐飞虱Kir的研究。通过膜片钳技术测定发现,在纳摩尔浓度下,氟啶虫酰胺即可抑制褐飞虱的其中一个Kir通道(Kir1)的钾电流,IC50值为0.64 μmol/L(图2),说明该杀虫剂可高活性地抑制Kir1通道电流,即Kir1通道应是氟啶虫酰胺的作用靶标[37]。

|
A:从表达NlKir1基因的HEK293细胞中采用膜片钳记录到的K+ 电流特性;B:加入氟啶虫酰胺后的K+ 电流特性;C:氟啶虫酰胺与钾离子通道抑制剂氯化钡对内向K+ 电流的抑制作用;D:氟啶虫酰胺对Kir通道抑制作用的剂量效应。***表示差异显著 (P < 0.001)。 A: The current trace recorded from HEK293 cells expressing NlKir1 gene;B: The current characterization of NlKir1 channel with flonicamid;C: The inhibitory effect of flonicamid and BaCl2 on NlKir1 currents;D: The inhibition of flonicamid on NlKir1 channel in dose-dependent manner. *** Means significant difference (P < 0.001). 图 2 氟啶虫酰胺对褐飞虱内向整流钾离子通道的抑制作用[37] Fig. 2 The inhibition of flonicamid on inward-rectifying potassium channel from N. lugen[37] |
接下来的毒理学问题是,Kir通道被抑制是如何导致剌吸式口器害虫死亡的?Kir通道在结构上非常简单,每个亚基由2个跨膜螺旋结构域(M1与M2)、跨膜螺旋间胞外环折回到膜内形成的离子选择性过滤器以及胞质结构域(氨基端与羧基端)组成。功能性Kir通道由4个同源或异源亚基构成,在中心形成充水的离子通道,钾离子沿此通道依照电化学梯度进行跨膜移动(图3)[40-41]。Kir通道是不依赖电压的钾离子通道家族,其结构与功能完全不同于电压门控钾离子通道,此外,该通道由于在超极化膜电位下可介导钾离子内流而不外流的独特能力而被称为生物学二极管[42]。Kir通道有2种主要的生理功能:其一是使静息电位稳定在钾平衡电位水平,维持胞内K+ 稳态;其二是参与钾离子的跨膜运动。在哺乳动物中,Kir通道主要在肾脏与肠道等组织中高水平表达,参与许多重要生理过程,尤其在维持渗透平衡中起关键作用[40]。人的Kir基因突变会造成多种衰弱性系统疾病,如巴特综合症(Bartter syndrome)就是一组由于Kir1通道突变造成的以低钾性代谢性碱中毒为主要特征的遗传性肾小管疾病[43-44]。
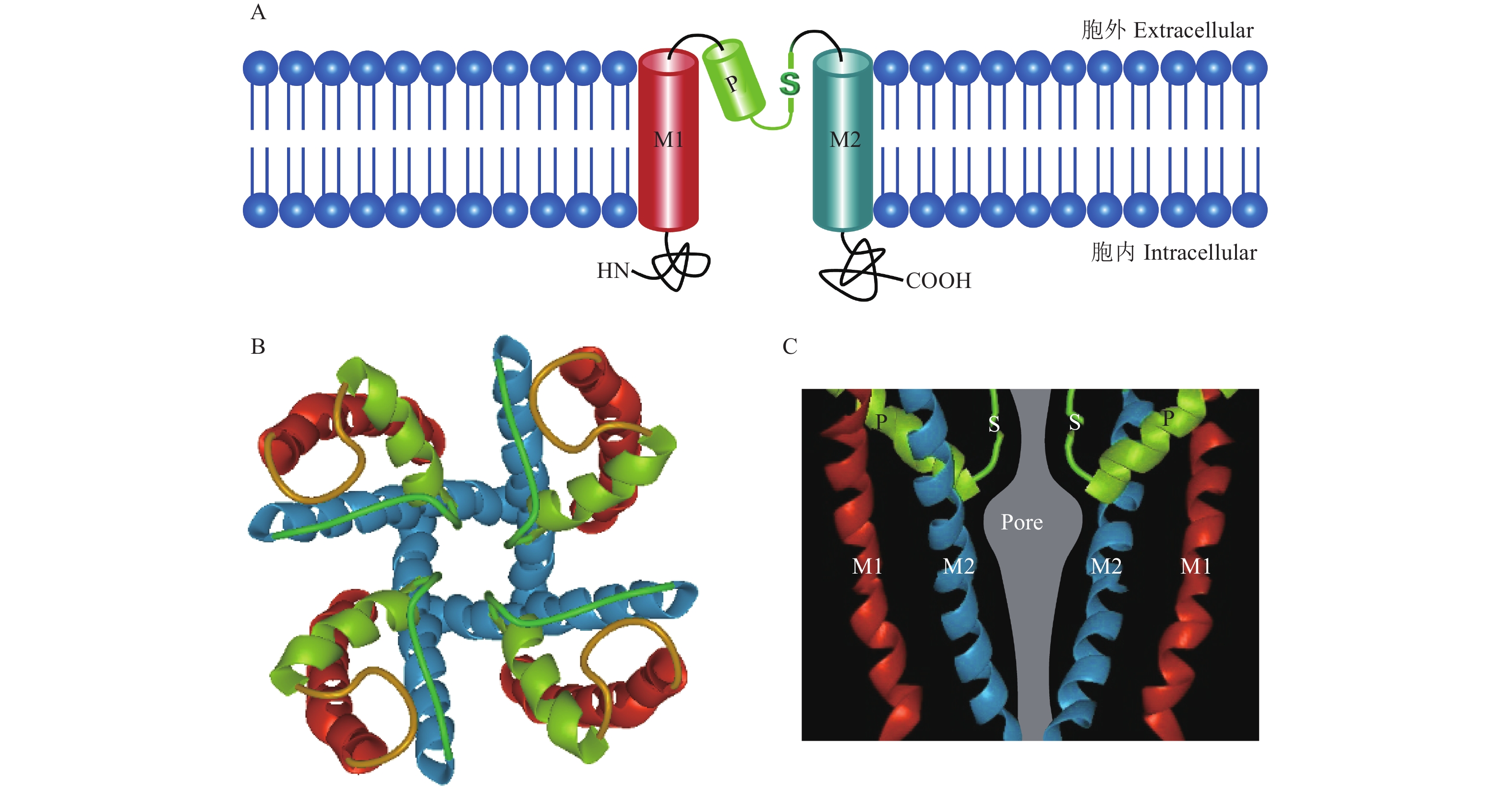
|
A:Kir亚基结构域及膜内拓扑结构;B:Kir通道的顶面观;C:膜孔示意图,M1与M2为跨膜螺旋结构域,P为膜孔内螺旋,S为离子选择性过滤器。 A: The domains of Kir subunit and the topological structure in membrane;B: The top view of Kir channel, showing the tetramer structure;C: Membrane pore, M1 and M2 is the transmembrane helix domains, P is the helix in membrane pore, S is the selective ion filter. 图 3 内向整流钾离子通道结构[41] Fig. 3 The structure of inwardly rectifying potassium channels[41] |
近年的研究表明,Kir通道对于维持肾小管与唾液腺内的K+ 稳态及其正常分泌活性具有重要作用[45-46],在昆虫马氏管分泌调控中也是如此。通过对蚊虫、果蝇以及褐飞虱Kir通道基因组织表达的研究,发现昆虫Kir基因主要在马氏管、后肠以及唾液腺中高水平表达[37, 47-48]。马氏管与后肠构成昆虫的排泄系统,马氏管产生的原尿在排出体外之前,需经过后肠对其中的水分和盐分进行选择性重新吸收。由于昆虫血淋巴与马氏管内的原尿液是等渗的,尿液不能经过滤产生,而是通过分泌形成;原尿液分泌的驱动力主要来自钾离子向管内的主动转运,而Kir通道在这一主动转运过程中扮演着关键角色[49-53]。因此,Kir通道受到抑制会改变上皮细胞K+ 平衡,降低马氏管的分泌活性并抑制昆虫体内离子的清除与尿液的排泄[51, 54-56]。目前已报道的Kir1通道阻断剂,如VU041、VU573和VU590等(图式2)即可通过抑制Kir通道而干扰马氏管的分泌,破坏尿的排泄与体内K+ 稳态[53-54, 57],采用VU041点滴处理冈比亚按蚊与埃及伊蚊雌成虫还可产生致死效应[56, 58]。
氟啶虫酰胺与Kir通道阻断剂的作用类似,其对离体马氏管分泌活性的抑制效应与Kir阻断剂VU590的效果基本相同,并能抑制雌蚊的排泄作用。经氟啶虫酰胺点滴处理的尖音库蚊Culex pipiens雌成虫排泄量显著减少,且减少程度具有剂量依赖效应,其有效抑制中浓度(ED50值)为9.50 ng/头,并可对雌成虫产生致死效应,LD50值为15.38 ng/头[37],说明氟啶虫酰胺可通过阻断Kir通道的钾离子内流而干扰马氏管的正常生理功能,影响昆虫的排泄过程。
昆虫Kir通道除了与马氏管的分泌和排泄有关外,近年还发现该通道与昆虫的取食行为有关,主要涉及对唾液腺分泌的调控[46]。Swale等发现,VU041能显著地抑制果蝇对蔗糖水的摄食,而VU041的结构类似物VU937(结构式见图式2)对果蝇取食则没有抑制作用,特异性地敲除Kir1基因,使果蝇唾液腺不再表达该基因也能使果蝇的总取食量显著减少,但取食时间显著延长[48],说明Kir通道在唾液分泌与取食过程中也起着重要作用。氟啶虫酰胺对刺吸式口器害虫的影响主要表现在对取食的抑制作用上[7]。笔者所在研究团队测定了氟啶虫酰胺对褐飞虱唾液鞘形成的抑制作用,发现经该杀虫剂处理后褐飞虱分泌形成的唾液鞘总数减少,分枝数也减少,其对褐飞虱唾液分泌抑制作用的IC50值为4.16 mg/L;此外,由于氟啶虫酰胺对取食的抑制作用,同时也造成了褐飞虱蜜露排泄量显著减少[37]。
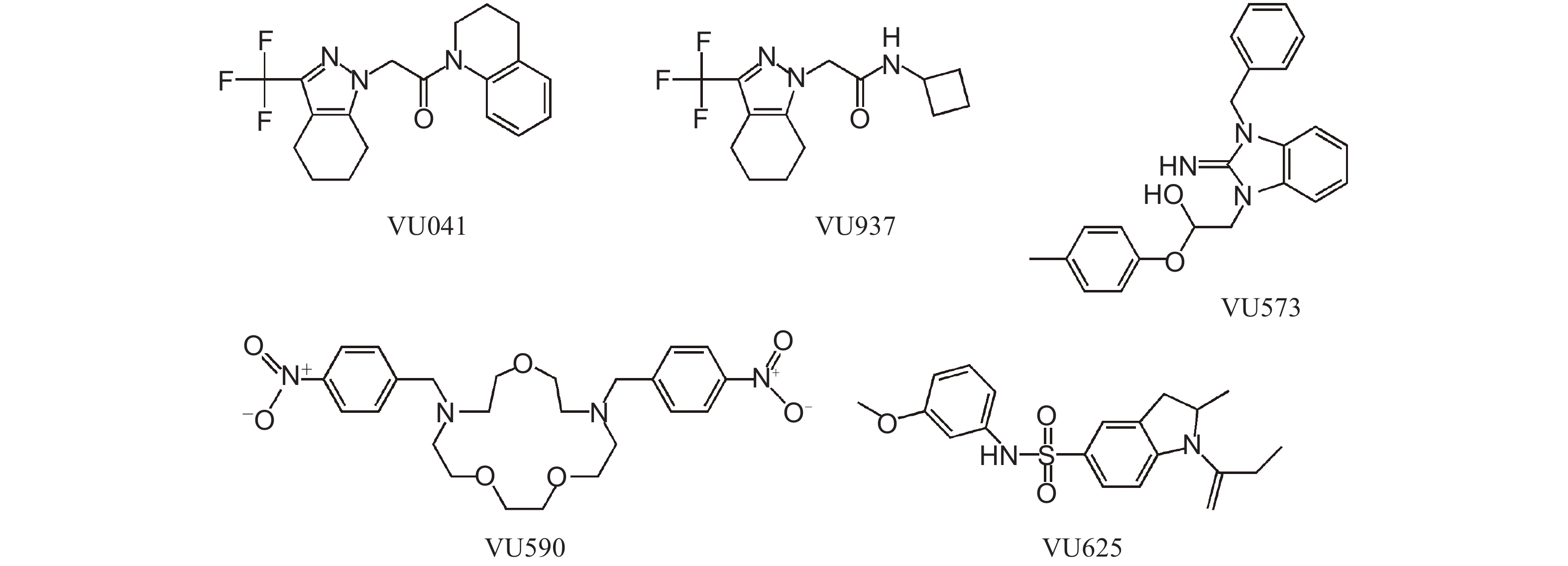
|
图式2 常见Kir通道阻断剂的结构式 Scheme2 The structural formula of Kir channel blockers |
上述研究表明,氟啶虫酰胺可通过阻断昆虫Kir通道的钾离子内流而干扰其唾液腺的正常分泌活动,从而抑制昆虫的取食行为。由于剌吸式口器昆虫靠吸取植物汁液存活,从植物组织中摄取大量液体后需要将体内过量的液体排出体外,以保持体内渗透压的平衡,而氟啶虫酰胺同时还可通过阻断Kir通道而破坏昆虫马氏管的正常生理功能,进而影响蜜露分泌或排泄,最后导致昆虫死亡。因此,氟啶虫酰胺可同时通过影响昆虫唾液腺与马氏管的正常分泌而起到杀虫作用,但具体其中哪一生理过程的破坏是最致命的,则有待进一步研究确定。
4 靶向内向整流钾离子通道杀虫剂的研发由于昆虫的Kir通道具有特殊的生理功能,并且已被证明是氟啶虫酰胺的作用靶标,说明该通道应是良好的杀虫剂作用靶标,这为创制新型杀虫剂提供了新的分子靶标。鉴于Kir通道具有重要的生理功能,以及其与多种遗传性疾病有关,开发针对Kir通道的药物一直是医药学界研究的目标。范德堡大学药学院的Denton教授利用铊离子在通过Kir通道时与钾离子具有等效性的特点,开发出了针对Kir通道抑制剂筛选的高通量筛选技术[59-61]。此后,Denton教授与俄亥俄州立大学的Piermarini教授又合作开展了针对埃及伊蚊Kir1通道抑制剂的筛选工作。他们从近3万个小分子化合物中发现了283个对AeKir1介导的铊荧光信号有抑制作用的化合物,经膜片钳测定,验证了其中编号为VU625(图式2)的小分子对AeKir1通道的抑制中浓度(IC50值)为96.8 nmol/L,是目前昆虫Kir1通道的最强抑制剂,但该化合物单独使用时对昆虫马氏管的分泌却没有影响,仅在与丙磺舒(probenecid,阳离子转运蛋白及ABC转运蛋白的抑制剂)共同注射时才表现出对马氏管排泄的抑制效应[55]。随后,他们又以冈比亚按蚊的Kir1通道为筛选靶标,对近26 000个化合物进行了高通量筛选,从中选出121个潜在的抑制剂,其中编号为VU041(图式2)的化合物对通过该通道的铊离子流有很强的抑制作用,膜片钳测定发现,化合物VU041对AnKir1内向K+电流的IC50值为496 nmol/L,其活性仅次于VU625。由于VU041具有较高的油水分配系数(LogP > 4),使其具备穿透蚊虫体壁的特性,因此极有可能开发成为新的杀虫剂。VU041可破坏马氏管的分泌活性,干扰雌蚊吸血后的排尿能力,而雌蚊在吸饱后须迅速将体内多余的液体排出体外,以避免腹部肿大,但被VU041处理后其体内多余的液体无法排出,使得身体一直处于肿胀状态( 图4)[53, 58]。Piermarini等发现,VU041对大豆蚜的Kir1与Kir2通道均有抑制作用,对大豆蚜的毒力甚至还高于氟啶虫酰胺[62]。VU041仅对蚊虫Kir通道K+ 电流有抑制作用,但对哺乳动物的类似通道却没有影响,并且对蜜蜂安全,同时与其他类型杀虫剂没有交互抗性[63],说明VU041是开发新型杀虫剂非常有潜力的分子骨架[58]。

|
A:对照雌蚊;B:注射Kir抑制剂VU041后的雌蚊。 A: Female in control; B: Female mosquito injected with Kir inhibitor. 图 4 Kir抑制剂VU041对吸血雌蚊排泄的影响[53] Fig. 4 The effects of Kir inhibitor (VU041) on the excretion of female mosquitoes after blood meal[53] |
笔者所在研究团队也构建了针对褐飞虱Kir1通道的高通量筛选技术,利用pcDNA3质粒将NlKir1基因在HEK293细胞中进行组成型表达,通过连续筛选得到稳定表达NlKir1通道的单克隆细胞系,在多孔板中利用铊荧光探针测定供试化合物对NlKir1通道K+ 电流的影响即可筛选获得潜在的NlKir1抑制剂。但由于缺少相应的化合物库,目前尚未开展具体的高通量筛选工作。
5 结论与展望现有研究表明,氟啶虫酰胺可高亲和性地抑制褐飞虱Kir1通道的内向K+ 电流,造成马氏管与唾液腺分泌功能的紊乱,影响害虫的取食与排泄过程,从而导致害虫死亡。但昆虫体内表达的Kir基因往往有多个,如褐飞虱及蚊虫都至少有3个Kir基因,然而目前仅成功确定了Kir1的电生理特性,对Kir2有个别报道[50, 62],而对Kir3电生理特性的研究目前尚不成功,推测其可能需要其他辅助蛋白的参与才具有生理活性,具体尚有待于进一步深入研究;有关氟啶虫酰胺对Kir2和Kir3这2个通道是否具有抑制作用也仍需进一步明确。在靶向Kir通道新药创制方面,目前已建立了针对蚊虫与褐飞虱Kir1通道的高通量小分子抑制剂筛选技术与平台,为高效筛选靶向该靶标的新型杀虫剂创造了技术条件,但要成功筛选出新型杀虫剂尚需要各研究单位进行多方面的合作研究。
| [1] |
GILBERT L I, GILL S S. Insect pharmacology: channels, receptors, toxins and enzymes[M]. San Diego, CA: Academic Press, 2010.
|
| [2] |
HILL C A, SHARAN S, WATTS V J. Genomics, GPCRs and new targets for the control of insect pests and vectors[J]. Curr Opin Insect Sci, 2018, 30: 99-106. DOI:10.1016/j.cois.2018.08.010 |
| [3] |
SPARKS T C. Insecticide discovery: an evaluation and analysis[J]. Pestic Biochem Physiol, 2013, 107(1): 8-17. DOI:10.1016/j.pestbp.2013.05.012 |
| [4] |
SPARKS T C, NAUEN R. IRAC: mode of action classification and insecticide resistance management[J]. Pestic Biochem Physiol, 2015, 121: 122-128. DOI:10.1016/j.pestbp.2014.11.014 |
| [5] |
徐汉虹, 赖多, 张志祥. 植物源农药印楝素的研究与应用[J]. 华南农业大学学报, 2017, 38(4): 1-11. XU H H, LAI D, ZHANG Z X. Research and application of botanical pesticide azadirachtin[J]. J South China Agric Univ, 2017, 38(4): 1-11. |
| [6] |
POWELL G F, WARD D A, PRESCOTT M C, et al. The molecular action of the novel insecticide, pyridalyl[J]. Insect Biochem Mol Biol, 2011, 41(7): 459-469. DOI:10.1016/j.ibmb.2011.03.007 |
| [7] |
MORITA M, YONEDA T, AKIYOSHI N. Research and development of a novel insecticide, flonicamid[J]. J Pestic Sci, 2014, 39(3): 179-180. DOI:10.1584/jpestics.J14-05 |
| [8] |
MORITA M, UEDA T, YONEDA T, et al. Flonicamid, a novel insecticide with a rapid inhibitory effect on aphid feeding[J]. Pest Manage Sci, 2007, 63(10): 969-973. DOI:10.1002/(ISSN)1526-4998 |
| [9] |
束兆林, 于居龙, 缪康, 等. 氟啶虫酰胺对水稻白背飞虱的防治效果及天敌安全性评价[J]. 农药, 2016, 55(11): 851-853. SHU Z L, YU J L, MIAO K, et al. The control effect and safety evaluation to natural enemies of flonicamid against white-backed planthopper[J]. Agrochemicals, 2016, 55(11): 851-853. |
| [10] |
KODANDARAM M H, KUMAR Y B, BANERJEE K, et al. Field bioefficacy, phytotoxicity and residue dynamics of the insecticide flonicamid (50 WG) in okra[Abelmoschus esculenta (L) Moench]
[J]. Crop Prot, 2017, 94: 13-19. DOI:10.1016/j.cropro.2016.12.003 |
| [11] |
PARK J W, PARK Y U, AN J J, et al. Insecticidal activity of 27 insecticides to pear psylla, Cacopsylla pyricola (Foerster) (Hemiptera: Psyllidae) in Jincheon
[J]. Korean J Pestic Sci, 2013, 17(1): 72-75. DOI:10.7585/kjps.2013.17.1.72 |
| [12] |
LEE S Y, YOON C, DO Y S, et al. Evaluation of insecticidal activity of pesticides against hemipteran pests on apple orchard[J]. Korean J Pestic Sci, 2015, 19(3): 264-271. DOI:10.7585/kjps.2015.19.3.264 |
| [13] |
范巧兰, 董晨晨, 张贵云, 等. 10% 氟啶虫酰胺悬浮剂对苹果黄蚜的防治效果[J]. 山西农业科学, 2018, 46(11): 1907-1909. FAN Q L, DONG C C, ZHANG G Y, et al. Field control efficacy of 10% SC flonicamid on Aphis ciricola [J]. J Shanxi Agric Sci, 2018, 46(11): 1907-1909. DOI:10.3969/j.issn.1002-2481.2018.11.31 |
| [14] |
杨帆, 单俊奇, 赵倩倩, 等. 不同施药方式下氟啶虫酰胺对甘蓝主要害虫的田间防治效果[J]. 长江蔬菜, 2017(24): 71-75. YANG F, SHAN J Q, ZHAO Q Q, et al. Field control efficacy of flonicamid on cabbage against main pest with different application method[J]. J Changjiang Vegetab, 2017(24): 71-75. |
| [15] |
吴声敢, 徐吉洋, 饶惠仙, 等. 草莓蚜虫防治用药对蜜蜂的急性毒性与风险评价[J]. 生态毒理学报, 2017, 12(2): 222-227. WU S G, XU J Y, RAO H X, et al. Acute toxicity and risk assessment of pesticides used in strawberry for controlling aphid to honeybees[J]. Asian J Ecotoxicol, 2017, 12(2): 222-227. |
| [16] |
苍涛, 王彦华, 吴长兴, 等. 新烟碱类杀虫剂对蜜蜂的急性毒性及风险评价[J]. 生态毒理学报, 2017, 12(4): 285-292. CANG T, WANG Y H, WU C X, et al. Acute toxicity and risk assessment of neonicotinoid insecticides to hon-eybees (Apis mellifera L.) [J]. Asian J Ecotoxicol, 2017, 12(4): 285-292. |
| [17] |
RODITAKIS E, FYTROU N, STAURAKAKI M, et al. Activity of flonicamid on the sweet potato whitely Bemisia tabaci (Homoptera: Aleyrodidae) and its natural enemies
[J]. Pest Manage Sci, 2014, 70(10): 1460-1467. DOI:10.1002/ps.2014.70.issue-10 |
| [18] |
MOENS J, TIRRY L, DE CLERCQ P. Susceptibility of cocooned pupae and adults of the parasitoid Microplitis mediator to selected insecticides
[J]. Phytoparasitica, 2012, 40(1): 5-9. DOI:10.1007/s12600-011-0198-9 |
| [19] |
KHAN M A, RUBERSON J R. Lethal effects of selected novel pesticides on immature stages of Trichogramma pretiosum (Hymenoptera: Trichogrammatidae)
[J]. Pest Manage Sci, 2017, 73(12): 2465-2472. DOI:10.1002/ps.2017.73.issue-12 |
| [20] |
KHAN M A, KHAN H, RUBERSON J R. Lethal and behavioral effects of selected novel pesticides on adults of Trichogramma pretiosum (Hymenoptera: Trichogrammatidae)
[J]. Pest Manage Sci, 2015, 71(12): 1640-1648. DOI:10.1002/ps.2015.71.issue-12 |
| [21] |
FREWIN A J, SCHAAFSMA A W, HALLETT R H. Susceptibility of Aphelinus certus to foliar-applied insecticides currently or potentially registered for soybean aphid control
[J]. Pest Manage Sci, 2012, 68(2): 202-208. DOI:10.1002/ps.v68.2 |
| [22] |
DEL MAR FERNÁNDEZ M, MEDINA P, FERERES A, et al. Are mummies and adults of Eretmocerus mundus (Hymenoptera: Aphelinidae) compatible with modern insecticides?
[J]. J Econ Entomol, 2015, 108(5): 2268-2277. DOI:10.1093/jee/tov181 |
| [23] |
BARBOSA P R R, MICHAUD J P, BAIN C L, et al. Toxicity of three aphicides to the generalist predators Chrysoperla carnea (Neuroptera: Chrysopidae) and Orius insidiosus (Hemiptera: Anthocoridae)
[J]. Ecotoxicology, 2017, 26(5): 589-599. DOI:10.1007/s10646-017-1792-5 |
| [24] |
GARZÓN A, MEDINA P, AMOR F, et al. Toxicity and sublethal effects of six insecticides to last instar larvae and adults of the biocontrol agents Chrysoperla carnea (Stephens) (Neuroptera: Chrysopidae) and Adalia bipunctata (L.) (Coleoptera: Coccinellidae)
[J]. Chemosphere, 2015, 132: 87-93. DOI:10.1016/j.chemosphere.2015.03.016 |
| [25] |
MOENS J, DE CLERCQ P, TIRRY L. Side effects of pesticides on the larvae of the hoverfly Episyrphus balteatus in the laboratory
[J]. Phytoparasitica, 2011, 39(1): 1-9. DOI:10.1007/s12600-010-0127-3 |
| [26] |
JALALI M A, VAN LEEUWEN T, TIRRY L, et al. Toxicity of selected insecticides to the two-spot ladybird Adalia bipunctata
[J]. Phytoparasitica, 2009, 37(4): 323-326. DOI:10.1007/s12600-009-0051-6 |
| [27] |
SRIVASTAVA M, FUNDERBURK J, OLSON S, et al. Impacts on natural enemies and competitor thrips of insecticides against the western flower thrips (Thysanoptera: Thripidae) in fruiting vegetables[J]. Florida Entomol, 2014, 97(2): 337-348. DOI:10.1653/024.097.0201 |
| [28] |
JANSEN J P, DEFRANCE T, WARNIER A M. Side effects of flonicamide and pymetrozine on five aphid natural enemy species[J]. BioControl, 2011, 56(5): 759-770. DOI:10.1007/s10526-011-9342-1 |
| [29] |
刘刚. 氟啶虫酰胺原药产品登记企业达到 11 家[J]. 农药市场信息, 2018(19): 32. LIU G. Eleven enterprises in China obtained the registration of flonicamid technical grade[J]. Pestic Market News, 2018(19): 32. |
| [30] |
KOO H N, LEE S W, YUN S H, et al. Feeding response of the cotton aphid, Aphis gossypii, to sublethal rates of flonicamid and imidacloprid
[J]. Entomol Exp Appl, 2015, 154(2): 110-119. DOI:10.1111/eea.2015.154.issue-2 |
| [31] |
TARIQ K, NOOR M, BACKUS E A, et al. The toxicity of flonicamid to cotton leafhopper, Amrasca biguttula (Ishida), is by disruption of ingestion: an electropenetrography study
[J]. Pest Manage Sci, 2017, 73(8): 1661-1669. DOI:10.1002/ps.2017.73.issue-8 |
| [32] |
CHO S R, KOO H N, YOON C, et al. Sublethal effects of flonicamid and thiamethoxam on green peach aphid, Myzus persicae and feeding behavior analysis
[J]. J Korean Soc Appl Biol Chem, 2011, 54(6): 889-898. DOI:10.1007/BF03253177 |
| [33] |
TAYLOR-WELLS J, GROSS A D, JIANG S Y, et al. Toxicity, mode of action, and synergist potential of flonicamid against mosquitoes[J]. Pestic Biochem Physiol, 2018, 151: 3-9. DOI:10.1016/j.pestbp.2018.06.004 |
| [34] |
NESTEROV A, SPALTHOFF C, KANDASAMY R, et al. TRP channels in insect stretch receptors as insecticide targets[J]. Neuron, 2015, 86(3): 665-671. DOI:10.1016/j.neuron.2015.04.001 |
| [35] |
KANDASAMY R, LONDON D, STAM L, et al. Afidopyropen: new and potent modulator of insect transient receptor potential channels[J]. Insect Biochem Mol Biol, 2017, 84: 32-39. DOI:10.1016/j.ibmb.2017.03.005 |
| [36] |
AUSBORN J, WOLF H, MADER W, et al. The insecticide pymetrozine selectively affects chordotonal mechanoreceptors[J]. J Exp Biol, 2005, 208: 4451-4466. DOI:10.1242/jeb.01917 |
| [37] |
REN M M, NIU J G, HU B, et al. Block of Kir channels by flonicamid disrupts salivary and renal excretion of insect pests[J]. Insect Biochem Mol Biol, 2018, 99: 17-26. DOI:10.1016/j.ibmb.2018.05.007 |
| [38] |
HAYASHI J H, KELLY G, KINNE L P. Flonicamid mechanism-of-action studies using whole-cell patch-clamping of cultured insect neurons[C]//Proceedings of the beltwide cotton conferences. San Antonio, Texas: NCC, 2006.
|
| [39] |
MILLER C. An overview of the potassium channel family[J]. Genome Biol, 2000, 1(4): 1-5. |
| [40] |
HIBINO H, INANOBE A, FURUTANI K, et al. Inwardly rectifying potassium channels: their structure, function, and physiological roles[J]. Physiol Rev, 2010, 90(1): 291-366. DOI:10.1152/physrev.00021.2009 |
| [41] |
MOCZYDLOWSKI E. Chemical basis for alkali cation selectivity in potassium-channel proteins[J]. Chem Biol, 1998, 5(11): R291-R301. DOI:10.1016/S1074-5521(98)90288-5 |
| [42] |
CHEN R, SWALE D R. Inwardly rectifying potassium (Kir) channels represent a critical ion conductance pathway in the nervous systems of insects[J]. Sci Rep, 2018, 8(1): 1617. DOI:10.1038/s41598-018-20005-z |
| [43] |
PATTNAIK B R, ASUMA M P, SPOTT R, et al. Genetic defects in the hotspot of inwardly rectifying K+(Kir) channels and their metabolic consequences: a review
[J]. Mol Genet Metab, 2012, 105(1): 64-72. DOI:10.1016/j.ymgme.2011.10.004 |
| [44] |
李丽, 司军强, 马克涛. 钾离子通道与疾病[M]. 北京: 科学技术文献出版社, 2014. LI L, SI J Q, MA K T. Potassium channel and diseases[M]. Beijing: Science and Literature Publishing House, 2014. |
| [45] |
CUEVAS C A, SU X T, WANG M X, et al. Potassium sensing by renal distal tubules requires Kir4.1[J]. J Am Soc Nephrol, 2017, 28(6): 1814-1825. DOI:10.1681/ASN.2016090935 |
| [46] |
ALMÁSSY J, SIGUENZA E, SKALICZKI M, et al. New saliva secretion model based on the expression of Na+-K+ pump and K+ channels in the apical membrane of parotid acinar cells
[J]. Pflugers Arch - Eur J Physiol, 2018, 470(4): 613-621. DOI:10.1007/s00424-018-2109-0 |
| [47] |
YANG Z X, STATLER B M, CALKINS T L, et al. Dynamic expression of genes encoding subunits of inward rectifier potassium (Kir) channels in the yellow fever mosquito Aedes aegypti
[J]. Comp Biochem Physiol Part B: Biochem Mol Biol, 2017, 204: 35-44. DOI:10.1016/j.cbpb.2016.11.003 |
| [48] |
SWALE D R, LI Z L, GUERRERO F, et al. Role of inward rectifier potassium channels in salivary gland function and sugar feeding of the fruit fly, Drosophila melanogaster
[J]. Pestic Biochem Physiol, 2017, 141: 41-49. DOI:10.1016/j.pestbp.2016.11.005 |
| [49] |
EVANS J M, ALLAN A K, DAVIES S A, et al. Sulphonylurea sensitivity and enriched expression implicate inward rectifier K+ channels in Drosophila melanogaster renal function
[J]. J Exp Biol, 2005, 208: 3771-3783. DOI:10.1242/jeb.01829 |
| [50] |
PIERMARINI P M, ROUHIER M F, SCHEPEL M, et al. Cloning and functional characterization of inward-rectifying potassium (Kir) channels from Malpighian tubules of the mosquito Aedes aegypti
[J]. Insect Biochem Mol Biol, 2013, 43(1): 75-90. DOI:10.1016/j.ibmb.2012.09.009 |
| [51] |
PIERMARINI P M, DUNEMANN S M, ROUHIER M F, et al. Localization and role of inward rectifier K+ channels in Malpighian tubules of the yellow fever mosquito Aedes aegypti
[J]. Insect Biochem Mol Biol, 2015, 67: 59-73. DOI:10.1016/j.ibmb.2015.06.006 |
| [52] |
WU Y P, BAUM M, HUANG C L, et al. Two inwardly rectifying potassium channels, Irk1 and Irk2, play redundant roles in Drosophila renal tubule function
[J]. Am J Physiol Regul Integr Comp Physiol, 2015, 309(7): 747-756. DOI:10.1152/ajpregu.00148.2015 |
| [53] |
BEYENBACH K W, YU Y S, PIERMARINI P M, et al. Targeting renal epithelial channels for the control of insect vectors[J]. Tissue Barriers, 2015, 3(4): e1081861. DOI:10.1080/21688370.2015.1081861 |
| [54] |
RAPHEMOT R, ROUHIER M F, HOPKINS C R, et al. Eliciting renal failure in mosquitoes with a small-molecule inhibitor of inward-rectifying potassium channels[J]. PLoS One, 2013, 8(5): e64905. DOI:10.1371/journal.pone.0064905 |
| [55] |
RAPHEMOT R, ROUHIER M F, SWALE D R, et al. Discovery and characterization of a potent and selective inhibitor of Aedes aegypti inward rectifier potassium channels
[J]. PLoS One, 2014, 9(11): e110772. DOI:10.1371/journal.pone.0110772 |
| [56] |
ROUHIER M F, RAPHEMOT R, DENTON J S, et al. Pharmacological validation of an inward-rectifier potassium (Kir) channel as an insecticide target in the yellow fever mosquito Aedes aegypti
[J]. PLoS One, 2014, 9(6): e100700. DOI:10.1371/journal.pone.0100700 |
| [57] |
RAPHEMOT R, LONERGAN D F, NGUYEN T T, et al. Discovery, characterization, and structure-activity relationships of an inhibitor of inward rectifier potassium (Kir) channels with preference for Kir2.3, Kir3.x, and Kir7.1[J]. Front Pharmacol, 2011, 2: 75. |
| [58] |
SWALE D R, ENGERS D W, BOLLINGER S R, et al. An insecticide resistance-breaking mosquitocide targeting inward rectifier potassium channels in vectors of Zika virus and malaria[J]. Sci Rep, 2016, 6: 36954. DOI:10.1038/srep36954 |
| [59] |
LEWIS L M, BHAVE G, CHAUDER B A, et al. High-throughput screening reveals a small-molecule inhibitor of the renal outer medullary potassium channel and Kir7.1[J]. Mol Pharmacol, 2009, 76(5): 1094-1103. DOI:10.1124/mol.109.059840 |
| [60] |
BHAVE G, LONERGAN D, CHAUDER B A, et al. Small-molecule modulators of inward rectifier K+ channels: recent advances and future possibilities
[J]. Future Med Chem, 2010, 2(5): 757-774. DOI:10.4155/fmc.10.179 |
| [61] |
RAPHEMOT R, WEAVER C D, DENTON J S. High-throughput screening for small-molecule modulators of inward rectifier potassium channels[J]. J Vis Exp, 2013, 71: 4209. |
| [62] |
PIERMARINI P M, INOCENTE E A, ACOSTA N, et al. Inward rectifier potassium (Kir) channels in the soybean aphid Aphis glycines: functional characterization, pharmacology, and toxicology
[J]. J Insect Physiol, 2018, 110: 57-65. DOI:10.1016/j.jinsphys.2018.09.001 |
| [63] |
ABBAS N, ABBAS N, EJAZ M, et al. Resistance in field populations of Amrasca devastans (Hemiptera: Cicadellidae) to new insecticides in Southern Punjab, Pakistan
[J]. Phytoparasitica, 2018, 46(4): 533-539. DOI:10.1007/s12600-018-0688-0 |
 2019, Vol. 21
2019, Vol. 21

