黄瓜生长环境湿度大,易发生病虫危害,目前主要通过化学农药进行防治。但由于连续大量使用农药,使得病虫害对药物产生抗药性,农药的使用量增加,最终可能导致农药残留超标[1]。因此一些广谱、作用机理独特、高效、安全、低残留的农药开始被用于黄瓜病害防治中,如2010年在中国注册登记用于防治黄瓜白粉病的氟吡菌酰胺[2]。中国在《食品安全国家标准 食品中农药最大残留限量》[3]中并未对黄瓜中使用的31种农药的最大残留限量 (MRL) 指定检测方法。笔者前期对在气相色谱-串联质谱上响应较好的氟啶虫酰胺、乙蒜素、氟吡菌酰胺、氟啶虫胺腈、环酰菌胺、氟吡菌胺、唑嘧菌胺、氟吗啉、烯肟菌酯和烯肟菌胺等10种农药开展了同时测定的研究,发现乙蒜素用乙腈提取时回收率低于50%,故予以剔除。其中,氟吡菌胺、氟吡菌酰胺、氟吗啉、唑嘧菌胺和烯肟菌酯主要用于防治霜霉病,环酰菌胺主要用于防治灰霉病,烯肟菌胺主要用于防治白粉病,氟啶虫酰胺和氟啶虫胺腈主要用于防治蚜虫等刺吸式口器害虫。在这9种农药中,氟吡菌胺、氟吡菌酰胺和氟啶虫胺腈的MRL值均为0.5 mg/kg,氟啶虫酰胺、环酰菌胺、烯肟菌胺、烯肟菌酯和唑嘧菌胺的MRL值均为1 mg/kg,氟吗啉的MRL值为2 mg/kg[3];日本规定黄瓜中氟吡菌酰胺的MRL值为0.6 mg/kg,氟吡菌胺和氟啶虫胺腈的MRL值为0.7 mg/kg,氟啶虫酰胺和环酰菌胺的MRL值为2 mg/kg,唑嘧菌胺的MRL值为3 mg/kg[4],而对烯肟菌胺、烯肟菌酯和氟吗啉尚未制定MRL值。丁苯吗啉虽未在黄瓜上登记使用,但因其能够防治白粉病,故也取之进行了同步研究。
目前,关于这10种农药的检测方法主要有酶联免疫法[5]、气相色谱法[6]、气相色谱-质谱法[7-8]、气相色谱-串联质谱法[9-10]和液相色谱-串联质谱法[11-16]等,其中有单一残留农药检测方法[5, 7, 10-15]和同时测定其中几种农药残留的检测方法[6, 8-9, 16]。关于QuEChERS前处理结合质谱技术检测农药残留已有大量报道,但这些方法最多只能同时测定这10种农药中的3种[8-9, 15]。为了提高检测效率,本研究采用QuEChERS技术结合气相色谱-串联质谱仪,建立了同时检测黄瓜中氟啶虫酰胺、丁苯吗啉、氟吡菌酰胺、氟啶虫胺腈、环酰菌胺、氟吡菌胺、唑嘧菌胺、氟吗啉、烯肟菌酯和烯肟菌胺 (结构式见图式 1) 这10种高效低毒或微毒农药残留的方法。

|
图式1 十种农药的化学结构式 Scheme1 Structural formula of 10 pesticides |
1 材料与方法 1.1 主要仪器、药剂与试剂
Agilent 7000D三重四极杆-串联质谱仪 (美国Agilent公司);SI-T246旋涡振荡器 (德国IKA公司);CM-1000旋涡振荡器 (东京理化器械株式会社);FISFB11301超声波清洗仪、Pacific T117超纯水发生器和ST16R高速冷冻离心机 (美国赛默飞世尔科技公司)。
氟啶虫酰胺 (flonicamid)、丁苯吗啉 (fenpropimorph)、氟吡菌酰胺 (fluopyram)、氟啶虫胺腈 (sulfoxaflor)、环酰菌胺 (fenhexamid)、氟吡菌胺 (fluopicolide)、唑嘧菌胺 (ametoctradin)、氟吗啉 (flumorph) 和烯肟菌酯 (enestroburin) 9种农药标准品 (纯度均 ≥ 95.0 %),购于DR. Ehrenstorfer GmbH公司;烯肟菌胺 (fenaminstrobin,100 μg/mL)标准品购于天津阿尔塔科技有限公司。乙腈 (色谱纯,美国Fisher公司);冰乙酸、氯化钠和碳酸钠 (分析纯,天津市风船化学试剂科技有限公司);无水硫酸镁 (分析纯,上海阿拉丁生化科技股份有限公司);QuEChERS萃取盐包 (4 g无水硫酸镁, 1 g氯化钠, 1 g柠檬酸钠, 0.5 g柠檬酸氢二钠,迪马科技有限公司);乙二胺-N-丙基硅烷 (PSA,美国安捷伦公司);石墨化碳黑 (GCB,120~400目,粒径38~120 μm,天津博纳艾杰尔科技有限公司)。
1.2 样品前处理称取10 g (精确至0.01 g) 样品于50 mL离心管中,加入10 mL乙腈,涡旋振荡30 min,加入4 g无水硫酸镁和1 g氯化钠,涡旋振荡5 min,于7 000 r/min下离心3 min;取5 mL上清液于预先加有125 mg PSA、900 mg 无水硫酸镁和25 mg GCB的离心管中,涡旋振荡1 min,超声10 min,于3 000 r/min下离心5 min;取上清液 1.00 mL,待GC-MS/MS测定。
1.3 GC-MS/MS检测条件色谱条件:HP-5 MS Ultra Inert色谱柱 (30 m × 250 μm,0.25 μm,美国Agilent公司);升温程序:80 ℃保持1 min,以10 ℃/min升温至240 ℃,再以2.5 ℃/min升温至250 ℃;最后以20 ℃/min升温至300 ℃,保持6.5 min;运行时间30 min。载气为氦气 (纯度 ≥ 99.999 %),流速1.0 mL/min。不分流进样,进样体积1 μL,进样口温度280 ℃,接口温度280 ℃。
质谱条件:电子轰击离子源 (EI),离子源温度300 ℃,电离能量70 eV ,四极杆温度180 ℃,溶剂延迟时间5.0 min,多反应监测 (MRM) 模式,其他质谱条件见表1。
|
|
表 1 十种农药的保留时间、特征离子和碰撞能量 Table 1 Retention time, characteristic ion-pair and collision energy of the 10 pesticides |
2 结果与讨论 2.1 检测条件的优化
在m/z 50~450范围内对10种农药的标准溶液进行MS2全扫描,确定各组分的保留时间。环酰菌胺与氟吡菌胺的保留时间较接近,采用10 ℃/min的速率升温至240 ℃后,再以2.5 ℃/min的速率缓慢升温,实现了各农药的完全分离。根据所得化合物的全扫描谱图,选择响应较强、高质量端的特征碎片离子作为母离子。通过产物离子模式,在不同的碰撞能量 (2.5~40 eV) 下对多反应监测方法进行优化,确定各组分的碎片离子信息及最佳的碰撞能量。升高离子源和四极杆温度后,10种农药的响应值均有一定程度的增大,尤其是氟吗啉和环酰菌胺的响应值甚至增大了80%以上,因此采用离子源300 ℃和四极杆180 ℃进行测定。设置合适的分段扫描窗口,每个分段时间内最多监测2种农药,以增加相应的采集点数,提高分析的准确性。优化结果见表1。
2.2 样品前处理条件的选择 2.2.1 提取条件的选择分别采用QuEChERS[17]、AOACV2007.1[18]和EN15662[19] 3种方法对黄瓜中的10种农药进行提取,添加水平均为0.10 mg/kg,6次重复,基质标准溶液外标法定量。结果 (表2) 表明:QuEChERS法的平均回收率在92%~106%之间,相对标准偏差 (RSD) 在1.2%~6.4%之间;EN15662法的平均回收率在90%~101%之间,RSD在0.8%~8.9%之间;AOACV2007.1法的平均回收率在89%~100%之间,RSD在1.0%~6.9%之间。鉴于QuEChERS法的回收率较高,且相对标准偏差较小,因此选择QuEChERS方法进行提取。
|
|
表 2 不同样品提取方法对10种农药回收率及相对标准偏差的影响 (n = 6) Table 2 Recoveries and relative standard deviations of the 10 pesticides by three extraction methods (n = 6) |
2.2.2 净化条件的优化
常用的净化材料有无水硫酸镁、PSA、GCB和C18等[8-10, 14-15, 20-23]。其中MgSO4常用于除水,PSA常用于消除各种有机酸、色素、糖、脂肪酸和一部分水,GCB能够去除类甾体和叶绿素等色素,C18在去除油脂等非极性杂质方面效果良好。考虑到黄瓜的成分,本研究选择无水硫酸镁、PSA和GCB为净化剂并对其用量进行了优化,每个水平3次重复,均采用基质标准溶液外标法定量。
2.2.2.1 PSA用量的优化在无水硫酸镁用量为750 mg条件下,考察了PSA用量对净化效果的影响。在5 mL预先加入0.20 mg/kg目标化合物的提取液中,分别加入50、75、100、125、150、200和250 mg的PSA。结果 (图1) 表明:PSA 用量在 125 mg 以内时,各农药回收率随着PSA 用量的增加缓慢升高;当PSA用量大于125 mg后,环酰菌胺、氟啶虫胺腈和唑嘧菌胺的回收率明显下降,同时提取液的颜色逐渐变浅。因此确定PSA用量为125 mg。
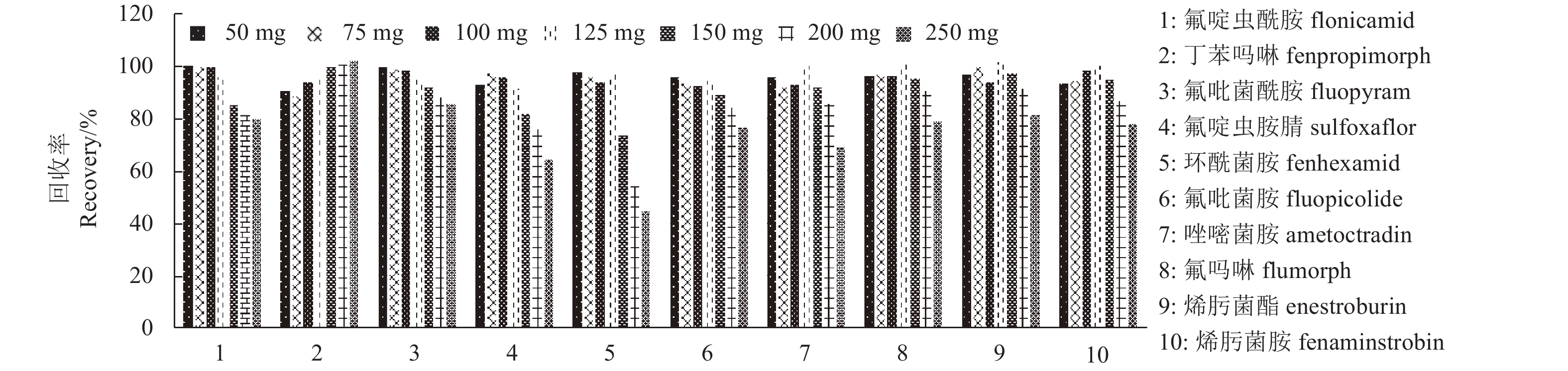
|
图 1 PSA用量对净化效率的影响 (5 mL提取液中,MgSO4 750 mg) Fig. 1 Effect of PSA to the purification efficiency (in 5 mL extract, MgSO4 750 mg) |
2.2.2.2 无水硫酸镁用量的优化
在PSA用量为125 mg条件下,考察了无水硫酸镁用量对净化效果的影响。在5 mL预先加入0.20 mg/kg目标化合物的提取液中,分别加入300、450、600、750、900、1 050、1 200和1 350 mg的无水硫酸镁。结果 (图2) 表明:无水硫酸镁用量在600 mg以内时,回收率随着其用量的增加而降低,在600~900 mg之间,回收率随着无水硫酸镁用量的增加而升高,超过900 mg则回收率又随着无水硫酸镁用量的增加而降低。综合考虑疏水效果和回收率,确定无水硫酸镁用量为900 mg。
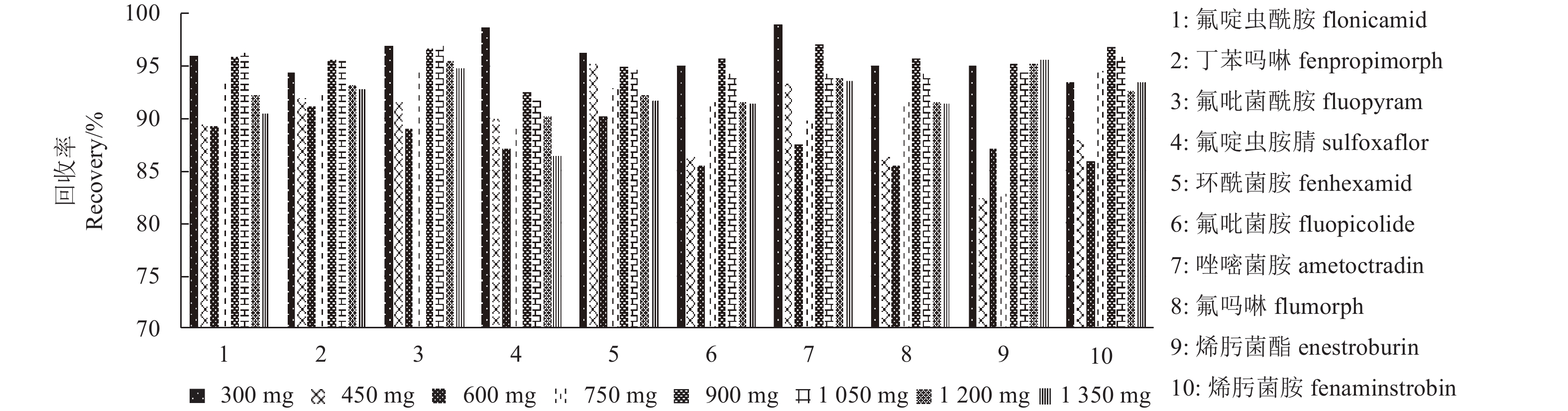
|
图 2 无水硫酸镁用量对净化效率的影响 (5 mL提取液中,PSA 125 mg) Fig. 2 Effect of MgSO4 to the purification efficiency (in 5 mL extract, PSA 125 mg) |
2.2.2.3 GCB用量的优化
在PSA用量为 125 mg和无水硫酸镁用量为900 mg的条件下,考察了GCB用量对净化效果的影响。在5 mL预先加入0.20 mg/kg目标化合物的提取液中,分别加入5、10、15、20、25、30、35和40 mg的GCB。结果 (图3) 表明:随着GCB用量增加提取液颜色明显变浅,当GCB用量为35 mg时基本呈无色透明状,但当GCB的用量超过25 mg时,环酰菌胺、氟啶虫胺腈、烯肟菌胺和唑嘧菌胺的回收率开始下降。因此确定GCB用量为25 mg。

|
图 3 GCB用量对净化效率的影响 (5 mL提取液中,PSA 125 mg, MgSO4 900 mg) Fig. 3 Effect of GCB to the purification efficiency (in 5 mL extract, PSA 125 mg,MgSO4 900 mg) |
综上所述,最终选择在5 mL提取液中加入125 mg PSA、900 mg无水硫酸镁和25 mg GCB进行净化。在Anastassiades等[17]建立的QuEChERS法中,每毫升提取液中加入150 mg无水硫酸镁和25 mg PSA进行净化,若扩大至5 mL提取液,即加入750 mg无水硫酸镁和125 mg PSA。本研究与之相比主要区别在于GCB的应用,尽管随着GCB用量的增大,大部分目标农药的RSD也不断增大,但考虑到加入GCB后提取液颜色明显变浅,减少了对进样口的污染,增大了仪器测定的稳定性,因此决定对QuEChERS进行了一定的改进。
2.3 方法的准确度和精密度取不含有待测组分的空白黄瓜样品进行添加回收试验,对中国已制定MRL标准的,分别以定量限 (LOQ)、0.5倍MRL值、1倍MRL值和1.5倍MRL值水平进行添加回收试验;丁苯吗啉以LOQ、0.05、0.1和0.15 mg/kg水平进行添加回收试验。由于部分化合物添加水平较高时已超出线性范围,因此1倍MRL值的添加水平用乙腈稀释1倍进样,1.5倍MRL值的添加水平用乙腈稀释2倍进样。每个水平重复10次,基质匹配标准溶液外标法定量。结果 (表3) 表明:10种农药的平均回收率在76%~105%之间,RSD 在4.0%~12%之间。多反应监测总离子流图见图4,从中可以看出,10种农药在优化后的色谱条件下实现了完全的分离,样品经过净化后,在目标物出峰处基本没有干扰。
|
|
表 3 空白黄瓜基质中10种农药的添加回收率及相对标准偏差 (n = 10) Table 3 Recoveries and relative standard deviations (RSD) of the 10 pesticides in cucumber sample (n = 10) |
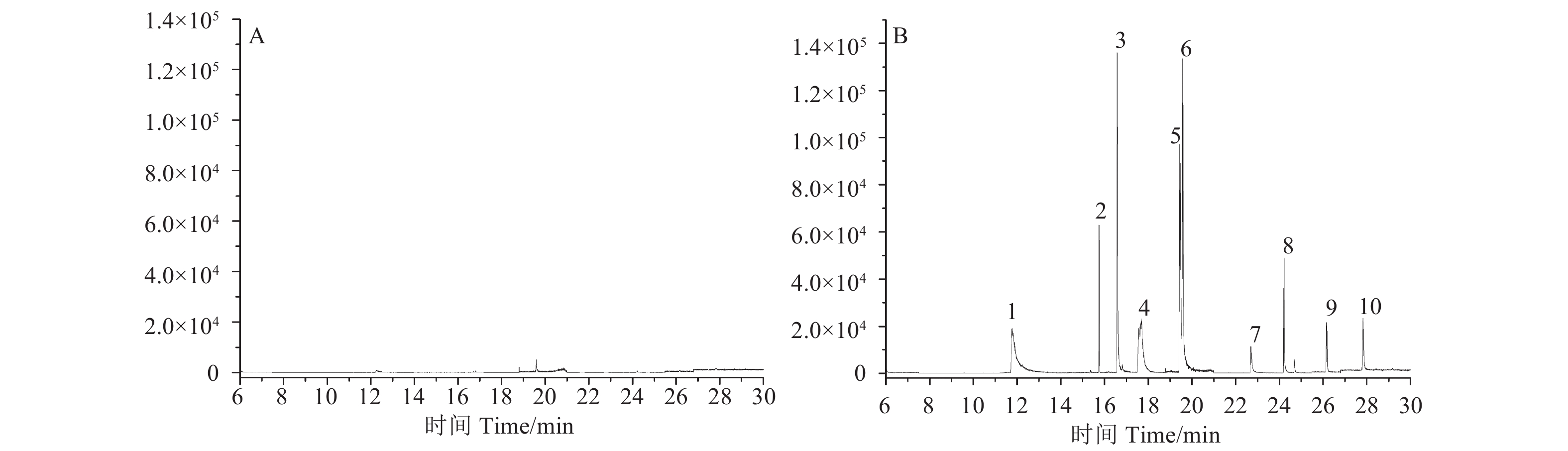
|
1:氟啶虫酰胺flonicamid;2:丁苯吗啉fenpropimorph;3:氟吡菌酰胺fluopyram;4:氟啶虫胺腈sulfoxaflor;5:环酰菌胺fenhexamid;6:氟吡菌胺fluopicolide;7:唑嘧菌胺ametoctradin;8:氟吗啉flumorph;9:烯肟菌酯enestroburin;10:烯肟菌胺fenaminstrobin。A:黄瓜空白样品;B:黄瓜添加样品 (丁苯吗啉 0.001 mg/kg,氟啶虫酰胺、氟吡菌酰胺、氟吡菌胺和氟吗啉0.005 mg/kg,环酰菌胺和烯肟菌酯0.01 mg/kg,唑嘧菌胺和烯肟菌胺0.02 mg/kg,氟啶虫胺腈0.05 mg/kg)。 A: Total ion chromatogram of black cucumber; B: Total ion chromatogram of spiked sample (fenpropimorph 0.001 mg/kg, flonicamid, fluopyram, fluopicolide and flumorph 0.005 mg/kg, fenhexamid and enestroburin 0.01 mg/kg, ametoctradin and fenaminstrobin 0.02 mg/kg, sulfoxaflor 0.05 mg/kg). 图 4 多反应监测总离子流图 Fig. 4 Total ion chromatograms of multiple reaction monitoring |
2.4 方法的线性范围和定量限
用基质空白溶液分别配制质量浓度为0.005、0.01、0.025、0.05、0.25、0.5、0.7、1.0、1.5、2.0和2.5 mg/L的基质匹配标准工作溶液 (丁苯吗啉为0.001、0.002、0.005、0.01、0.05、0.1、0.15、0.2、0.3、0.4和0.5 mg/L;氟啶虫胺腈为0.05、0.1、0.5、1.0、2.5、5.0、7.5、10、15、20和25 mg/L),按1.3节的条件测定。以各农药定量离子对的峰面积和对应的质量浓度绘制标准曲线,将回收率在70%~120%的最低添加水平确定为方法的定量限 (LOQ)。结果见表4。
|
|
表 4 十种农药的线性方程、线性范围、决定系数及定量限 Table 4 Linear equation, linear ranges, determination coefficients and LOQS of the 10 pesticides |
2.5 基质效应考察
用乙腈和黄瓜基质溶液,分别配制10倍定量限浓度的检测溶液,按1.3节的条件测定,根据2种检测液中目标物的色谱响应值,按公式ME = 100 × (Am–As)/As计算黄瓜的基质效应[24]。式中,ME为基质溶液中农药的基质效应,Am为基质溶液中农药的峰面积,As为纯溶剂中农药的峰面积。结果表明:烯肟菌酯、氟啶虫酰胺、唑嘧菌胺和烯肟菌胺的基质效应分别为5.3、6.1、9.5和12,为弱基质效应 (ME < 20%);氟吗啉、丁苯吗啉、氟吡菌酰胺和氟啶虫胺腈的基质效应分别为29、34、37和41,为中等程度基质效应 (20% < ME < 50%);而氟吡菌胺和环酰菌胺的基质效应分别为59和62,为强基质效应 ( ME > 50%)。因此,为提高结果的准确性,采用基质匹配标准溶液进行定量。
空白基质在目标物出峰处基本无干扰的情况下,10种农药的基质效应却呈现出很大的不同,说明基质效应受农药自身的影响较大。丁立平等[7]通过气相色谱-质谱仪测得烯肟菌胺在黄瓜中的基质效应不明显,本研究中烯肟菌胺的基质效应为12左右,与其结果基本一致。马琳等[16]的研究发现,氟吡菌胺在柑橘中为强基质效应,在番茄中为中等程度基质效应,在桃基质中为弱基质效应,说明基质溶液自身的组成对基质效应影响也很大。本研究中氟吡菌胺为强基质效应,可见,基质效应主要与农药自身和基质溶液的组成相关。
3 结论本研究建立了QuEChERS-气相色谱-串联质谱测定黄瓜中10种农药残留的检测方法。采用多反应监测模式,基质匹配标准曲线外标法定量,能够同时完成10种农药的定性和定量分析。该方法的准确度高,精密度好,能够满足中国及主要贸易国的最大残留限量要求,具有广泛的适用性。
| [1] |
王绪芬, 袁素芳. 瓜类蔬菜农药残留分布的特点及原因分析[J]. 安徽农业科学, 2014, 42(20): 6694. WANG X F, YUAN S F. Analysis on distribution characteristics and causes of cucurbit vegetable pesticide residues[J]. J Anhui Agric Sci, 2014, 42(20): 6694. DOI:10.3969/j.issn.0517-6611.2014.20.062 |
| [2] |
严智燕. 拜耳公司介绍新型杀菌剂 fluopyram[J]. 农药研究与应用, 2009, 13(5): 46. YAN Z Y. Bayer introduced a new fungicide fluopyram[J]. Agrochem Res Appl, 2009, 13(5): 46. |
| [3] |
食品安全国家标准 食品中农药最大残留限量: GB 2763—2016[S]. 北京: 中国标准出版社, 2017. National food safety standard-Maximum residue limits for pesticides in food: GB 2763—2016[S]. Beijing: Standards Press of China, 2017. |
| [4] |
Maximum residue limits (MRLs) list of agricultural chemicals in foods[EB/OL][2018-01-13]. http://www.m5.ws001.squarestart.ne.jp/foundation/note_en.html.
|
| [5] |
LIU Z J, ZHANG Z, ZHU G B, et al. Rapid screening of flonicamid residues in environmental and agricultural samples by a sensitive enzyme immunoassay[J]. Sci Total Environ, 2016, 551–552: 484-488. DOI:10.1016/j.scitotenv.2016.02.017 |
| [6] |
樊晓青, 占绣萍, 马琳. 分散固相净化-气相色谱法检测蔬菜中氟吡菌胺等15种农药残留[J]. 现代农药, 2014, 13(1): 41-43. FAN X Q, ZHAN X P, MA L. Determination of 15 pesticide residues including fluopicolide in vegetable by dispersive solid phase cleanup and GC[J]. Modern Agrochem, 2014, 13(1): 41-43. DOI:10.3969/j.issn.1671-5284.2014.01.012 |
| [7] |
丁立平, 方祥, 吴文凡. 固相萃取-气相色谱-质谱联用法测定蔬菜中烯肟菌胺的残留及其裂解机理[J]. 农药学学报, 2013, 15(6): 661-666. DING L P, FANG X, WU W F. Determination of fenaminstrobin in vegetables by gas chromatography-mass spectrometry with solid phase extraction and its fragmentation mechanism[J]. Chin J Pestic Sci, 2013, 15(6): 661-666. DOI:10.3969/j.issn.1008-7303.2013.06.10 |
| [8] |
丁立平, 蔡春平, 王丹红. 改进的 QuEChERS-气相色谱-质谱联用法测定蔬菜中的氟吗啉和烯酰吗啉残留[J]. 色谱, 2014, 32(8): 851-856. DING L P, CAI C P, WANG D H. Determination of flumorph and dimethomorph residues in vegetables by improved QuEChERS-gas chromatography-mass spectrometry[J]. Chin J Chromatogr, 2014, 32(8): 851-856. |
| [9] |
侯雪, 韩梅, 邱世婷, 等. 改进的 QuEChERS 气相色谱-串联质谱法测定草莓中21种杀菌剂残留[J]. 农药学学报, 2017, 19(1): 46-52. HOU X, HAN M, QIU S T, et al. Residues of 21 fungicides in Fragaria ananassa by modified QuEChERS and gas chromatography-tandem mass spectrometry [J]. Chin J Pestic Sci, 2017, 19(1): 46-52. DOI:10.16801/j.issn.1008-7303.2017.0007 |
| [10] |
李文卓, 钱圆, MATSUMOTO Haruna, et al. 气相色谱-串联质谱检测蔬菜中氟吡菌酰胺及其代谢物残留[J]. 农药学学报, 2016, 18(6): 759-764. LI W Z, QIAN Y, MATSUMOTO H, et al. Simultaneous determination of fluopyram and its metabolite in vegetables using gas chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2016, 18(6): 759-764. DOI:10.16801/j.issn.1008-7303.2016.0107 |
| [11] |
陈爱松, 崔银仓, 羌松, 等. 超高效液相色谱-串联质谱法测定哈密瓜和茄子中氟啶虫胺腈的残留量[J]. 食品工业科技, 2017, 38(20): 260-265. CHEN A S, CUI Y C, QIANG S, et al. Determination of sulfoxaflor residues in melon and eggplant by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Sci Technol Food Ind, 2017, 38(20): 260-265. DOI:10.13386/j.issn1002-0306.2017.20.046 |
| [12] |
陈靓, 井乐刚. 基于超高效液相色谱串联质谱法的番茄果实和土壤中氟吡菌胺残留测定[J]. 安全与环境学报, 2017, 17(1): 341-345. CHEN L, JING L G. Determination of the fluopicolide residue in the tomato fruit and the soil via UPLC-MS/MS[J]. J Saf Environ, 2017, 17(1): 341-345. DOI:10.13637/j.issn.1009-6094.2017.01.065 |
| [13] |
陈国, 孙亚米, 杨挺, 等. 液相色谱-串联质谱法测定黄瓜和苹果中氟啶虫酰胺及其代谢产物残留量[J]. 色谱, 2012, 30(6): 555-559. CHEN G, SUN Y M, YANG T, et al. Simultaneous determination of flonicamid and its metabolites in cucumbers and apples by liquid chromatography-tandem mass spectrometry[J]. Chin J Chromatogr, 2012, 30(6): 555-559. DOI:10.3724/SP.J.1123.2012.01034 |
| [14] |
CHAWLA S, PATEL D J, PATEL S H, et al. Behaviour and risk assessment of fluopyram and its metabolite in cucumber (Cucumis sativus) fruit and in soil
[J]. Environ Sci Pollut Res, 2018, 25(12): 11626-11634. DOI:10.1007/s11356-018-1439-y |
| [15] |
李蓉, 储大可, 张朋杰, 等. QuEChERS/HPLC-MS/MS 法测定黄瓜、菜心、葡萄、香蕉中 127 种农药残留[J]. 分析测试学报, 2015, 34(5): 502-511. LI R, CHU D K, ZHANG P J, et al. Determination of 127 pesticide residues in cucumber, flowering cabbage, grape and banana by QuEChERS method coupled with high performance liquid chromatography tandem mass spectrometry[J]. J Instrum Anal, 2015, 34(5): 502-511. DOI:10.3969/j.issn.1004-4957.2015.05.002 |
| [16] |
马琳, 陈建波, 赵莉, 等. 固相萃取-超高效液相色谱-串联质谱法同时测定果蔬中 6 种酰胺类农药残留量[J]. 色谱, 2015, 33(10): 1019-1025. MA L, CHEN J B, ZHAO L, et al. Determination of six amide pesticide residues in vegetables and fruits by solid phase extraction-ultra high performance liquid chromatography-tandem mass spectrometry[J]. Chin J Chromatogr, 2015, 33(10): 1019-1025. DOI:10.3724/SP.J.1123.2015.05013 |
| [17] |
ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and " dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. J AOAC Int, 2003, 86(2): 412-431. |
| [18] |
AOAC official method 2007.01 pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate[S]. Washington: AOAC International, 2007.
|
| [19] |
BS EN 15662: 2008. Foods of plant origin. Determination of pesticide residues using GC-MS and/or LC-MS/MS following acetonitrile extraction/partitioning and clean-up by dispersive SPE. QuEChERS-method[S]. BSI British Standards, 2008.
|
| [20] |
张爱芝, 王全林, 曹丽丽, 等. QuEChERS-超高效液相色谱-串联质谱法测定蔬菜中250种农药残留[J]. 色谱, 2016, 34(2): 158-164. ZHANG A Z, WANG Q L, CAO L L, et al. Determination of 250 pesticide residues in vegetables using QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J]. Chin J Chromatogr, 2016, 34(2): 158-164. DOI:10.3724/SP.J.1123.2015.09026 |
| [21] |
张雪莲, 张耀海, 焦必宁. 气相色谱-串联质谱法结合 QuEChERS 方法快速检测柑橘中 52 种农药多残留[J]. 食品科学, 2013, 34(6): 152-155. ZHANG X L, ZHANG Y H, JIAO B N. Rapid determination of 52 pesticide residues in citrus by gas chromatography-tandem mass spectrometry coupled with QuEChERS[J]. Food Sci, 2013, 34(6): 152-155. |
| [22] |
LIU X Q, LI Y F, MENG W T, et al. A multi-residue method for simultaneous determination of 74 pesticides in Chinese material medica using modified QuEChERS sample preparation procedure and gas chromatography tandem mass spectrometry[J]. J Chromatogr B: Analyt Technol Biomed Life Sci, 2016, 1015–1016: 1-12. DOI:10.1016/j.jchromb.2016.01.029 |
| [23] |
GIL GARCÍA M D, UCLÉS DUQUE S, LOZANO FERNÁNDEZ A B, et al. Multiresidue method for trace pesticide analysis in honeybee wax comb by GC-QqQ-MS[J]. Talanta, 2017, 163: 54-64. DOI:10.1016/j.talanta.2016.10.083 |
| [24] |
汪传炳, 黄秀根, 樊晓青, 等. 微量叠加定量法校准蔬菜农药残留色谱分析中的基质效应[J]. 上海农业学报, 2013, 29(4): 36-41. WANG C B, HUANG X G, FAN X Q, et al. Calibration of the matrix effects in vegetable pesticide residue gas chromatographic analysis by a quantitative micro addition method[J]. Acta Agriculturae Shanghai, 2013, 29(4): 36-41. DOI:10.3969/j.issn.1000-3924.2013.04.009 |
 2019, Vol. 21
2019, Vol. 21


