2. 农业农村部热带作物有害生物综合治理重点实验室,海口 571101;
3. 广西大学 农业环境与农产品安全重点实验室培育基地,南宁 530005
2. Key Laboratory of Integrated Pest Management of Tropical Crops, Ministry of Agriculture and Rural Affairs, Haikou 571101, China;
3. Key Laboratory of Agricultural Environment and Agricultural Products Safety, Guangxi University, Nanning 530005, China
黄胸蓟马Thrips hawaiiensis (Morgan) 是一种重要的蓟马类害虫[1-2],是中国香蕉作物上的重要害虫之一,主要聚集栖息于香蕉花蕾内部,以产卵和取食的方式在香蕉花瓣为害,严重影响香蕉果实的外观品质与经济价值,同时增加了防治成本[3],目前主要通过喷施化学药剂进行防治[4],但由于香蕉花蕾苞片的阻隔,喷雾施药难以接触到靶标害虫,使得防效不佳[5]。另外,大量喷施杀虫剂易导致抗药性、残留超标、环境污染以及杀伤天敌等问题[6-8]。因此,亟需探索防治香蕉黄胸蓟马的高效安全施药新技术。
注射施药技术主要依靠树体自身的蒸腾拉力或外力向树体内输入农药,可以有效防控病虫害的发生,已成功应用于现代果树及林木病虫害管理中[9]。注射施药不受降雨和干旱等自然环境条件的限制,且具有施药量准确、药剂利用率高、不污染环境和有利于保护天敌等优点[10]。螺虫乙酯 (结构式见图式1)是具有双向内吸传导性能的季酮酸类杀虫剂,广泛应用于防治蓟马、蚜虫、粉虱和螨类等害虫[11-12]。在笔者前期的研究中发现,与花蕾喷雾施药方式相比,花蕾注射螺虫乙酯对黄胸蓟马的防效更好[4]。吡虫啉 (结构式见图式1) 属新烟碱类内吸性神经毒剂,常用于防治蓟马、蚜虫和粉虱等害虫[13]。有报道指出,注射施用吡虫啉可以有效防治鳄梨蓟马Scirtothrips perseae (Nakahara)[14]和棕榈象甲Rhynchophorus ferrugineus 等害虫,且持效期较长[15]。但采用花蕾注射螺虫乙酯和吡虫啉后,药剂在香蕉果实中的消解动态及其残留尚未见报道。因此,本研究进一步评估了花蕾注射螺虫乙酯和吡虫啉对香蕉黄胸蓟马的防效,并采用超高效液相色谱-串联质谱法 (UPLC-MS/MS),分析了药剂在果实中的消解动态和最终残留量,以期为花蕾注射螺虫乙酯和吡虫啉在香蕉黄胸蓟马防治上的安全及科学使用提供依据。

|
图式1 螺虫乙酯 (A) 和吡虫啉 (B) 化学结构式 Scheme1 Structural formula of spirotetramat (A) and imidadoprid (B) |
1 材料与方法 1.1 试验材料 1.1.1 药剂与试剂
99.0%螺虫乙酯 (spirotetramat) 标准品 (德国拜耳作物科学公司);99.1%吡虫啉 (imidadoprid) 标准品 (索莱宝生物科技有限公司);22.4%螺虫乙酯悬浮剂 (SC) (拜耳中国作物科学有限公司);70%吡虫啉水分散粒剂 (WG) (安徽华星化工股份有限公司)。甲酸 (色谱纯)、N-丙基乙二胺吸附剂 (Bondesil-PSA) 和C18粉末 (美国Sigma-Aldrich公司);乙腈 (色谱纯,美国Fisher公司);试验用水均为超纯水。其余试剂均为国产市售分析纯。
1.1.2 主要仪器设备TQS-Micro液-质联用仪 (Waters公司产品);AUTOGIZER-701A高速匀浆机 (Tomtec, USA);EB-280-12电子天平 (日本岛津公司);Anke TDL-40B离心机 (上海安亭科学仪器厂);QL-901涡旋混合器 (江苏海门其林医用仪器厂);Milli-Q超纯水仪 (美国Millipore公司);注射施药器 (深圳诺普信农化股份有限公司)。
1.2 试验方法 1.2.1 试验地概况田间试验于2018年4—10月在中国海南省临高县五指山 (19.34° N, 109.53° E) 香蕉基地进行,种植品种为巴西蕉,种植面积约33.3 hm2,选择未施过药的香蕉园进行试验,正常水肥管理。
1.2.2 花蕾注射施药对黄胸蓟马的田间防效试验参照《农药田间药效试验准则 (二)》[16]中关于钻蛀性害虫的农药田间药效试验方法进行。施药前在香蕉园内选择已抽蕾且蕾苞没有弯垂的蕉树,采用随机区组设计试验小区,每处理4次重复,每小区10株香蕉树。采用22.4%螺虫乙酯SC和70%吡虫啉WG分别按有效成分0.12和0.18 g/株的剂量,使用带有专用香蕉花蕾注射器的电动喷雾器,于距离香蕉花蕾柄端5 cm处将注射器45° 倾斜角向上插入花蕾组织内施药1次,每株注射药液量250 mL。以注射清水为对照。
1.2.3 防效调查方法于香蕉断蕾时调查结果:每株香蕉从上往下调查7梳果,每梳调查10个果指,记录每个果指上因受蓟马为害而产生的黑斑数。分别按 (1) 式和 (2) 式计算果指受害率 (R) 和防效 (E)[4]。采用邓肯氏新复极差法对试验数据进行分析。
| $ R/{\text\%}= {N_{\rm{a}}}/{N_0} \times 100 $ | (1) |
| $ E/{\text\%} = \left( {{N_{\rm{c}}} - {N_{\rm{t}}}} \right)/{N_{\rm{c}}} \times 100 $ | (2) |
式 (1) 和 (2) 中,R为果指受害率;Na为受害果指数;N0为总果指数;E为防效;Nc为对照区黑斑数;Nt为处理区黑斑数。
1.2.4 消解动态与最终残留试验参照《农作物中农药残留试验准则》[17]中田间试验设计要求,选择从未使用过本试验所分析药剂的田块进行。22.4%螺虫乙酯SC和70%吡虫啉WG分别按有效成分0.12和0.18 g/株的剂量,通过花蕾注射施药1次,每株注射药液量250 mL。试验小区随机区组排列,每小区5株香蕉树,每处理4次重复,以注射清水为对照。分别于花蕾注射施药后5、14、21、28、35 d (施药后5 d香蕉处于幼果初期) 定株定梳采集香蕉果实进行消解动态分析;于施药后95 d采集香蕉成熟果实进行最终残留量检测。每小区采1株,每梳采集2个果指,将3个重复的香蕉果实全果匀浆混匀后,四分法留样100 g,于–20 ℃冰箱保存,待测。
1.2.5 标准溶液的配制及标准曲线绘制准确称取适量螺虫乙酯和吡虫啉标准品,用乙腈稀释配制成质量浓度为1.0 mg/L的标准溶液,于4.0 ℃冰箱保存,备用。将标准溶液用空白基质溶液稀释成0.005~0.2 mg/L的基质匹配标准工作溶液,现配现用。
1.2.6 样品前处理香蕉果实前处理方法[18-19]:分别称取10 g样品于50 mL烧杯中,加入20 mL乙腈,匀浆1 min。倒入装有4 g氯化钠和1 g无水硫酸镁的50 mL离心管中,涡旋1 min,于8 000 r/min下离心6 min。取1 mL上清液于2 mL离心管中,依次加入30 mg PSA、30 mg C18和0.15 g无水硫酸镁,涡旋1 min,于10 000 r/min下离心6 min。取上清液,过0.22 μm滤膜,待测。
1.2.7 检测条件色谱条件:ACQUITY_UPLCTM BEH C18液相色谱柱 (2.1 mm × 50 mm,1.7 μm);柱温35 ℃;进样量5 μL;流动相梯度洗脱条件见表1。
|
|
表 1 螺虫乙酯和吡虫啉梯度洗脱条件 Table 1 Gradient elution conditions for spirotetramat and imidacloprid |
质谱条件:离子源为ESI (+);正离子扫描模式;喷雾电压3 000 V;离子源温度150 ℃;脱溶剂气温度500 ℃;脱溶剂气流量1 000 L/h;锥孔气体流量150 L/h。多反应监测模式 (MRM)。通过保留时间和离子对信息比较进行定性分析,以母离子和响应值最高的子离子进行定量分析。螺虫乙酯监测母离子为m/z 375,子离子为m/z 217,定量离子为m/z 303.5;锥孔电压20 V;碰撞能量 (CE) 分别为5和20 V。吡虫啉监测母离子为m/z 256.3,子离子为m/z 175.2,定量离子为m/z 209.2;锥孔电压20 V;碰撞能量分别为15和20 V。螺虫乙酯和吡虫啉特征离子色谱图见图1。

|
图 1 螺虫乙酯和吡虫啉特征离子MRM色谱图 Fig. 1 The MRM chromatograms of spirotetramat and imidacloprid characteristic ions |
1.2.8 添加回收试验
量取基质匹配标准工作溶液,按1.2.7节的条件测定。以标准工作溶液的质量浓度为横坐标,以监测离子峰面积为纵坐标,制作标准曲线。
在空白香蕉果实样品中分别添加0.02、0.05和0.1 mg/kg 3个水平的标准工作溶液,按1.2.6节的前处理方法进行提取、净化,按1.2.7节的方法测定。每个添加水平重复5次。计算回收率及相对标准偏差。
2 结果与分析 2.1 花蕾注射螺虫乙酯和吡虫啉对黄胸蓟马的防效由表2可知:花蕾注射0.12 g/株22.4%螺虫乙酯SC对黄胸蓟马的防效为89%,果指受害率为25%;注射70%吡虫啉WG 0.18 g/株对黄胸蓟马的防效为86%,果指受害率为28%。表明花蕾注射螺虫乙酯和吡虫啉对黄胸蓟马均有较好的防效,且两者间无显著差异。
|
|
表 2 花蕾注射螺虫乙酯和吡虫啉对黄胸蓟马的防效 Table 2 Control efficacy of spirotetramat and imidacloprid against Thrips hawaiiensis using flower injection method |
2.2 分析方法验证
结果表明:在0.005~0.2 mg/L范围内,螺虫乙酯和吡虫啉的质量浓度与相应的峰面积间呈良好的线性关系。螺虫乙酯标准曲线方程为y = 48.36x + 0.45,r = 0.999 1;吡虫啉的标准曲线方程为y = 15.53x + 23.97,r = 0.999 8。添加回收试验结果表明:在0.02~0.1 mg/kg添加水平下,螺虫乙酯和吡虫啉的平均回收率在83%~105%之间,相对标准偏差 (RSD) 在0.8%~5.2%(n = 5)之间,符合农药残留检测的要求[17]。该方法准确性和重复性较好,按信/噪比等于10计算得螺虫乙酯和吡虫啉在香蕉果实中的定量限 (LOQ) 分别为0.004和0.003 mg/kg。
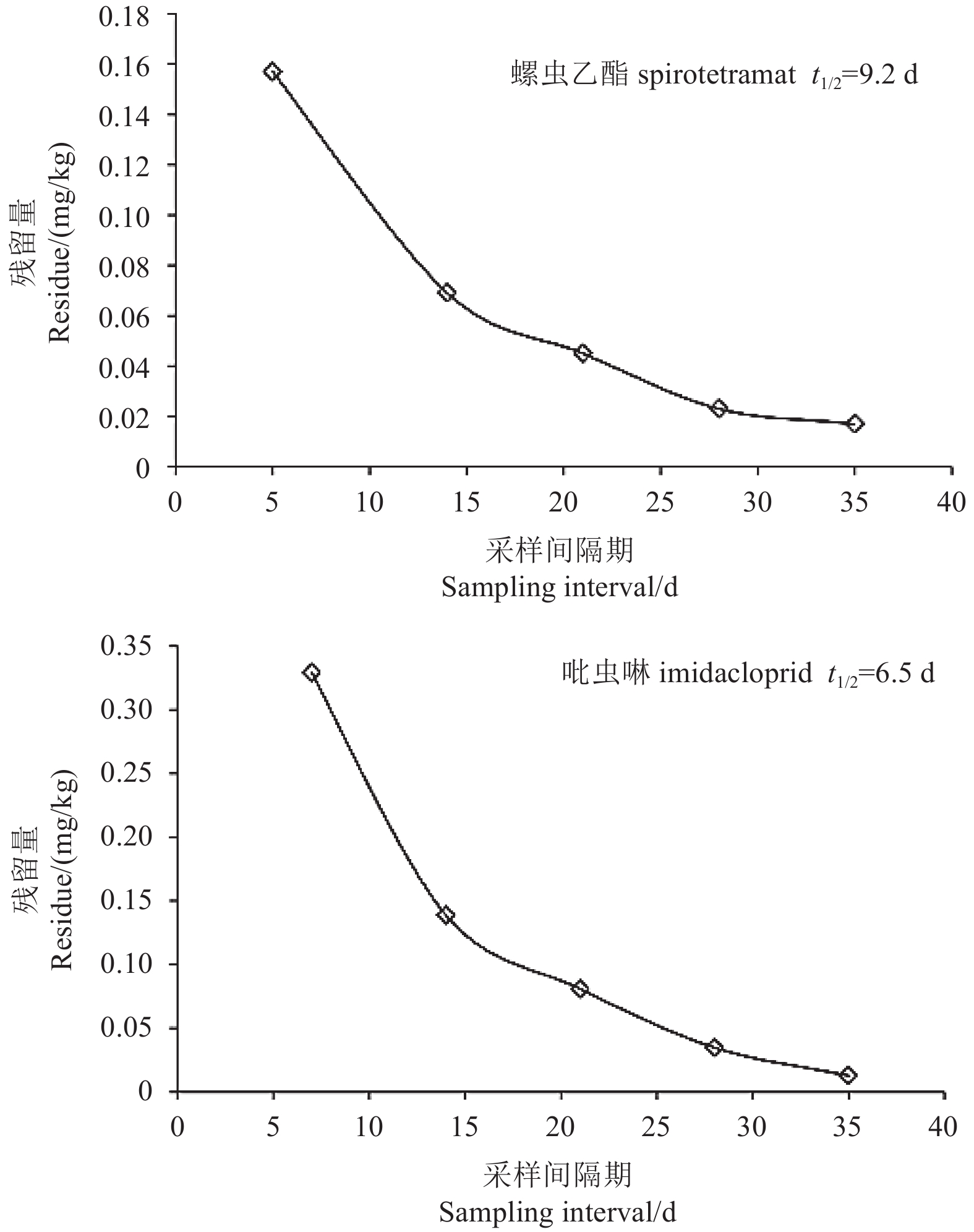
2.3 花蕾注射螺虫乙酯和吡虫啉在香蕉果实中的消解动态消解动态结果 (表3和图2) 表明:螺虫乙酯和吡虫啉在香蕉果实中的含量均随时间的延长而逐渐降低。其中,螺虫乙酯的半衰期为9.2 d,施药后35 d在香蕉果实中的含量为0.017 mg/kg;吡虫啉的半衰期为6.5 d,施药后35 d在香蕉果实中的含量为0.013 mg/kg。表明螺虫乙酯和吡虫啉均可被香蕉花蕾吸收并传导至香蕉果实中,且在药后5~35 d果实中均能检测到螺虫乙酯和吡虫啉的残留量,但其含量均低于国家标准中规定的2种药剂在瓜果上的MRL值 (0.2 mg/kg和0.5 mg/kg)[20]。
|
|
表 3 花蕾注射螺虫乙酯和吡虫啉后在香蕉果实中的含量 Table 3 Content of spirotetramat and imidacloprid in banana fruit after flower injection |
|
图 2 螺虫乙酯和吡虫啉在香蕉果实中的消解动态曲线 Fig. 2 Degradation dynamics curve of spirotetramat and imidacloprid in banana fruit |
2.4 花蕾注射螺虫乙酯和吡虫啉在香蕉果实中的最终残留量
试验结果表明:于香蕉现蕾初期采用22.4%螺虫乙酯SC和70%吡虫啉WG分别按有效成分0.12和0.18 g/株注射香蕉花蕾,施药1次,于施药后95 d香蕉成熟果实中均未检测到螺虫乙酯和吡虫啉。
3 结论与讨论本研究表明,花蕾注射螺虫乙酯和吡虫啉对黄胸蓟马均有较好的防效,且螺虫乙酯作为昆虫乙酰辅酶A羧化酶抑制剂,与目前香蕉园内广泛应用的作用于烟碱乙酰胆碱 (nACh) 受体杀虫剂吡虫啉的作用机制不同[11, 21],因此,可推荐采用花蕾注射方式轮换使用螺虫乙酯和吡虫啉对香蕉园内黄胸蓟马进行防治。
目前,人们常采用花蕾喷雾方式进行香蕉园内黄胸蓟马的防治,但由于花蕾喷雾防治效果不佳,且在香蕉生育期内需要多次大量喷施药剂,不仅费时费力,还会增加防治成本。注射施药作为一种精准的施药技术已成功应用于果树及林木病虫害管理中,且具有省时、省工和省药等特点。本研究表明,于香蕉现蕾初期,分别按有效成分0.12和0.18 g/株通过花蕾注射22.4%螺虫乙酯SC和70%吡虫啉WG,施药1次,对黄胸蓟马的防效分别为89%和86%,与前人采用花蕾注射或假茎注射70%吡虫啉WG或22.4%螺虫乙酯SC防治黄胸蓟马的效果基本一致[4, 22-23]。
消解动态及残留量检测对于螺虫乙酯和吡虫啉在香蕉园的安全使用及风险评估具有重要意义。丁丹等[24]研究表明,长沙、广州和贵州3地柑橘上螺虫乙酯的半衰期分别1.83、1.74和5.83 d;吴育佳等[25]研究表明,湖南、浙江和广东3地黄瓜上螺虫乙酯的半衰期分别为2.67、8.16和8.82 d;刘冰洁等[26]研究表明,北京和安徽2地花椰菜上吡虫啉的半衰期均为2.6 d。本研究中,在海南采用花蕾注射施药,香蕉果实中螺虫乙酯的半衰期为9.2 d,吡虫啉的半衰期较短,为6.5 d,这可能是由于施药方式、作物及环境条件的不同导致药剂消解速率的不同。但研究均表明螺虫乙酯和吡虫啉属于易消解农药[27],且不易形成持久性残留。此外,本研究消解动态结果表明,注射施药后15 d,香蕉果实中螺虫乙酯和吡虫啉的含量均在0.05 mg/kg以上,这也验证了本研究采用花蕾注射施药对黄胸蓟马具有较好的防效。施药后5~35 d果实中螺虫乙酯和吡虫啉的含量均低于国家标准中规定的其在瓜果上的MRL值 (0.2 mg/kg,0.5 mg/kg)[20],表明螺虫乙酯和吡虫啉分别按有效成分0.12和0.18 g/株的剂量采用花蕾注射在香蕉上使用是安全的。
本研究还初步评估了22.4%螺虫乙酯SC和70%吡虫啉WG分别按有效成分0.12和0.18 g/株注射施药1次,施药后95 d处于收获期的香蕉果实中螺虫乙酯和吡虫啉母体的残留量,结果也均低于中国国家标准中螺虫乙酯和吡虫啉在瓜果类上的MRL值。螺虫乙酯在环境中主要有BYI08330-烯醇糖苷 (S1)、BYI08330-醇酮(S2)、BYI08330-烯醇 (S3) 和BYI08330-一羟基 (S4) 4种代谢产物。黄玉南等[28]研究表明,螺虫乙酯及其代谢产物在猕猴桃和土壤中迅速降解为S2和S3,均为易降解农药;徐诚等[29]研究表明,螺虫乙酯及其4种代谢产物在柑橘中的残留量均低于国家标准中规定的MRL值;丁丹等[23]研究表明,柑橘中螺虫乙酯代谢物以S3为主,S1与S2有少量检出。而吡虫啉在植物体内的代谢研究已有大量报道,主要代谢产物有5-羟基吡虫啉、4,5-二羟基吡虫啉、吡虫啉脲、烯式吡虫啉和6-氯吡啶3-羧酸等[30]。因此,在对香蕉中的螺虫乙酯和吡虫啉进行膳食风险评估时,应包括这些代谢物的残留,以便更全面地为药剂的安全使用提供科学依据。
综上所述,本研究进一步评估了花蕾注射法施用螺虫乙酯和吡虫啉对黄胸蓟马的防效,并初步评估了其在香蕉园使用的安全性,为香蕉园内黄胸蓟马的防治提供了一种新型施药方法。
| [1] |
GOLDARAZENA A. First record of Thrips hawaiiensis (Morgan, 1913) (Thysanoptera: Thripidae), an Asian pest thrips in Spain
[J]. EPPO Bull, 2011, 41(2): 170-173. DOI:10.1111/epp.2011.41.issue-2 |
| [2] |
MURAI T. Development and reproductive capacity of Thrips hawaiiensis (Thysanoptera: Thripidae) and its potential as a major pest
[J]. Bull Entomol Res, 2001, 91(3): 193-198. |
| [3] |
付步礼, 李强, 夏西亚, 等. 对乙基多杀菌素中度抗性降低黄胸蓟马的适合度[J]. 昆虫学报, 2017, 60(2): 180-188. FU B L, LI Q, XIA X Y, et al. Moderate resistance to spinetoram reduces the fitness of Thrips hawaiiensis (Thysanoptera: Thripidae) [J]. Acta Entomologica Sinica, 2017, 60(2): 180-188. |
| [4] |
付步礼, 唐良德, 邱海燕, 等. 黄胸蓟马高效低毒防治新型药剂的筛选[J]. 果树学报, 2016, 33(4): 473-481. FU B L, TANG L D, QIU H Y, et al. Screening of high effect and low toxicity insecticides for controlling Thrips hawaiiensis (Morgan) [J]. J Fruit Sci, 2016, 33(4): 473-481. |
| [5] |
李强, 付步礼, 夏西亚, 等. 溴氰虫酰胺对香蕉田间黄胸蓟马的药效及其残留规律[J]. 农药学学报, 2017, 19(6): 723-728. LI Q, FU B L, XIA X Y, et al. Efficiency of cyantraniliprole on Thrips hawaiiensis and its residue behaviour in banana field [J]. Chin J Pestic Sci, 2017, 19(6): 723-728. |
| [6] |
MEYERDIRK D E, FRENCH J V, HART W G. Citrus mealybug: effect of pesticide residues on adults of the natural enemy complex[J]. J Econ Entomol, 1979, 72(6): 893-895. DOI:10.1093/jee/72.6.893 |
| [7] |
KOHJIMOTO T, NAGAOKA H, TAKAGI Y, et al. Side-effects of pesticide residues on strawberry leaves against natural enemies[J]. Annu Rep Kanto-Tosan Plant Prot Soc, 2004, 51: 145-149. |
| [8] |
KUMAR A R, RAHMAN V J, KUMAR D V, et al. Utilization of the bacterium, Pseudomonas putida as a potential biocontrol agent against red spider mite, Oligonychus coffeae (Acari: Tetranychidae) infesting tea
[J]. J Plantat Crops, 2011, 39(1): 236-238. |
| [9] |
王慧瑜, 赵玉安, 贾耀军. 树干注射施药技术研究概况[J]. 农药学学报, 2005, 7(2): 104-108. WANG H Y, ZHAO Y A, JIA Y J. Trunk injection techniques with chemicals[J]. Chin J Pestic Sci, 2005, 7(2): 104-108. DOI:10.3321/j.issn:1008-7303.2005.02.002 |
| [10] |
董崭, 袁会珠, 翟明利, 等. 树干注射吡虫啉、印楝素和乙酰甲胺磷防治槐尺蠖的效果比较[J]. 植物保护, 2008, 34(4): 145-148. DONG C, YUAN H Z, ZHAI M L, et al. The control efficiencies of imidacloprid, azadirachtin and acephate against Sermothisa cinerearia were compared by trunk injection [J]. Plant Prot, 2008, 34(4): 145-148. DOI:10.3969/j.issn.0529-1542.2008.04.036 |
| [11] |
PENG Z K, ZHENG H X, XIE W, et al. Field resistance monitoring of the immature stages of the whitefly Bemisia tabaci to spirotetramat in China
[J]. Crop Prot, 2017, 98: 243-247. DOI:10.1016/j.cropro.2017.04.009 |
| [12] |
HE J T, ZHOU L J, YAO Q, et al. Greenhouse and field-based studies on the distribution of dimethoate in cotton and its effect on Tetranychus urticae by drip irrigation
[J]. Pest Manag Sci, 2018, 74(1): 225-233. DOI:10.1002/ps.4704 |
| [13] |
BAI D L, LUMMIS S C R, LEICHT W, et al. Actions of imidacloprid and a related nitromethylene on cholinergic receptors of an identified insect motor neurone[J]. Pestic Sci, 1991, 33(2): 197-204. DOI:10.1002/ps.v33:2 |
| [14] |
BYRNE F J, URENA A A, ROBINSON L J, et al. Evaluation of neonicotinoid, organophosphate and avermectin trunk injections for the management of avocado thrips in California avocado groves[J]. Pest Manag Sci, 2012, 68(5): 811-817. DOI:10.1002/ps.v68.5 |
| [15] |
DEMBILIÓ, RIBA J M, GAMÓN M, et al. Mobility and efficacy of abamectin and imidacloprid against Rhynchophorus ferrugineus in Phoenix canariensis by different application methods.
[J]. Pest Manag Sci, 2015, 71(8): 1091-1098. DOI:10.1002/ps.2015.71.issue-8 |
| [16] |
农药田间药效试验准则(二): GB/T 17980[S]. 北京: 中国标准出版社, 2004. Pesticide guidelines for the field efficacy trials (Ⅱ): GB/T 17980[S]. Beingjing: Standards Press of China, 2004. |
| [17] |
农药残留试验准则: NY /T 788—2004[S]. 北京: 中国农业出版社, 2004. Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agriculture Press, 2004. |
| [18] |
MOHAPATRA S, DEEPA M, LEKHA S, et al. Residue dynamics of spirotetramat and imidacloprid in/on mango and soil[J]. Bull Environ Contam Toxicol, 2012, 89(4): 862-867. DOI:10.1007/s00128-012-0762-0 |
| [19] |
MOHAPATRA S, KUMAR S, PRAKASH G S. Residue evaluation of imidacloprid, spirotetramat, and spirotetramat-enol in/on grapes (Vitis vinifera L.) and soil
[J]. Environ Monit Assess, 2015, 187(10): 1-12. |
| [20] |
食品安全国家标准 食品中农药最大残留限量: GB 2763—2014[S]. 北京:中国农业出版社, 2014. National food safety standard, maximum residue limits for pesticides in food: GB 2763—2014[S]. Beijing: China agriculture press, 2014. |
| [21] |
MARCIC D, PETRONIJEVIC S, DROBNJAKOVIC T, et al. The effects of spirotetramat on life history traits and population growth of Tetranychus urticae (Acari: Tetranychidae)
[J]. Exp Appl Acarol, 2012, 56(2): 113-122. DOI:10.1007/s10493-011-9500-2 |
| [22] |
尹可锁, 杨韶松, 郑泗军, 等. 吡虫啉不同施药方式防控香蕉蓟马的研究[J]. 中国南方果树, 2017, 46(2): 111-113. YIN K S, YANG S S, ZHENG S J, et al. Study on the control efficacy of imidacloprid aganist banana thrips by different application methods[J]. South China fruits, 2017, 46(2): 111-113. |
| [23] |
尹可锁, 郑泗军, 杨韶松, 等. 利用假茎注射吡虫啉防控香蕉蓟马[J]. 植物保护, 2016, 42(5): 238-241. YIN K S, ZHENG S J, YANG S S, et al. Control of thrips by injecting imidacloprid into banana pseudostem[J]. Plant Prot, 2016, 42(5): 238-241. DOI:10.3969/j.issn.0529-1542.2016.05.044 |
| [24] |
丁丹, 杨仁斌, 雷鸣, 等. 螺虫乙酯及其四种代谢产物在柑桔中的消解残留规律研究[J]. 中国南方果树, 2018, 47(3): 41-45. DING D, YANG R B, LEI M, et al. Study on degradation and residual regulation of spirotetramat and its 4 metabolites in citrus[J]. South China Fruits, 2018, 47(3): 41-45. |
| [25] |
吴育佳, 杨仁斌, 聂红英. 螺虫乙酯在黄瓜及其土壤中残留量检测方法及残留规律研究[J]. 中国农学通报, 2015, 31(35): 110-115. WU Y J, YANG R B, NIE H Y. Study on residual detection method and residue rule of spirotetramat in cucumber and soil[J]. Chin Agric Sci Bull, 2015, 31(35): 110-115. DOI:10.11924/j.issn.1000-6850.casb15070108 |
| [26] |
刘冰洁, 贾春虹, 陈莉, 等. QuEChERS-超高效液相色谱-串联质谱法测定吡虫啉在花椰菜和土壤中的残留[J]. 食品安全质量检测学报, 2018, 9(6): 1254-1260. LIU B J, JIA C H, CHEN L, et al. Determination of imidacloprid residues in cauliflower and soil by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J]. J Food Saf Qual, 2018, 9(6): 1254-1260. DOI:10.3969/j.issn.2095-0381.2018.06.006 |
| [27] |
FAO. Pesticides residues in food 2008. Joint FAO/WHO Meeting on Pesticide Residues[J]. FAO Plant Production & Protection Paper, 2009. |
| [28] |
黄玉南, 乔成奎, 庞涛, 等. 螺虫乙酯及其代谢产物在猕猴桃中的残留消解动态[J]. 现代食品科技, 2018, 34(12): 221-227. HUANG Y N, QIAO C K, PANG T, et al. Residue and dissipation of spirotetramat and its metabolites in kiwifruits and soil[J]. Modern Food Science and Technology, 2018, 34(12): 221-227. |
| [29] |
徐诚, 张圣虎, 张毅, 等. 超高效液相色谱-三重四极杆-离子阱质谱法检测柑橘中螺虫乙酯及其 4 种代谢产物[J]. 色谱, 2018, 36(4): 339-344. XU C, ZHANG S H, ZHANG Y, et al. Determination of spirotetramat and its four metabolites in citrus by ultra-high performance liquid chromatographytriple quadrupole-ion trap mass spectrometry[J]. Chin J Chromatogr, 2018, 36(4): 339-344. |
| [30] |
范银君, 史雪岩, 高希武. 新烟碱类杀虫剂吡虫啉和噻虫嗪的代谢研究进展[J]. 农药学学报, 2012, 14(6): 587-596. FAN Y J, SHI X Y, GAO X W. Research progresses on the metabolism of neonicotinoids imidacloprid and thiamethoxam[J]. Chin J Pestic Sci, 2012, 14(6): 587-596. DOI:10.3969/j.issn.1008-7303.2012.06.01 |
 2019, Vol. 21
2019, Vol. 21


