2. 湖州师范学院 生命科学学院,浙江 湖州 313000;
3. 山东博锐检验检测有限公司,山东 淄博 255000
2. College of Life Sciences, Huzhou University, Huzhou 313000, Zhejiang Province, China;
3. Shandong Burey Inspection Company Limited, Zibo 255000, Shandong Province, China
竹红菌素 (Hypocrellin) 是一类能够从竹黄菌Shiraia bambuscola与竹红菌Hypocrella bambusae天然子座中提取的具有光动力学活性的苝醌类化合物[1]。目前,已经发现的竹红菌素主要有竹红菌甲素 (Hypocrellin A,简称HA)、竹红菌乙素 (Hypocrellin B)、竹红菌丙素 (Hypocrellin C) 和竹红菌丁素 (Hypocrellin D),其中在竹子中发现的竹红菌素中,HA的含量最高,达95%以上[2]。对于HA光敏作用的研究始于中国,万象义等[3]最先从竹红菌素中分离得到HA,开启了将其作为光治疗药物的研究历史。HA主要用作医学上光动力学疗法 (Photodynamic therapy,简称PDT) 中的光敏剂[4],对皮肤疾病[5-7]、恶性肿瘤[8]及艾滋病等[9]均有较好的光敏治疗效果。光敏剂在光和氧的存在下产生活性氧 (ROS),并利用其攻击生物体达到损害细胞的目的。光反应类型有Type I和Type II 2种,其中在Type I中产生的活性氧主要有超氧阴离子自由基 (
目前,绿色环保的生物农药越来越多地引起了人们的关注和重视。由于HA可通过产生活性氧自由基发挥杀虫抑菌作用[12],因此可能开发成一种新型、高效、低毒的生物农药。笔者前期的试验结果表明,HA对18种重要农林病原菌均具有明显抑制活性,其中能够较明显地抑制番茄灰霉病菌Botrytis cinerea,在50 mg/L下抑制率达65.15%[13]。在此基础上,笔者进一步研究了HA的光反应类型、活性氧的产量与其对番茄灰霉病菌抑制率的相关性,进而明确了HA抑制番茄灰霉病菌的关键因子,旨在为研究HA的作用机理奠定基础,并为其应用提供理论依据。
1 材料与方法 1.1 供试菌株番茄灰霉病菌Botrytis cinerea,由浙江农林大学生物农药高效制备技术国家地方联合工程实验室提供。
1.2 试剂N,N-二甲基-4-亚硝基苯胺,分析纯,购自Sigma公司;竹红菌甲素 (HA) 标准品,纯度97%,由上海诗丹德生物技术有限公司提供;组氨酸、色氨酸、甘露醇、抗坏血酸、核黄素、丙酮、硫酸亚铁铵和双氧水,分析纯,购自国药集团。
1.3 培养基马铃薯葡萄糖琼脂 (PDA) 培养基,参照文献方法[14] 制备;PD培养液:PDA培养基不加琼脂即得。
1.4 试验方法 1.4.1 供试菌株培养将番茄灰霉病菌菌种接于PDA培养基上,置于26 ℃恒温培养箱中,自然光条件下培养5 d。
1.4.2 光反应类型测定采用活性氧淬灭法[15]测定光反应类型。分别向PDA培养基中加入甘露醇、抗坏血酸和组氨酸作为 ·OH、
分别用无菌水配制0.1 mol/L的淬灭剂水溶液和400 mg/L的HA水溶液,各取1 mL加入到8 mL灭菌PDA平板中,混合均匀,得到含40 mg/L HA和0.01 mol/L淬灭剂的HA-淬灭剂-PDA平板,作为处理组。以无菌水代替HA溶液,得到含0.01 mol/L淬灭剂-PDA平板,作为对照组。用无菌打孔器在培养好的番茄灰霉病菌平板同一圆周上取直径为4 mm的菌饼,接入处理组与对照组平板中,分别置于26 ℃黑暗和光照度为12 000 lx下培养4 d。以十字交叉法测定培养后的菌落直径,重复3次。计算抑制率[12],根据加入不同淬灭剂后抑制率的差异大小判断光反应类型。
1.4.3 活性氧对番茄灰霉病菌的抑制作用测定 1.4.3.1 1O2的抑制作用测定1) HA对番茄灰霉病菌的抑制率测定
用无菌水将HA标准品配制成50、100、200、300和400 mg/L的水溶液,分别取1 mL加入到含有9 mL灭菌PDA平板中,混合均匀,得到5、10、20、30和40 mg/L的HA-PDA平板,作为处理组;以无菌水代替HA溶液得到的PDA平板作为对照组。抑制率测定与计算方法同1.4.2节。
2) 1O2浓度测定
参照Guo等[18]的方法并加以改进。分别取1 mL质量浓度为50、100、200、300和400 mg/L的HA水溶液、1 mL 0.1 mol/L的 1O2淬灭剂组氨酸水溶液和1 mL 10 mmol/L的 1O2捕捉剂N,N-二甲基-4-亚硝基苯胺水溶液,用去离子水定容至10 mL,混合均匀得到处理组样品。以无菌水代替HA溶液,获得对照组样品。将处理组与对照组样品均置于光照度为12 000 lx条件下,26 ℃恒温处理4 d后,稀释到合适浓度,测定440 nm处捕捉剂的吸光度 (A440),重复3次。计算 1O2的浓度。
3) 1O2浓度与抑制率相关性分析
利用SPSS软件对12 000 lx光照条件下不同质量浓度HA的抑制率与 1O2浓度进行相关性分析。
1.4.3.2 ·OH对番茄灰霉病菌的抑制作用测定1) ·OH抑制率测定
参考涂欢等[19]的方法,由芬顿试剂法反应式:Fe2+ + H2O2 → ·OH + OH– + Fe3+,可知产生的 ·OH浓度与Fe2+浓度成正比,故本研究中产生的·OH浓度按照Fe2+浓度计算。选用Fe (NH4)2(SO4)2为Fe2+ 来源,分别配制浓度为1 000、500、100、10和5 mmol/L的Fe(NH4)2(SO4)2水溶液和H2O2水溶液,用0.45 μm滤膜过滤除菌。取2种溶液各3 mL,加入装有24 mL灭菌PD培养基的三角瓶中,迅速取5个番茄灰霉病菌菌饼加入其中,摇匀记为处理组。对照组24 h后向三角瓶中加入菌饼,其他操作同处理组,由于活性氧自由基歧化速率快,24 h后反应体系中已不存在 ·OH,从而消除了活性氧对抑菌作用的影响。将处理组和对照组在26 ℃、150 r/min下振荡培养5 d。参照李学梅等[20]方法,将不同处理组的发酵液取出,于1 000 r/min条件下,离心10 min,弃去上清液,取底部菌丝用95%乙醇进行脱水处理,105 ℃烘干至恒重,称量菌丝干重,重复3次,计算 ·OH对番茄灰霉病菌的抑制率。
2) ·OH浓度与抑制率相关性分析
使用SPSS软件对不同浓度的·OH与抑制率进行相关性分析。
1.4.3.31)
参考周雪莹、李锦全等[21-22]方法并加以改进。根据核黄素光化学反应原理,核黄素浓度与
2)
利用SPSS软件对不同浓度的
在进行了1O2、·OH、
分别选用甘露醇和抗坏血酸为Type I淬灭剂,组氨酸为Type II淬灭剂,在光照 (12 000 lx) 和黑暗条件下测定其对番茄灰霉病菌的抑制率,结果见表1。
|
|
表 1 光照 (12 000 lx) 和黑暗条件下活性氧淬灭剂对HA抑制番茄灰霉病菌抑制率的影响 Table 1 Effect of ROS scavengers on inhibition rate of HA against B. cinerea under illumination of 12 000 lx and dark |
由表1数据可以看出,加入与不加入淬灭剂,光照条件下HA对番茄灰霉病菌的抑制率均明显高于黑暗条件下,说明光照对HA发挥抑菌作用具有重要影响。在光照条件下,加入淬灭剂后HA的抑制率比不加淬灭剂的显著降低,但在黑暗条件下,是否加入淬灭剂其抑制率均无显著差异。可见,HA利用在光照条件下产生的活性氧自由基来抑制番茄灰霉病菌。
对光照条件下各处理组的抑制率进行差异性分析。结果表明,添加3种不同的淬灭剂均能显著降低HA对番茄灰霉病菌的抑制率 (P < 0.05),特别是添加组氨酸时,其抑制率与对照组的差异最大。由于光反应类型Type I主要产生
1) HA对番茄灰霉病菌的抑制作用及 1O2浓度
测定结果 (表2) 表明:在12 000 lx光照度下,不同质量浓度的HA对番茄灰霉病菌均有明显的抑制作用,且不同质量浓度的抑制率间差异显著 (P < 0.05);同时,不同条件下 1O2的浓度均较高,且随着HA质量浓度的升高,生成的 1O2的浓度均呈显著增加 (P < 0.05)。
|
|
表 2 12 000 lx光照度下不同质量浓度HA对番茄灰霉病菌的抑制率及 1O2浓度 Table 2 Inhibition rate against B. cinerea and the concentration of 1O2 with HA at different concentrations under 12 000 lx illumination |
2) 1O2浓度与抑制率相关性
对抑制率 (Y) 与 1O2浓度 (X) 进行相关性分析的结果见图1。可见,1O2浓度和其抑制率之间呈极显著的线性正相关,回归方程为Y = 0.703X + 0.117,R2 = 0.986。由此可知,1O2在HA抑制番茄灰霉病菌过程中发挥着极显著的作用,是关键抑菌因子。
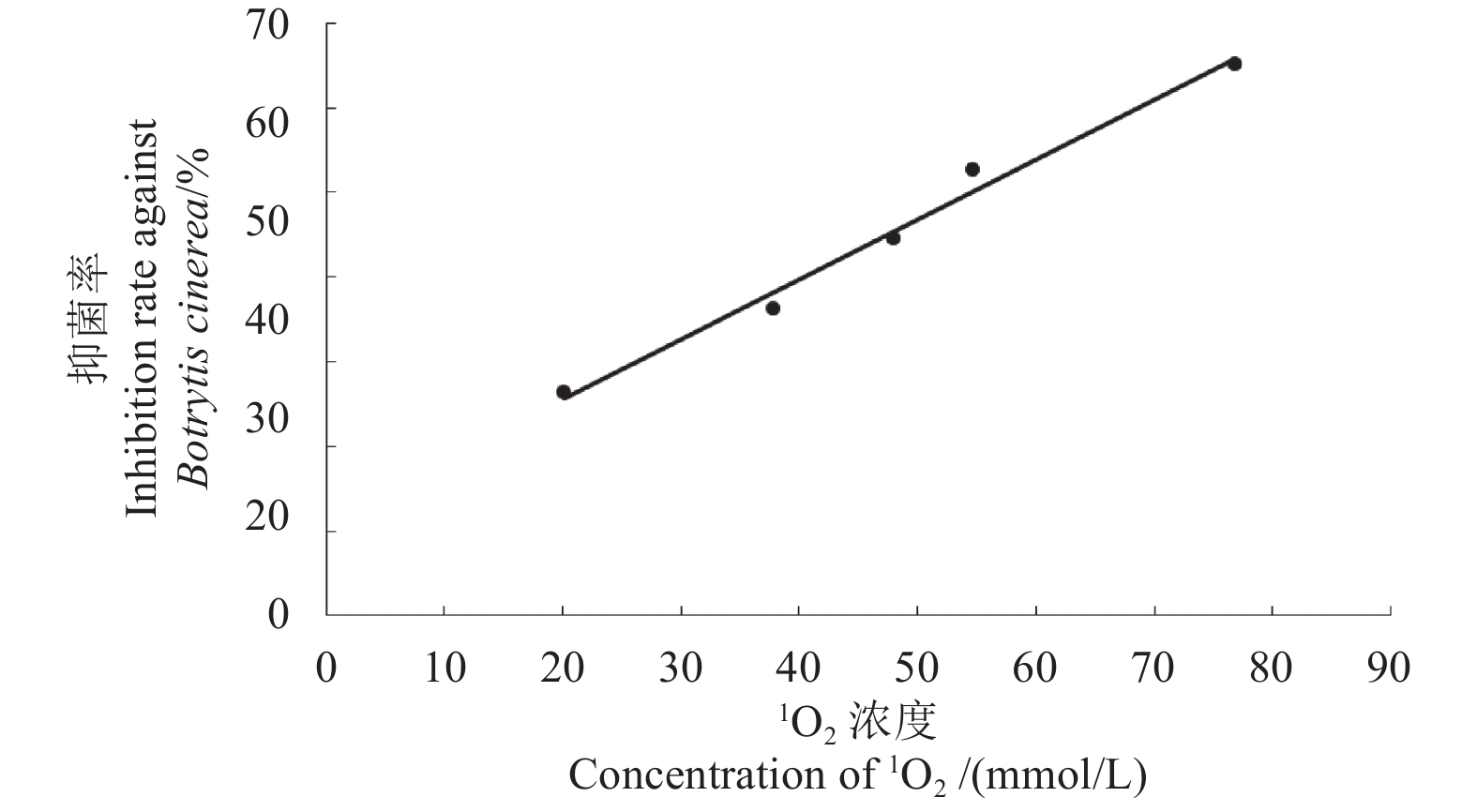
|
图 1 1O2浓度与抑制率的相关性 Fig. 1 Relativity between the concentration of 1O2 and inhibition rate against B. cinerea |
2.2.2 ·OH的抑菌作用
1) ·OH对番茄灰霉病菌的抑制率
测定结果 (表3) 表明:在本试验条件下,·OH对番茄灰霉病菌具有明显的抑制效果。除10.0和50.0 mmol/L下抑制率差异不显著外,其余均随着·OH浓度的增加,抑制率显著提高 (P < 0.05)。
|
|
表 3 .OH对番茄灰霉病菌的抑制率 Table 3 Inhibition rate of .OH against B. cinerea |
2) ·OH浓度与抑制率相关性
对抑制率 (Y) 与·OH浓度 (X) 相关性分析结果 (图2) 表明:·OH的浓度与抑制率之间呈极显著的线性正相关,回归方程为Y = 0.002 2X + 0.054 8,R2 = 0.910 1。表明·OH在抑制番茄灰霉病菌过程中发挥着重要作用,是抑菌的关键因子。

|
图 2 ·OH浓度与抑制率的相关性 Fig. 2 Relativity between concentration of ·OH and inhibition rate against B. cinerea |
2.2.3
1)
结果 (表4) 表明:在本研究条件下,
|
|
表 4
|
2)
相关性分析结果 (图3) 表明:
|
图 3
|
2.3 关键抑菌因子
在对 1O2、·OH和
竹红菌甲素 (HA) 是一种新型、天然的优良光敏剂,若将其开发为光活化农药,不仅可能解决化学农药污染严重、容易产生抗药性等问题,还能弥补传统生物农药的不足。这是因为HA经光动力作用后可高效防治植物病虫害,而且作用后能被光分解,不会残留在环境中造成污染;光反应产生的活性氧作为抑菌因子攻击生物有机体,通过破坏生物体细胞结构以达到抑菌的目的,相对于化学农药来说,其具有多作用位点,从而使病虫害对其不易产生抗性。此外,HA发酵工艺简单,与其他光敏剂相比,具有化学组成简单、化学结构确定、来源广泛及高量子产率等优点[23-24]。因此其具有可能开发为新一代绿色农药的潜力。
本研究中发现,HA在50 mg/L下对番茄灰霉菌最大抑制率可达65.15%的基础上,通过对其在12 000 lx光照条件下HA抑制番茄灰霉病菌过程中 1O2、·OH 和
已有大量研究结果表明,光敏剂对肿瘤疾病[7-8]、皮肤疾病[4-6]、害虫与菌类[13, 25]均有明显的光动力抑制作用,也有不少报道将活性氧量子产率作为衡量光敏剂光氧化效率的标准[26-28],但是对光活化农药关键抑菌因子的研究迄今尚未见报道。笔者研究表明,HA产生的活性氧产率与其对番茄灰霉病菌的抑制率呈极显著正相关,从而确定新型光敏剂HA在抑制番茄灰霉病菌中的关键抑菌因子为活性氧。根据活性氧的作用机理,HA在保存过程中应避光避氧,并选择晴天喷药,可提高防治效果。本研究结果可为HA的生产应用及其他光活化农药的的研发提供借鉴。
| [1] |
肖仔君, 陈惠音, 杨汝德. 竹红菌素[J]. 中国食品添加剂, 2003(4): 74-76. XIAO Z J, CHEN H Y, YANG R D. Hypocrellin[J]. China Food Additives, 2003(4): 74-76. DOI:10.3969/j.issn.1006-2513.2003.04.020 |
| [2] |
乔瑞. 竹红菌素类光动力药物[J]. 阜阳师范学院学报(自然科学版), 2009, 26(03): 28-33. QIAO R. Hypocrellin-based photodynamic sensitizers[J]. Journal of Fuyang Teachers College(Natural Science), 2009, 26(03): 28-33. DOI:10.3969/j.issn.1004-4329.2009.03.009 |
| [3] |
万象义, 陈远腾. 一种新的光化学疗法药物: 竹红菌甲素[J]. 科学通报, 1981, 26(11): 1040-1042. WAN X Y, CHEN Y T. Hypocrellin A: a new drug for photochemotherapy[J]. A Mon J Sci, 1981, 26(11): 1040-1042. |
| [4] |
CHIO-SRICHAN S, OUDRHIRI N, BENNACEUR-GRISCELLI A, et al. Toxicity and phototoxicity of Hypocrellin A on malignant human cell lines, evidence of a synergistic action of photodynamic therapy with imatinib mesylate[J]. J Photochem Photobiol B, 2010, 99(2): 100-104. DOI:10.1016/j.jphotobiol.2010.03.001 |
| [5] |
JIANG Y, LEUNG A W, WANG X N, et al. Inactivation of Staphylococcus aureus by photodynamic action of Hypocrellin B
[J]. Photodiagnosis Photodyn Ther, 2013, 10(4): 600-606. DOI:10.1016/j.pdpdt.2013.06.004 |
| [6] |
崔荔群. 探讨竹红菌素软膏治疗外阴白斑病的临床价值[J]. 中国卫生标准管理, 2017, 8(20): 108-109. CUI L Q. Investigate the clinical value of bamboo mushroom ointment in the treatment of leukoplakia[J]. China Health Standard Managent, 2017, 8(20): 108-109. DOI:10.3969/j.issn.1674-9316.2017.20.056 |
| [7] |
赵菊芬, 李茜, 杨柳风, 等. 聚焦超声联合竹红菌素软膏治疗外阴白色病变164例疗效观察[J]. 中国计划生育和妇产科, 2012, 4(1): 61-63. ZHAO J F, LI X, YANG L F, et al. Clinical observation of curative effect on focused-ultrasound combined with hypocrellin-ointment to treat leukoplakia vulvae in 164 cases[J]. Chin J Family Plann Gynecotokol, 2012, 4(1): 61-63. DOI:10.3969/j.issn.1674-4020.2012.01.017 |
| [8] |
JIN S, ZHOU L J, GU Z J, et al. A new near infrared photosensitizing nanoplatform containing blue-emitting up-conversion nanoparticles and Hypocrellin A for photodynamic therapy of cancer cells[J]. Nanoscale, 2013, 5(23): 11910-11918. DOI:10.1039/c3nr03515h |
| [9] |
HUDSON J B, ZHOU J, CHEN J, et al. Hypocrellin, from Hypocrella bambuase, is phototoxic to human immunodeficiency virus
[J]. Photochem Photobiol, 1994, 60(3): 253-255. DOI:10.1111/php.1994.60.issue-3 |
| [10] |
ZHANG Z Y, ZANG L Y, XU G R, et al. Characteristics of the primary reaction of Hypocrellin A photosensitization[J]. Sci China B, 1989, 32(9): 1063-1071. |
| [11] |
MAISCH T, BAIER J, FRANZ B, et al. The role of singlet oxygen and oxygen concentration in photodynamic inactivation of bacteria[J]. Proc Natl Acad Sci USA, 2007, 104(17): 7223-7228. DOI:10.1073/pnas.0611328104 |
| [12] |
赵学, 李朋举, 朱旭伟, 等. 竹红菌甲素对番茄灰霉病菌的抑制作用[J]. 农药学学报, 2015, 17(2): 149-155. ZHAO X, LI P J, ZHU X W, et al. Inhibitory effect of Hypocrellin A against Botrytis cinerea [J]. Chin J Pestic Sci, 2015, 17(2): 149-155. DOI:10.3969/j.issn.1008-7303.2015.02.05 |
| [13] |
朱齐超, 林海萍, 李朋举, 等. 竹红菌甲素对18种植物病原菌的抑制作用[J]. 植物病理学报, 2014, 44(1): 107-109. ZHU Q C, LIN H P, LI P J, et al. Inhibition of Hypocrellin A against 18 pathogenic fungi[J]. Acta Phytopathologica Sinica, 2014, 44(1): 107-109. |
| [14] |
李平兰, 贺稚非. 食品微生物学实验原理与技术[M]. 北京: 中国农业出版社, 2005. LI P L, HE Z F. Experiments theories and techniques in food microbiology[M]. Beijing: China Agriculture Press, 2005. |
| [15] |
赵学. 光活化农药竹红菌甲素对番茄灰霉的关键抑菌因子研究[D]. 杭州: 浙江农林大学, 2015. ZHAO X. Key factors of photoactivated pesticide Hypocrellin A against Botrytis cinerea[D]. Hangzhou: Zhejiang A&F University, 2015. |
| [16] |
WHEATLEY R, HACKETT C, BRUCE A, et al. Effect of substrate composition on production of volatile organic compounds from Trichoderma spp. inhibitory to wood decay fungi
[J]. Int Biodeterior Biodegrad, 1997, 39(2-3): 199-205. DOI:10.1016/S0964-8305(97)00015-2 |
| [17] |
张凯, 吴曼莉, 辜柳霜, 等. 胶孢炭疽菌生防放线菌gz-8的鉴定及生物活性初步评价[J]. 农药学学报, 2017, 19(6): 708-715. ZHANG K, WU M L, GU L S, et al. Identification and preliminary evaluation of a biocontrol actinomycete strain gz-8 against Colletotrichum gloeosporioides [J]. Chin J Pestic Sci, 2017, 19(6): 708-715. DOI:10.16801/j.issn.1008-7303.2017.0097 |
| [18] |
GUO X X, YANG X Q, YANG R Y, et al. Salicylic acid and methyl jasmonate but not rose bengal enhance artemisinin production through invoking burst of endogenous singlet oxygen[J]. Plant Sci, 2010, 178(4): 390-397. DOI:10.1016/j.plantsci.2010.01.014 |
| [19] |
涂欢, 徐涛, 易永, 等. 羟基自由基引起神经细胞[Ca2+]i增高的机制和Ebselen的抑制作用
[J]. 生物物理学报, 1996, 12(3): 522-526. TU H, XU T, YI Y, et al. Mechanism of the enhancement effect of hydroxyl rdicals on [Ca2+]i in rat cerebral cortical neuronal cells and the inhibition of Ebselen [J]. Acta Biophysica Sinica, 1996, 12(3): 522-526. |
| [20] |
李学梅, 李用芳, 李培睿, 等. 安络小皮伞液体发酵过程中还原糖与pH值、菌丝干重及产量的关系[J]. 中国食用菌, 2002, 21(2): 37-39. LI X M, LI Y F, LI P R, et al. The relations among reducing sugar, pH, dry weight of mycelium and production during the liquid fermentation of Marasmius androsaceus [J]. Ed Fungi China, 2002, 21(2): 37-39. DOI:10.3969/j.issn.1003-8310.2002.02.020 |
| [21] |
周雪莹, 熊文, 孔令魁. 核黄素光化学法对血浆中革兰阳性和阴性指示菌的减除作用和对血小板P选择蛋白表达的影响[J]. 中国实验血液学杂志, 2010, 18(04): 1059-1062. ZHOU X Y, XIONG W, KONG L K. Effects of riboflavin combined with potosensitization on reduction of Gram-postitive and gram-negative indicating germs in plasma and P-selectin expression of apheresis platelet concentrates[J]. Journal of Experimental Hematology, 2010, 18(04): 1059-1062. |
| [22] |
李锦全, 陈瑞川, 蔡克瑕, 等. 核黄素光化学反应诱导人胃癌细胞凋亡[J]. 癌症, 2003, 22(3): 253-256. LI J Q, CHEN R C, CAI K X, et al. Apoptosis of human gastric cancer cell induced by photochemical riboflavin[J]. Chin J Cancer, 2003, 22(3): 253-256. DOI:10.3321/j.issn:1000-467X.2003.03.007 |
| [23] |
周乃康, 尚立群, 柳曦. 竹红菌乙素-PDT与血卟啉衍生物-PDT对人肺癌细胞杀伤效应的比较研究[J]. 解放军医学杂志, 2004, 29(12): 1076-1078. ZHOU N K, SHANG L Q, LIU X. Comparative study on the killing effect between Hypocrellins B: photodynamic therapy and hematoporphyrin derivative-photodynamic therapy on human lung cancer cells[J]. Med J Chin PLA, 2004, 29(12): 1076-1078. DOI:10.3321/j.issn:0577-7402.2004.12.019 |
| [24] |
尚立群, 周乃康, 顾瑛, 等. 竹红菌乙素-PDT与血卟啉衍生物-PDT对食管癌细胞杀伤效应的比较研究[J]. 肿瘤防治杂志, 2005, 12(15): 1139-1142. SHANG L Q, ZHOU N K, GU Y, et al. Comparative study on killing effect to esophageal cancer cell line between Hypocrellins B: photodynamic therapy and hematoporphyrin derivative-photodynamic therapy[J]. Chin J Cancer Prev Treat, 2005, 12(15): 1139-1142. DOI:10.3969/j.issn.1673-5269.2005.15.006 |
| [25] |
殷红福. 光敏化合物竹红菌素抑菌杀虫作用研究[D]. 杭州: 浙江农林大学, 2011. YIN H F. Research on fungicidal and insecticidal effect of light-activated chemical hypocrellin[D]. Hangzhou: Zhejiang A&F University, 2011 |
| [26] |
HU Y Z, AN J Y, CHIANG L C. Studies on the photoinduced sulfonation of hypocrellins[J]. J Photochem Photobiol A, 1993, 70(3): 301-308. DOI:10.1016/1010-6030(93)85055-D |
| [27] |
夏万林, 张曼华, 蒋丽金. 竹红菌乙素与乙醇胺的作用[J]. 有机化学, 1992, 12(6): 618-623. XIA W L, ZHANG M H, JIANG L J. The reaction between Hypocrellin B ethanolamine[J]. Chin J Org Chem, 1992, 12(6): 618-623. |
| [28] |
李琼瑶, 肖绪玲, 何慧珠, 等. 几种光敏剂光敏氧化效率的比较[J]. 感光科学与光化学, 1989(2): 59-63. LI Q Y, XIAO X L, HE H Z, et al. The comparison of photosensitized oxygenation efficiency for several kinds of sensitizers[J]. Photograph Sci Photochem, 1989(2): 59-63. |
 2019, Vol. 21
2019, Vol. 21


