2. 植物病虫害生物学与防控湖南省重点实验室,长沙 410128;
3. 南方粮油作物协同创新中心,长沙 410128
2. Hunan Provincial Key Laboratory for Biology and Control of Plant Diseases and Insect Pests, Changsha 410128, China;
3. Southern Regional Collaborative Innovation Center for Grain and Oil Crops in China, Changsha 410128, China
稻瘟病是由稻瘟病菌 (有性世代:Magnaporthe oryzae,无性世代:Pyricularia oryzae) 引起的一种世界性重要水稻真菌病害[1],严重危害水稻的产量和品质,中国每年的产量损失约为445 900 t[2],已成为水稻持续高产稳产的严重障碍。目前对稻瘟病主要采取以减少越冬菌源为前提、选育推广抗病丰产品种为核心,以保健栽培等农业技术为基础以及适当利用化学农药为辅助的综合防治策略。其中化学杀菌剂的使用虽然效果较好,但潜在的病原菌抗药性风险及对生态环境和人类健康的危害不容忽视[3-4]。因此,生物农药的开发和利用得到了飞速发展,目前在植物病害防治领域研究报道较多的微生物主要包括放线菌、真菌以及细菌中的假单胞菌属 (Pseudomonas spp.) 和芽孢杆菌属 (Bacillus spp.) 等[5-7]。
芽孢杆菌是土壤和植物微生态中的优势微生物种群,已成为生物农药研发的热点,目前开发成功并投入应用的主要有苏云金芽孢杆菌B. thuringiensis、球形芽孢杆菌B. sphericus、缓病芽孢杆菌B. lentimorbus及日本金龟子芽孢杆菌B. popilliae[8]。2004年,由云南农业大学和中国农业大学共同研制的产品百抗[9] (枯草芽孢杆菌 B. subtilis B908可湿性粉剂) 是中国第一个在水稻上获准登记的芽孢杆菌杀菌剂,其对水稻纹枯病的防效达70%以上,对烟草青枯病的防效可达80%以上。
2006年,Gatson等[10]首次从墨西哥哈利斯科州的一个墓穴中分离到了特基拉芽孢杆菌B. tequilensis。Pradhan等[11]研究发现,特基拉芽孢杆菌CH可通过产生脂肽及生物表面活性剂等物质破坏病原菌的生物膜,从而起到抑制作用,但目前关于特基拉芽孢杆菌的开发利用尚处于起步阶段。笔者所在课题组于2015年从感病水稻品种湘早籼24号的健康植株茎叶中筛选获得1株拮抗细菌JN-369,对其菌种进行了鉴定,并初步测定了其抑菌谱;为明确该菌中具有抑制效果的活性物质,进一步系统研究了JN-369中的挥发性有机物 (VOCs)、蛋白类粗提物和脂肽类粗提物对稻瘟病菌的抑制作用,旨在为明确拮抗菌JN-369的生防潜力提供理论依据和实践基础。
1 材料与方法 1.1 供试材料 1.1.1 水稻品种感稻瘟病水稻品种湘早籼24号乳熟期的健康植株,采集于中国湖南省桃江县石牛江镇花田村 (28°42′55.56″N,112°15′74.24″E)。
1.1.2 菌株特基拉芽孢杆菌Bacillus tequilensis (JN-369)、稻瘟病菌Magnaporthe oryzae、水稻纹枯病菌Rhizoctonia solani、烟草赤星病菌Alternaria alternata、葡萄灰霉病菌Botrytis cinerea、辣椒胶孢炭疽菌Colletotrichum gloeosporioides、棉花枯萎病菌Fusarium oxysporum、黄瓜疫病菌Phytophthora melonis、水稻恶苗病菌Fusarium moniliforme、细菌性条斑病菌Xanthomonas oryzae pv. oryzicola、黄瓜细菌性角斑病菌Pseudomonas syringae pv. lachrymans、水稻白叶枯病菌Xanthomonas oryzae pv. oryzae及烟草青枯病菌Ralstonia solanacarum,均保存于湖南农业大学植物病原微生物及水稻病害实验室。
1.2 试验方法 1.2.1 拮抗菌的分离、筛选及鉴定采集感病水稻品种湘早籼24号的健康植株,从茎叶中分离获得内生细菌,并采用平板对峙法[12]筛选出抑菌效果好的拮抗菌株 (命名为JN-369),参照《常见细菌鉴定手册》进行菌落形态观察。参考东秀珠等[13]的方法对所分离出的拮抗菌株进行硫化氢试验、明胶液化试验、淀粉水解试验、甲基红试验、V.P试验、硝酸盐还原试验、接触酶试验、吲哚试验、苯丙氨酸脱氨酶试验和石蕊牛奶试验10项生理生化特征分析试验。每处理重复3次。
将待测菌株 JN-369 接种到NB培养基上,于28 ℃、180 r/min下恒温振荡培养18~24 h后,于10 000 r/min 下离心1 min,弃上清液,保留菌体。用细菌基因组提取试剂盒提取DNA,细菌16S rDNA 的通用引物为27F:5′-AGAGTTTGATCMTGGCTCAG-3′ 和1 492R:5′-TACGGYTACCTTGTTACGACTT-3′,以拮抗菌株JN-369的基因组为模板进行PCR扩增,扩增产物用1%的琼脂糖凝胶电泳检测,样品送上海生工公司进行测序。在NCBI上通过Blast与GenBank中核酸数据进行比对分析,筛选近源物种的序列,利用MEGA 5.10软件构建待测菌的系统发育树。
1.2.2 菌株JN-369的抑菌谱测定分别采用平板对峙法[12]及纸碟法[14]测定菌株JN-369对稻瘟病菌、黄瓜疫病菌、葡萄灰霉病菌、水稻恶苗病菌、烟草赤星病菌、水稻纹枯病菌、辣椒胶孢炭疽菌及棉花枯萎病菌8种病原真菌和卵菌,以及水稻细菌性条斑病菌、水稻白叶枯病菌、烟草青枯病菌、黄瓜细菌性角斑病菌4种病原细菌的抑制效果。将直径为6 mm的菌饼接种至平板中央,重复3次。待对照菌落直径达到培养皿直径3/4以上时,观察并测量各皿菌落直径,按 (1) 式计算菌株JN-369对病原菌生长的抑制率 (I, %)。
| $ I/{\text{% }} = \frac{{{\rm{\Delta }}A_0 - {\rm{\Delta }}A_{\rm{t}}}}{{{\rm{\Delta }}A_0 - {\rm{6}}}} \times {\rm{100}} $ | (1) |
式中:ΔΑ0为对照组菌落直径 (mm),ΔΑt为处理组菌落直径 (mm)。
1.2.3 菌株JN-369挥发性有机物的抑菌活性测定采用平板倒扣法[15]测定。吸取20 μL JN-369菌悬液均匀涂布于PDA平板上,向另一PDA平板中央接入直径为6 mm的供试稻瘟病菌菌饼,倒扣于含JN-369菌悬液的平板上,密封,于28 ℃恒温培养。以未接JN-369菌悬液的平板作为对照。每处理重复3次。按照1.22节方法计算抑制率。
1.2.4 菌株JN-369蛋白类物质的提取及其抑菌活性测定采用硫酸铵分级盐析法[16]提取蛋白类物质。用接种环挑取一环JN-369菌株,接种于装有50 mL新鲜NB培养液的100 mL锥形瓶中,于28 ℃、180 r/min条件下振荡培养24 h至对数生长期,获得种子发酵液;将种子发酵液按照体积分数为1%的接种量接种于装有200 mL新鲜NB培养液的300 mL锥形瓶中,于28 ℃、180 r/min振荡培养48 h,获得JN-369菌悬液 (菌体浓度为1 × 108 cfu/mL);将该菌悬液于4 ℃、10 000 r/min离心15 min,弃菌体,取上清液;向上清液中加入 (NH4)2SO4至80%饱和度,振荡混匀,于4 ℃静置48 h,析出蛋白沉淀;再于10 000 r/min离心15 min后,收集沉淀;用体积分数为5%的PBS缓冲液对获得的沉淀进行溶解悬浮,再置于透析袋 (8 000~14 000 D) 中采用相同浓度的PBS缓冲液透析除盐,经0.22 μm细菌过滤器过滤,即得菌株JN-369的蛋白类粗提物,于4 ℃保存。使用Nano Drop检测蛋白样品浓度,重复检测3次。
蛋白类粗提物的抑菌活性测定:向PDA平板中央接入直径为6 mm的稻瘟病菌菌饼,距菌饼中央左右两侧25 mm处各打一直径6 mm的孔,注入JN-369蛋白类粗提物40 μL (蛋白质质量浓度为1.454 mg/mL),以溶解剂PBS缓冲液处理为对照。每处理重复3次。于28 ℃恒温培养5 d,测量各皿菌落直径,按照1.22节方法计算抑制率。
1.2.5 菌株JN-369脂肽类物质的提取及其抑菌活性测定采用酸沉淀和甲醇提取的方法[17]提取脂肽类物质。将JN-369的菌悬液于4 ℃、10 000 r/min下离心15 min,弃菌体,取上清液;用盐酸调节上清液pH值至2.0,于4 ℃沉淀过夜,10 000 r/min下离心25 min后收集沉淀;用体积分数为10%的甲醇溶解提取沉淀2次,每次2 h;合并甲醇提取物,经0.22 μm细菌过滤器过滤,即得菌株JN-369的脂肽类粗提物,于4 ℃或 –20 ℃保存。脂肽类粗提物的抑菌活性测定方法同1.2.4节蛋白类粗提物的抑菌活性测定。重复3次。
2 结果与分析 2.1 拮抗菌株的分离、筛选及抑菌效果试验中共分离获得菌株527株,其中JN-369的拮抗效果较为显著,其抑菌带宽达47.8 mm (CK稻瘟病菌直径为65.41 mm),对稻瘟病菌菌丝生长的抑制率达80.46% ± 0.83% (图1)。

|
A为空白对照;B为菌株JN-369对稻瘟病菌的抑制效果。 A was the control; B showed the effect of the strain JN-369 to M. oryzae. 图 1 菌株JN-369对稻瘟病菌的抑制效果 Fig. 1 Inhibition effect of the strain JN-369 against M. oryzae |
2.2 菌株JN-369的生物学特性 2.2.1 JN-369菌落形态及生理生化特性
在NA平板上,JN-369菌落呈不规则形态,边缘光滑湿润,不透明,微黄色,中间颜色较深、边缘较浅,呈革兰氏阳性。菌体呈杆状,大小为 (0.6~1.0) μm × (2.0~4.0) μm,芽孢呈椭圆倒柱状,长0.5~1.0 μm (图2)。菌株JN-369的10项生理生化特征见表1,显示其能使淀粉水解及明胶液化,可还原硝酸盐。

|
图 2 菌株JN-369的菌体扫描电镜图 Fig. 2 Scanning electron microscope (SEM) of the strain JN-369 |
|
|
表 1 菌株JN-369 的主要生理生化特征 Table 1 Physiological and biochemical characteristics of the strain JN-369 |
2.2.2 菌株JN-369的分子生物学鉴定结果
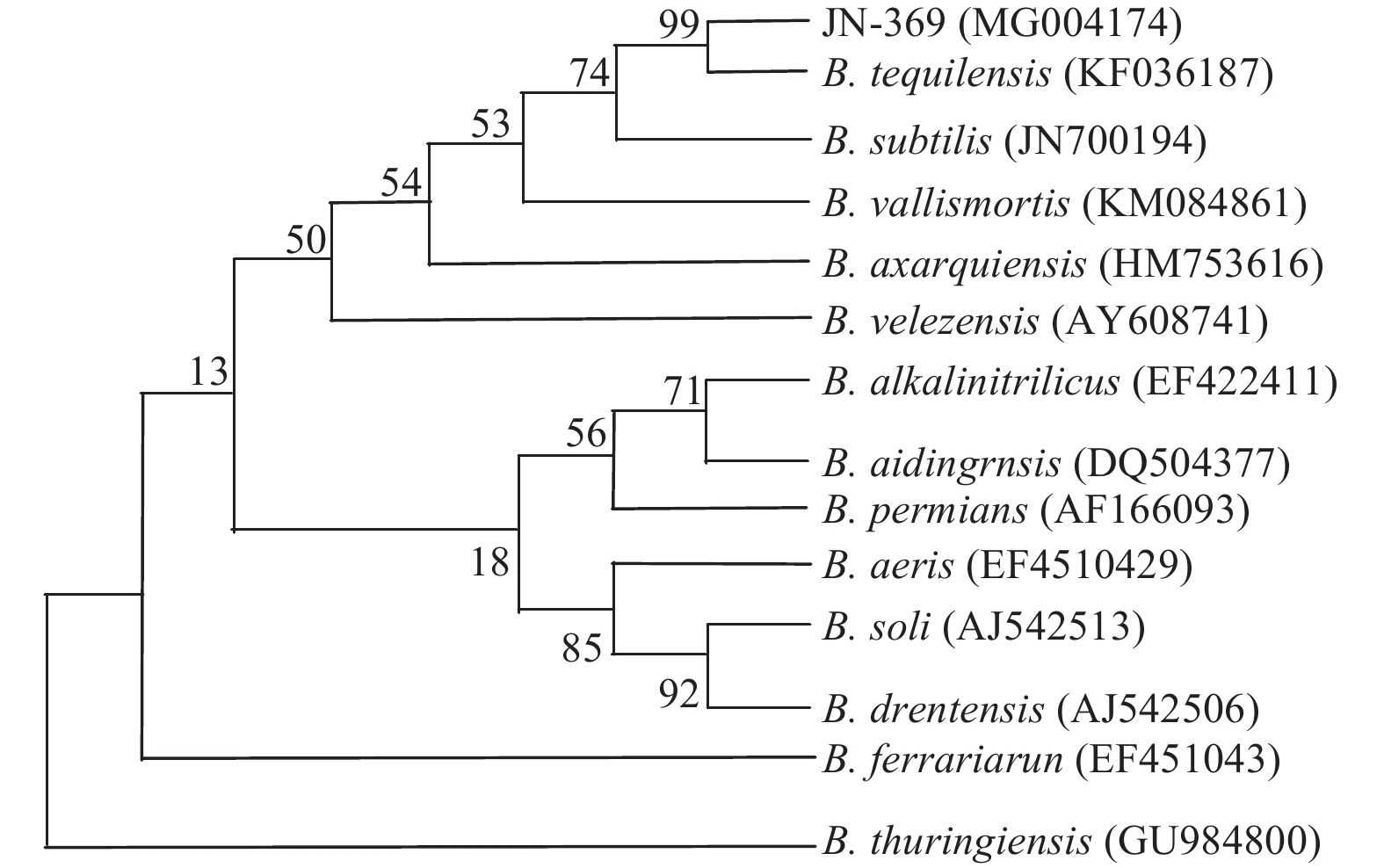
对菌株JN-369的16S rDNA序列进行测序,得其长度为1 462 bp。通过DNAstar软件拼接得到其16S rDNA部分有效序列,于GenBank进行BLAST同源序列检索,用MEGA 5.10软件中的Neighbor-Joining Tree法构建16S rDNA系统发育树 (重复抽样1 000次)。结果表明:菌株JN-369 (登陆号:MG004174),与特基拉芽孢杆菌B. tequilensis (登录号:KF036187) 的相似性为99%;结合形态学及生理生化特征,将菌株JN-369鉴定为特基拉芽孢杆菌 (图3)。
|
图 3 菌株JN-369的16S rDNA系统发育树 Fig. 3 16S rDNA phylogenetic tree of the strain JN-369 |
2.3 菌株JN-369的抑菌谱
菌株JN-369对供试的病原真菌及卵菌均有抑制效果,其中对稻瘟病菌的抑制效果最为显著,抑制率达80.46% ± 0.83%;对烟草赤星病菌和辣椒胶孢炭疽菌的抑制率也达到50.00%以上;但对水稻细菌性条斑病菌、水稻白叶枯病菌、烟草青枯病菌及黄瓜细菌性角斑病菌4种病原细菌则均无抑制作用 (表2)。
|
|
表 2 菌株JN-369对供试病原菌的抑制效果 Table 2 Inhibitory effect of the strain JN-369 against different pathogenic microorganism |
2.4 菌株JN-369挥发性气体以及蛋白类和脂肽类提取物对稻瘟病菌的抑制作用
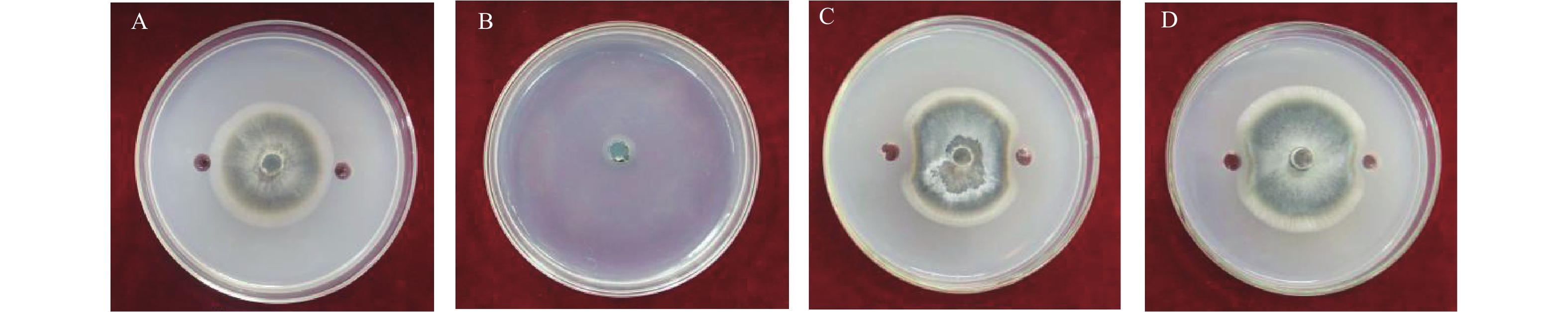
检测结果 (图4) 表明:菌株JN-369的挥发性气体及其蛋白类和脂肽类提取物对稻瘟病菌均具有一定的抑制作用。其中,20 μL 1 × 108 cfu/mL的JN-369菌悬液产生的挥发性气体对稻瘟病菌菌丝生长的抑制作用最为显著,抑制率可达72.92% ± 3.01%,连续培养45 d后,抑制率仍可达70%以上;40 μL 1.454 mg/mL的蛋白类粗提物的抑制率为24.68% ± 0.80%;40 μL 1.026 mg/mL的脂肽类粗提物的抑制率为14.34% ± 1.08%。表明菌株JN-369所产生的抑菌物质对稻瘟病菌具有很好的生物防治作用。
|
注:A为空白对照;B、C、D依次为挥发性有机物、蛋白类粗提物及脂肽类粗提物。 Note: A was the control; B, C and D showed the inhibitory effects of VOCs, crude proteins and crude lipopeptides against M. oryzae, respectively. 图 4 菌株JN-369挥发性有机物及其蛋白类和脂肽类提取物对稻瘟病菌的抑制活性 Fig. 4 Antifungal activities of VOCs, crude proteins and lipopeptides from JN-369 |
3 结论与讨论
植物内生拮抗菌是指作为植物内生菌,其本身及 (或) 代谢产生的抗菌物质能够强烈抑制植物病原菌而对寄主无害,因而具有生物防治效应的一类微生物。近年来,利用植物内生拮抗菌防治植物病害的生物防治手段已逐步受到关注并成为研究热点[18]。翟茹环等[19]分离得到枯草芽孢杆菌G8,并发现其粗蛋白液对黄瓜菌核病菌Sclerotinia sclerotiorum具有抑制作用;徐新星等[20]分离获得的枯草芽孢杆菌CF-3所产生的抑菌蛋白γ-谷氨酰转肽酶和胞内丝氨酸蛋白酶对复端孢霉Cephalothecium F具有抑制作用;向亚萍等[21]的研究表明,解淀粉芽孢杆菌B. amyloliquefaciens B1619可分泌3种脂肽类抗生素,其中杆菌霉素L和芬芥素对番茄枯萎病菌Fusarium oxysporum f. sp. lycopersici的生长具有较强的抑制作用,而表面活性素的抑制作用较弱;Chung等[22]从水稻中分离得到内生芽孢杆菌YC7007,在体外能够强烈抑制主要水稻真菌病原菌,如黄单胞菌Xanthomonas oryzae pv. oryza菌丝的生长;Gholami等[23]从大豆根中分离获得1株对大豆炭疽菌Colletotrichum truncatum具有抑制效果的特基拉芽孢杆菌;Li等[24]研究报道了解淀粉芽孢杆菌SYBC H47可通过产生杆菌霉素L、表面活性素等物质而抑制黑曲霉Aspergillus niger、总状毛霉菌Mucor racemosus、尖孢镰刀菌Fusarium oxysporum、柑橘青霉菌Penicillium citrinum以及白色念珠菌 Candida albicans菌丝的生长。可见,芽孢杆菌是具有较高生防潜力的生物拮抗菌,且由于芽孢杆菌个体大,繁殖速度快,抵抗外界有害因子的能力强,因而是一类较理想的生防菌株。
本研究从健康水稻植株中分离得到1株对水稻稻瘟病菌具有明显拮抗作用的内生菌株JN-369,根据菌体特征、16S rDNA序列分析及生理生化指标,初步鉴定该菌株为特基拉芽孢杆菌。对其抑菌活性、抑菌谱及抑菌物质的初步分析结果表明:菌株JN-369对8种常见植物病原菌均具有不同程度的抑制作用,表现出广谱的抗菌活性,同时其对水稻稻瘟病菌、烟草赤星病菌和辣椒胶孢炭疽菌3种植物病原真菌的抑制作用较强。
菌株JN-369能够产生某些高效的抑菌活性物质,其中其挥发性气体的抑菌效果较为显著,显示出了较高的研究和应用价值,具有很好的开发潜力。但关于该菌株所产生抑菌活性物质的具体种类、结构、特性及其抑菌机理等尚不明确,其可能是某一种或几种物质的单一作用,也可能是多种物质的协同作用效应,具体尚需后续进一步研究与探索。同时,由于植物病害生物防治的关键是在田间条件下发挥作用,但由于受到各种环境因素的影响,生防微生物在植物活体试验或田间试验中的防治效果往往不如在平板对峙试验中的抑制效果,亦即从室内到田间生防效果往往存在较大差距,所以后续仍需在不同条件下进行菌株JN-369对稻瘟病的田间防治效果试验,以期为研发防治稻瘟病的生物制剂提供理论基础。
| [1] |
MACLEAN J L, DAWE D C, HARDY B, et al. Rice almanac: source book for the most important economic activity on earth[M]. 3rd ed. Wallingford, UK: CABI Pub, 2002.
|
| [2] |
GUO F F, CHEN X L, LU M H, et al. Spatial analysis of rice blast in China at three different scales[J]. Phytopathology, 2018, 108(11): 1276-1286. DOI:10.1094/PHYTO-01-18-0006-R |
| [3] |
沙月霞, 曾庆超, 王昕, 等. 防治稻瘟病芽胞杆菌的筛选及效果评价[J]. 中国生物防治学报, 2018, 34(3): 414-422. SHA Y X, ZENG Q C, WANG X, et al. Screening and control efficiency evaluation of Bacillus against rice blast Magnaporthe oryzae [J]. Chin J Biol Control, 2018, 34(3): 414-422. |
| [4] |
YANG S H, LI J, ZHANG X H, et al. Rapidly evolving R genes in diverse grass species confer resistance to rice blast disease
[J]. Proc Natl Acad Sci USA, 2013, 110(46): 18572-18577. DOI:10.1073/pnas.1318211110 |
| [5] |
辛海峰, 孟艳艳, 李建宏, 等. 一株萎缩芽孢杆菌在小麦中的定植及对赤霉病的防治[J]. 生态学杂志, 2013, 32(6): 1490-1496. XIN H F, MENG Y Y, LI J H, et al. Bacillus atrophaeus strain’s colonization in wheat plant and its inhibition efficiency to Fusarium head blight [J]. Chin J Ecol, 2013, 32(6): 1490-1496. |
| [6] |
JOHANSSON A H, BEJAI S, NIAZI A, et al. Studies of plant colonisation by closely related Bacillus amyloliquefaciens biocontrol agents using strain specific quantitative PCR assays
[J]. Antonie van Leeuwenhoek, 2014, 106(6): 1247-1257. DOI:10.1007/s10482-014-0295-0 |
| [7] |
刘振华, 罗远婵, 张道敬, 等. 农用微生物杀菌剂剂型研究进展[J]. 农药学学报, 2014, 16(5): 497-507. LIU Z H, LUO Y C, ZHANG D J, et al. Research progress and prospects of microbial pesticide formulation for plant disease control[J]. Chin J Pestic Sci, 2014, 16(5): 497-507. DOI:10.3969/j.issn.1008-7303.2014.05.02 |
| [8] |
REN J H, LI H, WANG Y F, et al. Biocontrol potential of an endophytic Bacillus pumilus JK-SX001 against poplar canker
[J]. Biol Control, 2013, 67(3): 421-430. DOI:10.1016/j.biocontrol.2013.09.012 |
| [9] |
任争光, 张志勇, 魏艳敏. 芽孢杆菌防治园艺植物病害的研究进展[J]. 中国生物防治学报, 2006, 22(Suppl. 1): 194-198. REN Z G, ZHANG Z Y, WEI Y M. Research progress on biological control of horticultural plant diseases by Bacillus spp. [J]. Chin J Biol Control, 2006, 22(Suppl. 1): 194-198. |
| [10] |
GATSON J W, BENZ B F, CHANDRASEKARAN C, et al. Bacillus tequilensis sp. nov., isolated from a 2000-year-old Mexican shaft-tomb, is closely related to Bacillus subtilis
[J]. Int J Syst Evol Microbiol, 2006, 56(7): 1475-1484. DOI:10.1099/ijs.0.63946-0 |
| [11] |
PRADHAN A K, PRADHAN N, MALL G, et al. Application of lipopeptide biosurfactant isolated from a halophile: Bacillus tequilensis CH for inhibition of biofilm
[J]. Appl Biochem Biotechnol, 2013, 171(6): 1362-1375. DOI:10.1007/s12010-013-0428-3 |
| [12] |
李小俊, 成丽霞, 吴彦彬, 等. 拮抗菌抗菌谱及发酵液拮抗能力测定的新方法[J]. 生物技术, 2007, 17(1): 55-58. LI X J, CHENG L X, WU Y B, et al. New methods of testing fermentation liquid antagonistic effect of antagonistic bacteria and antimicrobial spectrum[J]. Biotechnology, 2007, 17(1): 55-58. DOI:10.3969/j.issn.1004-311X.2007.01.020 |
| [13] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 349-388. DONG X Z, CAI M Y. Manual of systematic methods of determinative bacteria[M]. Beijing: Science Press, 2001: 349-388. |
| [14] |
LUND F. Differentiating Penicillium species by detection of indole metabolites using a filter paper method
[J]. Lett Appl Microbiol, 1995, 20(4): 228-231. DOI:10.1111/j.1472-765X.1995.tb00434.x |
| [15] |
穆静娟, 焦加国, 葛新成, 等. 植物病原真菌广谱拮抗菌 M29 的筛选、鉴定及其抑菌机制[J]. 南京农业大学学报, 2017, 40(1): 84-92. MU J J, JIAO J G, GE X C, et al. Isolation and identification of a plant pathogenic fungi and broad-spectrum antagonistic bacterium Bacillus subtilis M29 and its antibiotic mechanism [J]. J Nanjing Agric Univ, 2017, 40(1): 84-92. |
| [16] |
ADENEKAN M K, FADIMU G J, ODUNMBAKU L A, et al. Effect of isolation techniques on the characteristics of pigeon pea (Cajanus cajan) protein isolates
[J]. Food Sci Nutr, 2018, 6(1): 146-152. |
| [17] |
DIMKIĆ I, STANKOVIĆ S, NIŠAVIĆ M, et al. The profile and antimicrobial activity of Bacillus lipopeptide extracts of five potential biocontrol strains
[J]. Front Microbiol, 2017, 8: 925. DOI:10.3389/fmicb.2017.00925 |
| [18] |
BELTRAN-GARCIA M J, WHITE JR J F, PRADO F M, et al. Nitrogen acquisition in Agave tequilana from degradation of endophytic bacteria
[J]. Sci Rep, 2014, 4: 6938. |
| [19] |
翟茹环, 尚玉珂, 刘峰, 等. 枯草芽孢杆菌 G8 抗菌蛋白的理化性质和抑菌作用[J]. 植物保护学报, 2007, 34(6): 592-596. ZHAI R H, SHANG Y K, LIU F, et al. Characteristics and inhibitory action of antifungal protein produced by Bacillus subtilis strain G8 [J]. Acta Phytophylacica Sinica, 2007, 34(6): 592-596. DOI:10.3321/j.issn:0577-7518.2007.06.006 |
| [20] |
徐新星, 曾轩, 李培中, 等. 枯草芽孢杆菌 CF-3 抑菌蛋白的分离与鉴定[J]. 现代食品科技, 2016, 32(12): 145-150. XU X X, ZENG X, LI P Z, et al. Purification and identification of fungistatic protein from Bacillus subtilis CF-3 [J]. Mod Food Sci Technol, 2016, 32(12): 145-150. |
| [21] |
向亚萍, 周华飞, 刘永锋, 等. 解淀粉芽孢杆菌 B1619 脂肽类抗生素的分离鉴定及其对番茄枯萎病菌的抑制作用[J]. 中国农业科学, 2016, 49(15): 2935-2944. XIANG Y P, ZHOU H F, LIU Y F, et al. Isolation and identification of lipopeptide antibiotics produced by Bacillus amyloliquefaciens B1619 and the inhibition of the lipopeptide antibiotics to Fusarium oxysporum f. sp. lycopersici [J]. Scientia Agricultura Sinica, 2016, 49(15): 2935-2944. DOI:10.3864/j.issn.0578-1752.2016.15.008 |
| [22] |
CHUNG E J, HOSSAIN M T, KHAN A, et al. Bacillus oryzicola sp. nov., an endophytic bacterium isolated from the roots of rice with antimicrobial, plant growth promoting, and systemic resistance inducing activities in rice
[J]. Plant Pathol J, 2005, 31(2): 152-164. |
| [23] |
GHOLAMI M, KHAKVAR R, ALIASGARZAD N. Application of endophytic bacteria for controlling anthracnose disease (Colletotrichum lindemuthianum) on bean plants
[J]. Arch Phytopathol Plant Prot, 2013, 46(15): 1831-1838. DOI:10.1080/03235408.2013.778477 |
| [24] |
LI X H, ZHANG Y Z, WEI Z W, et al. Antifungal activity of isolated Bacillus amyloliquefaciens SYBC H47 for the biocontrol of peach gummosis
[J]. PLoS One, 2016, 11(9): e0162125. DOI:10.1371/journal.pone.0162125 |
 2019, Vol. 21
2019, Vol. 21


