2. 山东省农药毒理与应用技术重点实验室,山东 泰安 271018;
3. 山东农业大学 农学院,山东 泰安 271018
2. Key Laboratory of Pesticide Toxicology & Application Technique of Shandong, Taian 271018, Shandong Province, China;
3. College of Agronomy, Shandong Agricultural University, Taian 271018, Shandong Province, China
丝核菌属是全世界多种作物上的破坏性土壤病原体,可在腐生期利用土壤中的有机残留物以无菌菌丝体 (菌丝或菌核) 的状态存活[1]。玉米纹枯病是由禾谷丝核菌Rhizoctonia cerealis、立枯丝核菌R. solani及玉蜀黍丝核菌R. zeae等土壤习居菌群侵染引起的土传真菌病害。其中,立枯丝核菌是优势病原菌[2-3],主要菌群包括AG-1-IA、AG-1-IB、AG-3、AG-5、AG-A和AG-K,其中AG-1-IA的分离株较易引起玉米纹枯病[4]。玉米作为世界农业经济中重要的谷类作物,对提高粮食产量具有重要意义,但由于纹枯病的逐年加重,导致其品质和产量下降,带来严重的经济损失[5]。目前玉米纹枯病主要防治措施以化学防治为主,常用药剂有三唑酮及井冈霉素等,随着其大量使用,药剂对病原菌的选择压力显著增加。已有关于立枯丝核菌对井冈霉素表现出抗性的报道[6],导致药剂防效下降。
杀菌剂噻呋酰胺 (thifluzamide) 又称噻氟菌胺,是美国孟山都公司研制、陶氏益农公司开发的噻唑酰胺类琥珀酸脱氢酶抑制剂 (SDHIs)[7],兼具保护和治疗作用,内吸性良好,可用于叶面喷雾或土壤处理。噻呋酰胺主要用于防治担子菌引起的病害,如丝核菌对水稻、马铃薯、玉米及花生等作物的为害。已有研究表明,噻呋酰胺用于水稻苗床处理时以200~300 g/hm2剂量的效果较好[8];采用喷淋浇灌法时240 g/L噻呋酰胺悬浮剂对花生白绢病的防治效果较好,且对花生安全[9];用于谷类作物和草坪等的茎叶处理时,用药量以125~250 g/hm2最为适宜。
齐永志等[10]通过紫外诱导获得5株小麦纹枯病菌R. cerealis对噻呋酰胺的抗性突变体,但发现其抗性均不能稳定遗传。王成凤[11]通过检测2008、2010和2013年小麦纹枯病菌对噻呋酰胺的敏感性,认为小麦纹枯病菌对噻呋酰胺抗性风险较低。目前噻呋酰胺尚未被正式用于田间玉米纹枯病的防治,亦未见相关研究报道,因此建立玉米纹枯病菌对噻呋酰胺的敏感基线,探究其对噻呋酰胺产生抗性突变的可能性及所获抗药性突变体的生物学性状,及时准确评估玉米纹枯病菌对噻呋酰胺的抗性风险甚为必要。
本研究尝试建立了山东省玉米纹枯病菌对噻呋酰胺的敏感基线,并通过紫外诱导及药剂驯化方法分别对病原菌进行抗性诱导,探究了抗性菌株的生物学性状,旨在评估玉米纹枯病菌对噻呋酰胺的抗药性风险,为噻呋酰胺在玉米病害防治上的科学合理应用提供依据。
1 材料与方法 1.1 供试材料菌株:2016—2017年在山东省泰安 (TA)、临沂 (LY)、潍坊 (WF)、莱芜 (LW)、日照 (RZ) 及青岛 (QD) 6个地区采集玉米纹枯病发病叶鞘、病叶、茎秆,经分离纯化获得102株玉米纹枯病病原菌,经细胞核观察染色和菌丝融合群测定,确定其均为立枯丝核菌R. solani,转接于马铃薯葡萄糖琼脂 (PDA) 培养基上,于4 ℃冰箱中保存。
供试玉米品种:郑单958 (河南金博士种业股份有限公司)。
药剂:96%噻呋酰胺 (thifluzamide) 原药 (山东康乔生物科技有限公司);94.7%戊唑醇 (tebuconazole) 及95%丙环唑 (propiconazole) 原药 (山东潍坊润丰化工股份有限公司);97%咯菌腈 (fludioxonil) 及97%啶酰菌胺 (boscalid) 原药 (陕西美邦药业集团股份有限公司);95%苯醚甲环唑 (difenoconazole) 原药 (山东东泰农化有限公司);95%多菌灵 (carbendazim) 原药 (山东华阳农药化工集团有限公司);64%井冈霉素 (validamycin) 原药 (浙江钱江生物化学股份有限公司);95%氟唑菌苯胺 (penflufen) 原药[拜耳作物科学 (中国) 有限公司]。
培养基:PDA固体培养基 (马铃薯200 g,葡萄糖20 g,琼脂粉15 g,蒸馏水1 L);PDB液体培养基 (马铃薯200 g,葡萄糖20 g,蒸馏水1 L);WA培养基 (琼脂粉10 g,蒸馏水1 L)。
1.2 试验方法 1.2.1 玉米纹枯病菌对噻呋酰胺敏感基线的建立采用菌丝生长速率法[12]测定山东省6个地区的102株玉米纹枯病菌对噻呋酰胺的敏感性,尝试建立敏感基线。用丙酮溶解原药,并用含体积分数为0.1%吐温-80的灭菌去离子水配制成500 μg/mL的母液,继而稀释配制成噻呋酰胺质量浓度分别为1、0.5、0.25、0.125、0.062 5 μg/mL的系列含药PDA平板,以加入同体积灭菌去离子水的PDA平板为对照。于活化完全的菌落边缘打取直径为5 mm的菌饼,菌丝面朝下接种至PDA平板上。每处理重复4次,置于25 ℃生化培养箱中培养3 d后,采用十字交叉法测量菌落直径,计算菌丝生长抑制率,并建立毒力回归方程,得到有效抑制中浓度 (EC50) 值。试验重复2次。
1.2.2 玉米纹枯病菌抗噻呋酰胺突变体的获得药剂连续选择驯化:从山东泰安 (TA)、临沂 (LY)、潍坊 (WF)、莱芜 (LW)、日照 (RZ) 及青岛 (QD) 6个地区随机选取12株玉米纹枯病菌作为亲本菌株,于PDA平板上、25 ℃生化培养箱培养2~3 d,打取直径为5 mm的菌饼,菌丝面向下转接于含EC50浓度以上噻呋酰胺的PDA平板上,每代选取生长较快的菌落进行转接,直至抗性突变体能在含0.5 μg/mL (最低抑菌浓度,MIC) 噻呋酰胺的PDA平板上较好地生长为止。试验重复4次,每重复为4皿。观察诱变菌株对噻呋酰胺的抗性变化,按式 (1) 及式 (2) 计算各抗药突变体的抗性水平和抗性突变频率[13]。
| ${\rm{RL/ {\text\%} = E}}{{\rm{C}}_{{\rm{50}}}}_{\left( {\rm{R}} \right)}{\rm{/E}}{{\rm{C}}_{{\rm{50}}}}_{\left( {\rm{S}} \right)}$ | (1) |
| ${\rm{RMF/{\text \%} = RN/TN \times 100}}$ | (2) |
式中:RL为抗性水平 (%);EC50(R)为抗药性突变体EC50值 (μg/mL);EC50(S)为亲本菌株EC50值 (μg/mL);RMF为抗性突变频率;RN为抗性突变体菌饼数;TN为驯化菌饼总数。
紫外诱导:参照Bruin等[14]及夏晓明[15]的方法并加以改进。待菌株培养稳定后,打取直径为5 mm的菌饼,转接于空白PDA平板上,培养24 h后,置于已预热15 min的紫外灯 (20 W,254 nm) 下20 cm处分别照射40、60、80、100、120、140和160 s,以未进行紫外灯照射的亲本菌株作为对照。25 ℃黑暗条件下培养3 d后,调查不同时间的致死率,得出95%菌落致死的时间。选取12株亲本菌株,培养24 h后,相同条件下紫外照射95%菌落致死时间后,25 ℃黑暗条件下培养3 d,观察菌丝生长状况。每亲本菌株接种12皿,每皿4块菌饼。将平板上长出的不规则扇形角突变转移到WA培养基上,显微镜下切取单细胞菌丝进行菌株纯化。将纯化后的菌丝转接到含MIC浓度噻呋酰胺的PDA平板上,能够较好生长的菌株即为抗药性突变体。以未经紫外照射的亲本菌株作为对照,分别按式 (1) 和式 (3) 计算抗药性突变体的抗性水平和突变频率。
| ${\rm{RMF/{\text \%} = AN/TN \times 100}}$ | (3) |
式中:AN为出现角突变菌丝块数。
1.2.3 抗性突变体的生物学性状研究 1.2.3.1 抗性遗传稳定性将诱导获得的抗性突变体及亲本菌株在不含噻呋酰胺的PDA平板上依次继代培养12代,采用菌丝生长速率法分别测定F0、F3、F6、F9及F12代对噻呋酰胺的敏感性 (EC50值),分析抗性突变体的抗药性能否稳定遗传。
1.2.3.2 抗性突变体生长速率及菌核的形成将抗性突变体及亲本菌株于PDA培养基上25 ℃、黑暗条件下培养3 d后备用。沿菌落边缘打取直径5 mm的菌饼,转接到空白PDA培养基平板上,置于25 ℃生化培养箱中黑暗培养2 d,其间每间隔12 h测量1次菌落直径。每菌株重复3次,比较抗性突变体与亲本菌株菌丝生长速率差异。继续培养至9 d后,观察菌核形成情况,收集各皿菌核于80 ℃烘干至恒重,比较抗性突变体与亲本菌株菌核干重差异。同时分别将抗性突变体及亲本菌株接种至100 mL PDB液体培养基中(因病原菌生长速率较快,每瓶仅需接种2个直径为5 mm的菌丝块),于25 ℃、120 r/min下振荡培养3 d,菌丝通过布氏漏斗过滤,80 ℃烘干,称量菌丝干重。每菌株重复3瓶。
1.2.3.3 抗药性突变体的致病力采用温室苗期菌饼接种法测定[16]。于25 ℃温室中将玉米培养到3叶1心期,将PDA平板上培养3 d后的抗性突变体及亲本菌株菌饼 (直径5 mm) 接种到玉米第1叶鞘内,每个菌株接种15株玉米。每天进行喷雾保湿,保证土壤表面湿润,观察记录玉米生长及病害发展情况,15 d后进行病害调查,统计发病级数,计算病情指数。病害分级方法[16]:0级,未发病;1级,第1叶鞘发病;2级,第2叶鞘发病;3级,第3叶鞘发病;4级,第3叶鞘以上发病或死亡。
1.2.3.4 交互抗药性测定分别配制含系列质量浓度戊唑醇 (0.031 25、0.062 5、0.125、0.25、0.5、1 μg/mL)、丙环唑 (0.037 5、0.075、0.15、0.3、0.6、0.8 μg/mL)、咯菌腈 (0.012 5、0.025、0.05、0.1、0.2、0.4 μg/mL)、苯醚甲环唑 (0.025、0.05、0.1、0.2、0.4、0.8 μg/mL)、多菌灵 (0.5、1、2、4、6、8 μg/mL)、井冈霉素 (0.1、0.2、0.4、0.8、1.2、1.6 μg/mL)、啶酰菌胺 (0.05、0.1、0.2、0.4、0.8、1.2、1.6 μg/mL) 及氟唑菌苯胺 (0.025、0.05、0.1、0.2、0.4、0.6、0.8 μg/mL) 的PDA平板,采用菌丝生长速率法测定抗噻呋酰胺突变体及亲本菌株对以上药剂的敏感性。将噻呋酰胺对抗性突变体及亲本菌株的EC50值分别作为x轴,其他几种药剂对突变体及亲本菌株的EC50值分别作为y轴,进行线性回归分析,得出回归方程、决定系数 (R2) 及P值,分析噻呋酰胺与其他药剂之间的交互抗性关系[10]。
1.3 数据分析采用SPSS 17.0统计软件进行差异显著性分析、单因子方差分析结合多重比较分析。
2 结果与分析 2.1 玉米纹枯病菌对噻呋酰胺的敏感基线菌丝生长速率法测定结果显示:供试102株玉米纹枯病菌对噻呋酰胺均具有较高的敏感性,其EC50值分布范围为0.010~0.194 μg/mL,平均EC50 值为 (0.086 ± 0.004) μg/mL,偏度 (skew) = 0.298,峰度 (kurt) = –0.298,P = 0.088 4 > 0.05,符合连续偏正态分布,且其敏感性频率分布呈连续单峰曲线 ( 图1)。因此可将其作为山东地区玉米纹枯病菌对噻呋酰胺的敏感基线。
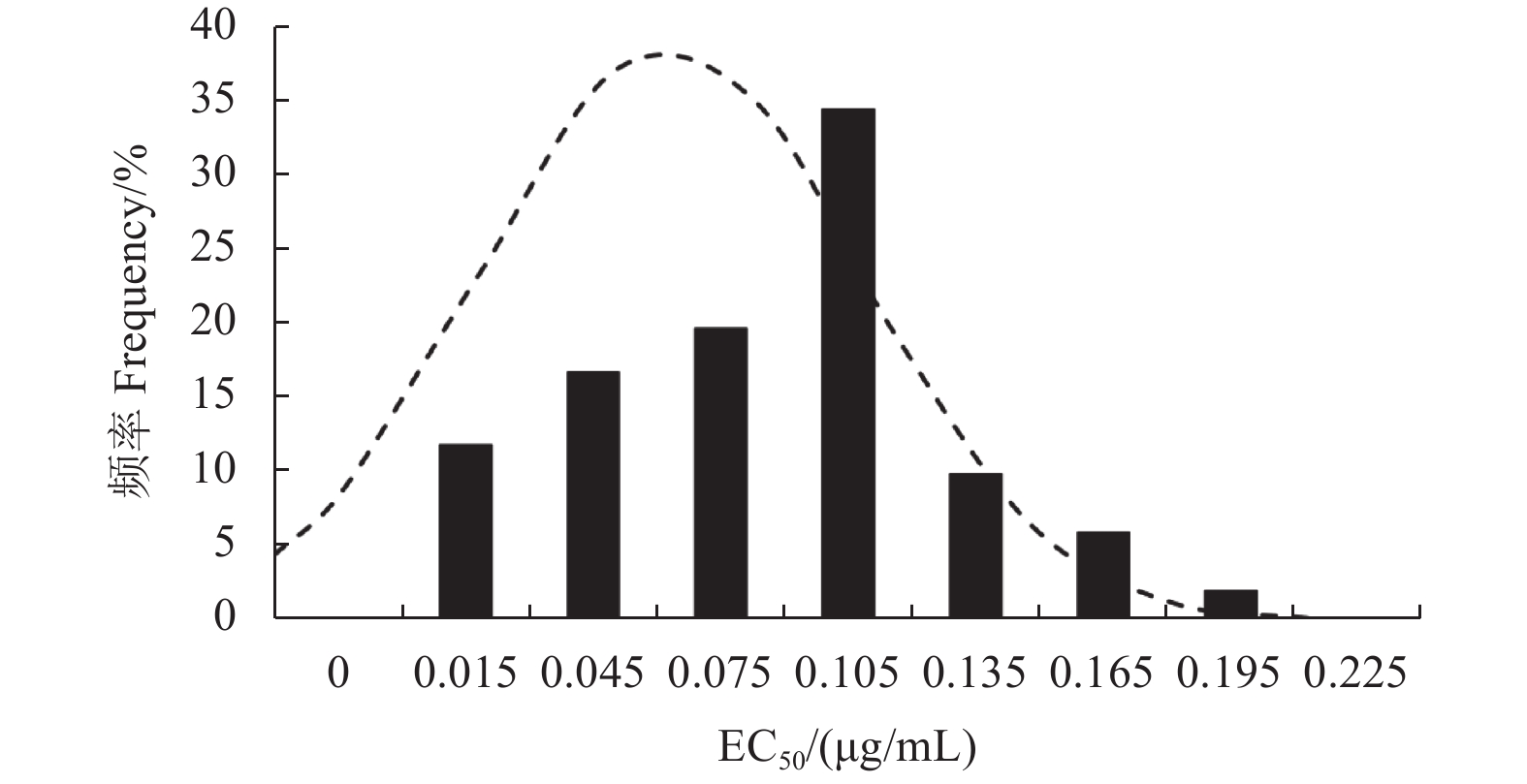
|
图 1 山东省102株玉米纹枯病菌对噻呋酰胺的敏感性频率分布 Fig. 1 Sensitivity distribution of 102 isolates of R. solani to thifluzamide |
2.2 玉米纹枯病菌抗噻呋酰胺突变体
通过紫外诱导方法对随机选取的12个菌株进行抗药性选育,仅从菌株TA3、TA17、LY8、QD14及WF6获得了5株耐药性菌株,分别编号为TA3-X2、TA17-X6、LY8-3、QD14-Y7和WF6-A2,其抗性突变频率为0.87%,抗性水平为6.46~20.08倍。通过药剂驯化方法对12个菌株进行诱导后仅获得1株抗噻呋酰胺的突变体,编号为QD2-Y4,突变频率为0.52%,抗性水平为8.08倍 (表1)。
|
|
表 1 抗性突变体及亲本菌株对噻呋酰胺的敏感性及抗性水平 Table 1 The sensitivity and resistance levels of resistant mutants and parental strains to thifluzamide |
2.3 抗药性突变体的主要生物学性状 2.3.1 抗药性遗传稳定性
由表2可知:抗性突变体及耐药性菌株在不含噻呋酰胺的PDA培养基上连续继代培养12代后,除突变体QD2-Y4对噻呋酰胺的敏感性变化不大以外,其余耐药性菌株敏感性均呈现明显的下降趋势,且随培养代数增加,抗性突变体的EC50值越来越接近各自的亲本菌株 (F0)。表明经紫外诱导获得的5株耐药性菌株其耐药性均不能稳定遗传,而通过药剂驯化获得的突变体QD2-Y4菌株的抗药性可稳定遗传。
|
|
表 2 玉米纹枯病菌抗噻呋酰胺突变体的抗性遗传稳定性 Table 2 Resistance stability of the mutants of R. solani to thifluzamide |
2.3.2 菌丝生长速率和产菌核能力
由表3可知:在24、36及48 h培养期间,除TA3-X2的菌落生长速率显著高于亲本菌株外,其余耐药性菌株及抗性突变体与亲本菌株差异均不明显;5株耐药性菌株和1株抗性突变体的菌丝干重和菌核干重则均显著低于其亲本菌株。
|
|
表 3 抗性突变体与亲本菌株菌丝生长速率和产菌核能力比较 Table 3 The comparison of mycelial growth rate and sclerotial capacity of resistant mutants and parental strains |
2.3.3 致病力
结果见图2。其中,抗性突变体TA3-X2、WF6-A2和QD2-Y4的致病力显著低于各自亲本菌株,病情指数分别下降6.06、15.00和13.34;TA17-X6、LY8-3和QD14-Y7的致病力虽与亲本菌株相比无显著性差异,但整体却低于各自亲本菌株。
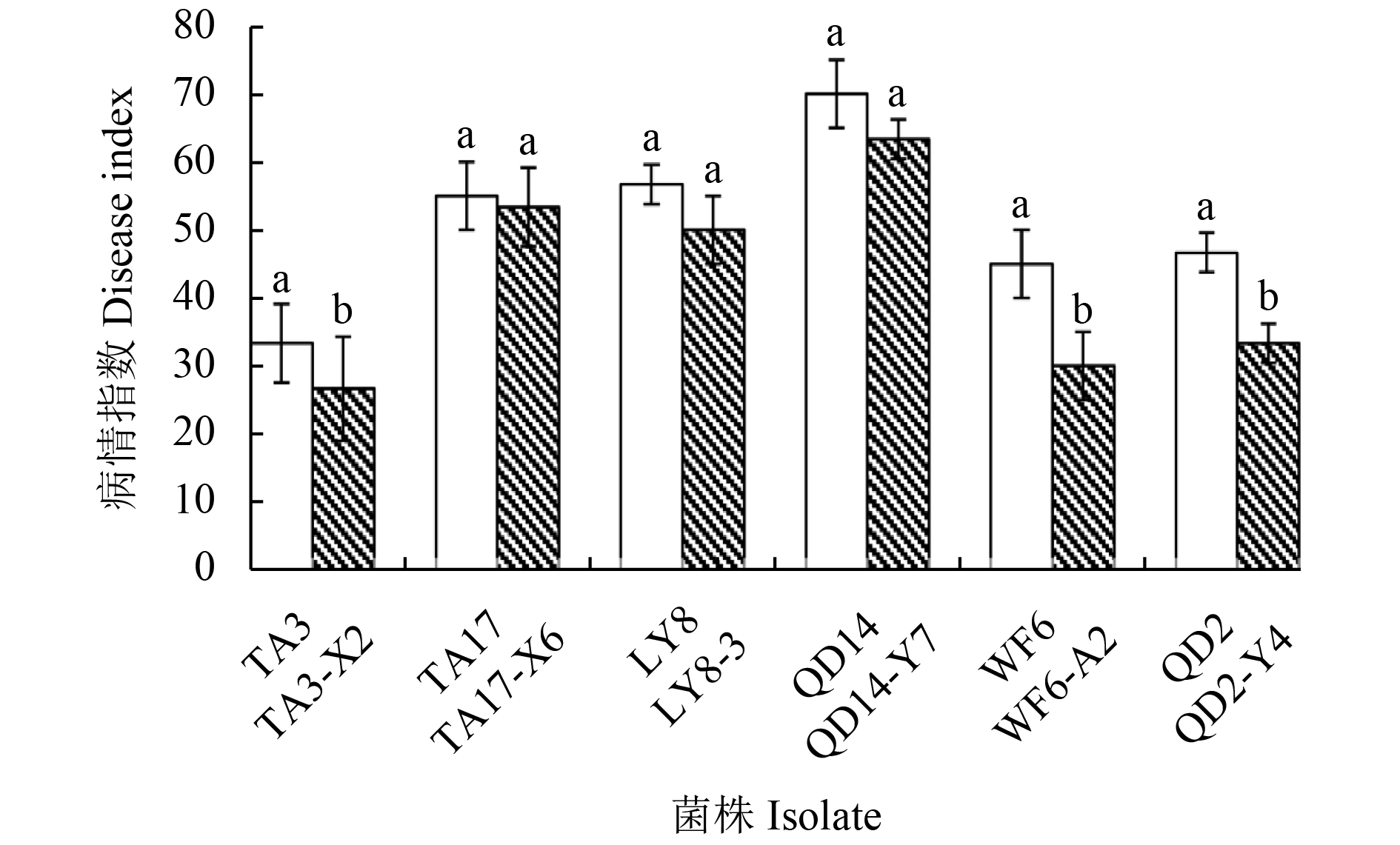
|
注:TA3、TA17、LY8、QD14、WF6和QD2为亲本菌株,其余为噻呋酰胺耐药性菌株和抗性突变体。图中不同字母表示亲本菌株及其突变体对玉米的致病力差异显著 (P = 0.05)。 Note: TA3, TA17, LY8, QD14, WF6 and QD2 are parental isolates, the rest are drug-resistant isolates and resistant mutants to thifluzamide. The different letters in the figure indicate significant differences in pathogenicity of the parental isolates and its mutants to maize. 图 2 亲本菌株及抗性突变体对玉米的致病力 Fig. 2 The pathogenicity of parental isolates and resistant mutants on maize |
2.3.4 抗噻呋酰胺菌系的交互抗药性
由表4可知:抗性突变体及亲本菌株对8种杀菌剂的敏感性由强到弱依次为咯菌腈 > 氟唑菌苯胺 > 戊唑醇 > 苯醚甲环唑 > 啶酰菌胺 > 丙环唑 > 井冈霉素 > 多菌灵。交互抗性测定结果 ( 表5) 表明:噻呋酰胺抗性突变体与戊唑醇、丙环唑、咯菌腈、井冈霉素、苯醚甲环唑及多菌灵6种杀菌剂之间无交互抗性关系,但与氟唑菌苯胺和啶酰菌胺2种同属琥珀酸脱氢酶抑制剂类 (SDHIs) 的药剂之间则存在交互抗性。
|
|
表 4 玉米纹枯病菌抗噻呋酰胺突变体及亲本对8种杀菌剂的敏感性 Table 4 Sensitivity of the thifluzamide-resistant mutants of R. solaniand parental isolates to eight fungicides |
|
|
表 5 玉米纹枯病菌对噻呋酰胺及其他 8 种杀菌剂的交互抗性 Table 5 Cross-resistance between thifluzamide and the other eight fungicides inR solani |
3 结论与讨论
噻呋酰胺作为SDHIs杀菌剂[17],其机理为抑制琥珀酸脱氢酶的合成[18],从而阻碍病原菌线粒体上电子传递,抑制病原菌的生长[19]。研究表明,噻呋酰胺对玉米纹枯病菌具有较高的抑制活性,可作为替代啶酰菌胺和井冈霉素防治纹枯病的药剂,且更为高效[20]。本研究采用菌丝生长速率法测定了山东省不同地区的102株玉米纹枯病菌对噻呋酰胺的敏感性,发现供试菌株对噻呋酰胺仍具有较高的敏感性,其EC50值分布范围为0.010~0.194 μg/mL,平均EC50 值为 (0.086 ± 0.004) μg/mL,且敏感性频率分布为连续单峰曲线,因此可将其作为山东地区玉米纹枯病菌对噻呋酰胺的敏感基线。
在杀菌剂抗性行动委员会 (FRAC) 列出的55种杀真菌药剂中,SDHIs是生产并投放市场的新化合物中增长最快的一类药剂[17]。该类杀菌剂已多次被报道具有抗性风险,如已检测到抗氟吡菌酰胺 (fluopyram) 的黄瓜白粉病菌[21],抗啶酰菌胺的马铃薯早疫病菌Alternaria solani和灰葡萄孢Botrytis cinerea[22-23],以及抗萎锈灵 (carboxin) 的米曲霉Aspergillus oryzae等[24]。噻呋酰胺作为SDHIs杀菌剂,虽然具有很高的生物活性,但由于其作用位点单一,因此抗药性风险较高[25]。本研究通过紫外诱导和药剂驯化各获得5株耐药性菌株和1株抗性突变体,其中,通过紫外诱导获得的耐药性菌株其耐药性并不能稳定遗传,在继代培养中会逐渐丧失,而通过药剂驯化获得的1株抗性突变体在经过12代无药培养后仍具有较高的抗药性,因此认为该菌株抗性能够稳定遗传。此外,生物学特性研究发现,抗性突变体在菌丝生长速率、菌丝干重、菌核干重以及致病力等方面与亲本菌株相当或低于亲本菌株,表明抗性突变体竞争能力不如亲本菌株。交互抗性研究表明,噻呋酰胺抗性突变体仅与同属SDHIs的氟唑菌苯胺和啶酰菌胺2种药剂之间存在交互抗性,而与戊唑醇、丙环唑、咯菌腈、井冈霉素、苯醚甲环唑和多菌灵之间均无交互抗性,因此推测玉米纹枯病菌对噻呋酰胺的抗药性风险为中等,这与Mu等[26]研究发现R. solani对噻呋酰胺产生抗性的风险是低到中等的结果一致。
孙海燕[27]研究发现,小麦纹枯病菌R. cerealis对噻呋酰胺的抗性与其琥珀酸脱氢酶上RCSdhB、RCSdhC和RCSdhD基因的点突变相关,而对本研究中能稳定遗传的抗药性菌株而言,其抗性产生是否与上述3个亚基的点突变有关还有待进一步研究。
| [1] |
PASCUAL, TO DA, RAYMONDO, et al. Characterization by conventional techniques and PCR of Rhizoctonia solani isolates causing banded leaf sheath blight in maize
[J]. Plant Pathol, 2000, 49(1): 108-118. DOI:10.1046/j.1365-3059.2000.00429.x |
| [2] |
黄明波, 谭君, 杨俊品, 等. 玉米纹枯病研究进展[J]. 西南农业学报, 2007, 20(2): 209-213. HUANG M B, TAN J, YANG J P, et al. Research advance on banded leaf and sheath blight of maize[J]. Southwest China J Agric Sci, 2007, 20(2): 209-213. DOI:10.3969/j.issn.1001-4829.2007.02.006 |
| [3] |
吴大椿, 方守国, 余知和. 玉米纹枯病病原及生物学特性研究[J]. 湖北农学院学报, 1997, 17(1): 15-19. WU D C, FANG S G, YU Z H. Studies on the pathogen and biological characteristics of maize sheath blight[J]. J Hubei Agric Coll, 1997, 17(1): 15-19. |
| [4] |
LI H R, WU B C, YAN S Q. Aetiology of Rhizoctonia in sheath blight of maize in Sichuan
[J]. Plant Pathol, 2002, 47(1): 16-21. |
| [5] |
AKHTAR J, JHA K V, KUMAR A, et al. Occurrence of banded leaf and sheath blight of maize in Jharkhand with reference to diversity in Rhizoctonia solani
[J]. Asian J Agric Sci, 2009, 1(2): 32-35. |
| [6] |
徐建强, 平忠良, 党威, 等. 中国河南省小麦纹枯病菌对井冈霉素及甲基立枯磷的敏感性[J]. 农药学学报, 2017, 19(1): 25-31. XU J Q, PING Z L, DANG W, et al. Sensitivity of Rhizoctonia cerealis to jinggangmycin and tolclofos-methyl in Henan Province in China [J]. Chin J Pestic Sci, 2017, 19(1): 25-31. |
| [7] |
SHUMATE R E, STARK C M, SCHEIBLE J J, et al. Process for marking N-alkylaminopolyhois: US5449770[P]. 1995-09-12.
|
| [8] |
仇是胜, 柏亚罗. 琥珀酸脱氢酶抑制剂类杀菌剂的研发进展(I)[J]. 现代农药, 2014, 13(6): 1-7. QIU S S, BO Y L. Progress on research and development of succinate dehydrogenase inhibitor fungicides (I)[J]. Mod Agrochem, 2014, 13(6): 1-7. DOI:10.3969/j.issn.1671-5284.2014.06.001 |
| [9] |
冷鹏, 吴书宝, 徐升华, 等. 噻呋酰胺 240 克/升悬浮剂防治花生白绢病田间药效试验[J]. 农药科学与管理, 2012, 33(2): 51-53. LENG P, WU S B, XU S H, et al. Field trails of thifluzamide 240 g/L SC on peanut sderotium rolfsii sacc[J]. Pestic Sci Administrat, 2012, 33(2): 51-53. DOI:10.3969/j.issn.1002-5480.2012.02.018 |
| [10] |
齐永志, 李海燕, 苏媛, 等. 小麦纹枯病菌对噻呋酰胺的敏感性及抗药性突变体的主要生物学性状[J]. 农药学学报, 2014, 16(3): 271-280. QI Y Z, LI H Y, SU Y, et al. Sensitivity to trifluzamide and main biological characteristics of resistant mutants of Rhizoctonia cerealis [J]. Chin J Pestic Sci, 2014, 16(3): 271-280. DOI:10.3969/j.issn.1008-7303.2014.03.05 |
| [11] |
王成凤. 小麦纹枯病菌 (Rhizoctonia cerealis) 对噻呋酰胺和咯菌腈的抗性风险评估[D]. 南京: 南京农业大学, 2014. WANG C F. Resistance and risk assessment of Rhizoctonia cerealis to thifluzamide and fludioxonil[D]. Nanjing: Nanjing Agricultural University, 2014. |
| [12] |
GEORGOPOULOS S G, DEKKER J. Detection and measurement of fungicide-resistance, general principles[J]. FAO Plant Prot Bull, 1982, 30(2): 39-42. |
| [13] |
赵卫松, 韩秀英, 齐永志, 等. 辣椒疫霉对双炔酰菌胺的敏感性测定及其抗药突变体生物学性状研究[J]. 农药学学报, 2011, 13(1): 21-27. ZHAO W S, HAN X Y, QI Y Z, et al. Study on the sensitivity of Phytophthora capsici to mandipropamid and biological characteristics of resistant mutants [J]. Chin J Pestic Sci, 2011, 13(1): 21-27. DOI:10.3969/j.issn.1008-7303.2011.01.04 |
| [14] |
BRUIN G C A, EDGINGTON L V. Induction of fungal resistance to metalaxyl by ultraviolet irradiation[J]. Phytopathology, 1982, 72(5): 476-480. DOI:10.1094/Phyto-72-476 |
| [15] |
夏晓明. 禾谷丝核菌 (Rhizoctonia cerealis) 对戊唑醇的抗性机制研究[D]. 泰安: 山东农业大学, 2006. XIA X M. Studies on the resistance mechanism of Rhizoctonia cerealis to tebuconazole[D]. Taian: Shandong Agricultural University, 2006. |
| [16] |
孔婷婷, 周晓锟, 高增贵, 等. 东北地区玉米纹枯病菌菌丝融合群鉴定及其致病力研究[J]. 玉米科学, 2013, 21(4): 132-137. KONG T T, ZHOU X K, GAO Z G, et al. Identification of anastomosis groups of Rhizoctonia solani on maize and the pathogenicities in Northeastern of China [J]. J Maize Sci, 2013, 21(4): 132-137. DOI:10.3969/j.issn.1005-0906.2013.04.028 |
| [17] |
SIEROTZKI H, SCALLIET G. A review of current knowledge of resistance aspects for the next-generation succinate dehydrogenase inhibitor fungicides[J]. Phytopathology, 2013, 103(9): 880-887. DOI:10.1094/PHYTO-01-13-0009-RVW |
| [18] |
胡伟群, 宋会鸣, 朱卫刚, 等. 噻呋酰胺与咯菌腈复配对水稻纹枯病的增效作用及田间防效[J]. 农药, 2014, 53(9): 683-684. HU W Q, SONG H M, ZHU W G, et al. Synergistic and field effects of thifluzamide and fludioxonil against Rhizoctonia solani [J]. Agrochemicals, 2014, 53(9): 683-684. |
| [19] |
HE L M, CUI K D, MA D C, et al. Activity, translocation, and persistence of isopyrazam for controlling cucumber powdery mildew[J]. Plant Dis, 2017, 101(7): 1139-1144. DOI:10.1094/PDIS-07-16-0981-RE |
| [20] |
CHEN Y, ZHANG A F, WANG W X, et al. Baseline sensitivity and efficacy of thifluzamide in Rhizoctonia solani
[J]. Ann Appl Biol, 2012, 161(3): 247-254. DOI:10.1111/aab.2012.161.issue-3 |
| [21] |
李良孔. 黄瓜白粉病菌对氟吡菌酰敏感基线的建立及其抗药性风险评估[D]. 长春: 吉林大学, 2011. LI L K. Baseline sensitivity of Podosphaera xanthii to fluopyram and its resistance risk assessment[D]. Changchun: Jilin University, 2011. |
| [22] |
CHEN F, LIU X, CHEN S, et al. Characterization of Monilinia fructicola strains resistant to both propiconazole and boscalid
[J]. Plant Dis, 2013, 97(5): 645-651. DOI:10.1094/PDIS-10-12-0924-RE |
| [23] |
WHARTON P, FAIRCHILD K, BELCHER A, et al. First report of in-vitro boscalid-resistant isolates of Alternaria solani causing early blight of potato in Idaho
[J]. Plant Dis, 2012, 96(3): 454. |
| [24] |
SHIMA Y, ITO Y, KANEKO S, et al. Identification of three mutant loci conferring carboxin-resistance and development of a novel transformation system in Aspergillus oryzae
[J]. Fungal Genet Biol, 2009, 46(1): 67-76. DOI:10.1016/j.fgb.2008.10.005 |
| [25] |
AJAYI-OYETUNDE O O, BUTTS-WILMSMEYER C J, BRADLEY C A. Sensitivity of Rhizoctonia solani to succinate dehydrogenase inhibitor and demethylation inhibitor fungicides
[J]. Plant Dis, 2017, 101(3): 487-495. DOI:10.1094/PDIS-07-16-1015-RE |
| [26] |
MU W, WANG Z, BI Y, et al. Sensitivity determination and resistance risk assessment of Rhizoctonia solani to SDHI fungicide thifluzamide
[J]. Ann Appl Biol, 2017, 170(2): 240-250. DOI:10.1111/aab.12334 |
| [27] |
孙海燕, 李伟, 邓渊钰, 等. 小麦纹枯病菌对噻呋酰胺抗性机制研究[C]//中国植物病理学会 2016 年学术年会论文集. 南京: 中国植物病理学会, 2016. SUN H Y, LI W, DENG Y Y, et al. Study on the resistance mechanism of Rhizoctonia solani[C]//Proceedings of 2016 Annual Meeting of the Chinese Society for Plant Pathology. Nanjing: Chinese Society for Plant Pathology, 2016. |
 2018, Vol. 20
2018, Vol. 20


