2. 华东理工大学 药学院,上海 200237
2. School of Pharmacy, East China University of Science and Technology, Shanghai 200237, China
自然界中,植物对于外来微生物的侵染主要有被动防御和主动防御两个方面[1],其中能够诱导植物产生系统获得抗病性的非生物因子被称为植物诱抗剂。利用弱致病性生物或者非生物因子的诱导,使植物产生抗病性,从而对其他病原生物的侵染均具有较强的抗性,这种抗病性可以从局部扩展到整个植株,被称为植物系统获得抗性 (systemic acquired resistance,SAR)[2]。植物诱抗剂能够减少致病微生物对植株的危害,对植物病害的大面积爆发具有预防作用。
已报道的植物诱抗剂包括寡聚多糖[3]、水杨酸[4-5]、茉莉酸甲酯[6]、β-氨基丁酸 (BABA) [7]、苯并噻二唑 (BTH)[8]和氟唑活化酯 (FBT)[9]等。与传统杀菌剂相比,植物诱抗剂具有微量、广谱、持效期长、不易产生抗药性以及对环境友好等特点[10]。吡唑并嘧啶衍生物 [(E)-N-(2-氟-4-三氟甲基苯乙烯基)-1-甲基-1H-吡唑并[3,4-d]嘧啶-4-胺,简称BDO-1] 和哒嗪酮衍生物 [4-羟基-1-(4-甲氧基苯基)-6-氧代-1,6-二氢吡嗪-3-甲酸甲酯,简称PDZ-1] 是由华东理工大学以开发诱导抗病激活剂为出发点创制的新化合物,结构式见图式1[11-12]。
为了明确2个化合物的诱导抗病活性及应用条件,笔者从化合物是否存在杀菌活性、诱导抗病活性高低、产生诱导抗病的条件筛选及田间防治效果验证等方面开展了相关研究。现将结果报道如下。
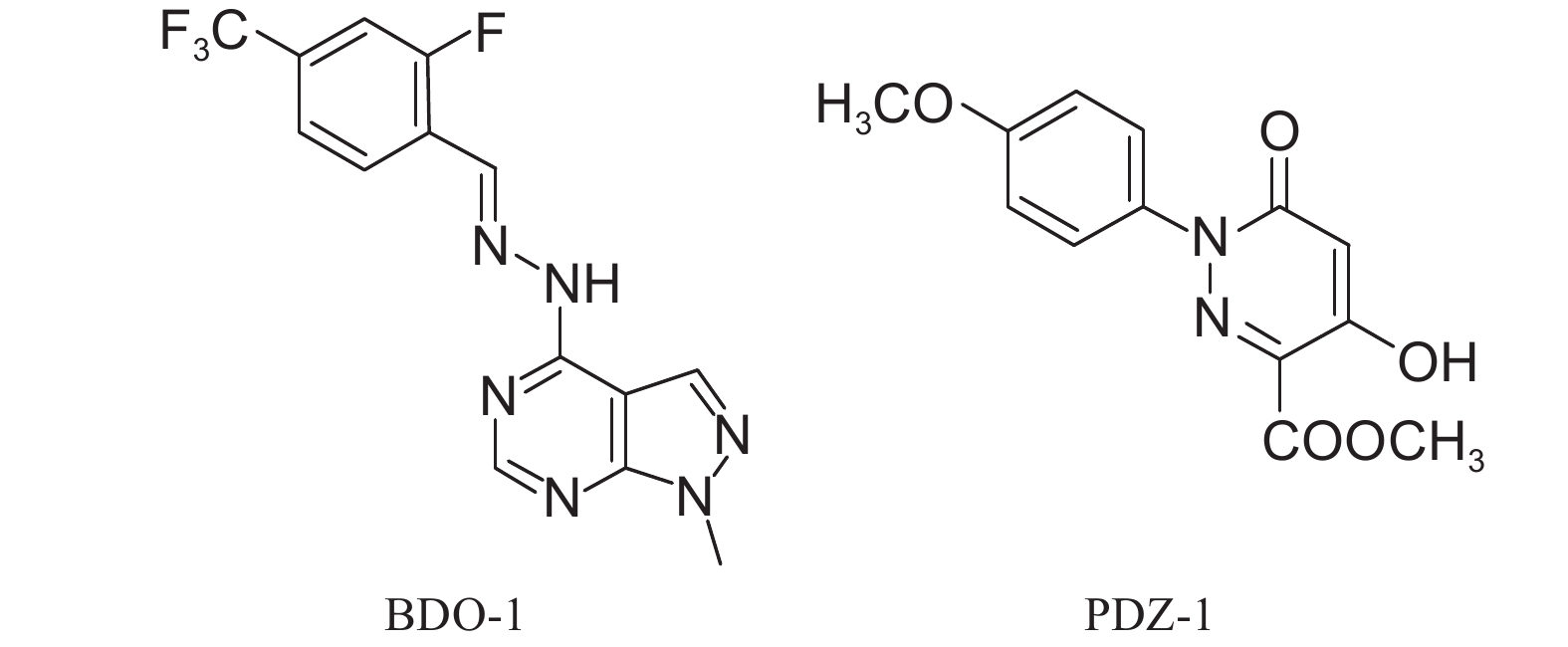
|
图式1 化合物BDO-1和PDZ-1的结构式 Scheme1 The structural formula of compound BDO-1 and PDZ-1 |
1 材料与方法 1.1 供试材料 1.1.1 药剂及试剂
吡唑并嘧啶衍生物BDO-1和哒嗪酮衍生物PDZ-1,纯度均为98%,由华东理工大学合成并提供;95%苯并噻二唑 (BTH) 原药和97%氟唑活化酯原药 (1,2,3-benzothiadiazole-7-carboxylic acid,2,2,2-trifluoroethyl ester,FBT),由华东理工大学合成并提供。50%烯酰吗啉可湿性粉剂 (dimethomorph WP),由山东省青岛瀚生生物科技股份有限公司生产 (作为番茄早疫病和辣椒疫病评价的对照药剂);70%甲基硫菌灵可湿性粉剂 (thiophanate-metlyl WP),由深圳诺普信农化股份有限公司生产;20%噻唑锌悬浮剂 (znthiazole SC),由浙江新农化工股份有限公司生产;75%百菌清 (chlorothalonil WP) 可湿性粉剂,由陕西亿农高科药业有限公司生产。二甲基亚砜 (DMSO) 和 吐温-80均购自北京酷来搏科技有限公司。
1.1.2 供试菌株尖孢镰孢菌Fusarium oxysporum(编号HG1501064706)、丁香假单胞菌流泪致病种Pseudomonas syringae pv. lachrymans(编号HG1202080102)、辣椒疫霉Phytophthora capsici(编号LJ12010802)、多主棒孢Corynespora cassiicola(编号HG07032001)、茄链格孢Alternaria solai(编号FQ09012003) 和茄匍柄霉Stemphylium solani(编号FQ150115020401),均由中国农业科学院蔬菜花卉研究所保存并提供,经鉴定具有较强致病性。古巴假霜霉菌Pseudoperospora cubensi,采自中国农业科学院蔬菜花卉研究所温室黄瓜苗上。
1.1.3 供试蔬菜品种黄瓜Cucumis sativus L.为‘中农 6 号’、番茄Lycopersicon esculentum Mill.为‘中杂105’、辣椒Capsicum annuum L.为‘中椒 6号’,由中国农业科学院蔬菜花卉研究所提供。
1.2 离体抑菌活性测定采用菌丝生长速率法[13]。将黄瓜的尖孢镰孢菌及多主棒孢菌活化后扩繁到PDA上,培养 3~5 d,待菌丝长满培养基表面备用。药剂配制、菌株接种及调查方法参考农药室内生物测定试验准则[14]进行。BDO-1和PDZ-1各设1、10、25和50 mg/L 4个质量浓度,以10 mg/L的BTH、FBT及相应杀菌剂 (70%甲基硫菌灵WP 400 mg/L和75%百菌清WP 750 mg/L) 为对照,另设溶剂对照和清水对照。每处理均设3 次重复。接种菌饼后于 25 ℃恒温箱中培养,待空白对照长满培养皿后,用十字交叉法测量菌落直径。待清水对照长满平板后调查菌丝生长情况,记录菌落生长直径,计算抑制率。
1.3 诱导抗病性研究分别将化合物BDO-1、PDZ-1和对照药剂BTH用DMSO和吐温-80 (DMSO加入量占总体积的 2%,吐温-80加入量占总体积的0.1%) 溶解后加入无菌水,配制成有效成分质量浓度分别为1、10、25和50 mg/L 的药液。采用室内盆栽试验法,于黄瓜两叶一心期、番茄四叶期及辣椒四叶期进行喷雾施药 (均匀喷施到叶片的正面和背面,以叶面雾滴均匀一致为宜),施药量为每株100 μL。每隔 5 d 施药 1 次,共施药3 次,最后一次施药 24 h 后接种。施用过程中用地膜将幼苗地上部分与地下部分隔开,避免药剂接触到土壤。以相应病害常用杀菌剂作为预防对照,叶部病害采用叶面喷雾方式施药,土传病害采用灌根方式施药。清水对照用清水喷雾处理供试植株叶面。古巴假霜霉菌、多主棒孢、茄链格孢和茄匍柄霉均采用喷雾方式接种,接种浓度为1 × 106 个/mL 孢子;丁香假单胞菌流泪致病病种也采用喷雾方式接种,接种浓度为1 × 106 cfu/mL;尖孢镰孢菌和辣椒疫霉采用伤根灌根方式接种[15],接种时用1 cm宽、1 mm厚塑料板插入植株四周的土中,3~4次/钵,以达到伤根的目的,接种浓度为每毫升含1 × 106 个孢子,每株灌施20 mL。待清水处理发病均匀时调查发病情况。病害调查方法、安全性评价方法和病情指数的计算,黄瓜霜霉病参照文献方法[16]进行,黄瓜棒孢叶斑病、番茄早疫病和番茄灰叶斑病参照文献方法[17],黄瓜枯萎病和辣椒疫病参文献方法[18]。
1.4 化合物对2种蔬菜病害施用条件筛选采用温室内盆栽试验法,以黄瓜枯萎病和黄瓜棒孢叶斑病为对象,分别设定BDO-1和PDZ-1的质量浓度为10 mg/L,各诱导 3 次,诱导间隔期分别为3、5、7 d,以研究化合物诱导间隔期对防治效果的影响;另设诱导间隔期为 5 d,分别诱导1、3、5次,以研究化合物诱导次数对防治效果的影响。药剂的配制、施药和接种方法同1.2节。
1.5 化合物对黄瓜枯萎病的田间防治效果于2017年9月在北京市海淀区中国农业科学院蔬菜花卉研究所所区农场进行防治效果的田间验证。试验地土质为棕壤,有机质含量2.7%,碱解氮116 mg/kg,pH=6.7。
从黄瓜四片真叶期采用1.4节中筛选出的最适条件开始施用BDO-1和PDZ-1,药液配制、施药方法、接种及调查方法均同1.2节。设BTH为诱导抗病剂对照,70%甲基硫菌灵WP为杀菌剂对照,清水灌根处理为阴性对照。每处理3次重复,每重复1个小区,每小区面积约15 m2,随机区组排列。
1.6 数据统计与分析以上所有试验均重复2次,最终结果以平均值计算。
利用 Excel和SPSS 17. 0 软件中 ANOVA 方法对试验数据进行方差分析,并用 Duncan’s 新复极差法比较数据之间的差异显著性。
2 结果与分析 2.1 化合物的离体杀菌活性测定结果 (表1) 表明,供试化合物在1、10、25和50 mg/L下对尖孢镰孢菌和多主棒孢菌菌的抑制率均显著低于杀菌剂甲基硫菌灵和百菌清,但与对照诱导抗病剂BTH和FBT无显著差异。表明BDO-1和PDZ-1本身对2种病原菌无杀菌活性。
|
|
表 1 BDO-1和PDZ-1对两种蔬菜病害病原菌的离体杀菌活性 Table 1 Fungicidal activities BDO-1 and PDZ-1 against pathogens of two vegetable diseases in vitro |
2.2 化合物的诱导抗病性
将化合物BDO-1和PDZ-1喷施到蔬菜叶面后,发现其对7种蔬菜病害均有不同程度的防治效果,其中,BDO-1在10 mg/L下对黄瓜细菌性角斑病、棒孢叶斑病、枯萎病、霜霉病及对番茄早疫病、灰叶斑和辣椒疫病的防治效果均达50%以上;PDZ-1在10 mg/L下对黄瓜细菌性角斑病和棒孢叶斑病防治效果较好,分别为62.33%和59.15%,且各处理最适浓度下的防治效果均高于对照诱导抗病剂BTH(表2)。
|
|
表 2 BDO-1和 PDZ-1对蔬菜主要病害的诱导抗病性 Table 2 Induced resistance on the main diseases of vegetables by BDO-1and PDZ-1 |
2.3 化合物的施药条件 2.3.1 诱导间隔期的筛选
由表3数据可以看出:在10 mg/L的剂量下,当诱导间隔期为5 d时,BDO-1和PDZ-1对黄瓜枯萎病的防治效果均达最高,分别为69.17%和44.65%,前者高于BTH (52.67%) 和FBT(56.92%);同样,当诱导间隔期为5 d时,BDO-1和PDZ-1对黄瓜棒孢叶斑病的防治效果也均为最高,分别为63.0%和51.91%。综上所述,采用化合物BDO-1和PDZ-1在10 mg/L的剂量下诱导5次,最佳间隔期为5 d。
|
|
表 3 化合物的诱导间隔期对2种蔬菜病害防治效果的影响 Table 3 Effect of induction interval of two compounds on the resistance effects of two kinds of vegetable diseases |
2.3.2 诱导次数的筛选
由表4可以看出:在10 mg/L的剂量下施药诱导5次,BDO-1和PDZ-1对黄瓜枯萎病的防治效果均最好,分别为56.77%和54.9%,高于对照BTH(46.87%) 和FBT(54.29%);对于防治黄瓜棒孢叶斑病,BDO-1和PDZ-1也均为诱导5次时的防治效果最高,分别为67.44%和56.64%。由此可知,化合物BDO-1和PDZ-1对黄瓜枯萎病和棒孢叶斑病的最佳诱导次数均为5次。
|
|
表 4 化合物的诱导次数对2种蔬菜病害防治效果的影响 Table 4 Effects of the number of induction of two compounds on the resistance of two kinds of vegetable diseases |
2.4 田间防治效果
田间试验结果 (表5) 表明:BDO-1对黄瓜枯萎病的防治效果达62.95%,显著高于对照诱导抗病剂 BTH (35.84%) 和对照杀菌剂70%甲基硫菌灵WP (58.75%);PDZ-1的防治效果为48.45%,也显著高于BTH (35.84%)。此外,BTH有轻微药害,表现为叶片颜色轻微变淡,而BDO-1和PDZ-1则对黄瓜生长无影响。田间试验结果与盆栽结果趋势一致。
|
|
表 5 化合物对黄瓜枯萎病的田间防治效果 Table 5 Effect of control efficacy against cucumber wilt by two compounds in field |
3 结论与讨论
本研究结果表明,新化合物吡唑并嘧啶衍生物BDO-1及哒嗪酮衍生物PDZ-1对多种蔬菜病害具有诱导抗病活性,抗病作用广谱,且其在10 mg/L下诱导5次、间隔期为5 d时防治效果最佳。与传统的商品化植物抗病激活剂相比,BDO-1及PDZ-1的化学结构突破了只有噻二唑的结构限制,是两类具有全新母体结构的具有植物抗病激活活性的化合物,这为植物抗病激活剂的多样性衍生及广泛应用提供了工作基础。
人工合成的诱导抗病剂是在结构上不同于天然植物诱导抗病剂的小分子化合物,但其可通过模仿天然诱导抗病剂或防御信号分子与寄主的相互作用来触发防御反应[19]。水杨酸 (SA) 是研究最早的天然植物防御激素。研究发现,外源刺激可以引发植株水杨酸水平的增强[20-21]。异烟酸 (INA) 和苯并噻二唑 (BTH) 模拟水杨酸的相关防御机制,但对植物毒性更低,因此在植物的基础防御和科研领域中被广泛应用[22-24],其中BTH是最常用的植物诱导抗病剂[25-30],在美国已被登记使用多年[31]。随着近年来组合化学的发展,出现了大量与INA和BTH或其他已存在的合成诱导抗病剂具有不同防御诱导性质的新化合物[32-33],如:水杨酸类似物噻二唑类、异噻唑类、吡啶类、吡唑类和氯代水杨酸类等,IMPRIMATINS类似物如哒嗪类、呋喃苯丙基类,磺酰胺类似物如苯环酰胺等,己二酸衍生物如FGA、N1、N2等,茉莉酸类及β-氨基丁酸等。氟唑活化酯 (FBT) 为中国自主研发的水杨酸类似物,已由南通泰禾化工股份有限公司获得新农药原药和制剂的登记 (农药登记号 LS20150091和 LS20150102)。研究发现,FBT在离体条件下对黄瓜枯萎病菌Fusarium oxysporum和大白菜根肿病菌Plasmodiophora brassicae无杀菌活性,但对黄瓜枯萎病、大白菜根肿病和黄瓜猝倒病等具有诱导抗病作用[34-36]。本研究发现,新创制化合物吡唑并嘧啶衍生物BDO-1和哒嗪酮衍生物PDZ-1在离体条件下对供试病原菌并无杀菌活性,但在10 mg/L下对7种蔬菜病害均有一定的防治效果,具有广谱诱导抗病作用,可作为植物抗病激活剂使用。本研究针对化学杀菌剂使用频繁、抗药性风险性高等问题,利用诱导抗病激活剂广谱、无抗药性的特点,研究了BDO-1 和PDZ-1对几种主要蔬菜病害的诱导抗病表达及应用技术,以期为BDO-1、PDZ-1在田间应用的可能性及未来的商品化提供技术参考。
| [1] |
范志金, 刘秀峰, 刘凤丽, 等. 植物抗病激活剂诱导植物抗病性的研究进展[J]. 植物保护学报, 2005, 32(1): 87-92. FAN Z J, LIU X F, LIU F L, et al. Progress of researches on induced resistance of plant activator[J]. Acta Phytophylacica Sinica, 2005, 32(1): 87-92. DOI:10.3321/j.issn:0577-7518.2005.01.018 |
| [2] |
蔡新忠, 郑重. 植物系统性获得抗病性的产生机理和途径[J]. 植物保护学报, 1999, 26(1): 83-90. CAI X Z, ZHENG Z. Mechanisms and pathways of plant systemic acquired resistance[J]. Acta Phytophylacica Sinica, 1999, 26(1): 83-90. DOI:10.3321/j.issn:0577-7518.1999.01.017 |
| [3] |
陈娅斐, 冯斌, 赵小明, 等. 壳寡糖诱导转反义 mapk 基因烟草的 TMV 抗性和 PAL 活性研究
[J]. 应用与环境生物学报, 2005, 11(6): 665-668. CHEN Y F, FENG B, ZHAO X M, et al. PAL Activity and TMV inhibition ability in transformed antisense mapk tobacco induced by oligochitosan [J]. Chin J Appl Environ Biol, 2005, 11(6): 665-668. DOI:10.3321/j.issn:1006-687X.2005.06.003 |
| [4] |
CIPOLLINI D, ENRIGHT S, TRAW M B, et al. Salicylic acid inhibits jasmonic acid-induced resistance of Arabidopsis thaliana to Spodoptera exigua
[J]. Mol Ecol, 2004, 13(6): 1643-1653. DOI:10.1111/mec.2004.13.issue-6 |
| [5] |
丁秀英, 苏宝林, 张军, 等. 水杨酸在植物抗病中的作用[J]. 植物学通报, 2001, 18(2): 163-168. DING X Y, SU B L, ZHANG J, et al. Role of salicylic acid in plant disease resistance[J]. Chin Bull Bot, 2001, 18(2): 163-168. DOI:10.3969/j.issn.1674-3466.2001.02.006 |
| [6] |
董桃杏, 蔡昆争, 张景欣, 等. 茉莉酸甲酯 (MeJA) 对水稻幼苗的抗旱生理效应[J]. 生态环境学报, 2007, 16(4): 1261-1265. DONG T X, CAI K Z, ZHANG J X, et al. The physiological roles of methyl jasmonate (MeJA) in drought resistance of rice seedlings[J]. Ecol Environ, 2007, 16(4): 1261-1265. DOI:10.3969/j.issn.1674-5906.2007.04.038 |
| [7] |
王静, 王海霞, 田振东. β-氨基丁酸诱导马铃薯对晚疫病的抗性组织化学及信号传导途径分析
[J]. 中国农业科学, 2014, 47(13): 2571-2579. WANG J, WANG H X, TIAN Z D. Histochemical assays and signaling pathway analysis of β-aminobutyric acid induced resistance in potato against Phytophthora infestans [J]. Scientia Agricultura Sinica, 2014, 47(13): 2571-2579. DOI:10.3864/j.issn.0578-1752.2014.13.009 |
| [8] |
LAWTON K A, FRIEDRICH L, HUNT M, et al. Benzothiadiazole induces disease resistance in Arabidopsis by activation of the systemic acquired resistance signal transduction pathway
[J]. Plant J, 1996, 10(1): 71-82. DOI:10.1046/j.1365-313X.1996.10010071.x |
| [9] |
石延霞, 王微微, 柴阿丽, 等. 2,2,2-三氟乙基苯并[1,2,3]噻二唑-7-甲酸酯对黄瓜霜霉病的诱导抗病性[J]. 农药学学报, 2011, 13(4): 419-422. SHI Y X, WANG W W, CHAI A L, et al. Resistance of cucumber to downy mildew induced by novel elicitor candidate, TBTC (1,2,3-benzothiadiazole-7-carboxylic acid, 2,2,2-trifluoroethyl ester)[J]. Chin J Pest Sci, 2011, 13(4): 419-422. DOI:10.3969/j.issn.1008-7303.2011.04.15 |
| [10] |
邱德文. 植物免疫诱抗剂的研究进展与应用前景[J]. 中国农业科技导报, 2014, 16(1): 39-45. QIU D W. Progress and prospect of plant immunity inducer[J]. J Agric Sci Technol, 2014, 16(1): 39-45. |
| [11] |
徐玉芳, 赵振江, 朱维平, 等. 一种吡唑并嘧啶化合物及其用途: CN 201310067016.X[P]. 2017-11-03. XU Y F, ZHAO Z J, ZHU W P, et al. Pyrazolo pyrimidine compound and application thereof: CN 201310067016.X[P]. 2017-11-03. |
| [12] |
徐玉芳, 赵振江, 朱维平, 等. 哒嗪酮类化合物及其用途: CN 201210328143.6[P]. 2014-03-26. XU Y F, ZHAO Z J, ZHU W P, et al. Pyridazine ketone compound and use thereof: CN 201210328143.6[P]. 2014-03-26. |
| [13] |
方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998. FANG Z D. Methodology for plant pathology[M]. 3rd ed. Beijing: China Agriculture Press, 1998. |
| [14] |
农药室内生物测定试验准则 杀菌剂 第 2 部分: 抑制病原真菌菌丝生长试验 平皿法: NY/T 1156.2—2006[S]. 北京: 中国农业出版社, 2006. Pesticides guidelines for laboratory bioactivity tests. Part 2: petri plate test for determining fungicide inhibition of mycelial growth: NY/T 1156.2—2006[S]. Beijing: China Agriculture Press, 2006. |
| [15] |
谢丙炎, 李惠霞, 冯兰香. β-氨基丁酸诱导甜(辣)椒抗疫病作用的研究
[J]. 园艺学报, 2002, 29(2): 137-140. XIE B Y, LI H X, FENG L X. Induction of resistance to Phytophthora capsici in pepper plants by DL-β-amino-n-butyric acid [J]. Acta Horticulturae Sinica, 2002, 29(2): 137-140. DOI:10.3321/j.issn:0513-353X.2002.02.010 |
| [16] |
农药田间药效实验准则(一)杀菌剂防治黄瓜霜霉病: GB/T 17980.26—2000[S]. 北京: 中国标准出版社, 2000. Pesticide-Guidelines for the field efficacy trials (Ⅰ).Fungicides against downy mildew of cucumber: GB/T 17980.26—2000[S]. Beijing: Standards Press of China, 2000. |
| [17] |
农药田间药效实验准则(一)杀菌剂防治蔬菜叶斑病: GB/T 17980.27—2000[S]. 北京: 中国标准出版社, 2000. Pesticide-guidelines for the field efficacy trials (Ⅰ).Fungicides against leaf spot of vegetables: GB/T 17980.27—2000[S]. Beijing: Standards Press of China, 2000. |
| [18] |
农药田间药效实验准则(一)杀菌剂防治辣椒疫病: GB/T 17980.32—2000[S]. 北京: 中国标准出版社, 2000. Pesticide-Guidelines for the field efficacy trials (Ⅰ).Fungicides against pepper phytophthora blight: GB/T 17980.32—2000[S]. Beijing: Standards Press of China, 2000. |
| [19] |
SREEJA S J. Synthetic plant activators for crop disease management-a review[J]. International Journal of Thesis Projects and Dissertations, 2014, 2(1): 19-28. |
| [20] |
GUO A L, SALIH G, KLESSIG D F. Activation of a diverse set of genes during the tobacco resistance response to TMV is independent of salicylic acid; induction of a subset is also ethylene independent[J]. Plant J, 2000, 21(5): 409-418. DOI:10.1046/j.1365-313x.2000.00692.x |
| [21] |
MANDAL S, MALLICK N, MITRA A. Salicylic acid-induced resistance to Fusarium oxysporum f. sp. lycopersici in tomato
[J]. Plant Physiol Biochem, 2009, 47(7): 642-649. DOI:10.1016/j.plaphy.2009.03.001 |
| [22] |
HIJWEGEN T, VERHAAR M A, ZADOKS J C. Resistance to Sphaerotheca pannosa in roses induced by 2,6-dichloroisonicotinic acid
[J]. Plant Pathol, 1996, 45(4): 631-635. DOI:10.1046/j.1365-3059.1996.d01-180.x |
| [23] |
FAORO F, MAFFI D, CANTU D, et al. Chemical-induced resistance against powdery mildew in barley: the effects of chitosan and benzothiadiazole[J]. Biocontrol, 2008, 53(2): 387-401. DOI:10.1007/s10526-007-9091-3 |
| [24] |
KANG N J. Induced resistance to powdery mildew by 2,6-dichloroisonicotinic acid is associated with activation of active oxygen species-mediated enzymes in cucumber plants[J]. J Jpn Soc Hortic Sci, 2009, 78(2): 185-194. DOI:10.2503/jjshs1.78.185 |
| [25] |
QU Y, WANG Y Y, YIN Q S, et al. Multiple biological processes involved in the regulation of salicylic acid in Arabidopsis response to NO2 exposure
[J]. Environ Exp Bot, 2018, 149: 9-16. DOI:10.1016/j.envexpbot.2018.02.003 |
| [26] |
NAYEM S A, ALI M S, HOSSAIN M B, et al. Role of benzothiadiazole and peak performance nutrient on inducing resistance in Citrus aurantifolia against Xanthomonas axonopodis pv. citri
[J]. Aust J Crop Sci, 2018, 12(3): 335-342. DOI:10.21475/ajcs |
| [27] |
REN Y L, WANG Y F, YANG B, et al. Postharvest BTH treatment induced disease resistance and enhanced reactive oxygen species metabolism in muskmelon (Cucumis melo L.) fruit
[J]. Eur Food Res Technol, 2012, 234(6): 963-971. DOI:10.1007/s00217-012-1715-x |
| [28] |
IRITI M, FAORO F. Benzothiadiazole (BTH) induces cell-death independent resistance in Phaseolus vulgaris against Uromyces appendiculatus
[J]. J Phytopathol, 2003, 151(3): 171-180. DOI:10.1046/j.1439-0434.2003.00700.x |
| [29] |
王莉, 黄丽丽, 康振生, 等. BTH 诱导黄瓜对霜霉病的抗性[J]. 植物病理学报, 2005, 35(3): 274-277. WANG L, HUANG L L, KANG Z S, et al. Efficiency of cucumber resistance induced by BTH to downy mildew[J]. Acta Phytopathologica Sinica, 2005, 35(3): 274-277. DOI:10.3321/j.issn:0412-0914.2005.03.015 |
| [30] |
GOZZO F. Systemic acquired resistance in crop protection: from nature to a chemical approach[J]. J Agric Food Chem, 2003, 51(16): 4487-4503. DOI:10.1021/jf030025s |
| [31] |
BEKTAS Y, EULGEM T. Synthetic plant defense elicitors[J]. Front Plant Sci, 2015, 5: 804. |
| [32] |
SVOBODA J, BOLAND W. Plant defense elicitors: analogues of jasmonoyl-isoleucine conjugate[J]. Phytochemistry, 2010, 71(13): 1445-1449. DOI:10.1016/j.phytochem.2010.04.027 |
| [33] |
石延霞, 徐玉芳, 谢学文, 等. 氟唑活化酯对黄瓜抗枯萎病的诱导作用[J]. 中国农业科学, 2015, 48(19): 3848-3856. SHI Y X, XU Y F, XIE X W, et al. Effects of FBT on induction of systemic resistance in cucumber against cucumber fusarium wilt caused by Fusarium oxysporum f. sp. cucumerinum Owen [J]. Scientia Agricultura Sinica, 2015, 48(19): 3848-3856. DOI:10.3864/j.issn.0578-1752.2015.19.007 |
| [34] |
石延霞, 韩之琪, 谢学文, 等. 氟唑活化酯诱导大白菜抗根肿病的研究[J]. 中国生物防治学报, 2015, 31(6): 907-912. SHI Y X, HAN Z Q, XIE X W, et al. Resistance of Chinese cabbage to Plasmodiophora brassicae under induction of fluoro-substituted benzothiadiazole derivatives [J]. Chin J Biol Control, 2015, 31(6): 907-912. |
| [35] |
韩之琪, 谢学文, 晋知文, 等. 氟唑活化酯诱导大白菜抗根肿病效果与机理初步研究[J]. 园艺学报, 2015, 42(4): 697-705. HAN Z Q, XIE X W, JIN Z W, et al. Systemic resistance induced by fluoro-substituted benzothiadiazole derivatives against Plasmodiophora brassicae in Chinese cabbage [J]. Acta Horticulturae Sinica, 2015, 42(4): 697-705. |
| [36] |
陈仕红, 纪明山, 左平春, 等. 氟唑活化酯诱导黄瓜抗猝倒病及其对黄瓜苗期生理指标的影响[J]. 农药学学报, 2016, 18(2): 207-212. CHEN S H, JI M S, ZUO P C, et al. Resistance induced by fluoro-substituted benzothiadiazole derivatives against cucumber damp-off and its effects on the physiological index of cucumber seedlings[J]. Chin J Pestic Sci, 2016, 18(2): 207-212. |
 2018, Vol. 20
2018, Vol. 20


