松脂二烯 (pinolene) 是存在于松脂的环烯烃二聚物。研究表明:松脂二烯可用作抗蒸腾剂,防止叶片枯萎变黄,其与农药混用,可提高农药在叶片上的润湿性和铺展性[1]。Moftah等[2]发现,松脂二烯可在植物叶片表面形成薄膜,并可降低阿拉伯地区植物蒸腾速率。Kosteckas等[3]发现,松脂二烯有天然杀菌效果,搭配氨基甲酸酯类杀菌剂施用,能够覆盖在甘蓝型冬油菜Brassica napus var. oleifera的长角果表面,有效控制菌核病菌Sclerotinia sclerotiorum和黑腐病菌Botrytis cinerea,并可抑制果实开裂,表明松脂二烯可作为农药的喷雾成膜助剂,提高农药防治效果,但对其作用机制未做研究。
笔者采用人工降雨和氙灯光照,对松脂二烯的抗雨水冲刷能力和抗光解能力进行了定量分析;通过光合测定仪,分析了松脂二烯对植物光合作用的影响;通过扫描电镜对松脂二烯在植物叶片表面上的成膜性能进行了表征。旨在为松脂二烯作为植物叶面喷雾成膜助剂的应用提供数据和理论支撑。
1 材料与方法 1.1 试验仪器Waters-class超高效液相色谱仪和Waters 600型高效液相色谱仪 (美国 Waters 公司);LI-6800便携式光合测定仪 (美国LICOR公司);PW-100-011扫描电镜 (荷兰PhenomWorld公司);ZK-3-10人工降雨模拟器 (北京知控高科技术有限公司);350W高压氙灯 (上海电光器件厂);GXZ智能型光照培养箱 (宁波江南仪器厂);ODS填料-净化柱 (日本大曹株式会社)。
1.2 供试植物及药剂供试植物:红叶石楠Photinia × fraseri Dress.及山核桃Carya cathayensis Sarg.,种植于浙江农林大学东湖校区试验基地,均长势良好。
99%噻虫啉 (thiacloprid) 标准品和95%甲氨基阿维菌素苯甲酸盐 (emamectin benzoate,以下简称甲维盐) 标准品(上海阿拉丁生化科技股份有限公司);3%噻虫啉微囊悬浮剂 (南通功成精细化工有限公司);2%甲维盐微乳剂 (浙江世佳科技有限公司);60%松脂二烯乳油 (pinolene EC,商品名:Vapor Gard,美国Miller Aide公司)。
将3%噻虫啉微囊悬浮剂用水稀释成1 L有效成分质量浓度为1 320 mg/L的噻虫啉悬浮液,标记为T,分别加入20 g和50 g质量分数为 60%的松脂二烯乳油,充分搅拌后标记为T + 1.2%Pinolene和T + 3%Pinolene;将2%甲维盐微乳剂用水稀释成1 L有效成分质量浓度为200 mg/L的溶液后,标记为Em,分别加入20 g和50 g的60%松脂二烯乳油,充分搅拌后标记为Em + 1.2%Pinolene和Em + 3%Pinolene。
1.3 药液在植物叶片上的成膜性能表征分别选取9株长势相近的健康红叶石楠,分为3组,每组3株。用手持喷雾器分别向叶片均匀喷施T + 1.2%pinolene和T + 3%Pinolene,直至有药液从叶片上滴下时止,以喷施等量的T + 清水作为对照。24 h后,分别选取植株顶端大小一致的叶片进行真空喷金处理,采用PW-100-011扫描电镜观测形貌并拍照[4-5]。
1.4 抗雨水冲刷试验在山核桃种植园中收集大小相近的新鲜山核桃叶,采用移液枪将225 μL的T、T + 1.2%Pinolene 和 T + 3%Pinolene均匀涂布于每张叶片表面。山核桃叶分为3组,每组5片,3次重复。采用10%动力下的小雨喷头进行模拟降雨,雨强为8 mm/h,分别采集降雨后0、0.5、1、2和4 h后的样品,待测。
1.5 叶片上噻虫啉保持量分析 1.5.1 噻虫啉标准溶液配制先用甲醇将噻虫啉标准品配制成50.0 mg/L的噻虫啉标准储备液,再用甲醇稀释成质量浓度分别为0.2、0.5、1.0、10.0和50.0 mg/L的噻虫啉系列标准溶液。
1.5.2 样品前处理参考文献方法[6-7]进行。准确称取1.0 g山核桃叶,剪碎,置于50 mL离心管中,加入10 mL甲醇,超声振荡提取3 min,于5 000 r/min下离心5 min,取上清液于25 mL圆底烧瓶中;再用2 mL甲醇提取叶片残渣,离心,合并上清液,在40 ℃下低压浓缩至近干,用2 mL甲醇分2次重新溶解成2mL浓缩液,待用;最后用2 mL甲醇活化ODS净化柱,将2 mL上述圆底烧瓶中的浓缩溶液上样,调整流速为1 mL/min,用8 mL V (甲醇) : V (水) = 40 : 60溶液洗脱,洗脱液收集于10 mL棕色容量瓶中,用甲醇定容至10 mL,过0.22 μm有机滤膜,采用UPLC分析噻虫啉含量。
1.5.3 UPLC分析条件[8-10]Waters C18色谱柱 (2.1 mm × 100 mm, 1.7 μm);检测波长242 nm;流动相为V (甲醇) : V (水) = 73:27;流速0.1 mL/min;进样量1 μL;柱温25 ℃。
1.5.4 添加回收试验在1.0 g空白山核桃叶中分别添加2 mL质量浓度分别为0.2、0.5、1.0、10.0和50 mg/L噻虫啉标准溶液,并加入8 mL甲醇,混合30 min后进行提取和净化。重复5次。按1.5.3节检测条件进行分析,计算添加回收率和相对标准偏差。
1.6 抗光解试验 1.6.1 甲维盐标准溶液配制用甲醇配制质量浓度为100 mg/L的甲维盐标准储备液,继而再稀释得到质量浓度分别为1、5、10、50和100 mg/L的甲维盐系列标准溶液。
1.6.2 抗光解试验于9 cm玻璃培养皿中喷施2 mL Em + 1.2%Pinolene和Em + 3%Pinolene,以喷施等量Em为对照 (CK),置于避光通风处自然风干,每处理重复3次。将3组处理放入氙气灯光照培养箱中,培养箱底面绿色,其余5面为黑色,以模拟自然界叶片环境。光照度为1 700 lx。在光照0、8、24和48 h时,分别向培养皿中分2次加入5 mL甲醇,振荡溶解。将溶液倒入25 mL蒸馏瓶中,于40 ℃下减压浓缩至近干。加入2 mL甲醇,转至2 mL冷冻管中,用甲醇定容至2 mL,待HPLC分析检测甲维盐含量。
1.6.3 HPLC分析条件[11-13]Waters XBridgeC18色谱柱 (4.6 mm × 250 mm, 5 μm);检测波长245 nm;流动相为V (己腈) : V (甲醇) : V (0.1%三乙胺) = 50 : 45 : 5;流速1 mL/min;进样量20 μL;柱温25 ℃。
1.6.4 甲维盐添加回收试验在空白玻璃培养皿中分别添加2 mL质量浓度分别为1、5、10、50和100 mg/L的甲维盐标准溶液,遮光后阴干,按1.6.2节中方法提取甲维盐。重复5次。按1.6.3节的检测条件分析,计算添加回收率及相对标准偏差。
1.7 松脂二烯对植物叶片光合作用的影响选取9株长势相近的健康红叶石楠,分为3组,每组3株,分别喷施20 mL T、T + 1.2%Pinolene和T + 3%Pinolene,于24 h后,选取叶片顶端、大小一致的叶片,使用便携式光合测定仪测定叶片各项光合指标[14-15]:蒸腾速率 (transpiration rate,Tr)、净光合速率 (net photosynthesis rate,Pn)、胞间CO2浓度 (intercellular CO2 concentration,Ci) 和对水汽的气孔导度 (stomatal conductance,Gs)。
测定响应曲线时,分别采用3 cm × 3 cm自带红蓝光源叶室和二氧化碳小钢瓶控制检测光强和二氧化碳浓度,流量设定为400 μmol/mol,相对湿度50%,温度30 ℃,叶室内光量子通量密度设为1 000 μmol/(m2·s)。各试验均重复5次。试验日为2017年7月17日和7月18日8: 00–16: 00,无风少云。
1.8 数据处理采用SPSS 17.0和Excel 2013软件进行数据统计分析和绘图。
2 结果与分析 2.1 扫描电镜观查结果观测结果 (图1) 显示:噻虫啉微囊颗粒电镜下放大3 000倍轮廓清晰,对比T、T + 1.2%Pinolene和T + 3%Pinolene 3种处理,T + 1.2%Pinolene和T + 3%Pinolene 2种处理下的噻虫啉微囊颗粒都得到了松脂二烯的包被,但后者比前者噻虫啉微囊颗粒被包裹得更为严密,并且在T + 3%Pinolene处理下,松脂二烯在噻虫啉微囊表面形成多道横向条纹覆盖。

|
注:图中T代表噻虫啉微囊颗粒,P代表松脂二烯。 Note: T is the thiacloprid microencapsulated granule, P is the pinolene. 图 1 松脂二烯与噻虫啉微囊在红叶石楠叶片上的电镜图像 (3 000 ×) Fig. 1 Scanning electron microscope images of pinolene and thiacloprid microencapsulated granule on Photinia × fraseri leaf (3 000 ×) |
2.2 松脂二烯抗雨水冲刷性能 2.2.1 噻虫啉标准曲线及添加回收率
在0.2~50 mg/L范围内,噻虫啉的质量浓度 (x) 与其对应峰面积 (y) 间呈良好的线性关系,回归方程为:y = 44 114x + 8 779,R2 = 0.999;添加回收试验结果表明,噻虫啉在山核桃叶的添加回收率为79%~84%,相对标准偏差为1.4%~4.0%。该方法的定量限为0.03 mg/L,检出限为0.01 mg/L。
2.2.2 叶片上噻虫啉保持量动态分析从表1数据可见:3组处理的噻虫啉初始保持量无明显差异,但随着降雨时间的延长,T + 3%Pinolene处理组在每个时间段噻虫啉的保持量与其他2个处理组间均表现出了极显著差异,在降雨进行到4 h时仍然能检测到噻虫啉,是3个处理组中抗雨水冲刷能力最强的一组;T + 1.2%Pinolene处理组在降雨2 h后仍能检测到噻虫啉,但降雨4 h时,其噻虫啉含量已低于检出限;而未添加pinolene的T处理组在降雨0.5 h后仅残留初始含量的1.4%,并且在降雨1 h及以后的样品中均未能检测到噻虫啉。综上所述,松脂二烯能够减少噻虫啉因降雨导致的其在植物叶片表面的损失量,具有一定抗雨水冲刷能力,从而可延长噻虫啉的药效,并且添加高浓度的松脂二烯比添加低浓度的抗雨水冲刷能力更强。
|
|
表 1 松脂二烯在山核桃叶上的抗雨水冲刷性能 Table 1 Evaluation of the rainfastness of pinolene on Carya cathayensis leaf |
2.3 松脂二烯抗光解性能 2.3.1 甲维盐标准曲线
在甲维盐质量浓度1~100 mg/L范围内,其质量浓度 (x) 与其峰面积 (y) 间呈良好的线性关系,回归方程为:y = 10 076x – 1 316,R2 = 0.996;该方法的定量限为0.3 mg/L,检出限为0.1 mg/L。
2.3.2 甲维盐保持量动态分析抗光解试验结果 (图2) 表明:未添加Pinolene的Em处理组,在光照48 h后已基本检测不到甲维盐,而此时添加了Pinolene的处理组中仍能检测到少量的甲维盐。结果还显示:3组数据在初始状态下无显著差异,而在光照8、24和48 h时,Em + 1.2%Pinolene与Em + 3%Pinolene处理组中甲维盐的含量均高于Em处理组,且均差异显著 (P < 0.05)。表明松脂二烯具有一定的抗紫外线光解能力。
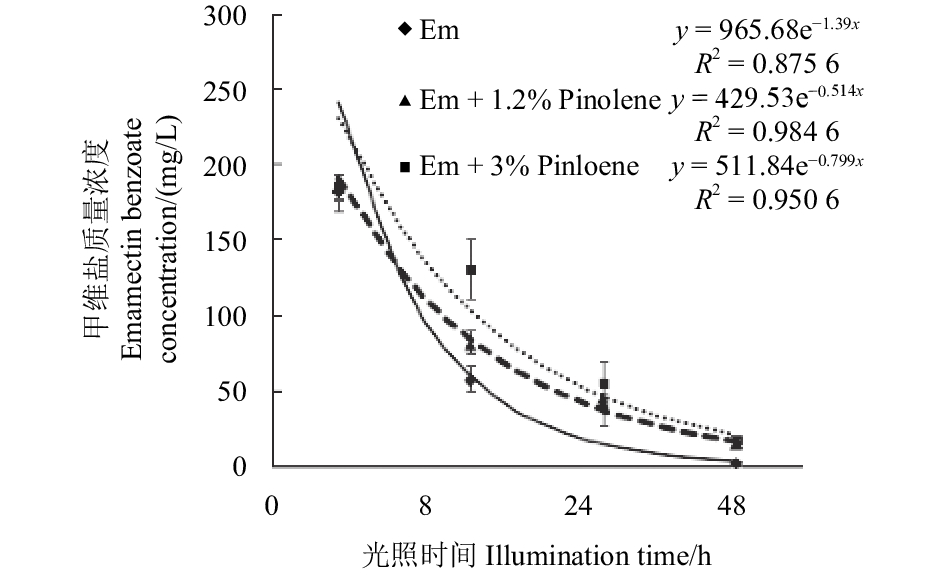
|
图 2 甲维盐桶混松脂二烯光解后保持量 Fig. 2 Retentions of emamectin benzoate after photolysis |
2.4 松脂二烯处理后红叶石楠光合作用中气体交换结果
气体交换结果如图3所示:相比单独喷施T处理组,T + 1.2%Pinolene处理组红叶石楠的蒸腾速率 (Tr)、气孔导度 (Gs) 均显著下降(分别下降了11.19%和6.07%);喷施T + 3%Pinolene处理组红叶石楠的胞间CO2浓度 (Ci)、净光合速率 (Pn) 分别比CK下降了3.62%和1.54%,无显著差异。相比于CK,3%Pinolene处理组红叶石楠的Tr、Ci和Gs均显著下降,(分别下降15.47%、5.73%和16.05%);3%Pinolene处理组红叶石楠的Pn相比CK下降了5.16%,但无显著差异。
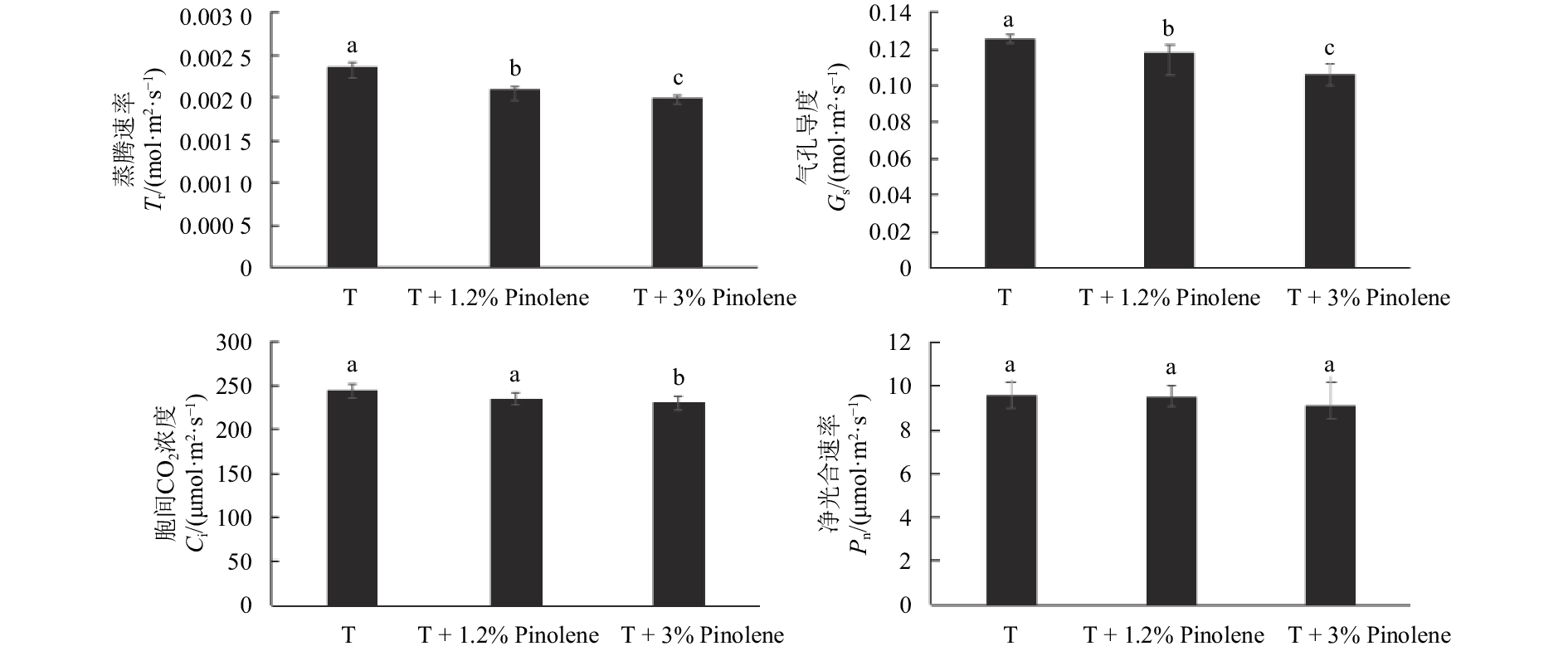
|
注:同一指标不同小写字母表示经Duncan's新复极差法检验差异显著 (P < 0.05)。 Note: Data of the same index with different lowercase letters are significantly different at P < 0.05 level. 图 3 不同处理下红叶石楠的净光合速率、气孔导度、胞间CO2浓度和蒸腾速率 Fig. 3 Net photosynthesis rate, stomatal conductance, intercellular CO2 concentration, and transpiration rate of Photinia × fraseri Dress. under different treatments |
3 讨论与结论
成膜材料的抗雨水冲刷能力是喷雾成膜剂的重要特性。Symonds等[16]将荧光标记的PVA喷施在蚕豆Vicia faba叶片后,通过人工降雨装置结合荧光显微镜检测的方法,研究了不同分子质量PVA与活性成分抗雨水冲刷能力的关系。结果显示,在PVA的分子质量达到52 kDa的阈值后,PVA分子质量越大,抗雨水冲刷能力越强;并表征了PVA在叶片上的成膜情况。
目前对松脂二烯的研究大多集中在水果保鲜[17]和抗植物叶片水分蒸腾[18]的应用上。Smith等[19]进行了连续3年的花生菌核病田间防治试验,相比于单独施用异菌脲的处理,使用体积分数为0.18%的松脂二烯桶混异菌脲进行高容量喷雾,可以使花生菌核病的发病率降低12%,明显提高了花生产量。
笔者对松脂二烯在植物叶面成膜形态、施于叶片后的光合作用关键指标、抗雨水冲刷能力和抗光解能力4个方面进行了研究。结果表明:松脂二烯能和农药颗粒结合并牢牢地吸附在植物表面,具有一定的抗雨水冲刷和抗光解能力,从而可提高农药在植物表面的滞留能力和农药的利用率,并且不影响植物的光合作用。这为林业实际生产过程中施药成本高、施药过程困难、希望一次性防治一个生长季节的病虫害等实际问题提供了新思路,也为松脂二烯的推广及应用提供了理论和数据支持。
| [1] |
张宗俭, 邵振润, 束放. 植物生长调节剂科学使用指南[M]. 3版. 北京: 化学工业出版社, 2015. ZHANG Z J, SHAO Z R, SHU F. Plant growth regulators scientific use guide[M]. 3rd ed. Beijing: Chemical Industry Press, 2015. |
| [2] |
MOFTAH A E, AL-HUMAID A I. Effects of kaolin and pinolene film-forming polymers on water relation and photosynthetic rate of tuberose (Polianthes tuberosa L.)
[J]. King Saud Univ, 2005, 18: 35-49. |
| [3] |
KOSTECKAS R, LIAKAS V, ŠIULIAUSKAS A, et al. Effect of pinolen on winter rape seed losses in relation to maturity[J]. Agron Res, 2009, 7(S1): 347-354. |
| [4] |
董峰. 基于果蔬包装的纳米纤维素/壳聚糖复合膜的制备、性能及应用[D]. 哈尔滨: 东北林业大学, 2015. DONG F. Preparation, Property and application of nanocellulose/chitosan composite film based on fruit and vegetable package[D]. Harbin: Northeast Forestry University, 2015. |
| [5] |
王碧, 覃松, 赵燕, 等. 葡甘聚糖-壳聚糖-聚乙烯醇共混膜的结构表征及性能研究[J]. 化学世界, 2008(08): 470-473. WANG B, QIN S, ZHAO Y, et al. Structure and properties of konjac glucomannan-chitosan-polyvinyl alcohol blend films[J]. Chemical World, 2008(08): 470-473. DOI:10.3969/j.issn.0367-6358.2008.08.006 |
| [6] |
李敏洁, 金芬, 杨莉莉, 等. 分散固相萃取/液相色谱-串联质谱法测定花生及土壤中的噻虫啉[J]. 分析测试学报, 2014, 33(4): 479-482. LI M J, JIN F, YANG L L, et al. Determination of thiacloprid in soil and peanut samples by dispersive solid phase extraction and liquid chromatography-tandem mass spectrometry[J]. J Instrum Analy, 2014, 33(4): 479-482. |
| [7] |
张丹莉. 噻虫啉在黄瓜和土壤中的检测方法及残留研究[D]. 西安: 长安大学, 2011. ZHANG D L. The research of testing method and residue of thiacloprid in the cucumber and soil[D]. Xi’an: Chang'an University, 2011. |
| [8] |
张冲, 葛峰, 单正军, 等. 噻虫啉环境行为研究[J]. 农药, 2010, 49(11): 830-833. ZHANG C, GE F, SHAN Z J, et al. Study on environmental behavior of thiacloprid[J]. Agrochemicals, 2010, 49(11): 830-833. DOI:10.3969/j.issn.1006-0413.2010.11.018 |
| [9] |
张征, 武中平, 张晓强, 等. 高效液相色谱-二极管阵列法测定蔬菜中噻虫啉残留量[J]. 食品科学, 2011, 32(24): 241-243. ZHANG Z, WU Z P, ZHANG X Q, et al. Determination of thiacloprid residue in vegetables by high performance liquid chromatography with diode array detection[J]. Food Sci, 2011, 32(24): 241-243. |
| [10] |
宋宁慧, 王点点, 吴文铸, 等. 噻虫啉在水稻中的残留消解动态及风险评估[J]. 环境科学学报, 2014, 34(8): 2169-2174. SONG N H, WANG D D, WU W T, et al. Residue dynamics and risk assessment of thiacloprid in rice[J]. Acta Scientiae Circumstantiae, 2014, 34(8): 2169-2174. |
| [11] |
朱军. 甲氨基阿维菌素苯甲酸盐的光解及对杀虫活性影响的研究[D]. 南京: 南京农业大学, 2010. ZHU J. Studies on photodegradation of emamectin benzoate and its effect on insectical activity[D]. Nanjing: Nanjing Agricultural University, 2010. |
| [12] |
石明. 甲维盐在柑橘和土壤中的残留检测分析方法[J]. 广东化工, 2013, 40(23): 157-158, 164. SHI M. Residue analysis of emamectin benzoate in citrus and soil[J]. Guangdong Chemical Industry, 2013, 40(23): 157-158, 164. DOI:10.3969/j.issn.1007-1865.2013.23.081 |
| [13] |
柳王荣, 杨仁斌, 黄尧, 等. 甲维盐在水稻环境中的残留分析方法[J]. 农药, 2011, 50(5): 362-364. LIU W R, YANG R B, HUANG Y, et al. Residue analysis of emamectin benzoate in rice field[J]. Agrochemicals, 2011, 50(5): 362-364. |
| [14] |
张仁和, 郑友军, 马国胜, 等. 干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J]. 生态学报, 2011, 31(5): 1303-1311. ZHANG R H, ZHENG Y J, MA G S, et al. Effects of drought stress on photosynthetic traits and protective enzyme activity in maize seeding[J]. Acta Ecologica Sinica, 2011, 31(5): 1303-1311. |
| [15] |
王志清. 不同色膜处理对番茄叶片光合作用特性的影响[J]. 北方园艺, 2013(16): 53-58. WANG Z Q. Effect of different color film treatments on leaf photosynthetic characteristics of tomato[J]. Northern Horticulture, 2013(16): 53-58. |
| [16] |
SYMONDS B L, THOMSON N R, LINDSAY C I, et al. Rainfastness of poly(vinyl alcohol) deposits on Vicia faba leaf surfaces: from laboratory-scale washing to simulated rain
[J]. ACS Appl Mater Interfaces, 2016, 8(22): 14220-14230. DOI:10.1021/acsami.6b01682 |
| [17] |
ALBRIGO L G, BROWN G E, FELLERS P J. Peel and internal quality of oranges as influenced by grove applications of pinolene and benlate[J]. Proc Fla State Hort Soc, 1970, 83: 263-267. |
| [18] |
BRILLANTE L, BELFIORE N, GAIOTTI F, et al. Comparing kaolin and pinolene to improve sustainable grapevine production during drought[J]. PLoS One, 2016, 11(6). |
| [19] |
SMITH F D, PHIPPS P M, STIPES R J. Use of pinolene or other spray adjuvants with iprodione for improved control of sclerotinia blight on peanut[J]. Peanut Sci, 1991, 18(2): 97-101. DOI:10.3146/i0095-3679-18-2-9 |
 2018, Vol. 20
2018, Vol. 20


