2. 农业有害生物预警与防控湖南省工程研究中心,长沙 410128
2. Hunan Provincial Engineering Research Center for Agricultural Detrimental Organism Early Warning and Prevention, Changsha 410128, China
缓、控释技术已被广泛应用于医药、涂料、化妆品、环境工程等行业和领域[1-5]。在农药剂型加工领域,缓、控释技术也是提高农药有效利用率和减轻环境污染的理想选择,已成为农药新剂型发展的重要方向[6]。缓、控释农药能通过对靶标维持较长时间的有效浓度而显著降低施药剂量[7]。目前,聚酯类、聚酸酐类及聚酰胺类等多种生物可降解聚合物作为农药缓、控释剂的载体材料,已被成功应用于缓、控释农药剂型中[8]。高越等[9]以聚 (N-正丙基丙烯酰胺) 水凝胶为载体,制备了高效氯氰菊酯/聚 (N-正丙基丙烯酰胺) 温敏控释微球;Liu等[10]以聚乳酸 (PLA) 为载体,构建了微球、微囊及多孔微囊3种体系,以实现对高效氯氟氰菊酯的控制释放。然而,由于这些聚合物的疏水性及其半晶质结构,导致其生物降解速率难以控制,此外,一些聚合物降解后生成酸性单体,使得基质pH值降低,从而导致某些农药分解,有效利用率下降[11-12]。
近年来,新型载药材料的不断涌现为农药缓、控释制剂的制备和功能化研发提供了新思路。Xiang等[13]以硅藻土和Fe3O4为原料,制备了可通过磁力回收的pH响应型控释农药,能够显著降低环境风险。Wibowo等[14]制备了氟虫腈/二氧化硅纳米微囊,通过改变二氧化硅壳的厚度可调节氟虫腈的释放速率。二氧化硅凭借其比表面积大、化学性质稳定、生物相容性良好以及价格低廉等优点,在众多载体材料中脱颖而出[15],在医药及化工[16]控释领域的应用已成为研究热点。钱坤等[17]采用乳液法将氟乐灵包覆在二氧化硅中,并重点考察了制备工艺、温度及pH条件对缓释性能的影响。结果表明,该氟乐灵/二氧化硅微球有效降低了原药的降解速率,延长了持效期,且温度和pH值的提高均能加快氟乐灵的释放速率。
吡唑醚菌酯(结构式见图式1)是一类广谱、高效、兼具吡唑结构特点的甲氧基丙烯酸酯类杀菌剂,对稻瘟病具有优异的防效[18]。但鉴于其对水生生物风险的考虑,其在水稻上的登记和应用已受到限制。现有报道多为评价吡唑醚菌酯微囊化后对水生生物的安全性,如王宁等[19]将吡唑醚菌酯微囊化后,发现其对斑马鱼的毒性等级降低为中等毒性,极大地提高了吡唑醚菌酯对水生生物的安全性。而有关其制备成微囊或微球后生物活性评价方面的报道较少,且尚未见关于其对水稻病害生物活性评价的研究报道。因此,本研究以吡唑醚菌酯为模式农药,通过其与正硅酸乙酯 (TEOS) 在碱性条件下的水解缩合反应,以表面活性剂十六烷基三甲基溴化铵(CTAB)为模板剂,制备得到吡唑醚菌酯/二氧化硅微球(MS),探讨了该微球在不同缓释介质中的释放行为,并通过对稻瘟病菌的室内毒力测定评价了其生物活性。
|
图式1 吡唑醚菌酯的结构式 Scheme1 Structural formula of pyraclostrobin |
1 材料与方法 1.1 材料及主要仪器
97%吡唑醚菌酯 (pyraclostrobin) 原药 (浙江博仕达作物科技有限公司);正硅酸乙酯 (TEOS,阿拉丁试剂公司);十六烷基三甲基溴化铵 (CTAB,阿拉丁试剂公司);乙酸乙酯、乙腈、甲醇和氨水 (分析纯,国药集团化学试剂有限公司)。透析袋MD44 (截留相对分子质量为8 000~14 000,北京索莱宝科技有限公司)。供试稻瘟病菌Pyricularia oryzae由湖南农业大学植物保护学院微生物实验室提供。
C-MAG HS 7可控加热磁力搅拌器及T25-digital 高速剪切机 (德国 IKA 公司);5804R高速台式大容量离心机 (德国Eppendorf公司);Rise-2006激光粒度分布仪 (济南润之科技有限公司);JSM-6360型扫描电子显微镜 (日本 JEOL 公司);Nicolet iS5 傅里叶变换红外光谱仪(Thermo Fisher Scientific);Agilent1260高效液相色谱仪 (美国安捷伦科技有限公司)。
1.2 吡唑醚菌酯/二氧化硅微球的制备参考文献[20]方法进行。称取0.5 g (精确至0.000 1 g) 吡唑醚菌酯,加入到5 mL乙酸乙酯和4 mL正硅酸乙酯的混合溶液中,磁力搅拌使其溶解。将上述溶液加入到不同质量分数 (1.0%、1.5%、2.0%和2.5%) 的CTAB水溶液中,混匀后于6 000 r/min下剪切5 min。逐滴加入浓氨水调节其pH值至8,搅拌2 h后陈化过夜,于1 000 r/min下离心分离。沉淀用去离子水洗涤3次,干燥后即得到吡唑醚菌酯/二氧化硅微球(MS)。不同CTAB质量分数下制得的样品分别对应标记为AS1.0、AS1.5、AS2.0和AS2.5。
1.3 吡唑醚菌酯/二氧化硅微球的表征 1.3.1 粒径测定与外观形貌表征采用激光粒度分布仪测定不同CTAB质量分数下所得SiO2微球的粒径大小与分布,通过扫描电子显微镜对样品外观形貌进行观察,并拍照、记录。
1.3.2 傅里叶变换红外光谱测定分别取适量吡唑醚菌酯/二氧化硅微球、空白二氧化硅微球及吡唑醚菌酯原药,采用溴化碘 (KBr) 压片法,通过傅里叶变换红外光谱仪(FTIR) 进行分析。
1.3.3 载药量与缓释性能测定准确称取0.025 g (精确至0.000 1 g) 吡唑醚菌酯/二氧化硅微球样品,溶于甲醇中,超声使微球破裂并完全释药。取一定量溶液用甲醇稀释后,通过HPLC测定吡唑醚菌酯的质量浓度 (mg/L)。HPLC检测条件:Agilent TC-C18不锈钢色谱柱 (4.6 mm × 250 mm,5 μm),流动相V (甲醇) : V (水) = 75 : 25,流速1.0 mL/min,检测波长275 nm,进样量5 μL,柱温35 ℃。
结合吡唑醚菌酯在甲醇溶液中的标准曲线y = 5.530 + 11.68x (R2 = 0.999 9) ,按公式 (1) 计算载药量。
| ${\text{载药量}}/{\text{\%}} = \frac{{{\text{微球中吡唑醚菌酯质量}}}}{{{\text{微球的质量}}}} \times 100$ | (1) |
采用透析袋法[21]探究室温下吡唑醚菌酯原药及微球的释放行为,并测定吡唑醚菌酯/二氧化硅微球在不同pH值和不同温度下的释药性能。将一定质量微球样品浸入pH值分别为4.0、6.9及9.2的磷酸盐缓冲液中,分别模拟酸性、中性及碱性环境下的释放。室温 (25 ℃) 下于100 r/min搅拌,每隔一段时间取1 mL上清液 (每次取样后立即补充1 mL原缓冲溶液),待HPLC测定。同样,取一定质量微球样品,分别在20和35 ℃下模拟不同温度下的释放,通过HPLC测定吡唑醚菌酯的释放量。
1.3.4 生物活性测定采用菌丝生长速率法[22]测定所制备微球对稻瘟病菌的杀菌活性。称取0.004 g (精确至0.000 1 g) 吡唑醚菌酯原药,用100 μL乙腈溶解后再用无菌水稀释为80 mg/L的母液;称取一定量制得的32%吡唑醚菌酯/二氧化硅微球,用无菌水溶解并配制成有效成分质量浓度80 mg/L的母液。按照表1中药液体积将原药及微球配制成药剂质量浓度分别为0.5、1、2、4及8 mg/L的含药培养基。以不含药剂但含100 μL乙腈的无菌水溶液和相同体积无菌水为对照 (CK),每处理重复3次。分别于处理后1、3、5、7及9 d,用十字交叉法测量菌落直径,取平均值,按式 (2) 计算菌丝生长抑制率。
| ${\text{菌丝生长抑制率}}/{\text{\%}} = \frac{{{\text{对照组菌落生长直径}} - {\text{处理组菌落生长直径}}}}{{{\text{对照组菌落生长直径}} - 7\;{\rm{mm}}}} \times 100$ | (2) |
利用SPSS软件,以药剂质量浓度的对数值为横坐标、抑制率几率值为纵坐标建立毒力回归方程,求出抑菌中浓度 (EC50),并进行相关性分析。
|
|
表 1 含药培养基配制 Table 1 Proportion of the drug-containing medium |
1.3.5 光解特性测定
按文献[23]方法进行。取一定量吡唑醚菌酯/二氧化硅微球,分散于20 mL无菌水中,置于具塞石英管内。以紫外灯为光源,辐照度为3.00 mW/cm2,额定功率为1.5 W × 2,石英管距光源 10 cm,温度保持 (25 ± 1) ℃。以相同质量浓度的吡唑醚菌酯原药水溶液作为对照。分别于1、2、4、8及10 h取样,过0.45 μm滤膜后用HPLC测定吡唑醚菌酯残留量 (mg/L),根据式 (3) 计算吡唑醚菌酯/二氧化硅微球与原药的光解率。每处理重复3次,同时设黑暗对照。
| ${\text{光解率}}/{\text{\% }} = \frac{{{\text{黑暗对照残留量}} - {\text{光照处理残留量}}}}{{{\text{黑暗对照残留量}}}} \times 100$ | (3) |
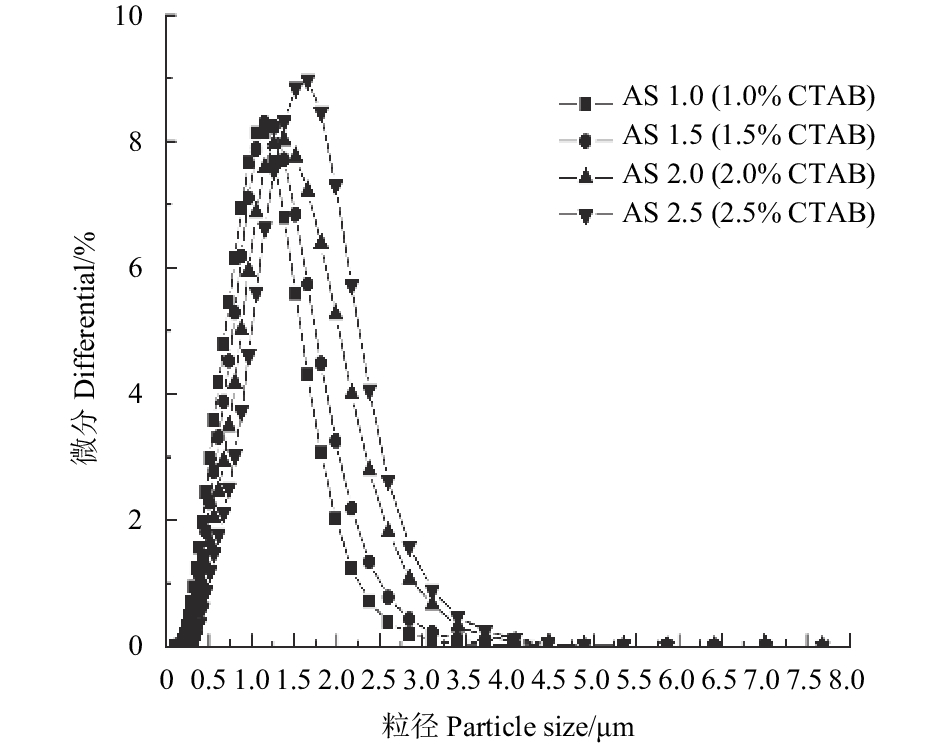
图1为不同CTAB质量分数下制备的吡唑醚菌酯/二氧化硅微球粒径分布图。从中可以看出,当CTAB质量分数为1.0% (AS1.0) 和1.5% (AS1.5) 时,微球粒径分布曲线几乎重叠,其平均粒径非常接近,分别为0.998和1.110 μm。CTAB含量升高,微球平均粒径也随之增大,当CTAB质量分数为2.5%时 (AS2.5),所制得微球的平均粒径最大,为1.428 μm。选取AS1.0样品为代表进行扫描电子显微镜 (SEM) 观测,结果如图2所示,微球粒径大小在1 μm左右,与粒度分析仪测得的粒径大小相符。SEM观察结果表明,所制备的吡唑醚菌酯/二氧化硅微球表面光滑且无明显粘连现象,形貌较为规整均一。

|
图 3 空白二氧化硅微球 (A)、吡唑醚菌酯/二氧化硅微球 (B) 及吡唑醚菌酯原药 (C) 的红外光谱 Fig. 3 FTIR spectra of silica microsphere (A), pyraclostrobin/silica microsphere (B) and pyraclostrobin TC (C) |
|
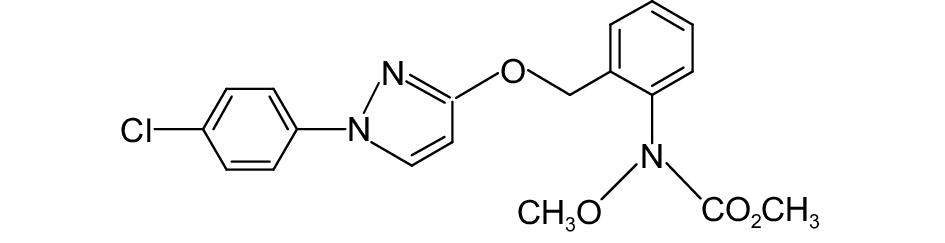
图 4 吡唑醚菌酯原药与吡唑醚菌酯/二氧化硅微球的累积释放曲线 Fig. 4 Cumulative release curves of pyraclostrobin TC and microsphere |
2.2 吡唑醚菌酯/二氧化硅微球的红外光谱分析
从空白微球的谱图 (图3A) 中可以明显看到,其在1 081.89 cm–1处出现了Si—O—Si的伸缩振动峰;吡唑醚菌酯原药 (图3C) 则在1 716.94 cm–1处出现了C=O键的强伸缩振动峰,在1 598.93 cm–1处出现了苯环骨架上 C—H键的伸缩振动峰;而所制备的吡唑醚菌酯/二氧化硅微球 (AS1.0)(图3B) 在1 081.89 cm–1处出现的峰由Si—O—Si伸缩振动引起,在1 716.94 cm–1与1 598.93 cm–1处则出现了吡唑醚菌酯C=O键和 C—H键的伸缩振动峰,证明吡唑醚菌酯已被成功包覆在二氧化硅微球中。
|
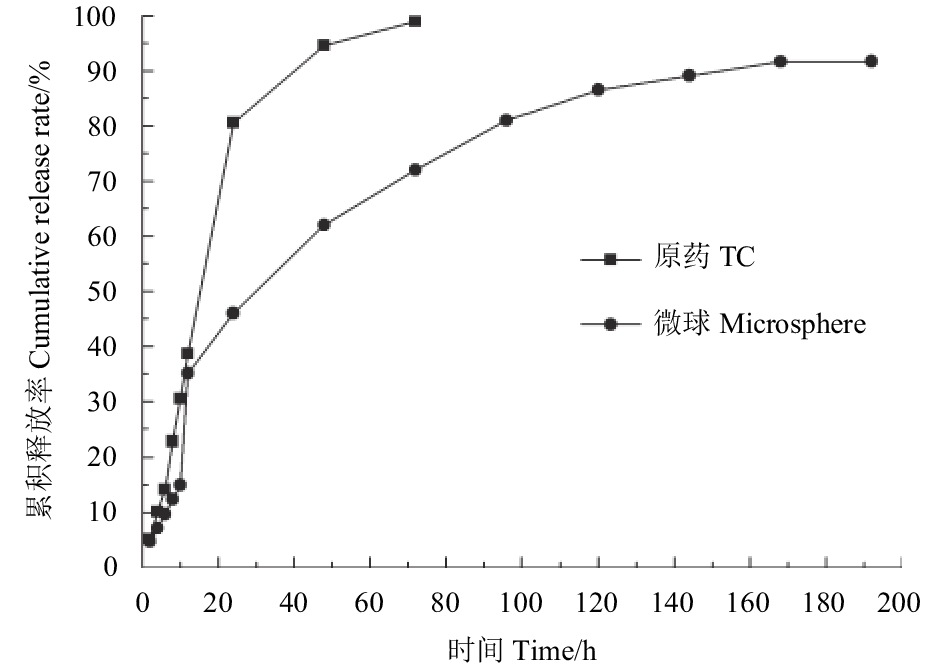
图 5 不同pH值下吡唑醚菌酯/二氧化硅微球(AS1.0)的累积释放曲线 Fig. 5 Cumulative release curves of microsphere (AS1.0) under different pH |
2.3 吡唑醚菌酯/二氧化硅微球载药量及缓释性能
吡唑醚菌酯/二氧化硅微球AS1.0、AS1.5、AS2.0和AS2.5的载药量分别为50.73%、45.63%、39.46%和25.18%,即其载药量随着CTAB质量分数的增大而降低,其中当CTAB质量分数为1.0%时载药量最高。从吡唑醚菌酯原药和微球的累积释放曲线 (图4) 可看出:室温下,原药在10 h时的累积释放率已超过30%,随后迅速增加,在24 h时达到80.6%;而吡唑醚菌酯/二氧化硅微球在10 h时的累积释放率为14.97%,在120 h时其累积释放率接近85%,此后达到平衡。表明所制备的吡唑醚菌酯/二氧化硅微球具有良好的缓释性能。
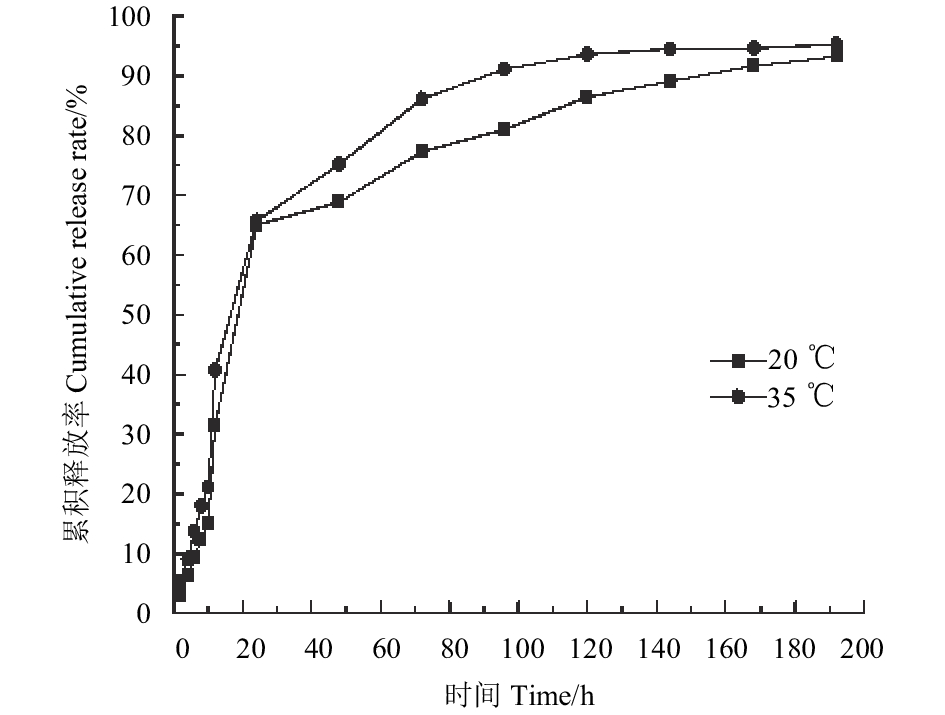
|
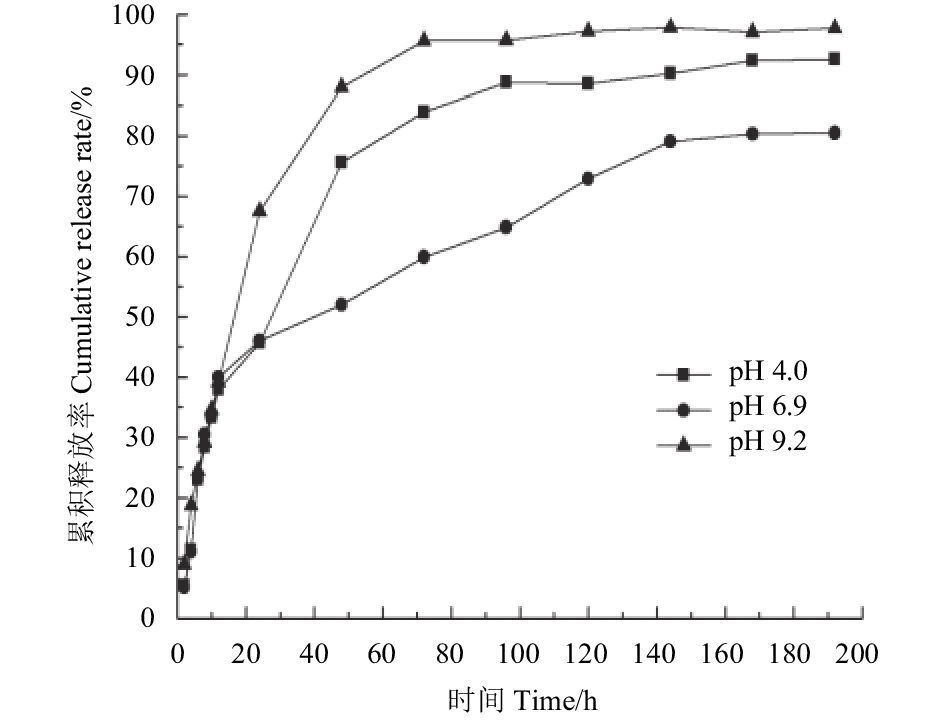
图 6 不同温度下吡唑醚菌酯/二氧化硅微球(AS1.0)的累积释放曲线 Fig. 6 Cumulative release curves of microsphere (AS1.0) under different temperature |
由不同pH值下的累积释放曲线 (图5) 可知:前20 h内,AS1.0微球在3种缓冲溶液中均出现了快速释放现象,累积释放率约为40%,这一突释现象与微球表层及浅层附着的部分活性成分有关[24]。在后期缓释阶段,AS1.0在中性介质中释放相对缓慢,144 h时其累积释放率接近80%,之后达到平衡;在碱性环境下其释放速率明显增快,96 h时的累积释放率达95%以上,这可能是由于酸性氧化物二氧化硅在碱性条件下降解速率加快,导致负载在其中的活性成分被更快释出;AS1.0在酸性介质中的释药速率介于碱性与中性介质之间,144 h时的累积释放率达90%以上,随后趋于平缓。
图6为不同温度下吡唑醚菌酯/二氧化硅微球 (AS1.0) 的累积释放曲线。在20和35 ℃条件下,其前24 h内的释放曲线几乎一致;196 h时,20和35 ℃条件下的累积释放率分别为93.19%和95.28%。整个释药过程中,高温下的释放速率稍快于低温下。从累积释放曲线来看,相较于温度而言,pH值对吡唑醚菌酯/二氧化硅微球释药速率的影响更为显著。
|
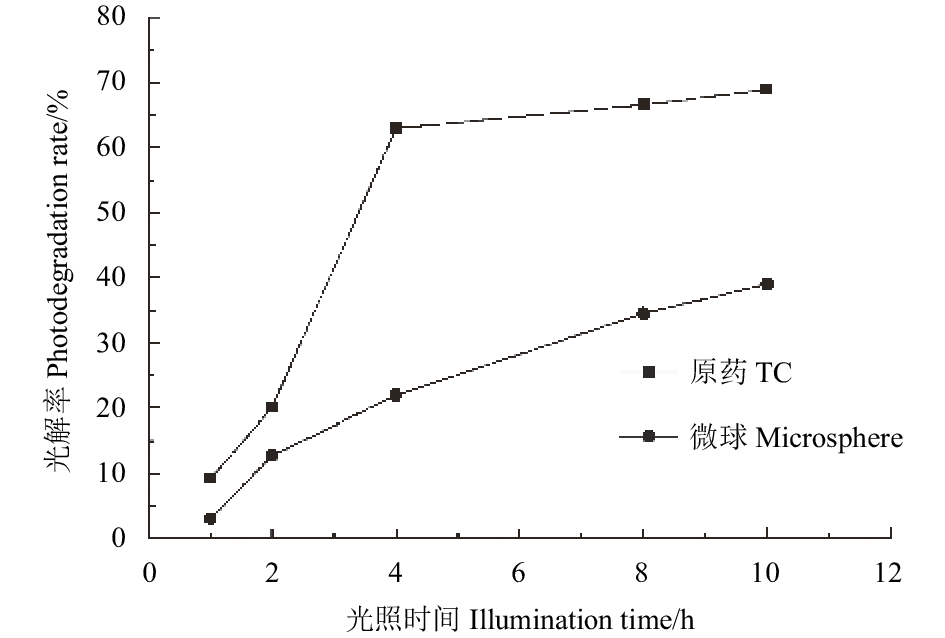
图 7 吡唑醚菌酯/二氧化硅微球及吡唑醚菌酯原药光解曲线 Fig. 7 Photolysis curve of pyraclostrobin microsphere and pyraclostrobin TC |

|
图 2 微球样品 (AS1.0) 扫描电子显微镜图 (× 5 000) Fig. 2 SEM image of the microsphere sample (AS1.0)(× 5 000) |
分别采用零级反应动力学、一级反应动力学、Higuchi动力学以及Korsmeyer-Peppas动力学方程对吡唑醚菌酯/二氧化硅微球 (AS1.0) 在酸性、碱性和中性介质中的释放进行了拟合。由表2可看出,酸性及碱性条件下,一级反应动力学方程的决定系数 (R2) 均大于其他3种数学模型,说明一级反应动力学模型更符合该微球的释放行为;中性条件下,Ritger-Peppa模型的R2值最高,最接近微球的释放行为。一般来说,常规农药的释放机制与零级反应动力学模型较为相符,而一级反应动力学及Ritger-Peppas方程符合缓释制剂的释放机理。因此,从方程拟合结果也证明了吡唑醚菌酯/二氧化硅微球具有缓释作用。
|
|
表 2 不同pH值下吡唑醚菌酯/二氧化硅微球缓释曲线拟合结果 Table 2 Fitting results for release curves of microsphere under different pH value |
2.4 吡唑醚菌酯/二氧化硅微球的杀菌活性
结果 (表3) 表明,在试验浓度下,给药后5 d内,吡唑醚菌酯/二氧化硅微球在抑制稻瘟病菌菌丝生长的速效性方面明显逊于原药,而随着微球中有效成分的不断释放,微球的毒力逐渐超过原药,表现出了非常明显的缓释效果。给药初期,原药的毒力是微球的13.5倍;给药后第5天,两者EC50值接近;第9天时微球的毒力是原药的11.7倍。
|
|
表 3 吡唑醚菌酯原药和吡唑醚菌酯/二氧化硅微球对稻瘟病菌菌丝生长的室内毒力 Table 3 Result of indoor toxicity determination of pyraclostrobin TC and pyraclostrobin microsphere against P. oryzae |
2.5 吡唑醚菌酯/二氧化硅微球与原药的光解率
吡唑醚菌酯易被水解和光解。高压汞灯下,其在pH=7缓冲溶液中的光解半衰期为12.37 min[25]。将其制成微球等缓释剂型可有效保护活性成分,延长持效期。朱欣妍等[26]以聚乳酸为载体,制备了甲氨基阿维菌素苯甲酸盐(甲维盐)聚乳酸微球,光照10 h后,原药的光解率是微球的2.6倍。图7为吡唑醚菌酯/二氧化硅微球和原药的光解曲线,经紫外灯照射4 h后,原药的光解率是微球的2.9倍;照射10 h后,原药的光解率高达68.92%,而微球仅为38.98%。可见,将吡唑醚菌酯制成二氧化硅微球,不仅能延长吡唑醚菌酯的持效期,还能显著降低其在水环境中的光解速率,提高其稳定性。
|
图 1 吡唑醚菌酯/二氧化硅微球样品粒径分布 Fig. 1 Size distribution profile of microsphere samples |
3 结论与讨论
本研究以吡唑醚菌酯为模式农药,利用其与正硅酸乙酯在碱性条件下的水解缩合反应,以十六烷基三甲溴化铵(CTAB)为模板剂,制备了吡唑醚菌酯/二氧化硅微球。所制备微球外观形貌规整,粒径在0.998~1.428 μm之间。当CTAB质量分数为1.0%时,其载药量最佳 (50.73%)。去除模板剂一般采用焙烧法或回流法[27],考虑到焙烧法需高温加热,可能会影响到有效成分吡唑醚菌酯,而回流法需使用大量有机溶剂,不利于生态环境保护,且模板剂去除后可能会造成粒子团聚,因而经综合考虑后,本研究中未将CTAB模板剂去除。
与原药相比,所制备的吡唑醚菌酯/二氧化硅微球具有良好的缓释性,且其在不同pH条件下的释放速率存在差异,在碱性条件下的释放速率大于酸性条件,在中性条件下释放最慢。相较于pH值而言,温度对微球中有效成分释放速率的影响较小,在高温下释放速率稍快于低温下。该微球在不同pH值下的释放行为无论是符合一级反应动力学方程亦或是更接近Ritger-Peppas方程,均符合缓释制剂的释放机理,进一步论证了该吡唑醚菌酯/二氧化硅微球具有一定的缓释作用。Xu等[28]以正硅酸乙酯为前体,制备了氯氟氰菊酯/二氧化硅单层微囊,利用三乙氧丙烯硅烷改性该单层微囊,得到氯氟氰菊酯/二氧化硅/N-异丙基丙烯酰胺双层微囊。研究发现,该单层微囊的载药量 (50%) 约为双层微囊的2倍;与单层微囊相比,双层微囊具有更好的控释性能,推测这可能是由扩散和侵蚀共同作用的结果。
生物活性测定结果表明,虽然在给药初期吡唑醚菌酯/二氧化硅微球对稻瘟病菌的速效性不如吡唑醚菌酯原药,但随着给药时间延长,其药效逐渐增强,证明该微球具有一定的缓释抑菌作用,这与郑玉[29]关于吡唑醚菌酯聚(乳酸羟基乙酸)共聚物(PLGA)微球对棉花枯萎病菌的室内毒力测定结果相符。光解试验表明,将吡唑醚菌酯制成二氧化硅微球,不仅能延长其持效期,还能显著降低其在水环境中的光解速率,提高稳定性。
伴随着国家关于农药、化肥“两减一增”政策的提出,越来越多的研究者已将研究重心转移到功能型、缓释型及环境友好型缓、控释剂型的研制上,因此,吡唑醚菌酯/二氧化硅微球的成功研制,为丰富吡唑醚菌酯剂型加工策略,改善其应用性能提供了可能。
| [1] |
REGUERA-NUÑEZ E, ROCA C, HARDY E, et al. Implantable controlled release devices for BMP-7 delivery and suppression of glioblastoma initiating cells[J]. Biomaterials, 2014, 35(9): 2859-2867. DOI:10.1016/j.biomaterials.2013.12.001 |
| [2] |
CHEN J, WANG W, XU Y Q, et al. Slow-release formulation of a new biological pesticide, pyoluteorin, with mesoporous silica[J]. J Agric Food Chem, 2011, 59(1): 307-311. DOI:10.1021/jf103640t |
| [3] |
SIEPMANN F, SIEPMANN J, WALTHER M, et al. Polymer blends for controlled release coatings[J]. J Controlled Release, 2008, 125(1): 1-15. DOI:10.1016/j.jconrel.2007.09.012 |
| [4] |
MARTINS I M, BARREIRO M F, COELHO M, et al. Microencapsulation of essential oils with biodegradable polymeric carriers for cosmetic applications[J]. Chem Eng J, 2014, 245: 191-200. DOI:10.1016/j.cej.2014.02.024 |
| [5] |
POPAT A, LIU J, HU Q H, et al. Adsorption and release of biocides with mesoporous silica nanoparticles[J]. Nanoscale, 2012, 4(3): 970-975. DOI:10.1039/C2NR11691J |
| [6] |
杨蕾, 叶非. 农药缓释剂的研究进展[J]. 农药科学与管理, 2009, 30(10): 36-39. YANG L, YE F. Research progress of slow-released formulation of pesticide[J]. Pestic Sci Admin, 2009, 30(10): 36-39. DOI:10.3969/j.issn.1002-5480.2009.10.011 |
| [7] |
PEPPAS N A, LANGER R. New challenges in biomaterials[J]. Science, 1994, 263(5154): 1715-1720. DOI:10.1126/science.8134835 |
| [8] |
孟锐, 李晓刚, 周小毛, 等. 药物微胶囊壁材研究进展[J]. 高分子通报, 2012(3): 28-37. MENG R, LI X G, ZHOU X M, et al. Research progress on capsule wall materials used for drug microcapsule[J]. Polym Bull, 2012(3): 28-37. |
| [9] |
高越, 郭瑞峰, 史高川, 等. 高效氯氰菊酯聚(N-正丙基丙烯酰胺)温敏微球的制备关键工艺研究
[J]. 农药学学报, 2017, 19(2): 266-272. GAO Y, GUO R F, SHI G C, et al. Study on the key preparation process of beta-cypermethrin poly (N-propylacrylamide) temperature-sensitive microsphere [J]. Chin J Pestic Sci, 2017, 19(2): 266-272. |
| [10] |
LIU B X, WANG Y, YANG F, et al. Construction of a controlled-release delivery system for pesticides using biodegradable PLA-based microcapsules[J]. Colloids Surf B: Biointerfaces, 2016, 144: 38-45. DOI:10.1016/j.colsurfb.2016.03.084 |
| [11] |
FU K R, PACK D W, KLIBANOV A M, et al. Visual evidence of acidic environment within degrading poly(lactic-co-glycolic acid) (PLGA) microspheres[J]. Pharm Res, 2000, 17(1): 100-106. DOI:10.1023/A:1007582911958 |
| [12] |
HO M L, FU Y C, WANG G J, et al. Controlled release carrier of BSA made by W/O/W emulsion method containing PLGA and hydroxyapatite[J]. J Control Release, 2008, 128(2): 142-148. DOI:10.1016/j.jconrel.2008.02.012 |
| [13] |
XIANG Y B, ZHANG G L, CHI Y, et al. Fabrication of a controllable nanopesticide system with magnetic collectability[J]. J Chem Eng, 2017, 328: 320-330. DOI:10.1016/j.cej.2017.07.046 |
| [14] |
WIBOWO D, ZHAO C X, PETERS B C, et al. Sustained release of fipronil insecticide in vitro and in vivo from biocompatible silica nanocapsules
[J]. J Agric Food Chem, 2014, 62(52): 12504-12511. DOI:10.1021/jf504455x |
| [15] |
WEN L X, LI Z Z, ZOU H K, et al. Controlled release of avermectin from porous hollow silica nanoparticles[J]. Pest Manag Sci, 2005, 61(6): 583-590. DOI:10.1002/(ISSN)1526-4998 |
| [16] |
CHEN Y, AI K L, LIU J H, et al. Multifunctional envelope-type mesoporous silica nanoparticles for pH-responsive drug delivery and magnetic resonance imaging[J]. Biomaterials, 2015, 60: 111-120. DOI:10.1016/j.biomaterials.2015.05.003 |
| [17] |
钱坤, 彭鑫亚, 薛霏, 等. 氟乐灵微球的制备及其控释效果研究[J]. 农药学学报, 2017, 19(6): 776-780. QIAN K, PENG X Y, XUE F, et al. Preparation of trifluralin microspheres and its controlled release performance[J]. Chin J Pestic Sci, 2017, 19(6): 776-780. |
| [18] |
张国生. 甲氧基丙烯酸酯类杀菌剂的应用、开发现状及展望[J]. 农药科学与管理, 2003, 24(12): 30-34. ZHANG G S. Current status of application, development and prospect of strobin fungicides[J]. Pestic Sci Admin, 2003, 24(12): 30-34. DOI:10.3969/j.issn.1002-5480.2003.12.014 |
| [19] |
王宁, 齐麟, 王娅, 等. 温度响应型吡唑醚菌酯微囊的制备与性能表征[J]. 农药学学报, 2017, 19(3): 381-387. WANG N, QI L, WANG Y, et al. Preparation and performance of thermo-sensitive pyraclostrobin microcapsules[J]. Chin J Pestic Sci, 2017, 19(3): 381-387. |
| [20] |
HE S, ZHANG W B, LI D G, et al. Preparation and characterization of double-shelled avermectin microcapsules based on copolymer matrix of silica-glutaraldehyde-chitosan[J]. J Mater Chem B, 2013, 1(9): 1270-1278. DOI:10.1039/c2tb00234e |
| [21] |
周训卿, 曹立冬, 刘亚静, 等. 嘧菌酯微囊的制备及其性能表征[J]. 农药学学报, 2014, 16(2): 213-219. ZHOU X Q, CAO L D, LIU Y J, et al. Preparation and performance characteristics of azoxystrobin microcapsules[J]. Chin J Pestic Sci, 2014, 16(2): 213-219. |
| [22] |
宋倩, 梅向东, 黄啟良, 等. 乳液聚合法制备阿维菌素微胶囊及其生物活性研究[J]. 农药学学报, 2009, 11(3): 392-394. SONG Q, MEI X D, HUANG Q L, et al. Preparation of abamectin microcapsules by means of emulsion polymerization and it’s bioactivity[J]. Chin J Pestic Sci, 2009, 11(3): 392-394. |
| [23] |
管磊, 张鹏, 王晓坤, 等. 吡唑醚菌酯在水环境中的光解及微囊化对其光稳定性的影响[J]. 农业环境科学学报, 2015, 34(8): 1493-1497. GUAN L, ZHANG P, WANG X K, et al. Photodegradation of pyraclostrobin in water environment and microencapsulation effect on its photostability[J]. J Agro-Environ Sci, 2015, 34(8): 1493-1497. DOI:10.11654/jaes.2015.08.009 |
| [24] |
LI Z Z, XU S A, WEN L X, et al. Controlled release of avermectin from porous hollow silica nanoparticles: influence of shell thickness on loading efficiency, UV-shielding property and release[J]. J Control Release, 2006, 111(1-2): 81-88. DOI:10.1016/j.jconrel.2005.10.020 |
| [25] |
马腾达. 吡唑醚菌酯的光解与水解特性研究[D]. 长春: 吉林农业大学, 2012. MA T D. The photolytic and hydrolyzed characteristics of pyraclostrobin[D]. Changchun: Jilin Agricultural University, 2012. |
| [26] |
朱欣妍, 尹明明, 陈福良. 甲维盐聚乳酸微球缓释性能及室内毒力的初步测定[J]. 农药, 2013, 52(9): 653-655. ZHU X Y, YIN M M, CHEN F L. The slow release property and pesticide effect of emamectin benzoate PLA microsphere[J]. Agrochemicals, 2013, 52(9): 653-655. |
| [27] |
徐虹, 李延报, 陆春华, 等. 模板剂去除方法对介孔氧化硅纳米球的影响[J]. 材料科学与工程学报, 2011, 29(3): 381-385. XU H, LI Y B, LU C H, et al. Influence of template removal methods on mesoporous silica nanospheres[J]. J Mater Sci Eng, 2011, 29(3): 381-385. |
| [28] |
XU Y, CHEN W T, GUO X Y, et al. Preparation and characterization of single- and double-shelled cyhalothrin microcapsules based on the copolymer matrix of silica-N-isopropyl acrylamide-bis-acrylamide
[J]. RSC Adv, 2015, 5(65): 52866-52873. DOI:10.1039/C5RA05560A |
| [29] |
郑玉. 吡唑醚菌酯 PLGA 微球的研制及其性能研究[D]. 北京: 中国农业科学院, 2014. ZHENG Y. The preparation of pyraclostrobin PLGA microsphere and research on its property[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. |
 2018, Vol. 20
2018, Vol. 20


