2. 荆州市荆州区纪南镇农业服务中心,湖北 荆州434034
2. Agricultural Service Center of Jingzhou Ji’nan, Jingzhou 434034, Hubei Province, China
由禾谷镰孢菌 (Fusarium graminearum,有性阶段为Gibberella zeae) 引起的小麦赤霉病 (fusarium head blight,FHB) 是世界范围内小麦上的严重病害[1-2],不仅会造成重大产量损失,还可能因产生真菌毒素脱氧雪腐镰刀菌烯醇 (DON) 而威胁食品安全。长期以来,主要依赖化学药剂如苯并咪唑类杀菌剂尤其是多菌灵及其复配制剂等进行防治[3-4]。自1992年首次在中国发现小麦赤霉病菌对多菌灵的抗性菌株以来[5-6],在药剂的长期选择压力下,其抗性种群迅速发展蔓延,抗性治理十分紧迫[5]。因此,急需调整对小麦赤霉病的防治策略,合理使用杀菌剂,同时亟待开发、引进与推广使用新药剂。
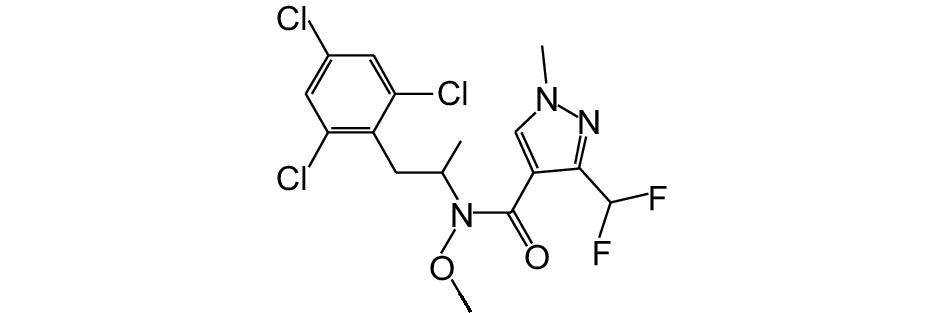
氟唑菌酰羟胺 (pydiflumetofen) 是先正达 (中国) 有限公司研发的一种新型琥珀酸脱氢酶抑制剂 (SDHI) 类杀菌剂,化学名称:3-(二氟甲基)-N-甲氧基-1-甲基-N-[(RS)-1-甲基2-(2, 4, 6-三氯苯基) 乙基]吡唑-4-甲酰胺,分子式:C16H16Cl3F3N3O2 (图式 1)。其主要通过影响病原菌的呼吸链电子传导系统,阻碍其能量代谢,从而抑制病原菌的生长[7]。氟唑菌酰羟胺高效、杀菌谱广,尤其对叶斑病菌Mycosphaerella graminicola和小麦白粉病菌Blumeria graminis.f.sp.tritici活性较高,此外对作物品质和产量亦有提高作用[8-10]。目前该药剂尚未在中国正式登记上市,在防治小麦赤霉病方面的研究报道也较少[10]。笔者测定了小麦赤霉病菌菌丝生长和孢子萌发对氟唑菌酰羟胺的敏感性,并尝试建立其敏感性基线,同时探明氟唑菌酰羟胺对田间小麦赤霉病的防效,以及对小麦籽粒中DON毒素含量和小麦产量的影响,旨在为该药剂的大面积推广应用提供科学依据。
|
图式1 氟唑菌酰羟胺的结构式 Scheme1 The structural formula of pydiflumetofen |
1 材料与方法 1.1 试验材料
小麦品种:襄麦35 (中感赤霉病品种) 由湖北省襄阳市农业科学院选育并提供。
菌种:黄冈1号野生敏感菌株 (强致病性禾谷镰孢菌Fusarium graminearum) 由湖北省农业科学院植保土肥研究所分离获得[11],在离体条件下经药剂驯化得到高抗氰烯菌酯的菌株5株,分别命名为R1、R2、R3、R4和R5。其多菌灵抗性菌株为湖北省农业科学院植保土肥研究所采集的田间自然抗性菌株,分别命名为Js449、Js462、Js484、Js506和Js519[11]。
106株野生菌株,由湖北省农业科学院植保土肥研究所从湖北小麦主产区襄阳、卧龙、随州、荆州、沙洋和潜江等6个地区分离获得。
药剂:99%氟唑菌酰羟胺 (pydiflumetofen) 原药由中国农业大学种子病理实验室提供;200 g/L氟唑菌酰羟胺悬浮剂 (SC) 由瑞士先正达作物保护有限公司提供。对照药剂25%氰烯菌酯 (phenamacril)SC由江苏省农药研究股份有限公司生产。
PDA培养基:马铃薯20%、葡萄糖 (蔗糖) 2%、琼脂粉1.5%~1.8%、琼脂条1.7%~2.0%及1 000 mL蒸馏水。
CMC培养基:硝酸纤维素钠15 g、酵母提取物1 g、NH4NO3 1 g、KH2PO4 1 g、MgSO4·7H2O 0.5 g及1 000 mL蒸馏水。
1.2 试验地点概况试验于2016−2017年在湖北省农业科学院试验农场进行,试验地土壤为黄棕壤,肥力中等,质地较黏,表层土壤 (0~20 cm) 农化性状为:pH=7.1,有机质、全氮和全磷含量分别为26.02、1.63及0.35 g/kg,有效磷和有效钾的含量分别为5.33 g/kg和59.71 mg/kg。
1.3 试验方法 1.3.1 禾谷镰孢菌对氟唑菌酰羟胺的敏感性测定 1.3.1.1 对菌落扩展的抑制作用测定采用菌丝生长速率法[12]。用甲醇将氟唑菌酰羟胺原药溶解并配制成1 × 104 mg/L的母液。在预试验基础上,再用甲醇将母液逐级稀释成4、1、0.25、0.062 5和0.015 625 mg/L的系列质量浓度药液,等量加入PDA培养基中,制成药剂最终质量浓度分别为0.4、0.1、0.025、0.006 25、0.001 562 5 mg/L、直径9 cm的含药平板。以含相同质量浓度甲醇的平板为对照。在预培养好的黄冈1号菌株菌落边缘同一圆周上打取直径为5 mm的菌饼,菌丝面朝下接种于培养皿中央,每处理3次重复,置于 25 ℃培养箱内黑暗培养。待对照菌落大小接近培养皿边缘时,测定各处理菌落直径 (mm),按文献[12]方法计算菌丝生长抑制率。
以抑制率的几率值 (y) 为纵坐标,药剂质量浓度对数 (x) 为横坐标,求出毒力回归方程y = bx + a和相关系数r,计算药剂对病原菌的抑制中浓度 (EC50) [12]。
1.3.1.2 对孢子萌发的抑制作用测定采用孢子萌发法[12]。无菌条件下,将黄冈1号菌株接种在CMC培养液中,于25 ℃、170 r/min条件下培养5 d。用双层纱布滤去菌丝,滤液于5 000 r/min离心5 min,弃上清液,将分生孢子重悬于灭菌的去离子水中,调节至每1 mL含105个孢子,制成孢子悬浮液,备用。将氟唑菌酰羟胺母液用甲醇稀释,配制成药剂最终质量浓度分别为4、1、0.25、0.062 5和0.015 625 mg/mL的含药WA平板。取100 μL孢子悬浮液均匀涂布到含药的WA平板上,置于25 ℃培养箱中黑暗培养8 h,在显微镜下随机调查3个视野、100个孢子的萌发情况。以含相同质量浓度甲醇的WA平板为对照,计算孢子萌发抑制率及EC50值[12]。
1.3.2 氟唑菌酰羟胺对田间小麦赤霉病的防治效果测定田间试验共设6个处理 (均为有效成分用量):200 g/L氟唑菌酰羟胺悬浮剂125、150、175和 200 g/hm2,25%氰烯菌酯悬浮剂600 g/hm2以及空白对照。每处理4次重复,小区面积25 m2,随机区组排列。于小麦扬花初期 (4月14日下午) 穗部喷药,共喷药1次。药后24 h,穗部喷雾接种禾谷镰孢菌孢子,接种量为330 L/hm2。待病情稳定后 (小麦乳熟期),参照文献 [13]方法调查发病情况,每小区按照对角线五点取样,每点调查200穗,以枯穗面积占调查穗总面积的百分率分级,记录各级病穗数及总穗数,计算病情指数和相对防效[13]。
于小麦成熟后,每小区随机收取1 m2范围内的麦穗,进行室内考种,每重复随机抽取50个穗,统计每穗的穗长及穗粒数,将整个小区的麦穗脱粒、混匀,测定千粒重 (g);统计各小区小麦产量 (kg/hm2)。
1.3.3 毒素脱氧雪腐镰刀菌烯醇 (DON) 含量测定委托中国农业科学院油料作物研究所农业部油料及制品质量监督检验测试中心完成。具体参照文献[14]方法:每小区随机称取1 kg麦粒,磨细至粒度小于2 mm,混匀;依次用PBS缓冲溶液 (pH 7.4) 和体积分数为70%的甲醇水溶液提取,提取液经稀释、过滤后,经免疫亲和柱净化;依次用5 mL PBS缓冲溶液和5 mL水预淋洗,再用2 mL甲醇洗脱。洗脱液经50 ℃氮气吹干,加入1.0 mL乙腈溶解残留物,涡旋混匀10 s,经0.22 μm微孔滤膜过滤后,待液相色谱-串联质谱测定。外标法定量。
1.3.4 交互抗性测定选取对多菌灵、氰烯菌酯和氟唑菌酰羟胺3种杀菌剂均敏感的菌株13株,多菌灵田间抗性菌株5株以及氰烯菌酯室内诱导抗性菌株5株,分别测定其对多菌灵、氰烯菌酯和氟唑菌酰羟胺的敏感性。以氟唑菌酰羟胺EC50值的对数为横坐标、多菌灵和氰烯菌酯EC50值的对数为纵坐标分别作图,求出直线回归方程和决定系数(R2)。
1.3.5 数据统计分析采用SPSS 19.0软件进行结果计算和方差分析;通过Duncan’s新复极差法分析各处理的差异显著性。
2 结果与分析 2.1 小麦赤霉病菌对氟唑菌酰羟胺的敏感性及敏感性基线对菌丝生长及孢子萌发的测定结果 (图1) 显示,106株菌株对氟唑菌酰羟胺的敏感性无明显差异,尚未见抗性菌群出现。其中,氟唑菌酰羟胺抑制菌丝生长的EC50值范围为0.018 0~0.209 0 mg/L,平均EC50值为 (0.072 8 ± 0.025 9) mg/L (图1A);抑制孢子萌发的EC50 值范围为0.052 7~0.473 2 mg/L,平均EC50值为 (0.176 0 ± 0.059 6) mg/L (图1B);其EC50值均属于正态分布。

|
A:菌丝生长;B:孢子萌发。 A: Mycelial growth; B: Conidium germination. 图 1 106株禾谷镰孢菌菌株对氟唑菌羟酰胺的敏感性频率分布 Fig. 1 Sensitivity distribution of 106 isolates of F. graminearum to pydiflumetofen |
2.2 氟唑菌酰羟胺悬浮剂对田间小麦赤霉病的防效
由表1中数据可见:试验田小麦赤霉病发病严重,空白对照区平均病情指数达到26.59,于扬花初期喷雾施药1次,200 g/L氟唑菌羟酰胺悬浮剂150和175 g/hm2处理的防效与25%氰烯菌酯悬浮剂600 g/hm2处理防效相当,无显著差异;氟唑菌羟酰胺200 g/hm2处理的防效达90.51%,显著高于氰烯菌酯 (P < 0.05),且在使用剂量范围内对小麦安全 (肉眼观察小麦生长未见明显药害)。经氟唑菌酰羟胺悬浮剂处理后,小麦千粒重和小区产量与空白对照区相比均存在显著差异 ( P < 0.05),并且随着药剂剂量的增加,穗粒数、千粒重及小区产量均呈增长趋势;但4种处理剂量之间无显著差异。
2.3 脱氧雪腐镰刀菌烯醇含量测定结果表明,经200 g/L氟唑菌酰羟胺悬浮剂处理后,小麦麦穗中脱氧雪腐镰刀菌烯醇 (DON)含量与对照相比存在显著差异。其中,氟唑菌酰羟胺悬浮剂175 g/hm2和对照药剂氰烯菌酯悬浮剂600 g/hm2处理的毒素含量分别为2.73和2.65 mg/kg,比空白对照区分别降低了55.09%和68.25%。
|
|
表 1 氟唑菌酰羟胺悬浮剂对小麦赤霉病的田间防治效果 Table 1 Field efficacy of pydiflumetofen EC against fusarium head blight |
2.4 氟唑菌酰羟胺与多菌灵和氰烯菌酯的交互抗性
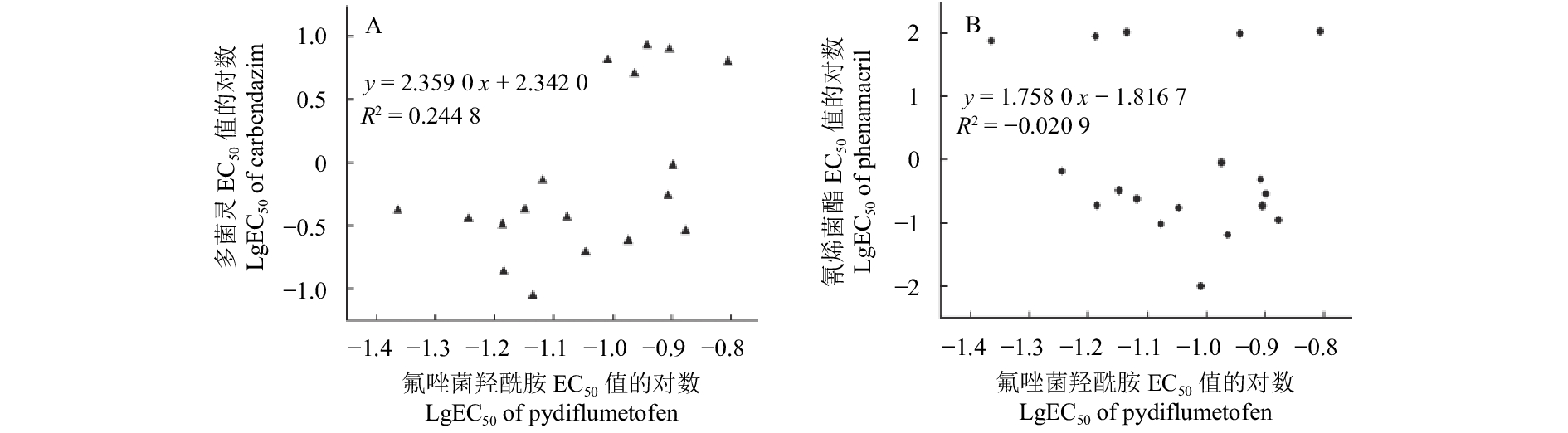
结果 ( 图2) 显示,无论是对多菌灵和氰烯菌酯敏感的菌株还是抗性菌株,其对氟唑菌酰羟胺的敏感性均无显著差异,R2分别为 0.244 8 (图2A) 和 –0.020 9 (图2B)。表明小麦赤霉病菌对氟唑菌酰羟胺与氰烯菌酯和多菌灵之间均不存在交互抗性。
|
图 2 氟唑菌酰羟胺与多菌灵 (A) 和氰烯菌酯 (B) 的交互抗药性 Fig. 2 Cross-resistance patterns between pydiflumetofen and carbendazim (A) and phenamacril (B) |
3 结论与讨论
氟唑菌酰羟胺属于琥珀酸脱氢酶抑制剂 (SDHI) 类杀菌剂,是N-甲氧基-(苯基乙基)-吡唑酰胺类新化合物中的第一个成员。Hou等[15]的研究表明,氟唑菌酰羟胺对亚洲镰孢菌F. asiaticum和禾谷镰孢菌的菌丝生长和分生孢子萌发均具有较强的抑制作用,本研究结果与之相符。氟唑菌酰羟胺对采自湖北省6个地区的106株禾谷镰孢菌菌丝生长的平均EC50值为 (0.072 8 ± 0.025 9) mg/mL,低于Chen等测得的氰烯菌酯对禾谷镰孢菌的平均EC50值 (0.110 0 ± 0.025 9) mg/mL[16],表明氟唑菌酰羟胺的活性显著高于氰烯菌酯。氟唑菌酰羟胺抑制分生孢子萌发的平均EC50值为 (0.176 0 ± 0.059 6) mg/mL,说明该药剂也可强烈抑制分生孢子的萌发,与Avenot等[17]关于氟唑菌酰羟胺作用于病原真菌线粒体电子呼吸链的结论一致。从分生孢子萌发抑制试验结果可以推测,氟唑菌酰羟胺对子囊孢子萌发可能也具有较强的抑制作用,因此该药剂的使用有望阻断小麦赤霉病的初侵染,但具体还需进一步就其对子囊孢子的活性进行测定。本研究EC50值曲线的变异范围均很小,未发现耐药性突变个体,因此认为,该病原菌群体对氟唑菌酰羟胺仍属于敏感群体,可将所得平均EC50值作为其敏感性基线,用于田间禾谷镰孢菌对氟唑菌酰羟胺抗药性监测。
由于植物病原真菌琥珀酸脱氢酶复合物II中含有SdhA、SdhB、SdhC和SdhD 4个亚基,且SdhB、SdhC或SdhD中单个亚基的点突变或其中几个亚基同时突变均可造成植物病原真菌的抗性[18]。但迄今为止,尚未见关于禾谷镰孢菌对SDHI类杀菌剂抗性机制的研究报道。本研究中交互抗性测定结果表明,抗多菌灵或氰烯菌酯的小麦赤霉病菌株对氟唑菌酰羟胺均不表现抗性。但由于本研究所测定的多菌灵和氰烯菌酯抗性菌株数较少,因此后续还需增加菌株数量,进一步明确药剂之间是否存在交互抗性。
目前生产上防治小麦赤霉病的药剂中,2-氰基丙烯酸酯类杀菌剂氰烯菌酯的防效显著且稳定性好,近年来已逐渐成为主打药剂,因此本研究以氰烯菌酯作为对照药剂。田间试验表明,不同剂量氟唑菌酰羟胺处理均能显著降低小麦赤霉病的发生,且200 g/hm2处理的最高防效达到90.51%,显著高于25%氰烯菌酯悬浮剂600 g/hm2的处理,进一步证明氟唑菌酰羟胺的活性显著高于氰烯菌酯。Olaya等[19]报道,氟唑菌酰羟胺对小麦叶斑病及白粉病的防效也较好。因此,在小麦实际生产中施用氟唑菌酰羟胺,或许可以同时防治小麦白粉病、叶斑病和赤霉病,达到“一喷多效”的效果。
本研究还表明,经氟唑菌酰羟胺处理后,小麦籽粒中脱氧雪腐镰刀孢菌烯醇 (DON) 含量显著降低,这与Peter等[20]的研究结果一致。但关于氟唑菌酰羟胺是直接抑制了小麦赤霉病菌DON毒素的产生,还是施用氟唑菌酰羟胺后由于病害减轻从而使得DON毒素含量降低,还有待进一步研究。
综上所述,本研究明确了氟唑菌酰羟胺不仅对小麦赤霉病有较好的田间防治效果,而且能够降低小麦籽粒中DON毒素的含量及提高小麦产量,因此可以作为生产中防治小麦赤霉病的替代或后备药剂,同时也可以考虑用作为治理小麦赤霉病菌对多菌灵抗性的替代药剂。
| [1] |
程顺和, 郭文善, 王龙俊, 等. 中国南方小麦[M]. 南京: 江苏科学技术出版社, 2012: 281-282. CHENG S H, GUO W S, WANG L J, et al. Wheat in southern China[M]. Nanjing: Jiangsu Science and Technology Press, 2012: 281-282. |
| [2] |
史文琦, 杨立军, 冯洁, 等. 小麦赤霉病流行区镰刀菌致病种及毒素化学型分析[J]. 植物病理学报, 2011, 41(5): 486-494. SHI W Q, YANG L J, FENG J, et al. Analysis on the population structure of Fusarium pathogenic spp. and its mycoto xin chemotypes in Fusarium head blight epidemic region [J]. Acta Phytopathologica Sinica,, 2011, 41(5): 486-494. |
| [3] |
龚双军, 杨立军, 向礼波, 等. 2013 年湖北省小麦赤霉病菌对多菌灵和戊唑醇的敏感性[J]. 农药学学报, 2014, 16(5): 610-613. GONG S J, YANG L J, XIANG L B, et al. Sensitivity of Fusarium graminearumto carbendazim and tebuconazole in Hubei Province [J]. Chin J Pestic Sci, 2014, 16(5): 610-613. |
| [4] |
马东方, 黄石, 黄文娣, 等. 小麦赤霉病菌对多菌灵和咪鲜胺的敏感性[J]. 贵州农业科学, 2016, 44(1): 66-67. MA D F, HUANG S, HUANG W D, et al. Sensitivity of Fusarium graminearum to carbendazim and prochloraz [J]. Guizhou Agric Sci, 2016, 44(1): 66-67. |
| [5] |
戴大凯, 贾晓静, 武东霞, 等. 小麦赤霉病菌多菌灵抗性群体的扩散路径分析——基于致病菌种类及所产毒素化学型鉴定和抗药性检出的时序性[J]. 农药学学报, 2013, 15(3): 279-285. DAI D K, JIA X J, WU D X, et al. Analysis of diffusion path of carbendazim-resistance population of Fusarium head blight-based on Fusarium species, mycotoxin chemotype and resistance timing [J]. Chin J Pestic Sci, 2013, 15(3): 279-285. |
| [6] |
王建新, 周明国, 陆悦健, 等. 小麦赤霉病菌抗药性群体动态及其治理药剂[J]. 南京农业大学学报, 2002, 25(1): 43-47. WANG J X, ZHOU M G, LU Y J, et al. Dynamics of resistant population of Fusarium graminearum to carbendazim and substitutable fungicide screening [J]. J Nanjing Agric Univ, 2002, 25(1): 43-47. |
| [7] |
智沈伟, 李兴海, 赵尔成, 等. 分散固相萃取-分散液液微萃取/高效液相色谱法测定西瓜中氟唑菌酰羟胺残留[J]. 分析测试学报, 2017, 36(10): 1265-1268. ZHI S W, LI X H, ZHAO E C, et al. Determination of pydiflumetofen residues in watermelon by high performance liquid chromatography with dispersive solid-phase extraction and dispersive liquid-liquid microextraction[J]. J InstrumAnal, 2017, 36(10): 1265-1268. DOI:10.3969/j.issn.1004-4957.2017.10.018 |
| [8] |
DUBOS T, PASQUALI M, POGODA F, et al. Differences between the succinate dehydrogenase sequences of isopyrazam sensitive Zymoseptoria tritici and insensitive Fusarium graminearum strains
[J]. PesticBiochem Physiol, 2013, 105(1): 28-35. |
| [9] |
仇是胜, 柏亚罗. 琥珀酸脱氢酶抑制剂类杀菌剂的研发进展 (I)[J]. 现代农药, 2014, 13(6): 1-7. QIU S S, BAI Y L. Progress on research and development of succinate dehydrogenase inhibitor fungicides (I)[J]. Mod Agrochem, 2014, 13(6): 1-7. |
| [10] |
仇是胜, 柏亚罗. 琥珀酸脱氢酶抑制剂类杀菌剂的研发进展 (II)[J]. 现代农药, 2015, 14(1): 1-7. QIU S S, BAI Y L. Progress on research and development of succinate dehydrogenase inhibitor fungicides (II)[J]. Mod Agrochem, 2015, 14(1): 1-7. |
| [11] |
曾凡松, 尹合兴, 史文琦, 等. β1- 和 β2- 微管蛋白基因在赤霉病菌抗多菌灵中的作用
[J]. 中国农业科学, 2015, 48(4): 695-704. ZENG F S, YIN H X, SHI W Q, et al. Function analysis of β1-tub and β2-tub in resistance of Gibberella zeae to carbendazim [J]. Scientia Agricultura Sinica, 2015, 48(4): 695-704. DOI:10.3864/j.issn.0578-1752.2015.04.07 |
| [12] |
GONG S J, HAO J J, XIA Y Y, et al. Inhibitory effect of bionic fungicide 2-allylphenol on Botrytis cinerea
[J]. Pest Manag Sci, 2009, 65(12): 1337-1343. DOI:10.1002/ps.v65:12 |
| [13] |
农药田间药效试验准则 第15部分杀菌剂防治小麦赤霉病: NY/T 1464–2007[S]. 北京:中国农业出版社, 2008. Guidelines on efficacy evaluation of pesticides fungicides part 15: against fusarium head blight of wheat: NY/T 1464–2007[S]. Beijing: China Agricultural Press, 2008. |
| [14] |
食品安全国家标准 食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定: GB 5009.111–2016[S]. 北京: 中国标准出版社, 2017. National food safety standards, determination of deoxynivalenol and its acetylated derivatives in foods: GB 5009.111–2016[S]Beijing: Standards Press of China, 2017. |
| [15] |
HOU Y P, MAO X W, WANG J X, et al. Sensitivity of Fusarium asiaticum to a novel succinate dehydrogenase inhibitor fungicide pydiflumetofen
[J]. Crop Prot, 2007, 96: 237-244. |
| [16] |
CHEN Y, LI H K, CHEN C J, et al. Sensitivity of Fusarium graminearum to fungicide JS399-19: in vitro determination of baseline sensitivity and the risk of developing fungicide resistance
[J]. Phytoparasitica, 2008, 36(4): 326-337. DOI:10.1007/BF02980812 |
| [17] |
AVENOT H F, MICHAILIDES T J. Progress in understanding molecular mechanisms and evolution of resistance to succinate dehydrogenase inhibiting (SDHI) fungicides in phytopathogenic fungi[J]. Crop Prot, 2010, 29(7): 643-651. DOI:10.1016/j.cropro.2010.02.019 |
| [18] |
STAMMLER G, REHFUS A, PROCHNOW J, et al. New findings on the development of insensitive isolates ofPyrenophora terestowards SDHI fungicides
[J]. Julius-Kühn-Archiv, 2014, 447: 568. |
| [19] |
OLAYA G, LINLEY R, EDLEBECK K, et al. ADEPIDYNTM fungicide: cross resistance patterns in Alternaria solani. APS Annual Meeting, Fungicide Resistance, 61-O[EB/OL]. [2018-04-10] https://www.apsnet.org/meetings/Documents/2016_meeting_abstracts/aps2016_619.htm.
|
| [20] |
PETER D, COQUERON P-Y, WETCHOLOWSKY I. Use of pydiflumetofen for the reduction of mycotoxin contamination in plants: PCT/EP2016/074109[EB/OL]. [2018-04-10]. https://patentscope.wipo.int/search/en/detail.jsf?docId=WO2017060499
|
 2018, Vol. 20
2018, Vol. 20


