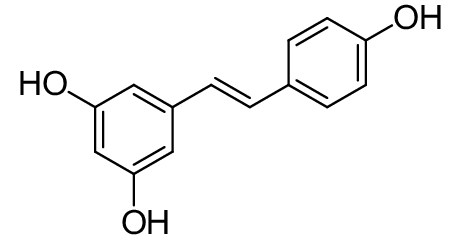
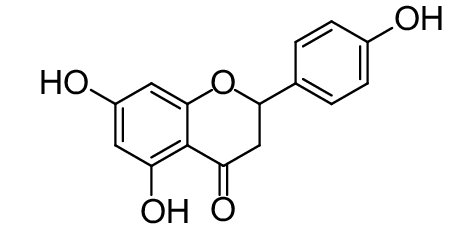
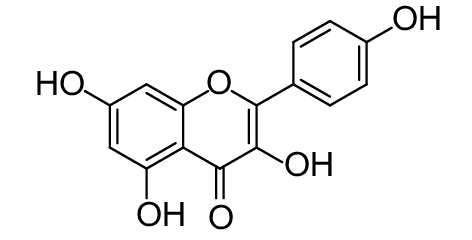
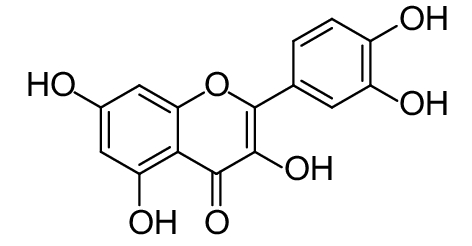
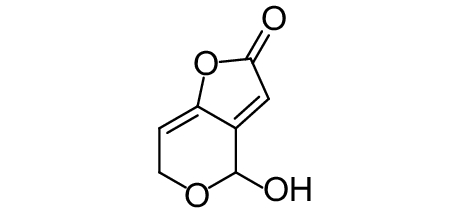
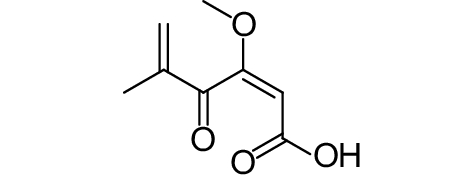
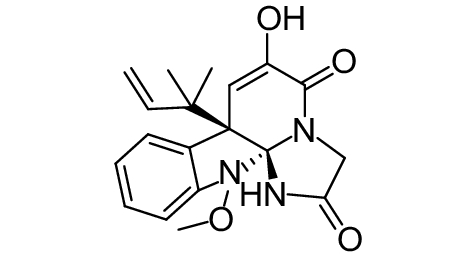
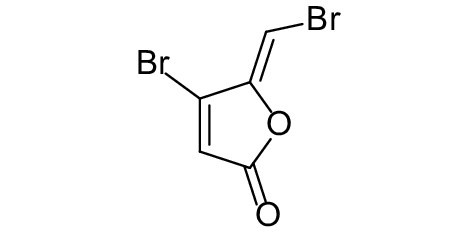
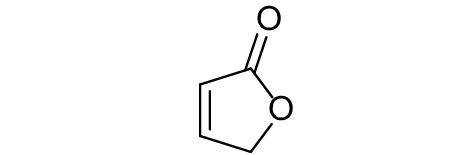
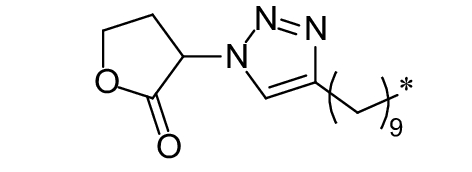
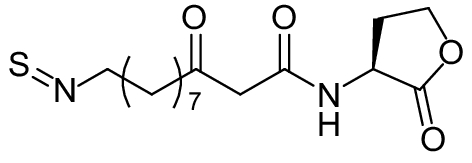
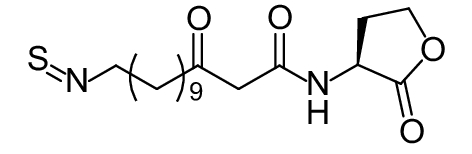
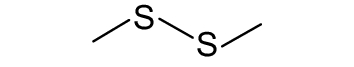细菌可通过分泌化学信号分子来检测菌群密度及调控细菌的多种生理功能,从而适应周围环境变化,这种信息交流系统称为细菌群体感应系统。这种信息交流机制最早发现于1970年,Nealson等[1]在对一种海洋微生物费氏弧菌Vibrio fischeri的发光机制进行研究时,发现其生物发光与细菌密度呈正相关。20世纪90年代后,科学家们通过对革兰氏阴性菌和革兰氏阳性菌等多种细菌进行研究,发现这种信息交流现象普遍存在于多种细菌中。1994年,Fuqua等[2]首次把细菌之间的这种特殊“语言”称为“群体感应” (Quorum sensing,QS)。群体感应系统调控着生物发光、生物被膜形成、毒力因子的表达等细菌的多种生理功能。目前,生产上防治植物病害主要的方法是化学防治,但长期过量使用化学农药已导致多种病原菌产生了耐药性,因此寻找新的植物病害防治策略显得尤为重要[3]。尽管植物致病菌多为真菌,但群体感应系统可影响许多植物病原细菌致病性的发生:一方面,致病菌在宿主体内受群体感应系统调控,表达相关毒力因子,使宿主植物发病;另一方面,致病菌受群体感应调节形成生物被膜,就会抵御宿主的免疫机制,同时对化学药剂产生抗药性[4]。因此,群体感应可作为防治植物病害的新靶标。
群体感应抑制剂 (Quorum sensing inhibitors,QSIs) 以群体感应系统为靶标,与传统化学农药不同,它并不会杀死病原菌,而是干扰病原菌生物被膜的形成、毒力因子的产生或致病基因的表达,因此,为抵御植物病原菌侵染和细菌耐药性开辟了新的路径。近年来,对群体感应抑制剂的研究引起了学者的广泛关注,并取得了一些进展。目前农业上研究最广泛的是AHLs (Acyl homoserine lactones,酰基高丝氨酸内酯) 降解酶,随着研究的深入,使用传统农药防治植物病害的瓶颈有望被打破[4]。笔者在前人[5-6]的基础上,介绍了群体感应概况,总结了近些年来发现的群体感应抑制剂,包括来自动植物体等天然的和人工合成的群体感应抑制剂,及其在防治植物病害和其他方面的应用,旨在为开发新型安全化学药剂替代物提供新的思路。
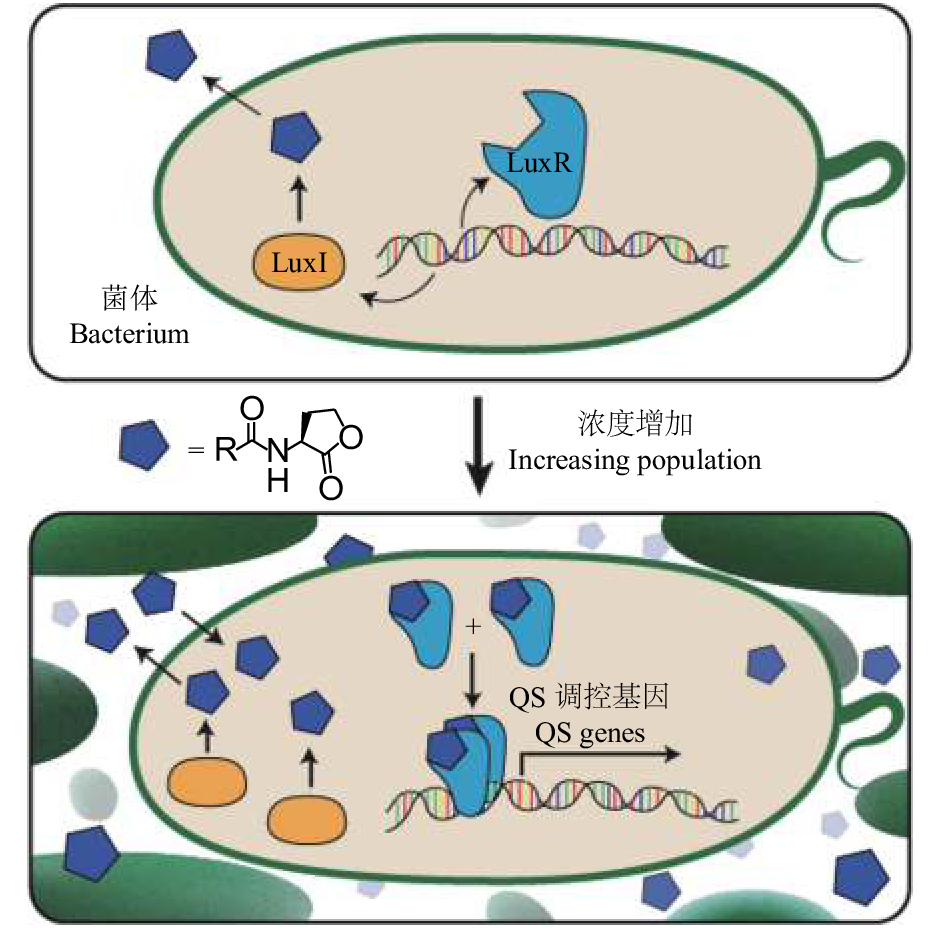
1 群体感应系统群体感应是指细菌能够通过分泌群体感应信号分子感应自身和周围其他种群数量的变化,当信号分子浓度达到一定阈值后,会与相应的受体蛋白结合,进一步激活靶基因的表达,从而调控细菌的一些行为,如生物发光、生物被膜形成、毒力因子表达、质粒转移、胞外蛋白酶产生等[7]。革兰氏阴性菌群体感应示意图见图1。其中LuxI型合成酶合成AHLs(蓝色五边体),其与同源LuxR型受体结合。在细胞浓度较高时,激活受体诱导QS基因转录。
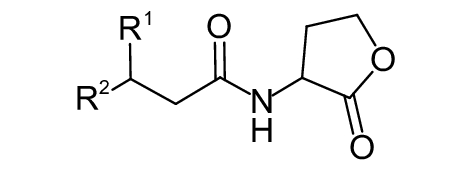
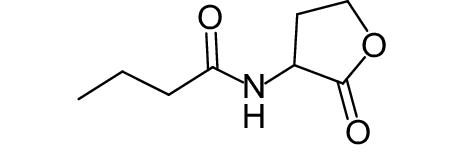
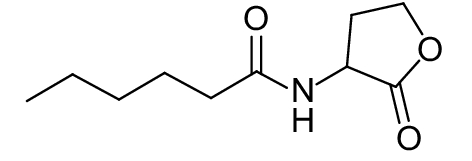
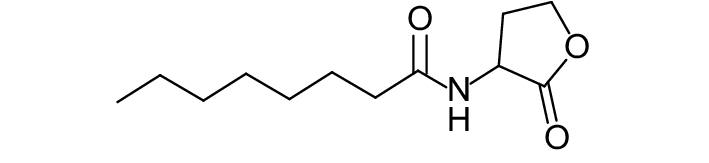
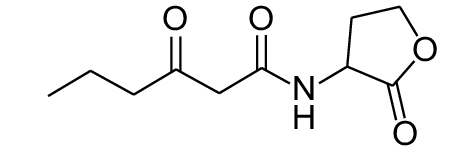
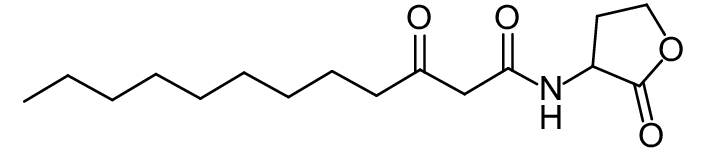
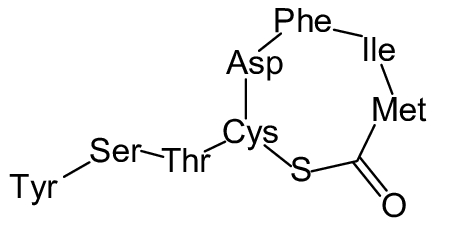
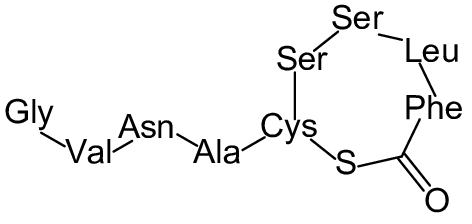
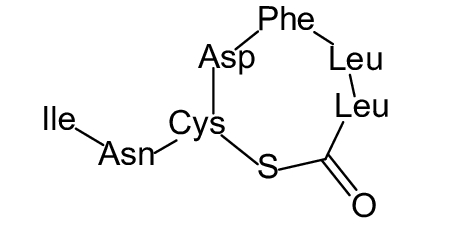
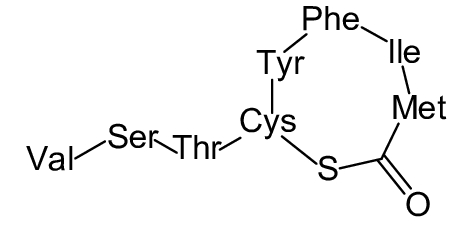
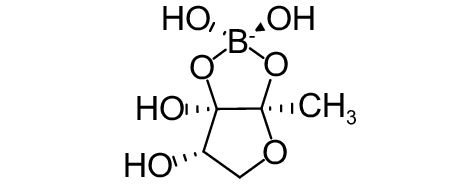
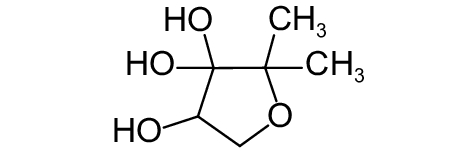
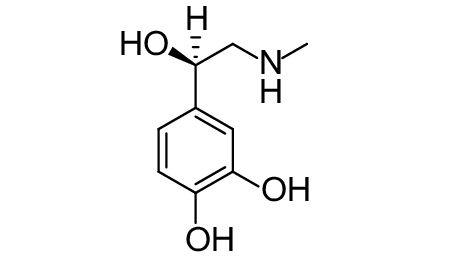
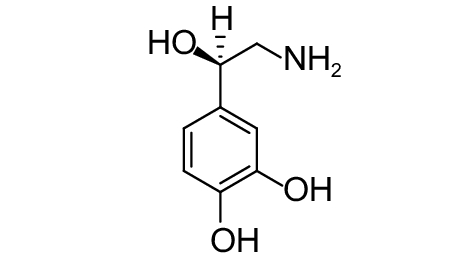
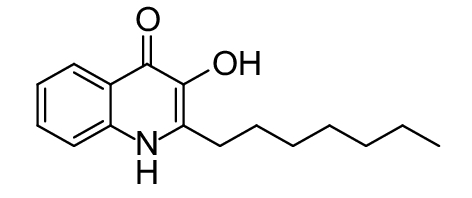
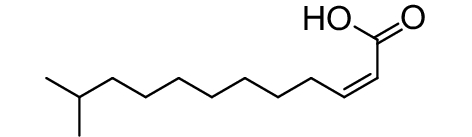
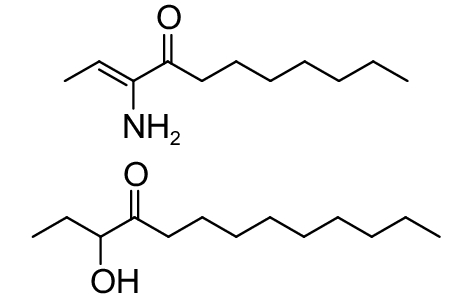
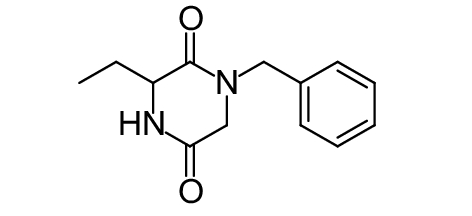
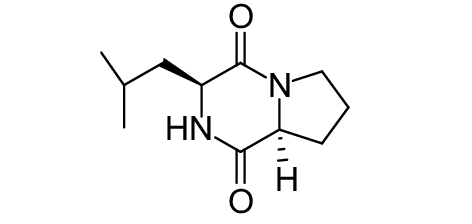
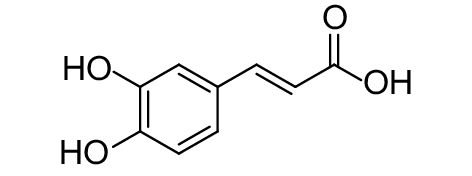
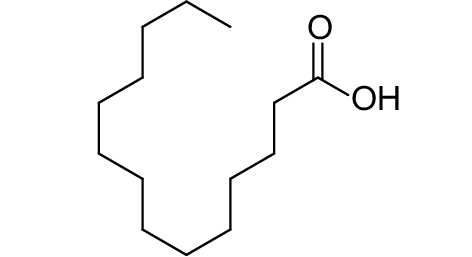
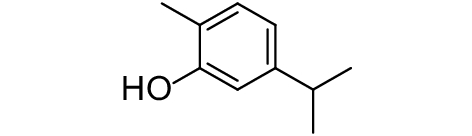
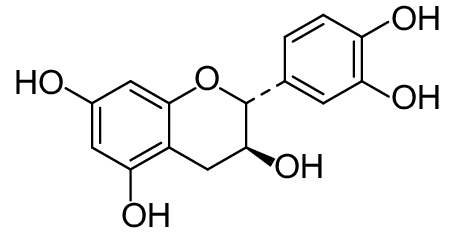
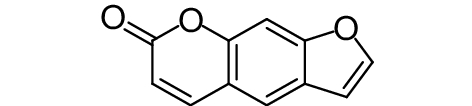
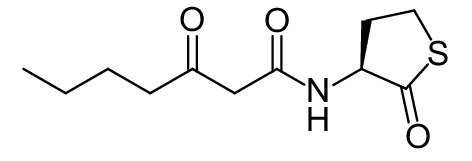
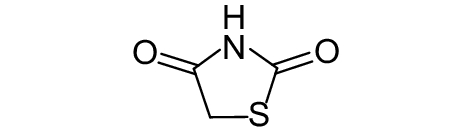
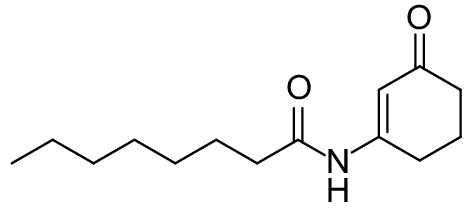
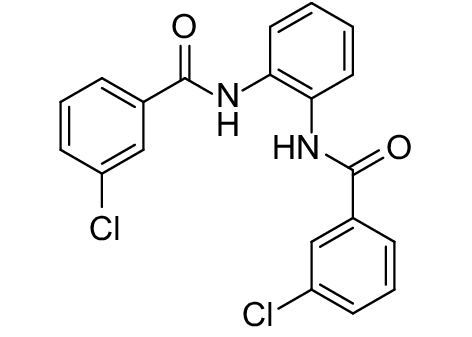
这种群体感应现象是通过一系列信号分子完成的。已经报道的主要群体感应信号分子的类型、化学结构及典型菌种见表1。主要可分为以下几种类型:1) 酰基高丝氨酸内酯 (AHLs)(表1,1-1~1-6);2) 寡肽 (AIP,5~10个氨基酸环内酯)(表1,1-7~1-10);3) 呋喃硼酸二酯 (AI-2)(表1,1-11~1-12);4) AI-3(肾上腺素/去肾上腺素)[9](表1,1-13~1-14);(5) 其他类型 (表1,1-15~1-19)。革兰氏阴性菌 (G–) 群体感应系统主要以AHLs为信号分子,而革兰氏阳性菌 (G+) 则利用AIP感知群体数量变化,还有多数革兰氏阴性菌和阳性菌均依赖AI-2的种间QS系统[10-11]。下面则分别按信号的分子不同对群体感应系统进行综述。
|
|
表 1 主要QS信号分子及化学结构 Table 1 Main QS signal molecule and their structural formula |
1.1 AHLs介导的革兰氏阴性细菌QS系统
革兰氏阴性菌一般以LuxI/R为QS系统,首先S-腺苷甲硫氨酸 (SAM) 与酰基侧链在LuxI合成酶作用下生物合成AHLs[18]。当AHLs浓度到达一定阈值时,其会与相应的受体蛋白LuxR氨基端结合,而LuxR羧基端则与靶标DNA序列结合,从而启动某些功能基因的表达[19]。AHLs分子的典型特征是含有一个高丝氨酸内酯环和一个酰胺链,区别在于酰胺链的长度不同 (碳原子数4~18个) 以及第3位上取代基 (氢、羟基、羰基) 不同[20]。由于高丝氨酸内酯环具有亲水性,N-酰基侧链具有疏水性,故这类化合物是一种水溶性、膜透过性分子,可以自由穿透细胞膜,并且胞内胞外浓度一致[21]。有的致病菌体内包含不止一套QS系统,如铜绿假单胞菌Pseudomonas aeruginosa产生的AHL信号分子C4-HSL(表1,1-2) 和3-oxo-C12-HSL(表1,1-6),其可分别与RhlR和LasR受体结合,另外其还具有喹诺酮信号PQS(表1,1-16)/MvfR系统[15]。QS系统之间具有等级调控效应,如LasI/LasR信号系统对RhlI/RhlR信号系统有调控作用[8]。
1.2 寡肽介导的革兰氏阳性菌QS系统革兰氏阳性菌一般通过寡肽类信号分子 (AIPs) 进行信息交流[5]。典型的如金黄色葡萄球菌Staphylococcus aureus,其AIP经体内的前肽AgrD蛋白加工,加工后的AIP不能自由穿透细胞膜,而是由膜转运蛋白AgrB输送到细胞外,在回到细胞内时与具有组氨酸激酶功能的AgrC胞外部分结合,从而使受体蛋白AgrA磷酸化,进而引起一系列毒力因子的表达[12]。这种双组分信号交换系统在枯草芽胞杆菌Bacillus subtilis中也存在,不同的是,其膜转运蛋白是ComX和ComP感应组氨酸激酶[13-14]。
1.3 AI-2介导的种间QS系统海洋发光细菌哈维氏弧菌Vibrio harveyi可以产生两种信号分子:AI-1(AHLs类) 和AI-2[12]。前者进行种内交流,后者进行种间交流。通过种间交流,细菌不但可以估计自身群体密度的变化,还可以感知周围其他细菌的密度,从而对自身的行为进行调整,以便在竞争中占据优势。还有一些呋喃酮结构的AI-2信号分子——AI-2b(表1, 1-12),事实证明其产生也依赖于LuxS蛋白[12]。现在普遍认为,革兰氏阴性菌和阳性菌都可以产生AI-2类信号分子,具有“通用性”,可以在不同种类的微生物间进行交流[12]。
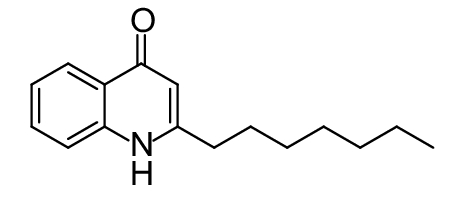
1.4 喹诺酮类QS系统喹诺酮类QS系统是铜绿假单胞菌特有的一类信号系统,其信号分子是2-庚基-3-羟基-4-喹诺酮 (2-heptyl-3-hydroxy-4-quinolone,PQS) 和其前体2-庚基-3-羟基-4-喹啉 (2-heptyl-3-hydroxy-4-quinoline,HHQ)[15]。PQS和HHQ是PqsR的天然激动剂,转录调节因子PqsR启动操纵子pqsABCDE的表达,该操纵子含有编码PQS合成酶基因,可进一步合成PQS;而PqsR启动操纵子pqsABCD表达,先合成HHQ,再通过PqsH进一步转化成PQS。因此,当PQS和HHQ激活PqsR时,它们就会诱导自身的产生,信号分子的浓度也会成倍上升[22]。PQS对毒力因子如绿脓菌素、弹性蛋白酶和LecA凝集素起着重要的调节作用,它们也是连接另外两个AHL信号分子的桥梁,这3个分子构成了一个非常复杂的信号网络[23]。
1.5 DSF调控的QS系统DSF信号分子最早在野油菜黄单胞菌Xanthomonas campestris中发现,并通过双组分信号交换系统被细菌识别[16]。首先,RpfF蛋白合成DSF信号分子并释放到胞外;随后被双组分蛋白RpfC识别。当DSF浓度较高时,RpfC即将磷酸转移到RpfG上,激活第二信使c-di-GMP磷酸二酯酶活性[16]。DSF可参与调节多种毒力因子,如细菌运动、生物被膜形成、铁的吸收、胞外多糖、胞外酶产生以及植物毒力因子等[24]。
1.6 AI-3介导的QS系统AI-3是另一类种间信号分子,一般存在于大肠杆菌Escherichia coli、沙门氏菌属Salmonella sp.和克雷伯菌属Klebsiella sp.和志贺氏菌属Shigella sp.等革兰氏阴性菌中[25],可由组氨酸感受器激酶QseC和反应调节器QseB组成的双组分信号感应系统识别AI-3。当AI-3与QseC结合后,QseC启动自磷酸化,QseB被激活,随即触发下游信号转导通路,最终激活细菌中关键致病基因的转录[25-26]。
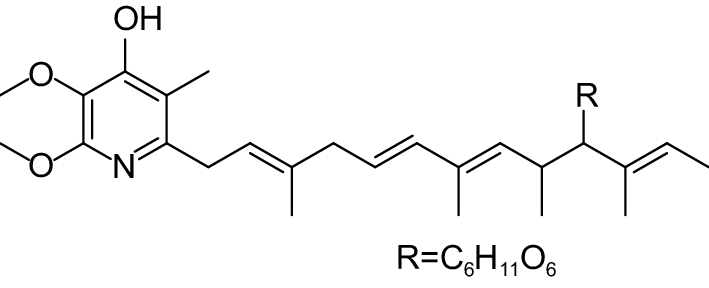
1.7 其他群体感应系统除此之外,细菌还有其他一些QS系统,如在霍乱弧菌Vibrio choierae和哈维式弧菌中发现的CAI-1(Cholerae autoinducer-1)(表1, 1-18) 型群体感应系统[16],以及在弗氏柠檬酸杆菌Citorbacter freundii的培养上清液中提取的二酮哌嗪类化合物DPKs(diketopiperazines)(表1, 1-19)[17]。
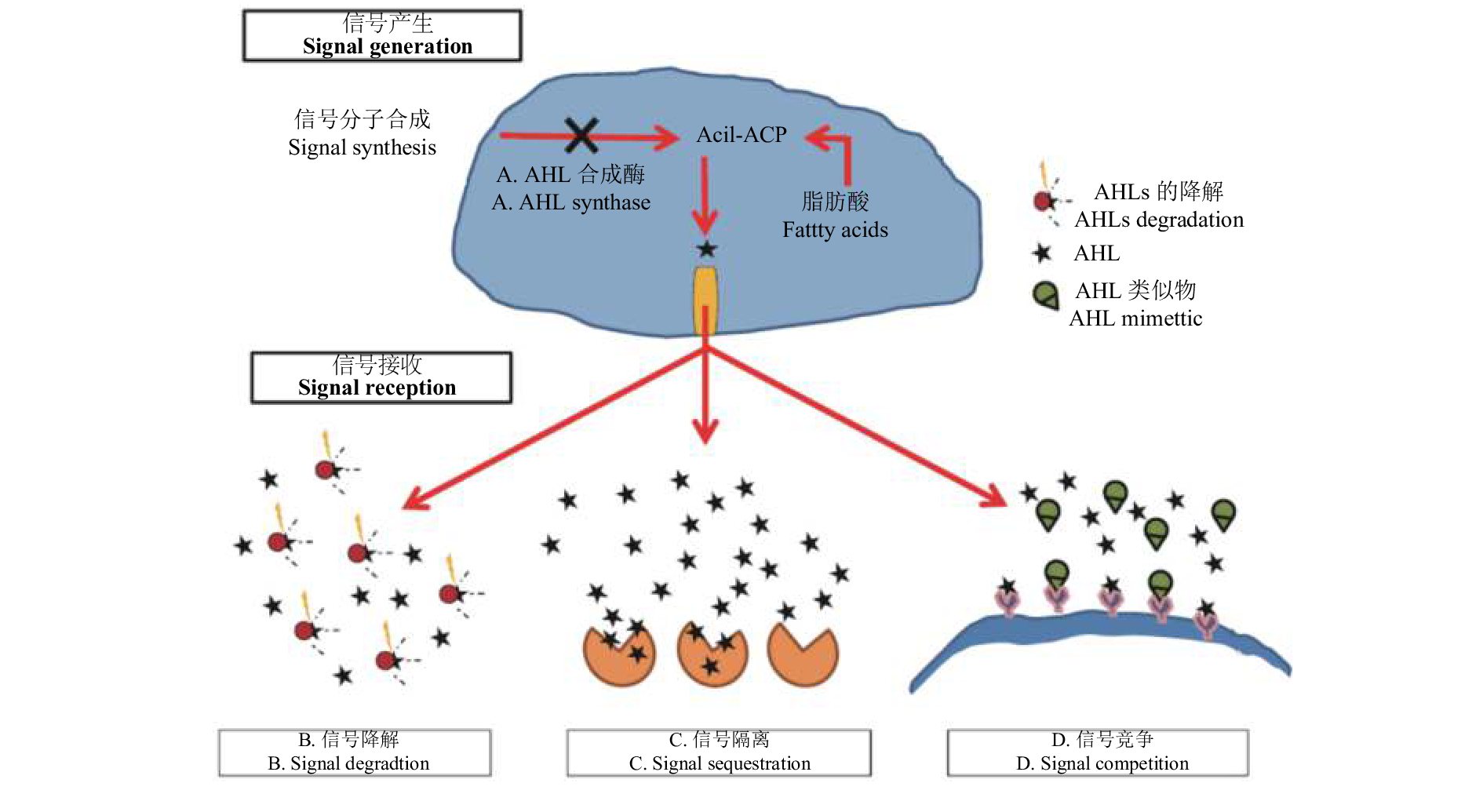
2 群体感应抑制剂通过干扰信号分子合成、集聚或者与受体蛋白结合都可以抑制由细菌群体感应引起的毒力因子的表达。抑制群体感应的机制主要有 (图2):1) 降低AHLs同源受体蛋白或AHLs合成酶的活性;2) 抑制信号分子的产生;3) 降解信号分子;4) 信号分子类似物竞争性地抑制信号分子与受体蛋白的结合[5]。
随着对群体感应系统研究的深入,出现了越来越多的群体感应抑制剂 (quorum sensing inhibitors, QSIs),其种类也呈现出多样化趋势。按照结构不同可分为呋喃酮类、内酯类、取代的HSL类和AIP类等。按照来源不同可分为天然群体感应抑制剂和人工合成群体感应抑制剂,而天然群体感应抑制剂又分为原核生物类、动物类、植物类、海洋生物类以及真菌类。
2.1 天然群体感应抑制剂 2.1.1 原核生物产生的QSIs相当一部分原核生物能产生群体感应猝灭酶以及次级代谢产物。现已证实至少有3种类型的群体感应猝灭酶能破坏AHLs,分别为AHL-酰基转移酶、AHL-内酯酶和AHL-氧化还原酶。其中,AHL-内酯酶能水解AHLs的内酯环,AHL-酰基转移酶能破坏AHLs酰基侧链的酰胺键,而AHL-氧化还原酶可还原AHLs,使其无法被受体识别[5, 28]。一部分细菌能同时产生AHL-内酯酶和AHL-酰基转移酶,如红球菌菌株 Rhodococcus erythropolis W2、粘着杆菌株Tenacibaculum discolor 20J和生丝单胞菌株Hyphamonas sp. DG895等[29-30]。红球菌菌株W2和交替单胞菌株Alteromonas sp. 168可特异性地降解信号分子C4-HSL和3-oxo-C12-HSL,前者可以减少马铃薯块茎中果胶杆菌属Pectobacterum sp.的致病性[29]。短小芽胞杆菌菌株Bacillus pumilus S8-07可特异性地降解3-oxo-C12-HSL[31]。伯克氏菌株Burkholderia GG4合成过氧化氢酶可特异性地降解3-oxo-C6-HSL(表1,1-5)[32]。Dong等[33]从芽胞杆菌中分离出一种内酯酶基因aiiA,可水解AHLs的内酯键,使其难以达到引起致病因子表达的临界浓度,从而使病原菌失去致病力。把内酯酶基因aiiA转移到植物体内,发现植物对欧文氏菌属Erwinia具有较好的抗性[34]。
木糖氧化无色杆菌Achromobacter xylosoxidans Q19可使信号分子PQS杂环上的2位羟基化,从而抑制铜绿假单胞菌的群体感应[35]。Newman等[36]从圆白菜、花椰菜和番茄中分离出5种致病菌株,包括假单胞菌和蜡样芽胞杆菌Bacillus cereus,发现这5种菌株均可以降解野油菜黄单胞菌的DSF信号分子。Caicedoa等[37]从柑橘叶中分离出2株假单胞菌和2株芽胞杆菌,其均可以降解柑橘溃疡病菌Xanthomonas citri的DSF信号分子。以上这些群体感应猝灭菌是植物病害防治过程中一种非常有价值的工具。
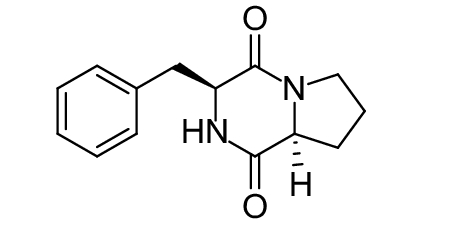
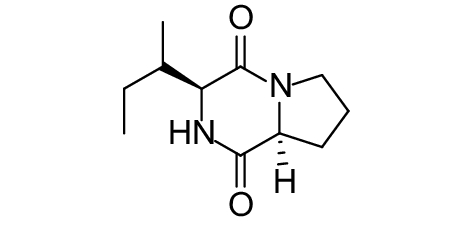
原核生物的次级代谢产物因为代谢方式不同而不同。从杀黄孢链霉菌Streptomyces xanthocidicus KPP01532中提取的化合物glucopiericidin A(表2,2-1) 能抑制紫色色杆菌Chromobacterium violaceum CV026 紫色素的产生,同时可抑制胡萝卜中由软腐欧文氏菌Erwinia carotovora 引起的软腐作用[38]。而Abed等[39]在海杆菌属Marinobacter sp. SK-3 中发现的二酮哌嗪类化合物环 (L-脯氨酸-L-苯丙氨酸)(表2,2-2) 和环 (L-脯氨酸-L-异亮氨酸)(表2,2-3) 均能有效抑制紫色色杆菌CV017 紫色素的产生,而环 (L-脯氨酸-L-苯丙氨酸)、环 (L-脯氨酸-L-异亮氨酸) 和环 (L-脯氨酸-L-亮氨酸)(表2,2-4) 均能抑制由3-oxo-C6-HSL介导的大肠杆菌报告菌pSB401生物荧光的产生。沙雷氏菌Serratia plymuthica和荧光假单胞菌Pseudomonas fluorescens可产生特殊的QSIs,如一种挥发性有机化合物二甲基二硫醚 (表2,2-5)可以抑制由AHL介导的群体感应[40]。
2.1.2 动物产生的QSIs在小鼠、大鼠和斑马鱼等动物体内也发现了群体感应猝灭酶。如:猪肾脏酰基转移酶I能降解3-oxo-C12-HSL和C6HSL(表1,1-3) 信号分子,但不能降解C4-HSL[9];Yang等[41]在牛、羊、马、鼠、兔的血清中发现了能灭活3-oxo-C12-HSL的物质。
蜂胶中的异戊烯咖啡酸 (表2,2-6) 能够显著抑制紫色色杆菌紫色杆菌素 (violacein) 的合成[42]。
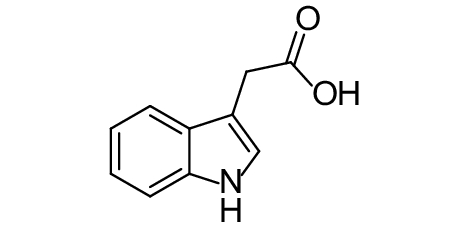
2.1.3 植物产生的QSIs植物生长素激素吲哚3-乙酸 (表2,2-7) 可抑制鼻疽伯克霍尔德氏菌Burkholderia mallei AHL合成酶的活性[43]。茶多酚在3.125 mg/mL下对紫色色杆菌12472色素的产生有98%抑制活性,对铜绿假单胞菌也表现出群体感应抑制作用[44]。刺山柑的甲醇提取物可抑制紫色色杆菌产生紫色杆菌素,并对大肠杆菌、奇异变形杆菌Proteus mirabilis的群游以及胞外蛋白和生物被膜的形成均有抑制作用[45]。Lou等[46]发现牛蒡叶乙醇提取物在2.0 mg/mL时,对铜绿假单胞菌生物被膜形成的抑制率高达100%,同时也可抑制弹性蛋白酶和绿脓菌素的活性。Chenia[47]对非洲吊瓜的正己烷提取物研究发现,该提取物干扰紫色色杆菌和根癌土壤杆菌Agrobacteriium tumefaciens的群体感应。经检测,LuxI和LuxR活性均受到影响,表明该粗提物同时作用于信号分子与受体。
研究表明,姜黄素可影响细菌群游、胞外多糖 (exopolysaccharide,EPS) 的产生以及生物被膜的成熟,同时可增强病原菌对传统抗生素的敏感性[48]。Abd-Alla等[49]从洋葱中提取的肉豆蔻酸 (表2,2-8),在不影响铜绿假单胞菌生长的情况下,能显著抑制铜绿假单胞菌产生绿脓菌素,抑制其蛋白酶、脂肪酶、果胶酶的活性。香芹酚 (表2,2-9) 可干扰铜绿假单胞菌生物被膜形成和绿脓菌素的产生,3.9 mmol/L的香芹酚对绿脓菌素的抑制率是60%[50]。Koh等[51]发现辣木的叶和果荚中的代谢物可以抑制紫色色杆菌产生紫色杆菌素。许多豆科植物提取物具有群体感应抑制活性,如紫花苜蓿、三叶草、百脉根幼苗、大麦、豌豆和豆薯等[5]。草本植物野茶树产生的儿茶素 (表2,2-10) 会影响大肠杆菌R质粒的接合转移。百里香和甘蓝提取物对紫色杆菌素的抑制率达60%。拟南芥渗出液干扰根癌土壤杆菌QS信号分子的表达[5]。
西柚中的呋喃香豆素 (表2,2-11) 能够抑制哈维氏弧菌Vibrio harveyi报告菌株BB886和BB170中的信号分子AI-1和AI-2活性,并能抑制大肠杆菌和铜绿假单胞菌等病原菌生物被膜的形成。提纯后的呋喃香豆素对这两种信号分子的抑制率在94.6%~97.7%之间,而西柚汁对AI-1和AI-2的抑制率相对较低,分别只有47%~62%和16.8%~27.5%[52]。白藜芦醇 (表2,2-12) 能有效抑制紫色色杆菌产生紫色杆菌素、以及铜绿假单胞菌PAO1生物被膜形成和毒力因子的表达。研究发现,用白藜芦醇处理过的铜绿假单胞菌PAO1的生物被膜增强了对抗生素的敏感性[53]。黄酮类化合物如柚皮素 (表2,2-13)、山奈酚 (表2,2-14) 和槲皮素 (表2,2-15) 都能抑制哈维氏弧菌BB886菌株由信号分子AI-2介导的生物发光。槲皮素和柚皮素还能抑制哈维氏弧菌BB120和大肠杆菌O157 : H7菌株生物被膜的形成[54]。
目前,文献报道了许多植物能产生QSI活性物质,但这些QSIs多用于医学上,用于植物病害防治的少之又少。因此,深入研究植物QSIs的活性与作用机制,并将植物本身的QSIs应用于植物病害防治上显得尤为重要。
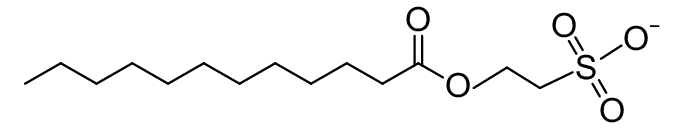
2.1.4 海洋生物产生的QSIs从海洋红藻中发现的卤代呋喃酮是最早发现的由海洋生物产生的群体感应抑制剂,其可通过与细菌的信号分子竞争性地结合LuxR而干扰QS过程,能有效阻断哈氏弧菌生物发光[55]。分泌QSIs最普遍的海洋生物是软珊瑚Alcyonacea和海绵Ircinia felix,此外,在柳珊瑚(Gorgonacea)、硬珊瑚(Alcyoneum)、苔藓虫(Bryozoa)以及海鞘 Pyrosomella verticilliata体内也发现了群体感应抑制物质[56]。从海绵中提取的6种呋喃三萜 (表2,2-16) 化合物具有群体感应抑制作用[57]。紫杉状海门冬藻Asparagopsis taxiformis能够产生十二酸磺酰乙酯 (C14H27O5S)(表2,2-17),该化合物可显著降低群体感应信号分子的活性,从而抑制细菌毒力产生[58]。蓝藻细菌能抑制群体感应相关基因表达。从巨大鞘丝藻Lyngbya majuscula中分离出的巨大鞘丝藻内酯 (表2,2-18) 和鞘丝藻酸 (表2,2-19) 均具有病原菌抑制能力,前者可干扰紫色色杆菌和铜绿假单胞菌的QS系统,后者可影响铜绿假单胞菌毒力因子的产生[59-60]。
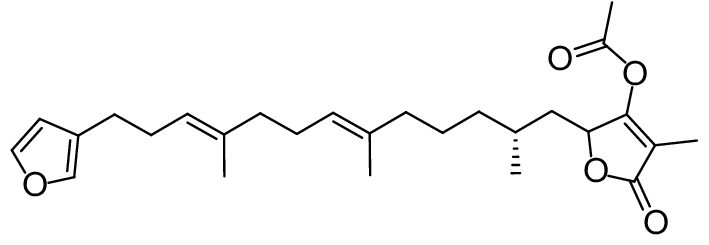
2.1.5 真菌类QSIs真菌产生的次级代谢产物主要有抗生素等。Rasmussen等[61]在33种青霉菌属Penicillium中发现了QSIs——棒曲霉素 (表2,2-20) 或青霉酸 (表2,2-21),其可干扰铜绿假单胞菌的RhlR和LasR受体蛋白。从青霉菌中提取的化合物meleagrin(表2,2-22),是一种烯酰基载体蛋白还原酶 (FabI) 抑制剂,对紫色色杆菌QS最小抑制浓度为138.42 μmol/L[62]。食用真菌如黑木耳、银耳也能产生群体感应抑制物质,影响紫色色杆菌色素产生[63]。
|
|
表 2 部分天然QSIs的化学结构及靶标 Table 2 Structural formulaand targets of some natural QSIs |
2.2 化学合成QSIs
尽管天然来源的群体感应抑制剂已有很多报道,但其浓度以及毒力普遍较低,可通过化学合成这些已知的天然QSIs类似物及其他QSIs来打破这种限制。目前化学合成的QSIs主要有呋喃酮类、取代HSL类、内酯类和其他类型化合物。
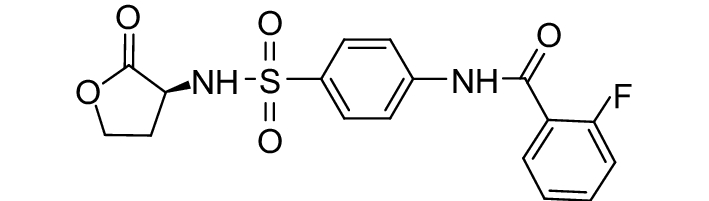
2.2.1 呋喃酮类人工合成的呋喃酮类化合物很多,研究也比较广泛。Hentzer等[64]发现呋喃酮C-30(表3,3-1) 可以作为铜绿假单胞菌的QS信号分子拮抗剂,能够抑制其编码外排泵 (efflux pump) 和相关毒力因子的基因表达;后又证实用C-30处理过的细菌对抗生素的敏感性显著增强。此外,C-30还可抑制变形链球菌Streptococcus mutans生物被膜的形成,使生物被膜更薄甚至解体,这也与C-30降低了QS调控基因的表达活性有关[65]。
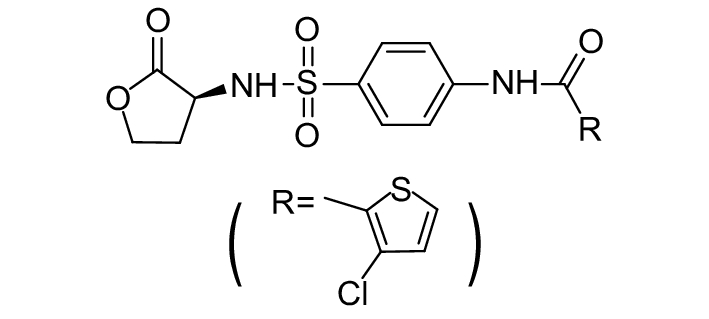
2(5H)-呋喃酮 (表3,3-2) 可破坏空肠弯曲杆菌Campylobacter jejuni的群体感应系统,并影响细菌群集运动和生物被膜形成[66]。Brackman等[67]用烷基和芳基取代的三唑环代替AHL类似物的酰胺键,合成了一系列化合物,发现其均能抑制铜绿假单胞菌的LuxR群体感应系统,但只有链长10~12个碳原子的化合物 (表3,3-3) 才能抑制LasR系统,抑制活性最高的几种物质同时可以降解铜绿假单胞菌和伯克氏菌的生物被膜。
2.2.2 取代的HSL类通过对AHL信号分子中高丝氨酸内酯环头部或烷基侧链尾部进行化学修饰或二者同时改造,研究者设计出了一批具有群体感应抑制活性的化合物。Gerdt等[68]发现OdDHL类似物改变了信号分子受体LasR的空间构型,从而影响与OdDHL的结合。两种异硫氰酸荧光素探针,Itc-11(表3,3-4) 和Itc-12(表3,3-5),共价修饰LasR的配基结合区域 (Cys79),并且均有铜绿假单胞菌群体感应抑制活性[69]。
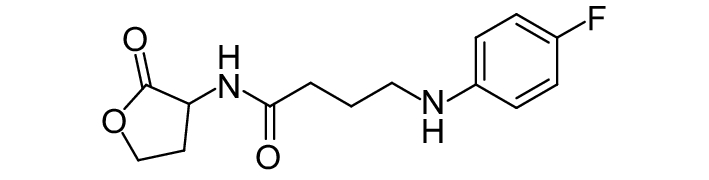
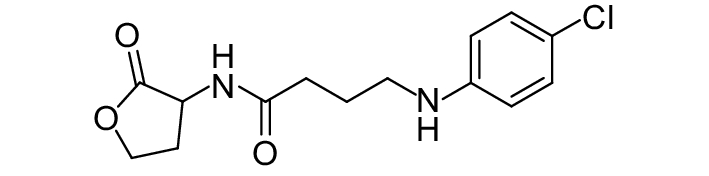
2.2.3 内酯类Zhao等对氯代内酯 (chlorolactone, CL) 的结构进行修饰,在高丝氨酸内酯环与烷基侧链间引入4-苯磺酰胺官能团,合成了一系列化合物,其中化合物 (表3,3-6) 对紫色菌素抑制率达99.2%[70];之后进一步在R位上引入呋喃、噻吩、吡啶、吡咯等杂环,发现当R位上为噻吩且为2位取代时 (表3,3-7) 有较好的QS抑制活性[71]。O'Loughlin等测定了CL(表3,3-8)、氯硫代内酯 (chlorothiolactone, CTL) (表3,3-9) 、间氯硫代内酯 (meta-chloro-thiolactone, mCTL) (表3,3-10)、间溴硫代内酯 (meta-bromo-thiolactone, mBTL) (表3,3-11) 对铜绿假单胞菌群体感应的影响,发现CL和CTL可以与铜绿假单胞菌群体感应信号受体 (LasR、RhlR) 产生竞争性结合,从而阻碍生物被膜的形成,但不干扰绿脓菌素产生;而mCTL与mBTL对绿脓菌素的IC50值分别为9 μmol/L和8 μmol/L[72]。Kalaiarasan等[73]在mCTL与mBTL上引入更多氢键,设计合成了N-(4-(4-氟苯胺)丁酰)-L-高丝氨酸内酯 (FABHL,表3,3-12) 和N-(4-(4-氯苯胺)丁酰)-L-高丝氨酸内酯 (CABHL,表3,3-13)。分子模拟计算结果表明,FABHL和CABHL能和LasR以氢键结合,也能影响生物被膜形成[73]。
McInnis等[74]设计并合成了一系列硫代内酯类信号分子类似物,并首次研究了该类化合物对LuxI/LuxR型群体感应系统的影响,评价了对3种LuxR型受体——LasR、LuxR和TraR的拮抗与激活作用。结果发现,化合物3-14(表3) 对LuxR受体具有抑制作用,同时对TraR受体具有高效激活作用。这项工作为研究革兰氏阴性菌QS系统寻找新型化学探针提供了思路。
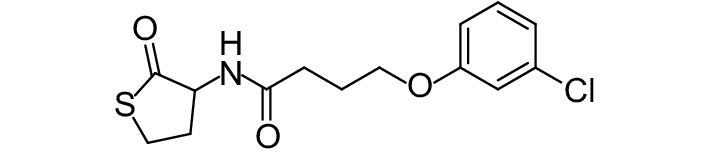
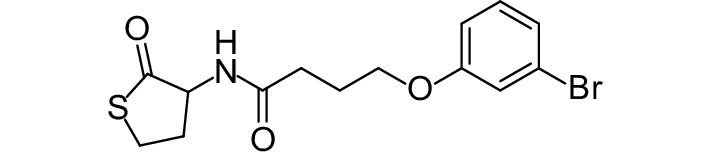
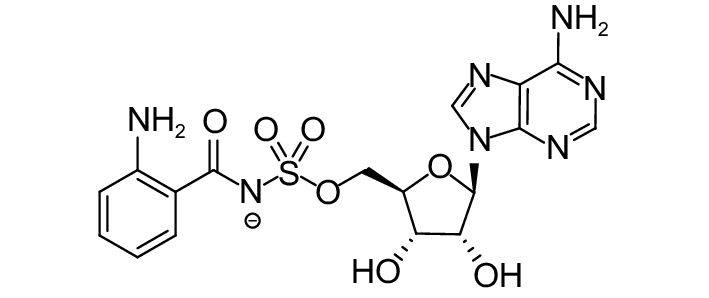
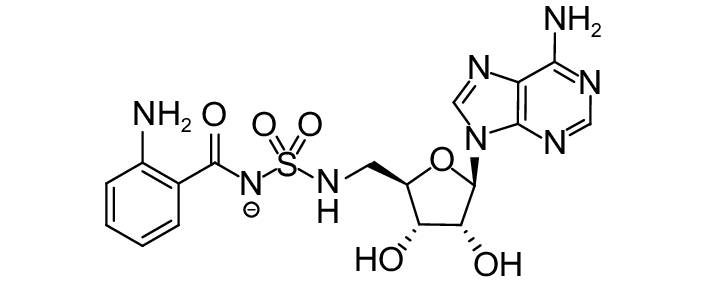
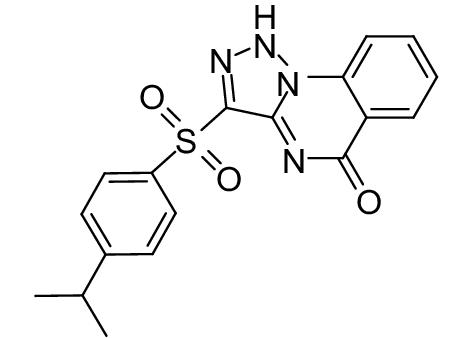
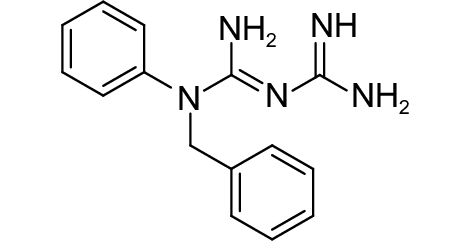
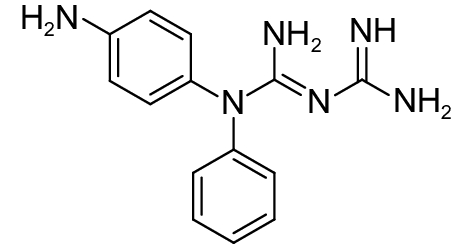
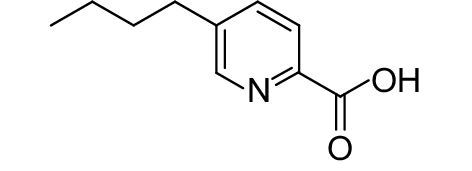
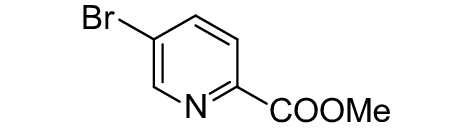
2.2.4 其他一些含二醇的化合物如邻苯三酚、硼酸和砜类化合物可显著抑制信号分子AI-2与LuxP的结合[75]。噻唑烷二酮类化合物 (表3,3-15) 通过干扰DNA与AI-2受体LuxR结合,抑制哈氏弧菌生物发光[76]。体外试验证实,J8-C8(表3,3-16) 可直接抑制水稻细菌性谷枯病菌Burkholderia glumae信号分子合成酶TofI,由于J8-C8辛酰链结构的存在,使得其可与酰基载体蛋白竞争性地抑制C8-HSL(表1,1-4) 的合成[77]。化合物3-17 (表3) 可与LasR蛋白上的残基Asp73形成氢键,从而降低LasR受体与信号分子结合的能力[69]。Cheng等[78]合成的苯甲酰亚氨-AMS (表3,3-18) 和苯甲酰亚氨-AMSN (表3,3-19) 是PqsA的高效抑制剂,可抑制铜绿假单胞菌HHQ和PQS信号分子的合成。β-酮酯类似物 (表3,3-20) 与AHL具有相似的结构,它通过与LuxR型受体蛋白结合可抑制群体感应系统[79]。化合物3-21 (表3) 可调节LasR受体活性,进而强烈抑制铜绿假单胞菌群体感应依赖的毒力因子的产生[8]。Sully等[80]对24 087种化合物进行高通量筛选,从中发现一种新颖的QSIs ——savarin(表3,3-22)——金黄色葡萄球菌毒力因子抑制剂,它能阻碍该菌的Agr群体感应系统,从而减轻由金黄色葡萄球菌引起的感染。Singh等[81]以已知的QSIs双氯苯乙胍己烷和氯苄烷铵盐为原型进行修饰,得到1-苄基-1-苯基双胍 (表3,3-23) 和1-(4-氨基苯基)-1-苯基双胍 (表3,3-24),其能有效抑制紫色色杆菌ATCC12472 的紫色素产生。Tung等[82]测定了5-丁基-2-吡啶甲酸 (表3,3-25) 及39个类似物如3-26 (表3) 的群体感应抑制活性,结果表明,该类化合物有适度的群体感应抑制活性,为发展一种新的QSIs支架结构提供了参考。
目前,人工合成的QSIs主要对哺乳动物致病菌的群体感应有效,对植物病原菌的群体感应抑制作用研究甚少,因此有待进一步探究人工合成QSIs对植物病害的防治效果。
|
|
表 3 部分合成QSIs的化学结构及作用机制 Table 3 Structural formulaof some synthetic QSIs and their mode of action |
3 QSIs的主要应用 3.1 水产养殖
细菌病害是商业化水产养殖中最为关键的问题之一,而细菌抗生素的大量使用以及生物性农药的残留会加剧致病菌的耐药性,因此促进了其他病原菌控制策略的发展,如群体感应猝灭 (quorum quenching,QQ)。利用一些能产生QSIs的海洋或淡水藻类物质可以阻断水生病原菌如哈氏弧菌的群体感应系统,从而抑制病原菌毒素的产生,最终达到治疗水产感染的目的。具有信号分子降解活性的QSIs能够提高被感染鱼类的存活率,从而提高水产品产量[6]。
3.2 污水治理膜生物反应器作为一种海水淡化及废水处理技术,广泛用于污水处理,但在使用过程中大量细菌会堵塞膜过滤器而形成生物淤积,从而大大降低污水处理效率。由于生物被膜是引起该类污染的第一步,因此运用QSIs抑制生物被膜的形成尤为关键。通过添加群体感应信号分子分解物质,使群体感应系统活性降低,控制生物淤积的产生,从而提高反应器运行效果和寿命。例如将包埋白色念珠菌 (金合欢醇产生菌) 的磁珠 (entrapping beads,AEBs) 放置在膜生物反应器 (membrane bioreactors,MBRs) 中,一方面跨膜压力 (TMP) 上升率会大幅降低,甚至降低曝气强度;另一方面金合欢醇可以破坏群体感应系统,调节废水处理反应器运行[83]。
3.3 农作物病害防治近些年来,干扰致病菌的QS系统在防治农作物病害上取得了初步进展,如利用固氮细菌的QS系统可以优化植物根部的结节形成[4]等。研究最为广泛的是群体感应猝灭酶,将QS信号分子降解酶基因插入到植物的脱氧核糖核酸 (DNA) 中,建立了植物的防御机制,可用于病害防治,提高作物产量。如:芽胞杆菌240B1菌株产生的AiiA酶可以降低胡萝卜软腐欧文氏菌的致病性[84];在马铃薯和烟草中,群体感应猝灭酶“内酯酶”的应用,降低了致病菌的致病能力[85];砖红色微杆菌Microbacterium testaceum对马铃薯叶片具有天然的AHLs降解作用[23];链霉菌菌株的次级代谢产物粉蝶霉素A可抑制胡萝卜软腐果胶杆菌Pectobacterium carotovorumQS调控的相关毒力因子的表达[23]。然而,为了证实这些QQ酶的稳定性和方法的适用性,还需要进行细致的研究;而有关转基因植物的培育仍然存在争议[86]。
4 小结与展望细菌QSIs以细菌的QS系统为作用靶标,与以往的细菌病害防治原理完全不同,其并不杀死细菌或抑制细菌生长,但可以干扰病原菌致病因子的正常表达,这一机制对病原细菌存活的压力较小,不易产生抗药性[87]。目前已报道许多不同种类的QSIs,包括天然产物及合成化合物,并且越来越多人工合成的QSIs应用于实际生产中,以弥补天然QSIs在数量和效力上的不足, 然而目前只有少数的QSIs作用靶标较为明确[16]。
以QS系统为靶标,猝灭植物病原细菌的群体感应信号传递途径,在现有研究基础上筛选QSIs仍然是未来开发新型抗植物病害药物的可行方法,然而目前人工合成的QSIs多应用于医学领域,防治农业病原菌的报道并不多。对于AHL在植物体内信号转导途径以及与受体蛋白结合机制的研究报道也不多,这可能与细菌和其宿主植物间复杂的关系有关。为此,应加强对植物病原菌致病性与群体感应关系的研究,针对性的筛选用于防治植物病害的QSIs,从而开发出新型、安全、高效的可替代农药。同时考虑到可持续农业发展,尽管通过QSIs抑制植物群体感应是一个有趣的课题,但少有研究它们对生态系统的实际影响。此外,有关QSIs释放到环境中的代谢活动和生态问题,以及使用QQ策略控制植物病害是否会对环境中存在的有益或共生细菌产生不良影响等尚不明确,因此,了解QSIs在植物、动物和细菌之间的联系和 (或) 相互作用将是未来研究的主要挑战[86]。
| [1] |
NEALSON K H, HASTINGS J W. Bacterial bioluminescence its control and ecological significance[J]. Microbiol Rev, 1979, 43(4): 496-518. |
| [2] |
FUQUA W C, WINANS S C, GREENBERG E P. Quorum sensing in bacteria-the LuxR-LuxI family of cell density-responsive transcriptional regulators[J]. J Bacteriol, 1994, 176(2): 269-275. DOI:10.1128/jb.176.2.269-275.1994 |
| [3] |
ROY V, ADAMS B L, BENTLEY W E. Developing next generation antimicrobials by intercepting AI-2 mediated quorum sensing[J]. Enzyme Microb Tech, 2011, 49(2): 113-123. DOI:10.1016/j.enzmictec.2011.06.001 |
| [4] |
周静煌, 严准, 高春生, 等. 群体感应抑制及其植物病害防控应用研究进展[J]. 南方农业学报, 2017, 48(12): 2197-2203. ZHOU J H, YAN Z, GAN C S, et al. Quorum sensing inhibition and its application in plant disease control: A review[J]. J Southern Agric, 2017, 48(12): 2197-2203. DOI:10.3969/j.issn.2095-1191.2017.12.13 |
| [5] |
KALIA V C. Quorum sensing inhibitors: an overview[J]. Biotechnol Adv, 2013, 31(2): 224-245. DOI:10.1016/j.biotechadv.2012.10.004 |
| [6] |
GRANDCLEMENT C, TANNIERES M, MORERA S, et al. Quorum quenching: role in nature and applied developments[J]. FEMS Microbiol Rev, 2016, 40(1): 86-116. DOI:10.1093/femsre/fuv038 |
| [7] |
GOBBETTI M, DE ANGELIS M, DI CAGNO R, et al. Cell-cell communication in food related bacteria[J]. Int J Food Microbiol, 2007, 120(1-2): 34-45. DOI:10.1016/j.ijfoodmicro.2007.06.012 |
| [8] |
MOORE J D, ROSSI F M, WELSH M A, et al. A comparative analysis of synthetic quorum sensing modulators in Pseudomonas aeruginosa: New insights into mechanism, active efflux susceptibility, phenotypic response, and next-generation ligand design
[J]. J Am Chem Soc, 2015, 137(46): 14626-14639. DOI:10.1021/jacs.5b06728 |
| [9] |
DONG Y H, ZHANG L H. Quorum sensing and quorum-quenching enzymes[J]. J Microbiol, 2005, 43(1): 101-109. |
| [10] |
AMARA N, KROM B P, KAUFMANN G F, et al. Macromolecular inhibition of quorum sensing: enzymes, antibodies, and beyond[J]. Chem Rev, 2011, 111(1): 195-208. DOI:10.1021/cr100101c |
| [11] |
WATERS C M, BASSLER B L. Quorum sensing: Cell-to-cell communication in bacteria[J]. Annu Rev Cell Dev Biol, 2005, 21: 319-346. DOI:10.1146/annurev.cellbio.21.012704.131001 |
| [12] |
REUTER K, STEINBACH A, HELMS V. Interfering with bacterial quorum sensing[J]. Perspect Medicin Chem, 2016, 8(8): 1-15. |
| [13] |
TORTOSA P, LOGSDON L, KRAIGHER B, et al. Specificity and genetic polymorphism of the Bacillus competence quorum-sensing system
[J]. J Bacteriol, 2001, 183(2): 451-460. DOI:10.1128/JB.183.2.451-460.2001 |
| [14] |
TRAN L S P, NAGAI T, ITOH Y. Divergent structure of the ComQXPA quorum-sensing components: molecular basis of strain-specific communication mechanism in Bacillus subtilis
[J]. Mol Microbiol, 2000, 37(5): 1159-1171. DOI:10.1046/j.1365-2958.2000.02069.x |
| [15] |
王诗琪, 何晓静, 李晓冰, 等. 铜绿假单胞菌群体感应系统研究进展[J]. 中国医院药学杂志, 2016, 36(2): 149-152. WANG S Q, HE X J, LI X B, et al. Research progress of quorum sensing system in Pseudomonas aeruginosa [J]. Chin J Hospit Pharm, 2016, 36(2): 149-152. |
| [16] |
DEFOIRDT T. Quorum-sensing systems as targets for antivirulence therapy[J]. Trends Microbiol, 2018, 26(4): 313-328. DOI:10.1016/j.tim.2017.10.005 |
| [17] |
李婷婷, 国竞文, 励建荣, 等. 细菌生物被膜的研究进展及与群体感应的关系[J]. 中国渔业质量与标准, 2017, 7(1): 1-7. LI T T, GUO J W, LI J R, et al. Research progress of bacterial biofilm and its relationship with quorum sensing[J]. Chinese Fishery Quality Standards, 2017, 7(1): 1-7. |
| [18] |
PEREIRA C S, THOMPSON J A, XAVIER K B. AI-2-mediated signalling in bacteria[J]. Fems Microbiol Rev, 2013, 37(2): 156-181. DOI:10.1111/j.1574-6976.2012.00345.x |
| [19] |
ZHANG R G, PAPPAS K M, BRACE J L, et al. Structure of a bacterial quorum-sensing transcription factor complexed with pheromone and DNA[J]. Nature, 2002, 417(6892): 971-974. DOI:10.1038/nature00833 |
| [20] |
MILLER M B, BASSLER B L. Quorum sensing in bacteria[J]. Annu Rev Microbiol, 2001, 55(1): 165-199. DOI:10.1146/annurev.micro.55.1.165 |
| [21] |
FUQUA C, PARSEK M P, GREENBERG E P. Regulation of gene expression by cell-to-cell communication: Acyl-homoserine lactone quorum sensing[J]. Annu Rev Genet, 2001, 35(1): 439-468. DOI:10.1146/annurev.genet.35.102401.090913 |
| [22] |
THOMANN A, DE MELLO MARTINS A G, BRENGEL C, et al. Application of dual inhibition concept within looped autoregulatory systems toward antivirulence agents against Pseudomonas aeruginosa infections
[J]. ACS Chem Biol, 2016, 11(5): 1279-1286. DOI:10.1021/acschembio.6b00117 |
| [23] |
TURAN N B, CHORMEY D S, BÜYÜKPINAR C, et al. Quorum sensing: little talks for an effective bacterial coordination[J]. Trac-Trend Anal Chem, 2017, 91: 1-11. DOI:10.1016/j.trac.2017.03.007 |
| [24] |
ZHOU L, ZHANG L H, CÁMARA M, et al. The DSF family of quorum sensing signals: diversity, biosynthesis, and turnover[J]. Trends Microbiol, 2017, 25(4): 293-303. DOI:10.1016/j.tim.2016.11.013 |
| [25] |
马波, 李明凯, 李洲朋, 等. 细菌群体感应信号分子与宿主免疫相互调节[J]. 生理科学进展, 2014, 45(1): 61-63. MA B, LI M K, LI Z P, et al. Bacterial quorum sensing signal molecules and host immune regulation[J]. Prog Physiol Sci, 2014, 45(1): 61-63. |
| [26] |
MOOKHERJEE A, SINGH S, MAITI M K. Quorum sensing inhibitors: can endophytes be prospective sources?[J]. Arch Microbiol, 2018, 200(2): 355-369. DOI:10.1007/s00203-017-1437-3 |
| [27] |
TRUCHADO P, LARROSA M, CASTRO-IBÁÑEZ I, et al. Plant food extracts and phytochemicals: their role as quorum sensing inhibitors[J]. Trends Food Sci Technol, 2015, 43(2): 189-204. DOI:10.1016/j.tifs.2015.02.009 |
| [28] |
SCARASCIA G, WANG T, HONG P Y. Quorum sensing and the use of quorum quenchers as natural biocides to inhibit sulfate-reducing bacteria[J]. Antibiotics (Basel), 2016, 5(4): E39. DOI:10.3390/antibiotics5040039 |
| [29] |
ROMERO M, MARTIN-CUADRADO A B, ROCA-RIVADA A, et al. Quorum quenching in cultivable bacteria from dense marine coastal microbial communities[J]. FEMS Microbiol Ecol, 2011, 75(2): 205-217. DOI:10.1111/fem.2010.75.issue-2 |
| [30] |
PARK S Y, HWANG B J, SHIN M H, et al. N-acylhomoserine lactonase producing Rhodococcus spp. with different AHL-degrading activities
[J]. FEMS Microbiol Lett, 2006, 261(1): 102-108. DOI:10.1111/fml.2006.261.issue-1 |
| [31] |
NITHYA C, ARAVINDRAJA C, PANDIAN S K. Bacillus pumilus of palk bay origin inhibits quorum-sensing-mediated virulence factors in Gram-negative bacteria
[J]. Res Microbiol, 2010, 161(4): 293-304. DOI:10.1016/j.resmic.2010.03.002 |
| [32] |
CHAN K G, ATKINSON S, MATHEE K, et al. Characterization of N-acylhomoserine lactone-degrading bacteria associated with the Zingiber officinale (ginger) rhizosphere: Co-existence of quorum quenching and quorum sensing in Acinetobacter and Burkholderia
[J]. BMC Microbiol, 2011, 11: 51. DOI:10.1186/1471-2180-11-51 |
| [33] |
DONG Y H, XU J L, LI X Z, et al. AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora
[J]. Proc Natl Acad Sci USA, 2000, 97(7): 3526-3531. DOI:10.1073/pnas.97.7.3526 |
| [34] |
DONG Y H, WANG L H, XU J L, et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase
[J]. Nature, 2001, 411(6839): 813-817. DOI:10.1038/35081101 |
| [35] |
SOH E Y C, CHHABRA S R, HALLIDAY N, et al. Biotic inactivation of the Pseudomonas aeruginosa quinolone signal molecule
[J]. Environ Microbiol, 2015, 17(11): 4352-4365. DOI:10.1111/1462-2920.12857 |
| [36] |
NEWMAN K L, CHATTERJEE S, HO K A, et al. Virulence of plant pathogenic bacteria attenuated by degradation of fatty acid cell-to-cell signaling factors[J]. Mol Plant-Micr Interact, 2008, 21(3): 326-334. DOI:10.1094/MPMI-21-3-0326 |
| [37] |
CAICEDO J C, VILLAMIZAR S, FERRO M I T, et al. Bacteria from the citrus phylloplane can disrupt cell-cell signalling in Xanthomonas citri and reduce citrus canker disease severity
[J]. Plant Pathol, 2016, 65(5): 782-791. DOI:10.1111/ppa.2016.65.issue-5 |
| [38] |
KANG J E, HAN J W, JEON B J, et al. Efficacies of quorum sensing inhibitors, piericidin A and glucopiericidin A, produced by Streptomyces xanthocidicus KPP01532 for the control of potato soft rot caused by Erwinia carotovora subsp. atroseptica
[J]. Microbiol Res, 2016, 184: 32-41. DOI:10.1016/j.micres.2015.12.005 |
| [39] |
ABED R M M, DOBRETSOV S, AL-FORI M, et al. Quorum-sensing inhibitory compounds from extremophilic microorganisms isolated from a hypersaline cyanobacterial mat[J]. J Ind Microbiol Biot, 2013, 40(7): 759-772. DOI:10.1007/s10295-013-1276-4 |
| [40] |
CHERNIN L, TOKLIKISHVILI N, OVADIS M, et al. Quorum-sensing quenching by rhizobacterial volatiles[J]. Env Microbiol Rep, 2011, 3(6): 698-704. DOI:10.1111/emi4.2011.3.issue-6 |
| [41] |
YANG F. Quorum quenching enzyme activity is widely conserved in the sera of mammalian species[J]. FEBS Lett, 2005, 579: 3713-3717. DOI:10.1016/j.febslet.2005.05.060 |
| [42] |
GEMIARTO A T, NINYIO N N, LEE S W, et al. Isoprenyl caffeate, a major compound in manuka propolis, is a quorum-sensing inhibitor in Chromobacterium violaceum
[J]. Anton Leeuw, 2015, 108(2): 491-504. DOI:10.1007/s10482-015-0503-6 |
| [43] |
CHRISTENSEN Q H, GROVE T L, BOOKER S J, et al. A high-throughput screen for quorum-sensing inhibitors that target acyl-homoserine lactone synthases[J]. Proc Natl Acad Sci U S A, 2013, 110(34): 13815-13820. DOI:10.1073/pnas.1313098110 |
| [44] |
YIN H P, DENG Y F, WANG H F, et al. Tea polyphenols as an antivirulence compound disrupt quorum-sensing regulated pathogenicity of Pseudomonas aeruginosa
[J]. Sci Rep, 2015, 5: 16158. DOI:10.1038/srep16158 |
| [45] |
ABRAHAM S V P I, PALANI A, RAMASWAMY B R, et al. Antiquorum sensing and antibiofilm potential of Capparis spinosa
[J]. Arch Med Res, 2011, 42(8): 658-668. DOI:10.1016/j.arcmed.2011.12.002 |
| [46] |
LOU Z, WANG H, TANG Y, et al. The effect of burdock leaf fraction on adhesion, biofilm formation, quorum sensing and virulence factors of Pseudomonas aeruginosa
[J]. J Appl Microbiol, 2017, 122(3): 615-624. DOI:10.1111/jam.2017.122.issue-3 |
| [47] |
CHENIA H Y. Anti-quorum sensing potential of crude Kigelia africana fruit extracts
[J]. Sensors (Basel), 2013, 13(3): 2802-2817. DOI:10.3390/s130302802 |
| [48] |
PACKIAVATHY I A S V, PRIYA S, PANDIAN S K, et al. Inhibition of biofilm development of uropathogens by curcumin-an anti-quorum sensing agent from Curcuma longa
[J]. Food Chem, 2014, 148(3): 453-460. |
| [49] |
ABD-ALLA M H, BASHANDY S R. Production of quorum sensing inhibitors in growing onion bulbs infected with Pseudomonas aeruginosa E (HQ324110)
[J]. ISRN Microbiol, 2012, 2012: 161890. |
| [50] |
TAPIA-RODRIGUEZ M R, HERNANDEZ-MENDOZA A, GONZALEZ-AGUILAR G A, et al. Carvacrol as potential quorum sensing inhibitor of Pseudomonas aeruginosa and biofilm production on stainless steel surfaces
[J]. Food Control, 2017, 75: 255-261. DOI:10.1016/j.foodcont.2016.12.014 |
| [51] |
KOH C L, SAM C K, YIN W F, et al. Plant-derived natural products as sources of anti-quorum sensing compounds[J]. Sensors, 2013, 13(5): 6217-6228. DOI:10.3390/s130506217 |
| [52] |
GIRENNAVAR B, CEPEDA M L, SONI K A, et al. Grapefruit juice and its furocoumarins inhibits autoinducer signaling and biofilm formation in bacteria[J]. Int J Food Microbiol, 2008, 125(2): 204-208. DOI:10.1016/j.ijfoodmicro.2008.03.028 |
| [53] |
VASAVI H S, SUDEEP H V, LINGARAJU H B, et al. Bioavailability-enhanced ResveramaxTM modulates quorum sensing and inhibits biofilm formation in Pseudomonas aeruginosa PAO1
[J]. Microb Pathog, 2017, 104: 64-71. DOI:10.1016/j.micpath.2017.01.015 |
| [54] |
VIKRAM A, JAYAPRAKASHA G K, JESUDHASAN P R, et al. Suppression of bacterial cell-cell signalling, biofilm formation and type III secretion system by citrus flavonoids[J]. J Appl Microbiol, 2010, 109(2): 515-527. |
| [55] |
MANEFIELD M, DE NYS R, NARESH K, et al. Evidence that halogenated furanones from Delisea pulchra inhibit acylated homoserine lactone (AHL)-mediated gene expression by displacing the AHL signal from its receptor protein
[J]. Microbiology, 1999, 145(2): 283-291. DOI:10.1099/13500872-145-2-283 |
| [56] |
TELLO E, CASTELLANOS L, AREVALO-FERRO C, et al. Absolute stereochemistry of antifouling cembranoid epimers at C-8 from the Caribbean octocoral Pseudoplexaura flagellosa. Revised structures of plexaurolones
[J]. Tetrahedron, 2011, 67(47): 9112-9121. DOI:10.1016/j.tet.2011.09.094 |
| [57] |
QUINTANA J, BRANGO-VANEGAS J, COSTA G M, et al. Marine organisms as source of extracts to disrupt bacterial communication: bioguided isolation and identification of quorum sensing inhibitors from Ircinia felix
[J]. Rev Brasil Farmacogn, 2015, 25(3): 199-207. DOI:10.1016/j.bjp.2015.03.013 |
| [58] |
JHA B, KAVITA K, WESTPHAL J, et al. Quorum sensing inhibition by Asparagopsis taxiformis, a marine macro alga: Separation of the compound that interrupts bacterial communication
[J]. Mar Drugs, 2013, 11(1): 253-265. |
| [59] |
DOBRETSOVY S, TEPLITSKI M, ALAGELY A, et al. Malyngolide from the cyanobacterium Lyngbya majuscula interferes with quorum sensing circuitry
[J]. Env Microbiol Rep, 2010, 2(6): 739-744. DOI:10.1111/emi4.2010.2.issue-6 |
| [60] |
KWAN J C, MEICKLE T, LADWA D, et al. Lyngbyoic acid, a " tagged” fatty acid from a marine cyanobacterium, disrupts quorum sensing in Pseudomonas aeruginosa
[J]. Mol Biosyst, 2011, 7(4): 1205-1216. DOI:10.1039/c0mb00180e |
| [61] |
RASMUSSEN T B, SKINDERSOE M E, BJARNSHOLT T, et al. Identity and effects of quorum-sensing inhibitors produced by Penicillium species
[J]. Microbiology, 2005, 151(5): 1325-1340. DOI:10.1099/mic.0.27715-0 |
| [62] |
SAURAV K, COSTANTINO V, VENTURI V, et al. Quorum sensing inhibitors from the sea discovered using bacterial N-acyl-homoserine lactone-based biosensors
[J]. Mar Drugs, 2017, 15(3): 53. DOI:10.3390/md15030053 |
| [63] |
ZHU H, WANG S X, ZHANG S S, et al. Inhibiting effect of bioactive metabolites produced by mushroom cultivation on bacterial quorum sensing-regulated behaviors[J]. Chemotherapy, 2011, 57(4): 292-297. DOI:10.1159/000329525 |
| [64] |
HENTZER M, WU H, ANDERSEN J B, et al. Attenuation of Pseudomonas aeruginosa virulence by quorum sensing inhibitors
[J]. Embo J, 2003, 22(15): 3803-3815. DOI:10.1093/emboj/cdg366 |
| [65] |
HE Z Y, WANG Q, HU Y J, et al. Use of the quorum sensing inhibitor furanone C-30 to interfere with biofilm formation by Streptococcus mutans and its luxS mutant strain
[J]. Int J Antimicrob Ag, 2012, 40(1): 30-35. DOI:10.1016/j.ijantimicag.2012.03.016 |
| [66] |
CASTILLO S, HEREDIA N, GARCÍA S. 2(5H)-Furanone, epigallocatechin gallate, and a citric-based disinfectant disturb quorum-sensing activity and reduce motility and biofilm formation of Campylobacter jejuni
[J]. Folia Microbiol, 2015, 60(1): 89-95. DOI:10.1007/s12223-014-0344-0 |
| [67] |
BRACKMAN G, RISSEEUW M, CELEN S, et al. Synthesis and evaluation of the quorum sensing inhibitory effect of substituted triazolyldihydrofuranones[J]. Bioorg Med Chem, 2012, 20(15): 4737-4743. DOI:10.1016/j.bmc.2012.06.009 |
| [68] |
GERDT J P, MCINNIS C E, SCHELL T L, et al. Unraveling the contributions of hydrogen-bonding interactions to the activity of native and non-native ligands in the quorum-sensing receptor LasR[J]. Org Biomol Chem, 2015, 13(5): 1453-1462. DOI:10.1039/C4OB02252A |
| [69] |
LASARRE B, FEDERLE M J. Exploiting quorum sensing to confuse bacterial pathogens[J]. Microbiol Mol Biol Rev, 2013, 77(1): 73-111. DOI:10.1128/MMBR.00046-12 |
| [70] |
ZHAO M M, YU Y Y, HUA Y H, et al. Design, synthesis and biological evaluation of N-sulfonyl homoserine lactone derivatives as inhibitors of quorum sensing in Chromobacterium violaceum
[J]. Molecules, 2013, 18(3): 3266-3327. DOI:10.3390/molecules18033266 |
| [71] |
SUN Q, ZHAO M M, LIANG J W, et al. Design, synthesis and activity evaluation study of novel substituted N-sulfonyl homoserine lactone derivatives as bacterial quorum sensing inhibitors
[J]. Med Chem Res, 2017, 26(12): 3345-3353. DOI:10.1007/s00044-017-2027-2 |
| [72] |
O'LOUGHLIN C T, MILLER L C, SIRYAPORN A, et al. A quorum-sensing inhibitor blocks Pseudomonas aeruginosa virulence and biofilm formation
[J]. Proc Natl Acad Sci USA, 2013, 110(44): 17981-17986. DOI:10.1073/pnas.1316981110 |
| [73] |
KALAIARASAN E, THIRUMALASWAMY K, HARISH B N, et al. Inhibition of quorum sensing-controlled biofilm formation in Pseudomonas aeruginosa by quorum-sensing inhibitors
[J]. Microb Pathog, 2017, 111: 99-107. DOI:10.1016/j.micpath.2017.08.017 |
| [74] |
MCINNIS C E, BLACKWELL H E. Thiolactone modulators of quorum sensing revealed through library design and screening[J]. Bioorg Med Chem, 2011, 19(16): 4820-4828. DOI:10.1016/j.bmc.2011.06.071 |
| [75] |
ALAGARASAN G, ASWATHY K S, MADHAIYAN M. Shoot the message, not the messenger-combating pathogenic virulence in plants by inhibiting quorum sensing mediated signaling molecules[J]. Front Plant Sci, 2017, 8: 556. DOI:10.3389/fpls.2017.00556 |
| [76] |
BRACKMAN G, AL QUNTAR A A A, ENK C D, et al. Synthesis and evaluation of thiazolidinedione and dioxazaborocane analogues as inhibitors of AI-2 quorum sensing in Vibrio harveyi
[J]. Bioorg Med Chem, 2013, 21(3): 660-667. DOI:10.1016/j.bmc.2012.11.055 |
| [77] |
CHUNG J, GOO E, YU S, et al. Small-molecule inhibitor binding to an N-acyl-homoserine lactone synthase
[J]. Proc Natl Acad Sci USA, 2011, 108(29): 12089-12094. DOI:10.1073/pnas.1103165108 |
| [78] |
JI C, SHARMA I, PRATIHAR D, et al. Designed small-molecule inhibitors of the anthranilyl-CoA synthetase PqsA block quinolone biosynthesis in Pseudomonas aeruginosa
[J]. ACS Chem Biol, 2016, 11(11): 3061-3067. DOI:10.1021/acschembio.6b00575 |
| [79] |
FORSCHNER-DANCAUSE S, POULIN E, MESCHWITZ S. Quorum sensing inhibition and structure-activity relationships of β-keto esters
[J]. Molecules, 2016, 21(8): 971. DOI:10.3390/molecules21080971 |
| [80] |
SULLY E K, MALACHOWA N, ELMORE B O, et al. Selective chemical inhibition of agr quorum sensing in Staphylococcus aureus promotes host defense with minimal impact on resistance
[J]. PLoS Pathog, 2014, 10(6): e1004174. DOI:10.1371/journal.ppat.1004174 |
| [81] |
SINGH S, WANJARI P J, BHATIA S, et al. Design, synthesis, biological evaluation and toxicity studies of N, N-disubstituted biguanides as quorum sensing inhibitors
[J]. Med Chem Res, 2015, 24(5): 1974-1987. DOI:10.1007/s00044-014-1255-y |
| [82] |
TUNG T T, JAKOBSEN T H, DAO T T, et al. Fusaric acid and analogues as Gram-negative bacterial quorum sensing inhibitors[J]. Eur J Med Chem, 2017, 126: 1011-1020. DOI:10.1016/j.ejmech.2016.11.044 |
| [83] |
LEE K, LEE S, LEE S H, et al. Fungal quorum quenching: a paradigm shift for energy savings in membrane bioreactor (MBR) for wastewater treatment[J]. Environ Sci Technol, 2016, 50(20): 10914-10922. DOI:10.1021/acs.est.6b00313 |
| [84] |
邱健, 贾振华, 李承光. 细菌群体感应淬灭酶的研究进展[J]. 微生物学通报, 2006, 33(4): 139-143. QIU J, JIA Z H, LI C G. Advance on bacterial quorum-quenching enzymes[J]. Microbiol China, 2006, 33(4): 139-143. |
| [85] |
MEI G Y, YAN X X, TURAK A, et al. AidH, an Alpha/Beta-hydrolase fold family member from an Ochrobactrum sp. strain, is a novel N-acylhomoserine lactonase
[J]. Appl Environ Microbiol, 2010, 76(15): 4933-4942. DOI:10.1128/AEM.00477-10 |
| [86] |
PAUL D, GOPAL J, KUMAR M, et al. Nature to the natural rescue: silencing microbial chats[J]. Chem-Biol Interact, 2018, 280: 86-98. DOI:10.1016/j.cbi.2017.12.018 |
| [87] |
张力群, 田涛, 梅桂英. 群体感应淬灭防治植物细菌病害的新策略[J]. 中国生物防治, 2010, 26(3): 241-247. ZHANG L Q, TIAN T, MEI G Y. Quorum quenching, a new strategy for controlling plant bacterial diseases[J]. Chin J Biol Control, 2010, 26(3): 241-247. |
 2018, Vol. 20
2018, Vol. 20