2. 农药国家工程研究中心 (天津),天津 300071
2. National Pesticide Engineering Research Center (Tianjin), Tianjin 300071, China
基于新的作用靶标进行全新分子设计和基于新的先导化合物进行结构优化是新农药创制的两条基本途径,也是中国新农药创制面临的最大困难和瓶颈。对药物作用靶标的搜寻及验证已成为新药开发中的热点[1-2]。随着生物技术的发展及其与计算机技术的交叉渗透,新农药的创制开发发生了根本性的变化。基于受体的合理药物设计在医药领域发展迅速,但在农用杀菌剂领域由于可供筛选的新靶蛋白 (受体) 数量有限,且农药创制不仅要考虑靶标生物本身,还要考虑其对环境生物及人类的影响,故农药创制链条与医药相比严重滞后。根据天然产物或新型高活性化合物挖掘新靶标是新农药创制的重要途径。天然活性物质容易降解及环境相容性好,且大多数具有全新的作用方式,但其化学结构复杂,合成难度大,通常不能直接作为农药使用,但解析这些天然产物的作用机制将提供新的作用靶标,不仅为新型多靶向农药开发奠定基础,而且可以有效解决抗药性问题。目前关于农用化学品作用机制的研究方法鲜有综述,本文将从新型杀菌化合物的靶标识别方法、分子靶标验证方法及靶向杀菌剂分子设计方面进行概述,旨在为农用化学品的可持续发展提供思路。
1 新型杀菌化合物靶标识别方法靶标蛋白的分离和结构鉴定是农药毒理学研究领域的重要内容之一,也是靶向药物分子设计的研究基础。一些靶向药物通常会通过影响靶标的细胞结构 (如抑制细胞壁生物合成和细胞骨架形成等) 来抑制有害物生长;过去其作用方式大多数情况下可通过遗传方法的研究获得,但是这些方法试验周期较长、试验过程繁琐,研究结果准确性不高,存在假阳性的可能。随着分子生物学技术及计算机科技的迅速发展,基因组学、转录组学、蛋白质组学[3-5]和代谢组学[6]等技术被广泛应用;利用组学研究策略来研究天然产物的作用机制,最简单的方法就是分析基因表达水平和蛋白质翻译水平在处理前后的变化,利用这些变化的基因来寻找药剂分子的作用靶标,尽管药剂在植物体内发挥作用的过程极其复杂,且寻找其作用靶标有一定难度,但是利用组学技术验证已知作用靶标的药物已经取得成功[7-9];此外,亲和层析技术[10]和蛋白质微阵列[11]也在药物作用机制研究中具有重要作用。广泛用于药物靶标识别技术的还有脉冲蛋白水解 (pulse proteolysis)[12-13]、氧化速率蛋白稳定性 (stability of proteins from rates of oxidation, SPROX)[14-15]和细胞热转变分析 (cellular thermal shift assay, CETSA)[16-17]等技术。下面将分别就转录组学、蛋白质组学和亲和层析等技术在靶标识别中的研究进展进行综述。
1.1 基于转录组学的研究转录组学是从RNA水平上研究基因的表达。获取转录组数据信息的方法主要是基于杂交技术的cDNA芯片和寡聚核苷酸芯片技术以及基于序列分析的基因测序技术分析 (serial analysis of gene expression, SAGE) 和大规模平行测序系统 (massively parallel signature sequencing, MPSS)。利用转录组研究确定药剂分子的作用机制及作用位点,大都需要结合其他生物学技术才能实现[18-20]。当药剂在体内抑制某一种生化途径中的关键酶或是其受体后,编码该酶或受体的基因及这一生化途径中的基因均会发生相应的变化,利用cDNA芯片或转录组测序技术即可得到这些变化的基因。Liu等[21]从生防菌柠檬形克勒克酵母Kloeckera apiculata中提取得到对意大利青霉Penicillium italicum有较好防治效果的2-苯乙醇。通过对用2-苯乙醇处理的青霉菌进行表达调控研究,发现其可调控细胞自噬、磷脂酰肌醇信号系统、脂肪酸代谢,抑制核糖体RNA聚合酶、DNA复制、氨基酸的生物合成以及氨基酰-tRNA合成,并可使细胞周期的表达上调,但却抑制了苯丙氨酰-tRNA合成酶的表达[21]。万寿菊Tagetes erecta L.提取物2,4-二环烯戊烷环戊酮可有效控制由尖孢镰孢菌Fusarium oxysporium引起的枯萎病,Du等[22]利用RNA-Seq测序技术,分析了用2,4-二环烯戊烷环戊酮处理前后的差异表达基因7 817个,并通过显微结构观察确认其处理后真菌的细胞膜和细胞壁发生了变化,最终确定其主要抑制甾醇的生物合成途径。Cools等[23]通过cDNA芯片对唑类杀菌剂的抗性菌株进行表达分析,发现了麦角甾醇生物合成、线粒体呼吸和运输机制中的差异表达基因。
1.2 基于蛋白质组学的研究蛋白质组 (proteome) 一词最先由澳大利亚生物学家Marc Wilkins提出,是指由一个完整的基因组 (genome),或是一个完整的细胞或组织所表达的全部蛋白质[24]。蛋白质组具有时空特异性,它可因组织和环境状态的不同而改变,在基因转录时,一个基因可以通过不同方式的剪接及翻译后修饰产生不同蛋白质,所以蛋白质组不同于基因组,不是一个基因组的直接产物。蛋白质组学 (proteomics) 是一门研究生物体蛋白质组的学科,主要研究基因调节水平及基因表达后的蛋白质水平,主要依靠蛋白质微阵列、双向电泳技术和近几年兴起的iTRAQ技术来分析[25-26]。丁吡吗啉是一种来自羧酸酰胺家族的新型杀真菌剂,用于防治植物致病性卵菌如辣椒疫霉Phytophthora capsici[27],Pang等[28]利用iTRAQ技术研究了疫霉对丁吡吗啉的蛋白质组学反应,以确定杀菌剂的靶标位点,他们比较了野生型和抗药性菌株 (R3-1和R3-2) 的差异表达蛋白1 336个,确定了差异蛋白主要参与能量代谢和葡萄糖代谢,使用D-[U-14C]标记葡萄糖进行的生物化学分析,证实了蛋白质组学数据分析结果,在辣椒疫霉中丁吡吗啉的主要作用模式是抑制细胞壁的生物合成。2-氰基-3-氨基-3-苯基丙烯酸乙酯是一种新型的氰基丙烯酸酯类杀菌剂,对镰孢菌特别是禾谷镰孢菌具有很强的抑制作用[29],其可使禾谷镰孢菌菌丝体变形膨胀,分支增加,通过2-DE蛋白质组学分析发现,至少38种蛋白的表达水平发生了2倍以上变化,通过功能分析发现这些蛋白主要参与DNA的合成和转运[30]。
蛋白质微阵列也是分析小分子与蛋白质相互作用的蛋白质组学药物靶标识别方法,该方法是将抗体或蛋白质固定在微阵列中,并将小分子进行生物素、荧光标签或放射性同位素标记,使其结合到蛋白质微阵列中,通过检测蛋白质微阵列中样品的消耗量确定靶蛋白[11]。Koster等[31]通过利用微阵列结合质谱测序技术鉴定了磺胺类药物的预期靶蛋白。
1.3 基于亲和层析技术的研究分离靶蛋白最直接的方法是用分子荧光探针或同位素示踪标记药物分子,再采用凝胶层析、离子交换层析以及电泳等技术分离得到标记蛋白,也可以利用药物-受体的特异性结合特性,采用亲和层析技术选择性地分离靶蛋白。在药物毒理研究中,与小分子化合物相结合的许多蛋白都是利用亲和原理的方法直接分离得到,例如通过亲和层析法发现了环孢菌素A的结合蛋白为亲环蛋白[32]、他克莫司的结合蛋白为FKBP12[33]、二氢沉香呋喃倍半萜多酯的结合蛋白为V-ATP酶H亚基等[34]。但此类方法通常需要对小分子化合物进行化学修饰,如添加荧光素或生物素等标签,使小分子能够通过荧光进行检测或被稳定地固定在固相载体表面,而修饰后的小分子化合物的活性往往会发生改变。
依赖于靶点稳定性的药物亲和反应 (drug affinity responsive target stability,DARTS) 的药物靶标辨识技术于2009年被首次提出[35](图1),该方法的优点在于无需对小分子化合物进行修饰。小分子配体与蛋白结合后会形成一个构象稳定的蛋白,使其不容易被蛋白酶水解。该技术正是利用这一特性,通过观察小分子化合物处理前后的蛋白水解情况,寻找到小分子的结合蛋白。目前该技术主要用于医药靶标识别,在农药中研究较少。Chin等[36]利用该技术证明了α-酮戊二酸的直接作用靶标为ATP合成酶;Derry等[37]利用该技术证明了天然产物葡萄籽提取物 (grape seed extract, GSE) 的分子靶点为内质网应激蛋白;Park等[38]证明硫双二氯酚的药物结合蛋白为NAD依赖性脱氢酶;Kim等[39]利用该技术获得了他克莫司 (Tacrolimus, FK506) 的新靶标蛋白V-ATP合成酶催化亚基ATP6V1A;Cai等[40]获得了白桦脂酸的作用靶点为葡萄糖调节蛋白78 (glucose-regulated protein 78, GRP78);Lazarev等[41]证明了秋水仙素N-氨基乙胺衍生物AEAC的作用靶点为热激蛋白70 (heat shock protein 70, Hsp70)。

|
A. 亲和层析分离靶蛋白;B. DARTS试验分离靶蛋白;C. DARTS试验原理及流程 A. Affinity chromatography; B. DARTS; C. Flow of DARTS 图 1 DARTS试验原理及其与亲和层析比较[35] Fig. 1 Comparison with affinity chromatography and DARTS[35] |
在未知药物靶标筛选方面单一的试验技术往往会使假阳性概率提高,而结合通过多种试验手段可以大幅提高准确率;通过亲和层析技术筛选与药物直接结合的靶蛋白,随后通过组学技术进一步筛选,最后结合反向遗传学等手段来完成。
2 分子靶标验证方法组学和亲和层析等新技术手段已经在天然产物药物的作用机制研究中得到了广泛应用,可通过组学技术寻找产生药物作用差异的基因,通过质谱技术寻找经药物处理前后的差异表达蛋白,通过亲和层析技术获得与天然产物结合的靶蛋白。但这些技术只能初步得到候选基因/蛋白,为了得到其作用的靶位点,还需利用生物信息学、结构生物学和化学生物学等技术手段加以确认,确定天然产物与分子靶标的相互作用及结合模式,其中所涉及的试验技术主要包括分子对接法、荧光光谱法、等温滴定量热法、微量热泳动技术、生物分子相互作用分析 (biomolecular interaction analysis,BIA) 技术、蛋白共结晶技术、傅里叶变换红外光谱、毛细管电泳法、圆二色谱法和基因编辑等技术。
2.1 分子对接法分子对接法 (molecular docking) 在药物靶标验证中发挥了重要作用,为先导化合物的发现和优化提供了有效的工具。以结构生物学为基础,对小分子药物的重要候选蛋白质的结构进行分析得到蛋白质靶标的三维结构,从而进行药物与靶标蛋白相互作用的动力学模拟研究,并确定小分子与蛋白质靶标的相互作用,确认小分子在生物体内的作用靶点。Ding等[42]利用计算机模拟技术确定了三唑环N1原子可提供电子与细胞色素P450(cytochrome P450, CYP450) 卟啉环活性中心的亚铁原子形成配位键,而苯环和烷基取代基可与CYP450芳香受体部分发生疏水叠合,从而阻碍CYP450的正常生理功能。Du等[43]确定酰氨基团羰基上的氧原子与SDH活性口袋中的TRP173的羟基和TYR58的羟基形成了氢键,从而影响蛋白的功能。Arnoldi等[44]合成了一系列具有抑菌作用的2-二氯苯基-3-三唑基丙基醚衍生物,QSAR研究表明,这些化合物抑制了14α-脱甲基酶活性。Yang小组利用分子对接并结合自由能计算 (分子动力学模拟和分子力学Poisson−Boltzmann表面积计算),确定了辛唑嘧菌胺作用于bc1复合物的Qo位点[45]。
2.2 荧光光谱技术荧光猝灭 (fluorescence quenching) 是指荧光分子与溶剂分子之间发生猝灭,多用于研究生物大分子与小分子药物或金属离子之间的相互作用。由于含有芳香族氨基酸 (如色氨酸、酪氨酸和苯丙氨酸) 残基的蛋白质在波长280 nm或295 nm紫外光的激发下会产生荧光,通常情况可利用蛋白质体内的内源荧光为探针,借助荧光猝灭法可测得药物分子与蛋白质的结合常数,且可与紫外-可见吸收光谱法及圆二色谱法一起使用,从而验证其相互作用。黄英等[46]、李悦等[47]及Liu[48]等利用荧光光谱法及分子对接模拟技术分别研究了香豆素衍生物和杨梅素与牛血清白蛋白及没食子酸与人血清白蛋白的相互作用,证实了光谱法在研究小分子化合物与蛋白结合过程中的可操作性。丙环唑是一种N-取代的三唑类杀菌剂,其可能对水生生态系统和人类健康产生不利影响,为了评价丙环唑在蛋白质水平的毒性,Wang等[49]采用分子模拟和光谱方法对丙环唑对人血清白蛋白的影响进行了表征,发现丙环唑对人血清白蛋白存在荧光猝灭现象。Lou等[50]通过对啶酰菌胺与牛血清白蛋白进行荧光分析,确定了啶酰菌胺可与牛血清白形成复合物而使其猝灭。
2.3 等温滴定量热法等温滴定量热法 (isothermal titration calorimetry, ITC) 是一种直接测量生物分子在结合过程中释放或吸收热量的热力学技术[51]。ITC可以连续准确地检测每个滴定过程中的焓熵变化,且不影响蛋白质本身的性质和功能。ITC不仅可测定结合亲和力,还能阐明潜在的分子相互作用机制。Schneider等利用激光共聚焦显微镜观察了抗菌肽CATH-2对金黄色葡萄球菌细胞壁及膜透性的变化,并用ITC技术证明CATH-2直接与脂磷壁酸和心磷脂相互作用[52];抗菌肽Fengycins对丝状真菌有强烈的抑制作用,Eeman等通过ITC研究了Fengycins与脂质囊泡蛋白分子的相互作用,结果表明,Fengycins可诱导脂质结构的放热变化,使较少排序的脂质结构域变得更有序[53]。
2.4 微量热泳动技术微量热泳动技术 (microscale thermophoresis, MST) 是Wienken等于2010年首次利用物理学原理研究蛋白质及小分子在生物溶液中的相互作用时所采用的技术,此项技术的兴起是研究生物分子间互作领域的一场革命[54]。MST可以通过测量分子在温度梯度场中运动的变化来检测水化层、电荷或者大小,它能检测到蛋白质自身所含芳香类氨基酸发出的内源荧光,比荧光光谱技术具有更广的应用领域。
2.5 BIA技术BIA是一种基于表面等离子共振的新型生物传感分析技术,自1990年正式出现后,由于样品无需标记并且可实现自动化,因而有关利用该技术的研究发展迅速[55];其应用也从最初的检测抗原-抗体相互作用机制扩展到研究小分子与蛋白质相互作用、核酸与蛋白质相互作用以及蛋白质与蛋白质的相互作用等方面。Matyskiela等[56]利用BIA技术研究了一种新的免疫调控药物CC-885的作用机制,发现已上市的免疫调控药物如雷利度胺 (lenalidomide) 和沙利度胺 (thalidomide) 等是通过E3泛素连接酶的基质受体部分CRBN而发挥定向作用,而CC-885则是以一个新的基质GSPT1为目标发挥作用。
模拟药物作用细胞的信号传导通路和培养复合物晶体来确定药物与靶标蛋白的结合位点等技术可为建立候选药物与分子靶标间相互作用的化学生物学模型、研究候选药物与靶标分子间相互作用模式、明确候选药物的作用机理以及指导高效药物的创制提供帮助。
3 依赖靶标及先导的新型杀菌剂开发设计杀菌剂的靶标及先导结构很多,从靶标出发设计和依赖先导结构设计是新型杀菌剂开发的重要途径,以下列举几种常见杀菌剂的开发途径。
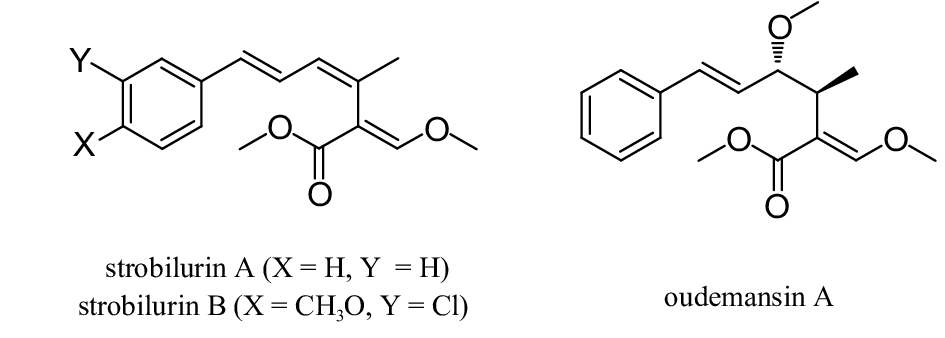
3.1 以strobilurin A为先导设计细胞色素复合物III的Qo位点抑制剂Strobilurins类杀菌剂的先导结构来源于天然源strobilurin A, B以及oudemansin A共有的结构—β-甲氧基丙烯酸酯 (图式 1)[57-58]。以strobilurin A为先导化合物进行修饰衍生,已先后有多个品种实现了商品化,如嘧菌酯、醚菌酯、氟嘧菌酯、醚菌胺、苯氧菌胺、肟菌酯、肟醚菌胺、唑菌胺酯、啶氧菌酯、苯醚菌酯、丁香菌酯、苯噻菌酯和烯肟菌胺等。从Strobilurins类杀菌剂的发展可知,以先导结构衍生为中心,与同源模建靶标蛋白进行分子对接,使分子与蛋白之间尽可能相互作用,通过对分子结构进一步微调,可提高分子结构优化的效率[59-61]。
|
图式1 Strobilurin A、B和oudemansin A结构式[57-58] Scheme1 The structural formula of strobilurin A, B and oudemansin A[57-58] |
Strobilurins类杀菌剂具有广谱、高效、低毒的特点,其对4大类植物病原真菌,即子囊菌、担子菌、半知菌和卵菌纲均有不同程度的抑制活性[62]。研究表明,其作用于真菌线粒体中细胞色素bc1中心的Qo位点,从而阻碍电子传递 (图2)[63]。目前,有关Strobilurins类杀菌剂与真菌线粒体细胞色素bc1中心Qo位点的具体结合模式及结合位点尚未见报道。2002年,Gisi等通过已报道的线粒体细胞色素bc1复合物的晶体结构、以及动物 (小牛、鸡和兔) 组织线粒体细胞色素bc1与不同的Strobilurins类杀菌剂的结合方式,以嘧菌酯为例,经同源模建推测了Strobilurins杀菌剂与真菌细胞色素bc1复合物可能的结合模式[64],为后续的Strobilurins类分子设计提供了指导。
3.2 以肉桂酸为先导的卵菌类抑制剂
丙烯酰胺吗啉类杀菌剂的先导结构起源于1984年Curtze等首次报道的二芳基丙烯酰吗啉类结构[65],并以此发现了烯酰吗啉 (图式 2),而同类杀菌剂氟吗啉和丁吡吗啉 (图式 2) 的发现,则是以烯酰吗啉为先导,分别利用氟原子和吡啶环的特性,采用Me-too或广义的中间体衍生法设计合成[66];它们对卵菌病害防治具有很好的保护和治疗效果。这3者虽结构相似,但作用机制不同:烯酰吗啉可能是干扰了卵菌细胞壁的合成或组装;氟吗啉并不影响细胞壁的合成,但影响了细胞的极性生长,干扰了细胞壁在菌体内的正常分布[67];丁吡吗啉则是主要抑制辣椒疫霉细胞中纤维素的生物合成和能量代谢[68]。
3.3 以萎锈灵为先导的琥珀酸脱氢酶抑制剂
琥珀酸脱氢酶抑制剂 (SDHIs) 作为近几年杀菌剂中的黑马,早期的品种有萎锈灵(图式 3)、灭锈胺和氟酰胺等,但因杀菌谱窄,其应用受到了限制。直至2003年成功商品化的啶酰菌胺(图式 3)展示出相对广谱的、系统的杀菌活性,其对链格孢属、葡萄孢菌属和核盘菌属等引起的病害具有保护和治疗效果,且与其他杀菌剂无交互抗性。此后,SDHI类杀菌剂再次成为研究的热点[69-70]。
近10年来,SDHI类杀菌剂得到了快速发展,目前商品化的品种有10个吡唑类和1个噻吩类衍生物 (表1)[69-70]。以吡唑酰胺SDHI类杀菌剂为先导的衍生化研究相对较多,Yang小组分别设计合成了以二苯醚结构、吲哚和苯并噁唑为取代基的吡唑酰胺类衍生物,并发现高活性化合物可作为琥珀酸泛醌氧化还原酶抑制剂 (SQRIs) 的候选化合物[71-72]。
|
|
表 1 吡唑类及噻吩类琥珀酸脱氢酶抑制剂[69-70] Table 1 Pyrazoles and thiophenes used as succinate dehydrogenase inhibitors[69-70] |
SDHI类杀菌剂属于线粒体呼吸抑制剂,其作用靶标位点是线粒体呼吸链中的复合物II,即琥珀酸脱氢酶或琥珀酸泛醌还原酶。线粒体呼吸链由I、II、III和IV 4个酶复合物组成,其中复合物I~III之间存在三羧酸循环,而琥珀酸脱氢酶是三羧酸循环的功能单元,与线粒体电子传递相连。SDHI类杀菌剂通过干扰病原菌线粒体呼吸系统上复合体II的电子传递,从而抑制线粒体的功能,阻止其能量产生,抑制病原菌生长[73]。
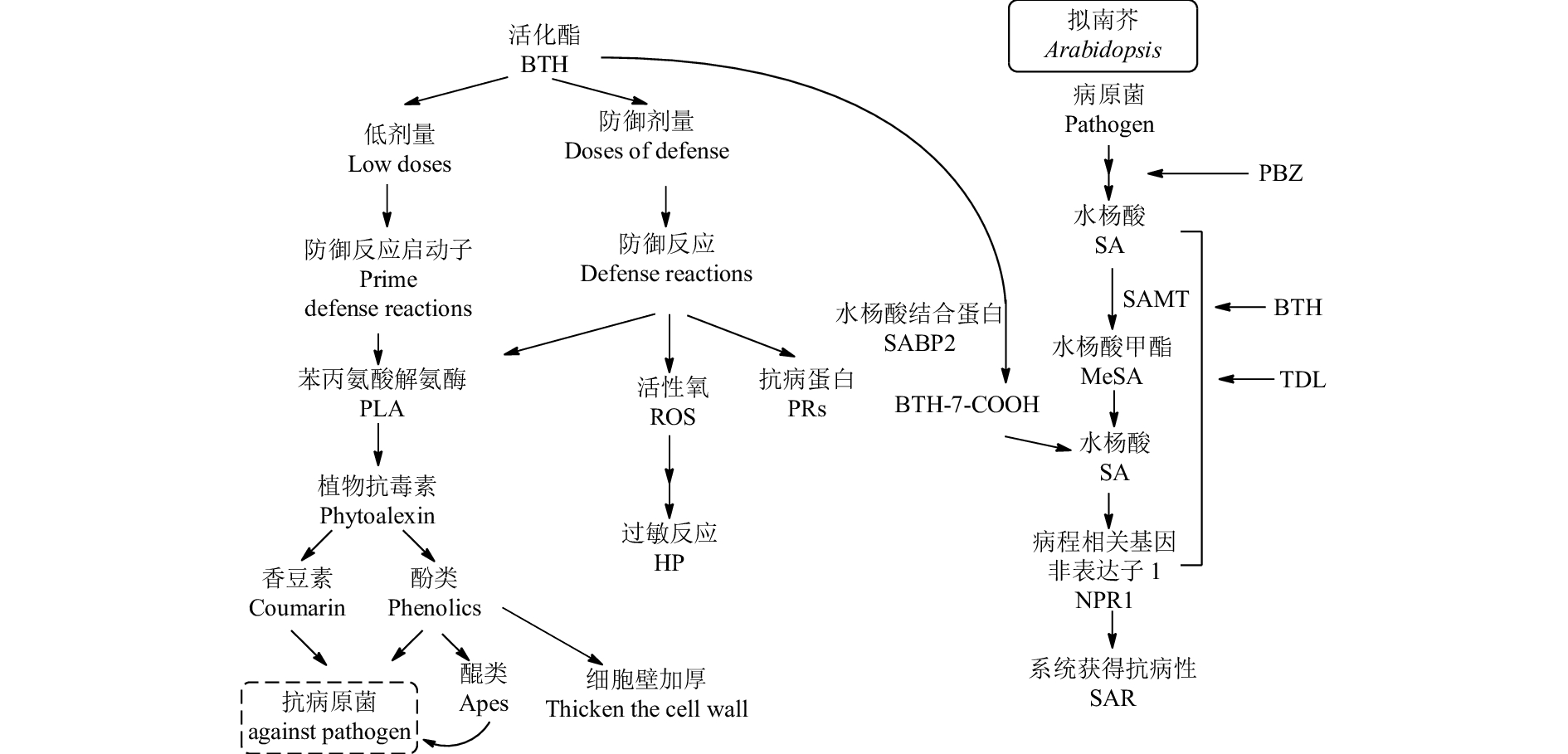
3.4 以含N, S杂环结构为先导的植物免疫激活剂植物激活剂是化合物在离体条件下无杀菌活性或仅有微弱的抑菌作用,但其可激活植物自身的免疫系统,使植物产生持久的系统获得抗病性 (systemic acquired resistance),以此来应对外界病原菌的侵害[74]。该类药剂对病原菌无直接作用,不产生选择压,无抗药性风险,因而也是一种真正的“绿色农药”。目前,含有N, S杂环的植物激活剂的代表性品种有烯丙异噻唑 (PBZ)、活化酯 (BTH)、噻酰菌胺 (TDL) 和异噻菌胺 (isotianil) 等 (图式 4);而以上述分子中杂环酸部分为先导结构又开发了一些新产品:如以PBZ和异噻菌胺为先导开发出了dichlobentiazox;以BTH为先导开发了氟唑活化酯 (B2-a) [76];以TDL为先导开发了甲噻诱胺 (SZG-7) [77]等。
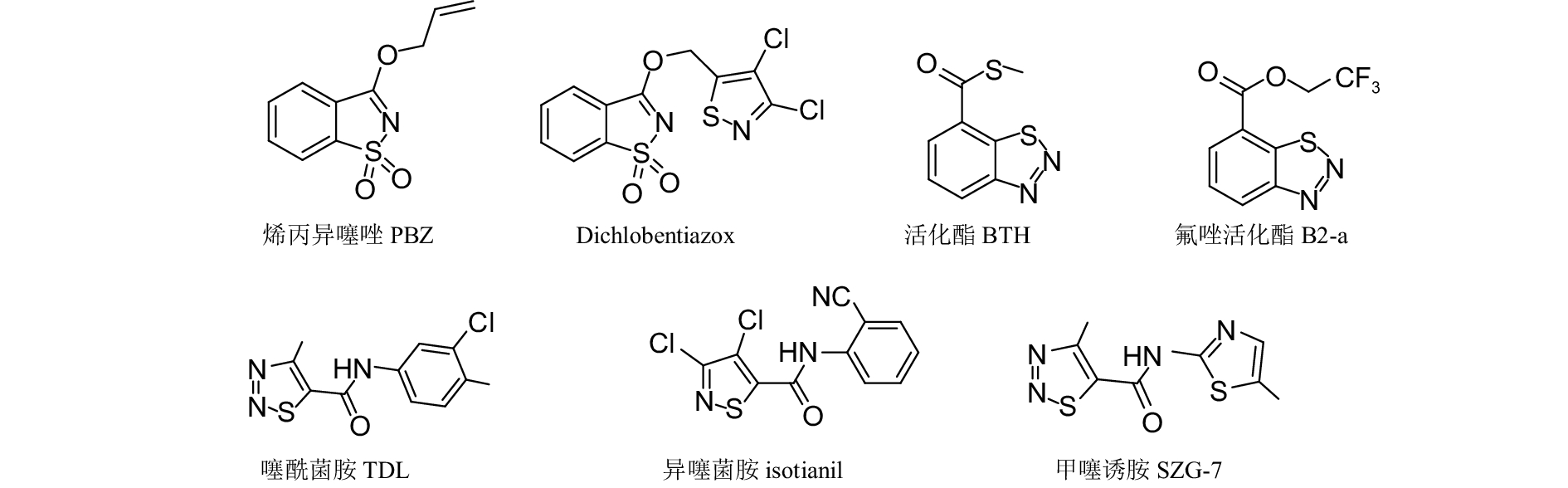
|
图式4 含N、S杂环合成类植物激活剂 Scheme4 Synthetic plant elicitors with N, S heterocyclic moities |
植物免疫激活剂的作用机制复杂,包含多种抗病机制和多个非单一的信号途径,如水杨酸 (SA)、茉莉酸 (JA)、乙烯 (ET) 和一氧化氮 (NO) 信号途径等[75],且不同结构分子的作用机制不同。以水杨酸途径为例,如图3所示,烯丙异噻唑 (PBZ) 诱导植物的抗病机制是依赖于SA的累积,而活化酯 (BTH)[78]、噻酰菌胺 (TDL)[79]的诱导作用则并不是依赖于SA的累积,而是依赖病程相关蛋白 (NPR1)。Tripathi等通过化学蛋白质组学和HPLC技术确定用BTH处理拟南芥后,BTH并非直接诱导植物产生SAR作用,而是在水杨酸结合蛋白SABP2催化下生成了代谢产物BTH-7-甲酸,继而在后期起到诱导SAR作用[80]。
3.5 其他新先导的杀菌剂及其作用机制
肌球蛋白是周明国团队以氰烯菌酯 (phenamacril)(图式 5) 为先导发现的重要靶标,其作用靶标为肌球蛋白I型肌球蛋白-5[29]。氰烯菌酯是一种氰基丙烯酸酯类化合物,与现有的杀菌剂无交互抗性,主要对尖孢镰孢菌F. oxysporium和禾谷镰孢菌Fusarium graminearum显示较高活性。其抗性风险研究发现,若肌球蛋白的216、217、418和420位点发生突变,会导致抗药性产生。真菌复合体III的Qi泛醌是陶氏益农发现的一个新的靶标位点,它与现有杀菌剂的作用位点不同。由其开发的fenpicoxamid (图式 5) 能有效防治谷物如叶枯病和锈病等病害,并且与现有杀菌剂无交互抗性。
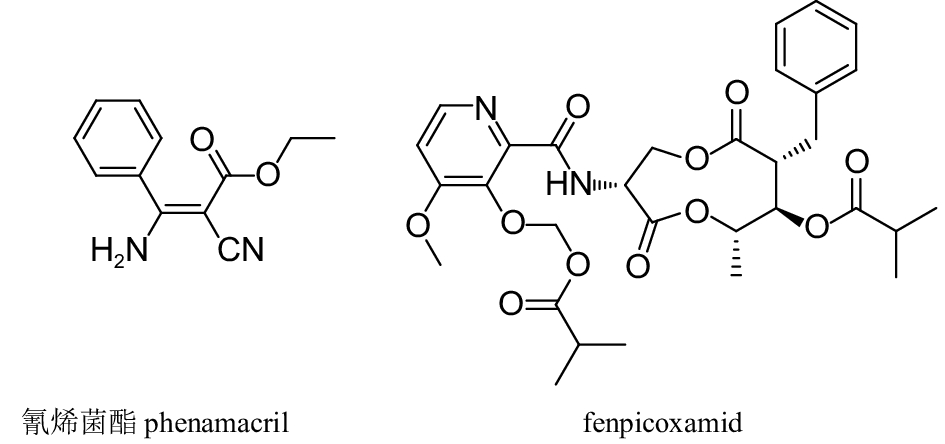
|
图式5 氰烯菌酯和fenpicoxamid的结构 Scheme5 Structural formula of phenamacril and fenpicoxamid |
4 小结与展望
结构新颖的杀菌活性分子可能具有全新的杀菌作用机制,对其进行深入研究,不仅可解析杀菌活性分子的抑菌机理,同时可能发现新的作用靶标。新靶标的挖掘比新先导的发现更具理论意义和实际应用价值,利用新靶标可能筛选出更多的先导分子,为先导化合物的优化和候选杀菌活性化合物的开发提供结构来源,从而为解决杀菌剂抗药性问题以及多靶向农药研究开发奠定基础。
| [1] |
LU P Y, HONTECILLAS R, PHILIPSON C W, et al. Lanthionine synthetase component c-like protein 2: a new drug target for inflammatory diseases and diabetes[J]. Current Drug Targets, 2014, 15(6): 565-572. DOI:10.2174/1389450115666140313123714 |
| [2] |
MORRIS G, ANDERSON G, DEAN O, et al. The glutathione system: a new drug target in neuroimmune disorders[J]. Mol Neurobiol, 2014, 50(3): 1059-1084. DOI:10.1007/s12035-014-8705-x |
| [3] |
HODGINS K A, BOCK D G, HAHN M A, et al. Comparative genomics in the asteraceae reveals little evidence for parallel evolutionary change in invasive taxa[J]. Mol Ecol, 2015, 24(9): 2226-2240. DOI:10.1111/mec.2015.24.issue-9 |
| [4] |
CHRISTIAN M, HANNAH W B, LÜTHEN H, et al. Identification of auxins by a chemical genomics approach[J]. J Exp Bot, 2008, 59(10): 2757-2767. DOI:10.1093/jxb/ern133 |
| [5] |
TISSIER A F, MARILLONNET S, KLIMYUK V, et al. Multiple independent defective suppressor-mutator transposon insertions in Arabidopsis: a tool for functional genomics
[J]. Plant Cell, 1999, 11(10): 1841-1852. DOI:10.1105/tpc.11.10.1841 |
| [6] |
OTT K H, ARANÍBAR N, SINGH B, et al. Metabonomics classifies pathways affected by bioactive compounds. Artificial neural network classification of NMR spectra of plant extracts[J]. Phytochemistry, 2003, 62(6): 971-985. DOI:10.1016/S0031-9422(02)00717-3 |
| [7] |
HUTTER B, SCHAAB C, ALBRECHT S, et al. Prediction of mechanisms of action of antibacterial compounds by gene expression profiling[J]. Antimicrob Agents Chemother, 2004, 48(8): 2838-2844. DOI:10.1128/AAC.48.8.2838-2844.2004 |
| [8] |
PAN Y M, CHENG T J, WANG Y L, et al. Pathway analysis for drug repositioning based on public database mining[J]. J Chem Inf Mod, 2014, 54(2): 407-418. |
| [9] |
WRIDE D A, POURMAND N, BRAY W M, et al. Confirmation of the cellular targets of benomyl and rapamycin using next-generation sequencing of resistant mutants in S. cerevisiae
[J]. Mol Biosyst, 2014, 10(12): 3179-3187. DOI:10.1039/C4MB00146J |
| [10] |
DAL PIAZ F, VASSALLO A, LEPORE L, et al. Sesterterpenes as tubulin tyrosine ligase inhibitors. First insight of structure-activity relationships and discovery of new lead[J]. J Med Chem, 2009, 52(12): 3814-3828. DOI:10.1021/jm801637f |
| [11] |
HUANG J, ZHU H, HAGGARTY S J, et al. Finding new components of the target of rapamycin (TOR) signaling network through chemical genetics and proteome chips[J]. Proc Natl Acad Sci USA, 2004, 101(47): 16594-16599. DOI:10.1073/pnas.0407117101 |
| [12] |
LIU P F, KIHARA D, PARK C. Energetics-based discovery of protein-ligand interactions on a proteomic scale[J]. J Mol Biol, 2011, 408(1): 147-162. DOI:10.1016/j.jmb.2011.02.026 |
| [13] |
CHANG Y, SCHLEBACH J P, VERHEUL R A, et al. Simplified proteomics approach to discover protein-ligand interactions[J]. Protein Sci, 2012, 21(9): 1280-1287. DOI:10.1002/pro.2112 |
| [14] |
DEARMOND P D, XU Y, STRICKLAND E C, et al. Thermodynamic analysis of protein-ligand interactions in complex biological mixtures using a shotgun proteomics approach[J]. J Proteome Res, 2011, 10(11): 4948-4958. DOI:10.1021/pr200403c |
| [15] |
JIN L, WANG D Y, GOODEN D M, et al. Targeted mass spectrometry-based approach for protein-ligand binding analyses in complex biological mixtures using a phenacyl bromide modification strategy[J]. Anal Chem, 2016, 88(22): 10987-10993. DOI:10.1021/acs.analchem.6b02658 |
| [16] |
SAVITSKI M M, REINHARD F B M, FRANKEN H, et al. Tracking cancer drugs in living cells by thermal profiling of the proteome[J]. Science, 2014, 346(6205): 1255784. DOI:10.1126/science.1255784 |
| [17] |
MARTINEZ MOLINA D, NORDLUND P. The cellular thermal shift assay: a novel biophysical assay for in situ drug target engagement and mechanistic biomarker studies[J]. Annu Rev Pharmacol Toxicol, 2016, 56(1): 141-161. DOI:10.1146/annurev-pharmtox-010715-103715 |
| [18] |
BHARUCHA N, KUMAR A. Yeast genomics and drug target identification[J]. Comb Chem High Throughput Scr, 2007, 10(8): 618-634. DOI:10.2174/138620707782507340 |
| [19] |
GOBERT G N, JONES M K. Discovering new schistosome drug targets: the role of transcriptomics[J]. Curr Drug Targets, 2008, 9(11): 922-930. DOI:10.2174/138945008786786136 |
| [20] |
PAN Z Q, AGARWAL A K, XU T, et al. Identification of molecular pathways affected by pterostilbene, a natural dimethylether analog of resveratrol[J]. BMC Med Genomics, 2008, 1: 7. DOI:10.1186/1755-8794-1-7 |
| [21] |
LIU P, CHENG Y J, YANG M, et al. Mechanisms of action for 2-phenylethanol isolated from Kloeckera apiculata in control of Penicillium molds of citrus fruits
[J]. BMC Microbiol, 2014, 14: 242. DOI:10.1186/s12866-014-0242-2 |
| [22] |
DU R C, LIU J D, SUN P P, et al. Inhibitory effect and mechanism of Tagetes erecta L. Fungicide on Fusarium oxysporum f. sp. niveum
[J]. Sci Rep, 2017, 7(1): 14442. DOI:10.1038/s41598-017-14937-1 |
| [23] |
COOLS H J, FRAAIJE B A, BEAN T P, et al. Transcriptome profiling of the response of Mycosphaerella graminicola isolates to an azole fungicide using cDNA microarrays
[J]. Mol Plant Pathol, 2007, 8(5): 639-651. DOI:10.1111/mpp.2007.8.issue-5 |
| [24] |
WILKINS M R, SANCHEZ J C, GOOLEY A A, et al. Progress with proteome projects: why all proteins expressed by a genome should be identified and how to do it[J]. Biotechnol Genet Eng Rev, 1996, 13: 19-50. DOI:10.1080/02648725.1996.10647923 |
| [25] |
HONG H, YE L, CHEN H, et al. Isobaric tags for relative and absolute quantitation-based proteomic analysis of patent and constricted ductus arteriosus tissues confirms the systemic regulation of ductus arteriosus closure[J]. J Cardiovasc Pharmacol, 2015, 66(2): 204-213. DOI:10.1097/FJC.0000000000000266 |
| [26] |
GU G R, CHENG W Z, YAO C L, et al. Quantitative proteomics analysis by isobaric tags for relative and absolute quantitation identified lumican as a potential marker for acute aortic dissection[J]. J Biomed Biotechnol, 2014, 2011: 920763. |
| [27] |
YAN X J, QIN W C, SUN L P, et al. Study of inhibitory effects and action mechanism of the novel fungicide pyrimorph against Phytophthora capsici
[J]. J Agri Food Chem, 2010, 58(5): 2720-2725. DOI:10.1021/jf902410x |
| [28] |
PANG Z L, CHEN L, MIAO J Q, et al. Proteomic profile of the plant-pathogenic oomycete Phytophthora capsici in response to the fungicide pyrimorph
[J]. Proteomics, 2015, 15(17): 2972-2982. DOI:10.1002/pmic.201400502 |
| [29] |
ZHENG Z T, HOU Y P, CAI Y Q, et al. Whole-genome sequencing reveals that mutations in myosin-5 confer resistance to the fungicide phenamacril in Fusarium graminearum
[J]. Sci Rep, 2015, 5: 8248. DOI:10.1038/srep08248 |
| [30] |
HOU Y P, ZHENG Z T, XU S, et al. Proteomic analysis of Fusarium graminearum treated by the fungicide JS399-19
[J]. Pestic Biochem Physiol, 2013, 107(1): 86-92. DOI:10.1016/j.pestbp.2013.05.009 |
| [31] |
KÖSTER H, LITTLE D P, LUAN P, et al. Capture compound mass spectrometry: a technology for the investigation of small molecule protein interactions[J]. Assay Drug Dev Technol, 2007, 5(3): 381-390. DOI:10.1089/adt.2006.039 |
| [32] |
CARDENAS M E, HEMENWAY C, MUIR R S, et al. Immunophilins interact with calcineurin in the absence of exogenous immunosuppressive ligands[J]. EMBO J, 1994, 13(24): 5944-5957. |
| [33] |
WALENSKY L D, DAWSON T M, STEINER J P, et al. The 12 kD FK 506 binding protein FKBP12 is released in the male reproductive tract and stimulates sperm motility[J]. Mol Med, 1998, 4(8): 502-514. |
| [34] |
LU L N, QI Z J, LI Q L, et al. Validation of the target protein of insecticidal dihydroagarofuran sesquiterpene polyesters[J]. Toxins, 2016, 8(3): 79. DOI:10.3390/toxins8030079 |
| [35] |
LOMENICK B, HAO R, JONAI N, et al. Target identification using drug affinity responsive target stability (DARTS)[J]. Proc Natl Acad Sci USA, 2009, 106(51): 21984-21989. DOI:10.1073/pnas.0910040106 |
| [36] |
CHIN R M, FU X, PAI M Y, et al. The metabolite α-ketoglutarate extends lifespan by inhibiting ATP synthase and TOR[J]. Nature, 2014, 510(7505): 397-401. DOI:10.1038/nature13264 |
| [37] |
DERRY M M, SOMASAGARA R R, RAINA K, et al. Target identification of grape seed extract in colorectal cancer using drug affinity responsive target stability (DARTS) technique: role of endoplasmic reticulum stress response proteins[J]. Curr Cancer Drug Targets, 2014, 14(4): 323-336. DOI:10.2174/1568009614666140411101942 |
| [38] |
PARK Y D, SUN W, SALAS A, et al. Identification of multiple cryptococcal fungicidal drug targets by combined gene dosing and drug affinity responsive target stability screening[J]. mBio, 2016, 7(4): e01073-16. DOI:10.1128/mBio.01073-16 |
| [39] |
KIM D, HWANG H Y, KIM J Y, et al. FK506, an immunosuppressive drug, induces autophagy by binding to the V-ATPase catalytic subunit a in neuronal cells[J]. J Proteome Res, 2017, 16(1): 55-64. DOI:10.1021/acs.jproteome.6b00638 |
| [40] |
CAI Y L, ZHENG Y F, GU J Y, et al. Betulinic acid chemosensitizes breast cancer by triggering ER stress-mediated apoptosis by directly targeting GRP78[J]. Cell Death Dis, 2018, 9(6): 636. DOI:10.1038/s41419-018-0669-8 |
| [41] |
LAZAREV V F, SVERCHINSKY D V, MIKHAYLOVA E R, et al. Sensitizing tumor cells to conventional drugs: HSP70 chaperone inhibitors, their selection and application in cancer models[J]. Cell Death Dis, 2018, 9(2): 41. DOI:10.1038/s41419-017-0160-y |
| [42] |
DING F, GUO J, SONG W H, et al. Comparative quantitative structure–activity relationship (QSAR) study on acute toxicity of triazole fungicides to zebrafish[J]. Chem Ecol, 2011, 27(4): 359-368. DOI:10.1080/02757540.2011.585780 |
| [43] |
DU S J, LU H Z, YANG D Y, et al. Synthesis, antifungal activity and QSAR of some novel carboxylic acid amides[J]. Molecules, 2015, 20(3): 4071-4087. DOI:10.3390/molecules20034071 |
| [44] |
ARNOLDI A, CARZANIGA R, MORINI G, et al. Synthesis, fungicidal activity, and QSAR of a series of 2-dichlorophenyl-3-triazolylpropyl ethers[J]. J Agric Food Chem, 2000, 48(6): 2547-2555. DOI:10.1021/jf9906432 |
| [45] |
ZHU X L, ZHANG M M, LIU J J, et al. Ametoctradin is a potent Qo site inhibitor of the mitochondrial respiration complex III[J]. J Agric Food Chem, 2015, 63(13): 3377-3386. DOI:10.1021/acs.jafc.5b00228 |
| [46] |
黄英, 王娟, 郭改英, 等. 光谱法研究硫鸟嘌呤与七元瓜环及牛血清白蛋白的超分子相互作用[J]. 高等学校化学学报, 2013, 34(2): 375-380. HUANG Y, WANG J, GUO G Y, et al. Interaction of 6-thioguanine with cucurbit[J]. Chem J Chinese Univ, 2013, 34(2): 375-380. DOI:10.7503/cjcu20120645 |
| [47] |
李悦, 谷雨, 何佳, 等. 光谱法与分子模拟技术研究杨梅素与牛血清白蛋白的相互作用[J]. 化学学报, 2012, 70(2): 143-150. LI Y, GU Y, HE J, et al. Study on interaction between myricetin and bovine serum albumin by spectroscopy and molecular modeling[J]. Acta Chim Sin, 2012, 70(2): 143-150. |
| [48] |
LIU Z J, LI D, NIU F L. Characterization of gallic acid interaction with human serum albumin by spectral and molecular modeling methods[J]. Chem Res Chin Univ, 2012, 28(2): 287-290. |
| [49] |
WANG C, LI Y. Study on the binding of propiconazole to protein by molecular modeling and a multispectroscopic method[J]. J Agric Food Chem, 2011, 59(15): 8507-8512. DOI:10.1021/jf200970s |
| [50] |
LOU Y Y, ZHOU K L, SHI J H, et al. Characterizing the binding interaction of fungicide boscalid with bovine serum albumin (BSA): a spectroscopic study in combination with molecular docking approach[J]. J Photochem Photobiol B: Biol, 2017, 173: 589-597. DOI:10.1016/j.jphotobiol.2017.06.037 |
| [51] |
FREIRE E, MAYORGA O L, STRAUME M. Isothermal titration calorimetry[J]. Anal Chem, 1990, 62(18): 950A-959A. DOI:10.1021/ac00217a715 |
| [52] |
SCHNEIDER V A F, COORENS M, TJEERDSMA-VAN BOKHOVEN J L M, et al. Imaging the antistaphylococcal activity of CATH-2: mechanism of attack and regulation of inflammatory response[J]. mSphere, 2017, 2(6): e00370-17. DOI:10.1128/mSphere.00370-17 |
| [53] |
EEMAN M, OLOFSSON G, SPARR E, et al. Interaction of fengycin with stratum corneum mimicking model membranes: a calorimetry study[J]. Colloids Surf B Biointerfaces, 2014, 121: 27-35. DOI:10.1016/j.colsurfb.2014.05.019 |
| [54] |
WIENKEN C J, BAASKE P, ROTHBAUER U, et al. Protein-binding assays in biological liquids using microscale thermophoresis[J]. Nat Commun, 2010, 1(7): 100. DOI:10.1038/ncomms1093 |
| [55] |
MALMQVIST M, GRANZOW R. Biomolecular interaction analysis[J]. Methods, 1994, 6(2): 95-98. DOI:10.1006/meth.1994.1012 |
| [56] |
MATYSKIELA M E, LU G, ITO T, et al. A novel cereblon modulator recruits GSPT1 to the CRL4CRBN ubiquitin ligase
[J]. Nature, 2016, 535(7611): 252-257. DOI:10.1038/nature18611 |
| [57] |
BARTLETT D W, CLOUGH J M, GODWIN J R, et al. The strobilurin fungicides[J]. Pest Manag Sci, 2002, 58(7): 649-662. DOI:10.1002/(ISSN)1526-4998 |
| [58] |
BARTLETT D W, CLOUGH J M, GODWIN J R, et al. Review: the strobilurin fungicides[J]. Pest Manag Sci, 2004, 60(3): 309-309. DOI:10.1002/(ISSN)1526-4998 |
| [59] |
ZHAO P L, WANG L, ZHU X L, et al. Subnanomolar inhibitor of cytochrome bc1 complex designed by optimizing interaction with conformationally flexible residues
[J]. J Am Chem Soc, 2010, 132(1): 185-194. DOI:10.1021/ja905756c |
| [60] |
HAO G F, WANG F, LI H, et al. Computational discovery of picomolar Qo site inhibitors of cytochrome bc1 complex
[J]. J Am Chem Soc, 2012, 134(27): 11168-11176. DOI:10.1021/ja3001908 |
| [61] |
HAO G F, YANG S G, HUANG W, et al. Rational design of highly potent and slow-binding cytochrome bc1 inhibitor as fungicide by computational substitution optimization
[J]. Sci Rep, 2015, 5: 13471. DOI:10.1038/srep13471 |
| [62] |
刘长令. 世界农药大全: 杀菌剂卷[M]. 北京: 化学工业出版社, 2006: 143-152. LIU C L. Pestcide in worldwide, Fungicide volume[M]. Beijing: Chemical Industry Press, 2006: 143-152. |
| [63] |
YAMAGUCHI I, FUJIMURA M. Recent topics on action mechanisms of fungicides[J]. J Pest Sci, 2005, 30(2): 67-74. DOI:10.1584/jpestics.30.67 |
| [64] |
GISI U, SIEROTZKI H, COOK A, et al. Mechanisms influencing the evolution of resistance to Qo inhibitor fungicides[J]. Pest Manag Sci, 2002, 58(9): 859-867. DOI:10.1002/(ISSN)1526-4998 |
| [65] |
DIPL P H, DIPL J C, CHRISTO D, et al. Acrylomorpholides, their preparation and use: DE, 3306996[P/OL]. (1984-08-30)[2018-05-03]. http://www.freepatentsonline.com/DE3306996.html.
|
| [66] |
LIU C L, GUAN A Y, YANG J D, et al. Efficient approach to discover novel agrochemical candidates: intermediate derivatization method[J]. J Agric Food Chem, 2016, 64(1): 45-51. DOI:10.1021/jf5054707 |
| [67] |
ZHU S S, LIU X L, LIU P F, et al. Flumorph is a novel fungicide that disrupts microfilament organization in Phytophthora melonis
[J]. Phytopathology, 2007, 97(5): 643-649. DOI:10.1094/PHYTO-97-5-0643 |
| [68] |
PANG Z L, SHAO J P, CHEN L, et al. Resistance to the novel fungicide pyrimorph in Phytophthora capsici: risk assessment and detection of point mutations in CesA3 that confer resistance
[J]. PLoS one, 2013, 8(2): e56513. DOI:10.1371/journal.pone.0056513 |
| [69] |
JESCHKE P. Progress of modern agricultural chemistry and future prospects[J]. Pest Manag Sci, 2016, 72(3): 433-455. DOI:10.1002/ps.2016.72.issue-3 |
| [70] |
XIONG L, SHEN Y Q, JIANG L N, et al. Succinate dehydrogenase: an ideal target for fungicide discovery[M]. Americ: ACS, 2015: 175-194.
|
| [71] |
XIONG L, ZHU X L, SHEN Y Q, et al. Discovery of N-benzoxazol-5-yl-pyrazole-4-carboxamides as nanomolar SQR inhibitors
[J]. Eur J Med Chem, 2015, 95: 424-434. DOI:10.1016/j.ejmech.2015.03.060 |
| [72] |
XIONG L, LI H, JIANG L N, et al. Structure-based discovery of potential fungicides as succinate ubiquinone oxidoreductase inhibitors[J]. J Agric Food Chem, 2017, 65(5): 1021-1029. DOI:10.1021/acs.jafc.6b05134 |
| [73] |
仇是胜, 柏亚罗. 琥珀酸脱氢酶抑制剂类杀菌剂的研发进展(II)[J]. 现代农药, 2015, 14(1): 1-7. QIU S S, BAI Y L. Progress on research and development of succinate dehydrogenase inhibitor fungicides(II)[J]. Mod Agrochem, 2015, 14(1): 1-7. |
| [74] |
范志金, 刘秀峰, 刘凤丽, 等. 植物抗病激活剂诱导植物抗病性的研究进展[J]. 植物保护学报, 2005, 32(1): 87-92. FAN Z J, LIU X F, LIU F L, et al. Progress of researches on induced resistance of plant activator[J]. J Plant Prot, 2005, 32(1): 87-92. |
| [75] |
PIETERSE C M J, LEON-REYES A, VAN DER ENT S, et al. Networking by small-molecule hormones in plant immunity[J]. Nat Chem Biol, 2009, 5(5): 308-316. DOI:10.1038/nchembio.164 |
| [76] |
钱旭红, 朱维平, 赵振江, 等. 苯并[1,2,3]噻二唑-7-羧酸酯衍生物作为植物抗病激活剂的应用: CN, 102532058A[P], 2012-07-04. QIAN X H, ZHU W P, ZHAO Z J, et al. Synthesis and application of novel benzo-1,2,3-thiadiazole-7-carboxylic ester derivatives as plant activator: CN, 102532058A[P]. 2012-07-04. |
| [77] |
范志金, 鲍丽丽, 刘秀峰, 等. 苯并[1,2,3]噻二唑衍生物及其合成方法和用途: CN, 1785983[P], 2006-06-14. FAN Z J, BAO L L, LIU X F, et al. Synthesis and application of novel benzo-1,2,3-thiadiazole derivatives: CN, 1785983[P]. 2006-06-14. |
| [78] |
TRIPATHI D, JIANG Y L, KUMAR D. SABP2, a methyl salicylate esterase is required for the systemic acquired resistance induced by acibenzolar-S-methyl in plants
[J]. FEBS Lett, 2010, 584(15): 3458-3463. DOI:10.1016/j.febslet.2010.06.046 |
| [79] |
MAEDA T, ISHIWARI H. Tiadinil, a plant activator of systemic acquired resistance, boosts the production of herbivore-induced plant volatiles that attract the predatory mite Neoseiulus womersleyi in the tea plant Camellia sinensis
[J]. Exp Appl Acarol, 2012, 58(3): 247-258. DOI:10.1007/s10493-012-9577-2 |
| [80] |
BEKTAS Y, EULGEM T. Synthetic plant defense elicitors[J]. Front Plant Sci, 2015, 5: 804. |
 2018, Vol. 20
2018, Vol. 20