海洋生物是人类新型药物和功能食品的重要来源,为适应其特殊的生存环境 (高盐、高压、缺氧、光照弱等),它们在生长和代谢过程中会产生大量具有特殊化学结构、生理活性及功能的物质[1]。海洋细菌是海洋微生物中的优势类群,具有产生新型生物活性物质的巨大潜力,已成为药物筛选的重要来源之一,是目前研究的热点领域[2]。贝莱斯芽孢杆菌Bacillus velezensis是一种新型生防细菌,是2005年由西班牙学者Ruiz-García等[3]在西班牙南部马赫拉加发现并命名的芽孢杆菌新种,2008年被确定为解淀粉芽孢杆菌的后期异型体[4]。作为一种新型生防细菌,已有研究表明其对多种植物病原菌有强抑制作用,但是前期研究者所用的贝莱斯芽孢杆菌均来自土壤、植物组织或动物粪便等陆生环境[5-8],目前尚未见对来自海洋生境贝莱斯芽胞杆菌生防活性的相关研究报道。而结合海洋的特殊环境,推测海洋生境的贝莱斯芽孢杆菌有可能表现出更大的开发潜能。因此,笔者针对分离自中国渤海海域的TCS001菌株进行了菌种鉴定及其抑菌活性研究,旨在发掘出具有强抑菌活性的生防菌株。
1 材料与方法 1.1 试验材料 1.1.1 供试菌株待测拮抗菌株:海洋细菌TCS001由本实验室分离自中国渤海海泥,已对其进行低盐驯化与诱变育种,菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心 (CGMCC),保藏号为CGMCC No. 8921。
供试植物病原真菌由本实验室保存,分别为:黄瓜灰霉病菌Botrytis cinerea、黄瓜蔓枯病菌Ascochyta citrullina、黄瓜菌核病菌Sclerotinia sclerotiorum、黄瓜褐斑病菌Corynespora cassiicola、棉花枯萎病菌Fusarium oxysporum及香蕉叶斑病菌Pseudocercospora musae。
1.1.2 培养基NA培养基用于TCS001菌株的分离活化;NB (pH = 8.0) 培养基用于TCS001菌株发酵培养;种子培养基 (胰蛋白胨7 g,酵母粉2 g,葡萄糖2 g,NaCl 6 g,KCl 0.06 g,MgCl2·6H2O 0.5 g,用蒸馏水定容至1 000 mL,pH = 7.0) 用于TCS001菌株种子液培养;PDA培养基用于植物病原真菌的培养。
1.2 TCS001菌株的鉴定 1.2.1 菌株形态及生理生化特征鉴定通过革兰氏染色和芽孢染色进行形态特征观察[9]。生理生化特征测定参照《常见细菌系统鉴定手册》[10]进行。
1.2.2 菌株分子鉴定利用上海生工DNA快速提取试剂盒进行TCS001菌株基因组DNA的提取[11],以促旋酶 (gyrase) A亚单位基因 (gyrA) 引物[F:(5′-CAGTCAGGAAATGCGTACGTCCTT-3′) 和R:( 5′-CAAGGTAATGCTCCA GGCATTGCT-3′)] [12]对菌株的基因组进行扩增。反应体系:模板DNA 1 μL,10 μmol/L引物F和引物R各1 μL,2 × Taq Master Mix 12.5 μL。反应条件:95 ℃ 5 min;94 ℃ 1 min,60 ℃ 1 min,72 ℃ 2 min,30个循环;72 ℃ 10 min[13]。经纯化后将gyrA序列扩增产物送上海生工生物工程股份有限公司测序。
根据基因测序结果,采用BLAST搜索程序从GenBank数据库中调出同源性高的相关菌株的基因序列,利用MEGA 7.0软件进行序列多重比对后,采用Neighbor-Joining法构建系统进化树,以确定菌株TCS001的分类地位。
1.3 TCS001菌株抑菌谱测定及液体发酵采用平板对峙培养法[14]测定TCS001菌株对6种供试病原菌的抑制作用,在PDA平板中心接入直径为7 mm、生长旺盛的病原菌菌饼,菌丝面朝下,在距培养皿中央2 cm处以对角线方式接种4个TCS001菌落,以不接种TCS001菌株的培养皿为对照。每处理设4个重复,于25 ℃暗培养,待对照组病原菌直径长到培养皿直径的3/4时,采用十字交叉法测量病原菌菌落直径,并按 (1) 式计算抑制率,利用SPSS 22.0软件对抑制率进行单因素方差分析。
| ${\text{抑制率}}/{\text\%} = \frac{{{\text{对照组菌落直径}}- {\text{处理组菌落直径}}}}{{{\text{对照组菌落直径}}- 7}} \times 100$ | (1) |
无菌条件下,用接种环取一环在NA培养基上活化培养3 d的TCS001菌株,接种于装有150 mL种子培养液的250 mL锥形瓶中,于27 ℃、140 r/min条件下振荡培养20 h至对数增长期,形成种子液。按4%的接种量取4 mL上述种子液接种于100 mL NB培养液中,于27 ℃、160 r/min条件下振荡培养36 h,即得TCS001菌悬液。
1.4 TCS001发酵滤液对黄瓜灰霉病菌的影响 1.4.1 对黄瓜灰霉病菌孢子萌发的影响将1.3节中的TCS001菌悬液于4 ℃、12 000 r/min条件下离心20 min,取上清液经22 μm的微孔滤膜过滤3次,即得发酵滤液[15],备用。采用凹玻片法[16]观察发酵滤液对黄瓜灰霉病菌孢子萌发的影响。将在PDA培养基中培养8 d的黄瓜灰霉病菌制成孢子悬浮液,利用无菌水调节其浓度为2 × 105个/mL。将TCS001发酵滤液按5、10、20、40、80和160倍的稀释比例,分别与孢子悬浮液等体积混匀。各处理取60 μL滴加在凹玻片上,每处理设5个重复,置于培养皿中,25 ℃下恒温保湿、暗培养15 h后,在光学显微镜下观察各试验组孢子形态以及萌发数量,计算孢子萌发抑制率,并利用SPSS 22.0软件进行单因素方差分析。
1.4.2 对黄瓜灰霉病菌菌丝生长的影响采用菌丝生长速率法[17]测定不同浓度发酵滤液对黄瓜灰霉病菌菌丝生长的抑制作用。将发酵滤液与PDA培养基混合,使发酵滤液分别稀释5、10、20、40、80和160倍,以加入等体积无菌水的PDA培养基为对照,每处理设5个重复,于25 ℃恒温培养72 h后采用十字交叉法测量菌落直径,计算抑菌率,并利用SPSS 22.0软件进行单因素方差分析。
2 结果与分析 2.1 菌株TCS001鉴定结果 2.1.1 培养性状及形态特征在NA培养基上生长后,TCS001单菌落形态呈近圆形,浅黄色,不透明;培养初期菌落表面光滑,边缘整齐,后期表面有褶皱,边缘略不整齐,中间有凸起,四周呈云雾状扩散。经革兰氏染色表明:TCS001菌株为革兰氏阳性,杆状 (图1),菌体长3.1~6.0 μm,宽约0.6 μm (图1-A),芽孢呈椭圆形,近端生,孢囊稍膨大 (图1-B),长1.2~2.0 μm,宽约0.7 μm (图1-C)。

|
A:TCS001未形成芽孢时的细胞形态;B:TCS001产生芽孢后的形态;C:TCS001游离的芽孢形态。 A: Cell morphology of strain TCS001 without spore; B: Cell morphology of strain TCS001 with spore; C: Spore morphology of strain TCS001. 图 1 TCS001在光学显微镜下的形态 (100 ×) Fig. 1 Morphology of strain TCS001 under an optical microscope (100 ×) |
2.1.2 生理生化特征
生理生化试验表明,TCS001菌株能分解利用葡萄糖、乳糖、蔗糖、果糖、甘露醇和麦芽糖,可水解淀粉和明胶,能利用葡萄糖产酸,其氧化酶反应、V-P反应、硝酸盐还原反应和接触酶反应均呈阳性,甲基红试验和H2S反应呈阴性。根据TCS001菌株的培养性状、形态及生理生化特征,初步鉴定其为芽孢杆菌属 (Bacillus) 细菌[9-10]。
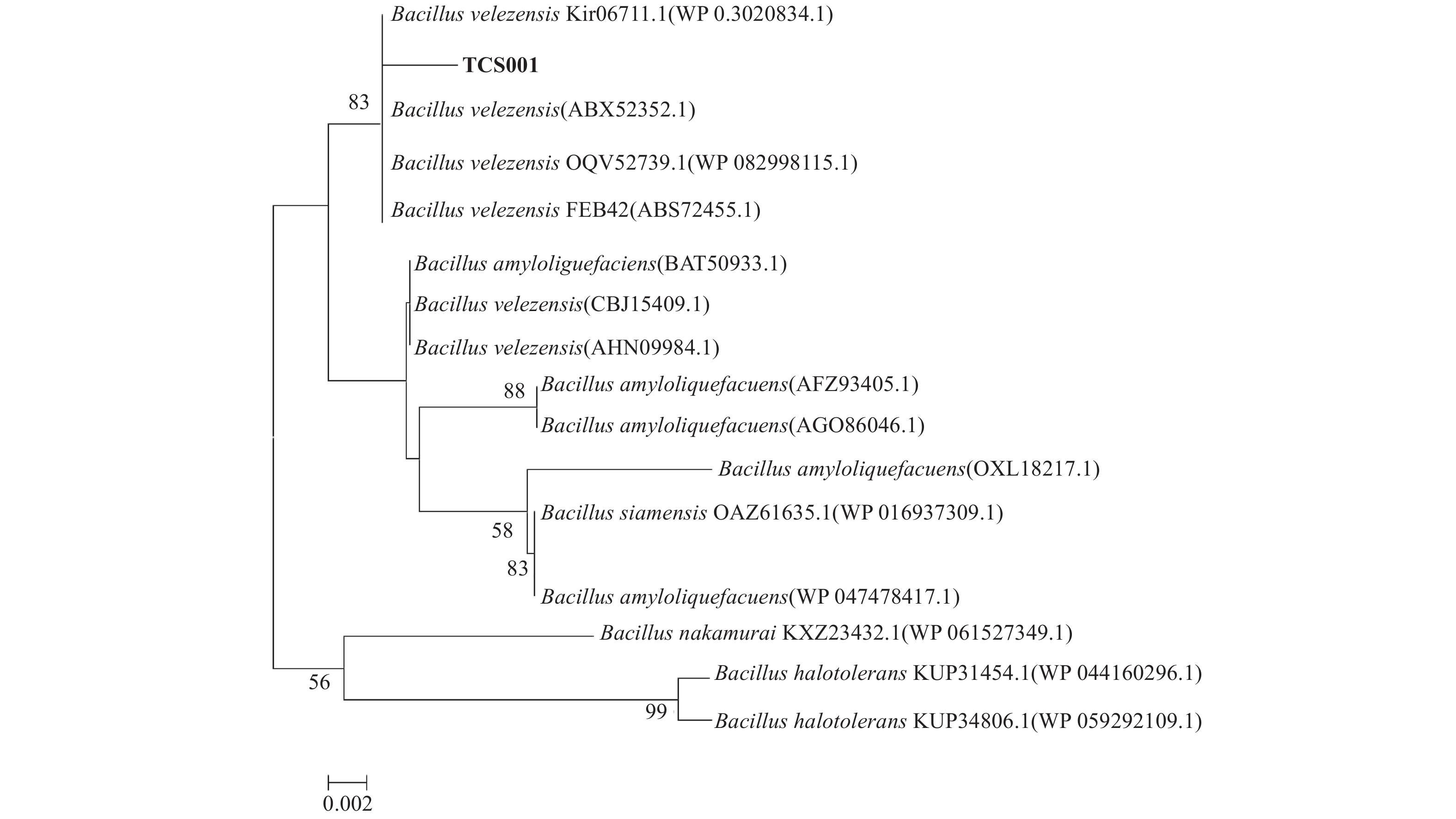
2.1.3 分子鉴定提取菌株TCS001的基因组DNA,电泳检测得其大小超过10 kb。扩增得到gyrA基因,测序后的基因序列片段长度为971 bp,与Rooney等[12]公布的741~939 bp长度范围结果相符。将该基因序列进行BLAST分析,根据gyrA基因序列比对结果构建系统发育树 (图2),从中可看出,菌株TCS001的序列与4株B. velezensis的序列位于系统发育树的同一分支。同源性比对数据和系统发育树位置进一步证明了菌株TCS001为贝莱斯芽孢杆菌Bacillus velezensis。
|
注:分支处的数值为Bootstrap法重复1 000次评估得到的各节点支持率,标尺0.002为进化距离。 Note: Numbers at nodes indicating Bootstrap values for each node out of 1 000 bootstrap replications; Scale 0.002 meaning evolutionary distance. 图 2 基于gyrA 基因序列构建的拮抗细菌TCS001与相关细菌的邻接法系统发育树 Fig. 2 NJ phylogenetic tree based on gyrA gene sequences of antagonistic bacterium TCS001 and related bacteria |
2.2 TCS001菌株对植物病原真菌的抑制作用
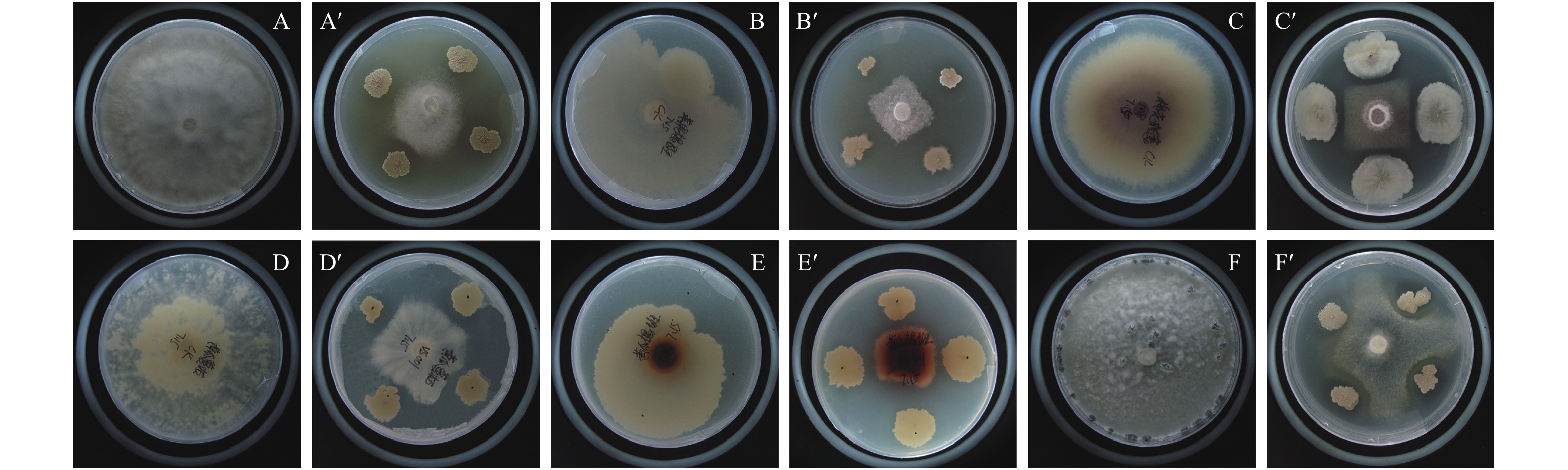
平板对峙培养法测定结果 (表1,图3) 表明:TCS001菌株对6种供试植物病原真菌均表现出良好的抑制效果 (P < 0.05),抑制率为57.62%~87.66%,其中对黄瓜灰霉病菌的抑制效果最强,对黄瓜菌核病菌的抑制效果最弱。
|
|
表 1 贝莱斯芽孢杆菌TCS001对供试植物病原真菌的抑制作用 (n = 4) Table 1 Inhibition rate of B. velezensis strain TCS001 against different fungal phytopathogens (n = 4) |
|
A:黄瓜灰霉病菌;B:香蕉叶斑病菌;C:棉花枯萎病菌;D:黄瓜蔓枯病菌;E:黄瓜褐斑病菌;F:黄瓜菌核病菌。其中 A、B、C、D、E、F 为对照组;A’、B’、C’、D’、E’、F’ 为试验组。 A: B. cinerea; B: P. musae; C: F. oxysporum; D: A. citrullina; E: C. cassiicola; F: S. sclerotiorum. A, B, C, D, E and F are the control group; A’, B’, C’, D’, E’and F’ are the treatment group. 图 3 贝莱斯芽孢杆菌TCS001对供试植物病原真菌的抑制效果 Fig. 3 Antagonistic effect of B.velezensis strain TCS001 against different fungal phytopathogens |
2.3 TCS001发酵滤液对黄瓜灰霉病菌孢子萌发和菌丝生长的影响 2.3.1 对孢子萌发的影响
不同稀释倍数下,TCS001发酵滤液对黄瓜灰霉病菌孢子萌发的抑制率存在显著差异 (P < 0.05),随发酵滤液稀释倍数增大,抑制效果逐渐下降 ( 表2)。
显微观察发现,对照组孢子萌发较好,芽管较长,粗细均匀 (图4-A);发酵滤液处理组孢子萌发出现不同程度畸形,主要表现为4种形态:芽管中间膨大 (图4-B);芽管顶端膨大 (图4-C);芽管整体膨大 (图4-D);芽管膨大且出现异常分枝 (图4-E)。
2.3.2 对菌丝生长的影响不同稀释倍数下,TCS001发酵滤液对黄瓜灰霉病菌菌丝生长的抑制率也存在显著差异 (P < 0.05),随发酵滤液稀释倍数增大,抑制效果逐渐下降 ( 表2)。
研究显示,当TCS001发酵滤液稀释倍数 ≤ 20时,其对黄瓜灰霉病菌菌丝生长和孢子萌发的抑制率均大于90%,说明TCS001发酵液中含有活性明显的抑菌物质,具有明显的生防菌剂开发潜力。
|
|
表 2 贝莱斯芽孢杆菌TCS001发酵滤液对黄瓜灰霉病菌孢子萌发及菌丝生长的抑制效果 (n = 5) Table 2 Inhibitory effect of strain TCS001 fermentation filtrate on spore germination and mycelial growth of B. cinerea pathogen (n = 5) |

|
A:对照;B、C、D、E:处理组 (箭头表示膨大处)。 A: Control group; B, C, D, E: Treatment groups (arrows denote expansion). 图 4 贝莱斯芽孢杆菌TCS001发酵滤液对黄瓜灰霉病菌孢子萌发的影响 Fig. 4 Effects of strain TCS001 fermentation filtrate on spore germination of B. cinerea pathogen |
3 小结与讨论
本研究对从中国渤海海泥中分离得到的菌株TCS001进行了形态特征观察、生理生化性质鉴定及gyrA序列分析,确定该菌株为贝莱斯芽孢杆菌B. velezensis。已有研究发现,贝莱斯芽孢杆菌对棉花黄萎病病原菌大丽轮枝菌Verticillium dahliae Kleb、白菜黑斑病致病菌芸薹链格孢Alternaria brassicae、番茄灰霉病致病菌灰葡萄孢B. cinerea Pers、腐霉属 (Pythium spp.)、丝核菌属 (Rhizoctonia spp.)、链格孢属 (Alternaria spp.)、镰刀菌属 (Fusarium spp.)、疫霉属 (Phytophthora spp.) 和黑腐菌属 (Thielaviopsis spp.) 等植物病害均有一定的抑制活性[18-20]。还有研究者将贝莱斯芽孢杆菌直接作为生物制剂应用于真菌病害的防治。本研究所用的贝莱斯芽孢杆菌TCS001也表现出了良好的广谱抗菌活性,对黄瓜灰霉病菌、香蕉叶斑病菌及棉花枯萎病菌等6种供试植物病原真菌均有显著的抑菌效果,抑制率均在57%以上。
目前关于贝莱斯芽孢杆菌的研究主要集中于对其活菌活性的研究上,而对其代谢产物的研究较少。但如果考虑将其制成活菌制剂,则要求菌株本身具有较强的加工和贮存耐受性,很多生防菌株往往难以实现这一点。因此,从生防菌株代谢物中开发新的抗真菌药物已引起人们的重视,成为研发的新热点[21]。本研究将TCS001菌株发酵液通过离心及过滤进行初步分离,进一步探索了该发酵滤液的抑菌作用,结果证明TCS001发酵液中含有活性明显的抑菌物质,且通过离心及过滤措施可有效富集该活性物质,从而提高其对供试靶标菌的抑菌活性。
综上表明,贝莱斯芽孢杆菌TCS001菌株在植物病原真菌的生物防治方面具有一定的潜在开发利用价值,有望通过进一步分离纯化其发酵滤液,得到高活性的抗真菌药物。笔者后续将进一步对TCS001活体菌株的田间防治效果以及该菌所产生的具体抗真菌代谢活性物质等进行研究。
致谢 (Acknowledgement):衷心感谢沈阳农业大学纪明山教授团队对本课题的指导与支持!
| [1] |
LIU Y, ZHENG H, ZHAN G H, et al. Establishment of an efficient transformation protocol and its application in marine-derived Bacillus strain
[J]. Sci China Life Sci, 2014, 57(6): 627-635. DOI:10.1007/s11427-014-4632-3 |
| [2] |
孙晓磊, 闫培生, 王凯, 等. 深海细菌及其活性物质防控植物病原真菌的研究进展[J]. 生物技术进展, 2015, 5(3): 176-184. SUN X L, YAN P S, WANG K, et al. Progress of deep-sea bacteria and its bioactive compounds on prevention of plant pathogenic fungi[J]. Curr Biotechnol, 2015, 5(3): 176-184. |
| [3] |
RUIZ-GARCÍA C, BÉJAR V, MARTÍNEZ-CHECA F, et al. Bacillus velezensis sp. nov., a surfactant-producing bacterium isolated from the river Vélez in Málaga, southern Spain
[J]. Int J Syst Evol Microbiol, 2005, 55(1): 191-195. DOI:10.1099/ijs.0.63310-0 |
| [4] |
WANG L T, LEE F L, TAI C J, et al. Bacillus velezensis is a later heterotypic synonym of Bacillus amyloliquefaciens
[J]. Int J Syst Evol Microbiol, 2008, 58(3): 671-675. DOI:10.1099/ijs.0.65191-0 |
| [5] |
KANJANAMANEESATHIAN M, WIWATTANAPATAPEE R, ROTNIAM W, et al. Application of a suspension concentrate formulation of Bacillus velezensis to control root rot of hydroponically-grown vegetables
[J]. N Z Plant Prot, 2013, 66: 229-234. |
| [6] |
连彩, 郭晓军, 朱宝成, 等. 兰花枯萎病拮抗细菌的筛选与鉴定[J]. 华北农学报, 2012, 27(2): 222-225. LIAN C, GUO X J, ZHU B C, et al. Screening and identification of antagonistic bacterium against Colletoichum wilt [J]. Acta Agriculturae Boreali-Sinica, 2012, 27(2): 222-225. |
| [7] |
LIM S M, YOON M Y, CHOI G J, et al. Diffusible and volatile antifungal compounds produced by an antagonistic Bacillus velezensis G341 against various phytopathogenic fungi
[J]. Plant Pathol J, 2017, 33(5): 488-498. DOI:10.5423/PPJ.OA.04.2017.0073 |
| [8] |
CHEN L. Complete genome sequence of Bacillus velezensis LM2303, a biocontrol strain isolated from the dung of wild yak inhabited Qinghai-Tibet plateau
[J]. J Biotechnol, 2017, 251: 124-127. DOI:10.1016/j.jbiotec.2017.04.034 |
| [9] |
宫燕伟, 王佳宁, 梁晨, 等. 蓝莓枝枯病拮抗细菌 HMQAU140045的鉴定和抑真菌活性[J]. 农药学学报, 2017, 19(2): 195-202. GONG Y W, WANG J N, LIANG C, et al. Identification and antifungal activity of antagonistic bacterium HMQAU140045 against blueberry twig blight [J]. Chin J Pestic Sci, 2017, 19(2): 195-202. |
| [10] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 349-388. DONG X Z, CAI M Y. Manual of systematic methods of determinative bacteria[M]. Beijing: Science Press, 2001: 349-388. |
| [11] |
陶天申, 杨瑞馥, 东秀珠. 原核生物系统学[M]. 北京: 化学工业出版社, 2007. TAO T S, YANG R F, DONG X Z. Systematics of prokaryotes (conciseness)[M]. Beijing: Chemical Industry Press, 2007. |
| [12] |
ROONEY A P, PRICE N P J, EHRHARDT C, et al. Phylogeny and molecular taxonomy of the Bacillus subtilis species complex and description of Bacillus subtilis subsp. inaquosorum subsp. nov.
[J]. Int J Syst Evol Microbiol, 2009, 59(10): 2429-2436. DOI:10.1099/ijs.0.009126-0 |
| [13] |
喻国辉, 牛春艳, 陈远凤, 等. 利用 16S rDNA 结合 gyrA 和 gyrB 基因对生防芽孢杆菌 R31 的快速鉴定
[J]. 中国生物防治, 2010, 26(2): 160-166. YU G H, NIU C Y, CHEN Y F, et al. Use of 16S rDNA, gyrA and gyrB gene sequence to identify a biocontrol Bacillus sp. strain R31 [J]. Chin Biol Control, 2010, 26(2): 160-166. |
| [14] |
赵玉玲, 董奉鑫, 李素俭, 等. 生防菌 Act12 铁载体合成酶 Ser 基因的功能
[J]. 微生物学通报, 2017, 44(1): 79-85. ZHAO Y L, DONG F X, LI S J, et al. Functional analysis of Ser gene from biological bacterium Act12 [J]. Microbiol China, 2017, 44(1): 79-85. |
| [15] |
纪明山, 王毅婧. 地衣芽孢杆菌生防菌株 SDYT-79 发酵条件优化[J]. 沈阳农业大学学报, 2011, 42(2): 164-169. JI M S, WANG Y J. Optimizing fermentation condition for the antagonistic Bacillus licheniformis SDYT-79 strain [J]. Shenyang Agric Univ, 2011, 42(2): 164-169. |
| [16] |
方中达. 植病研究方法[M]. 3 版. 北京: 中国农业出版社, 1998: 146-155. FANG Z D. Methodology on plant pathology research[M]. 3rd ed. Beijing: China Agriculture Press, 1998: 146-155. |
| [17] |
杨胜清, 张帆, 马贵龙. 贝莱斯芽孢杆菌 S6 拮抗物质分离纯化及抑菌机理[J]. 农药, 2017, 56(9): 645-648. YANG S Q, ZHANG F, MA G L. Purification and inhibitive mechanism of antagonist substances from Bacillus velezensis S6 strain [J]. Agrochemicals, 2017, 56(9): 645-648. |
| [18] |
杜淑涛, 李术娜, 朱宝成. 白菜黑斑病拮抗细菌 Bacillus velezensis DL-59 的筛选鉴定及田间防效实验
[J]. 河北农业大学学报, 2010, 33(6): 51-56. DU S T, LI S N, ZHU B C. Screening and identification of antagonistic strain DL-59 of Bacillus velezensis against Alternaria brassicae and biocontrol efficiency [J]. J Agric Univ Hebei, 2010, 33(6): 51-56. |
| [19] |
王伟, 李术娜, 李红亚, 等. 番茄灰霉病拮抗细菌的筛选与 X-75 菌株鉴定[J]. 园艺学报, 2010, 37(2): 307-312. WANG W, LI S N, LI H Y, et al. Screening of antagonistic bacteria against Botrytis cinerea and identification of strain X-75 [J]. Acta Horticulturae Sinica, 2010, 37(2): 307-312. |
| [20] |
GAO Z F, ZHANG B J, LIU H P, et al. Identification of endophytic Bacillus velezensis ZSY-1 strain and antifungal activity of its volatile compounds against Alternaria solani and Botrytis cinerea
[J]. Biol Control, 2017, 105: 27-39. DOI:10.1016/j.biocontrol.2016.11.007 |
| [21] |
束长龙, 曹蓓蓓, 袁善奎, 等. 微生物农药管理现状与展望[J]. 中国生物防治学报, 2017, 33(3): 297-303. SHU C L, CAO B B, YUAN S K, et al. The present situation and prospect of microbial pesticide management[J]. Chin J Biol Control, 2017, 33(3): 297-303. |
 2018, Vol. 20
2018, Vol. 20


