2. 陕西省植物源农药研究与开发重点实验室,陕西 杨凌 712100
2. Shaanxi Province Key Laboratory Research & Development on Botanical Pesticides, Northwest A & F University, Yangling 712100, Shaanxi Province, China
大蓟Cirsium japonicum DC.为菊科蓟属植物,具有多种药理活性,在中国分布极为广泛[1-2]。据报道,大蓟次生代谢物主要包括挥发油类、长链炔醇类、三萜和甾醇类、黄酮及黄酮苷类、木脂素类等[3-6]。目前关于大蓟农药活性的研究报道很少,仅有几篇有关大蓟根提取物抑菌活性的报道[7-8]。由于大蓟地上部分的资源量较根部更多,也更容易采集,而且大蓟根的药用价值更大,因此从综合利用的角度出发,笔者对大蓟地上部分的化学成分及其抑菌活性进行了系统研究,现将结果报道如下。
1 材料与方法 1.1 植物材料大蓟地上组织,2017年6月采集于陕西杨凌,经西北农林科技大学李玉平教授鉴定为大蓟Cirsium japonicumDC.,标本现存于西北农林科技大学植物保护学院农药研究所。将植物材料自然晾晒风干,粉碎,保存备用。
1.2 供试菌株苹果腐烂病菌Valsa mali Miyabe et Yamada、玉米弯孢病菌Curvularia lunata、苹果炭疽病菌Colletotrichum gloesporioides、茄子黄萎病菌Verticillium dahliae Kleb和番茄灰霉病菌Botrytis cinerea,均由西北农林科技大学农药研究所提供。
1.3 仪器及药剂Shimadzu LC-6AD高效液相色谱仪;Bruker RPX 500MHz核磁共振波谱仪 (TMS为内标);Thermo LCQ Advantage MAX质谱仪;WPR熔点仪 (上海精科仪器有限公司);Sephadex LH-20 (美国通用电气公司)。
嘧菌酯 (azoxystrobin) 原药 (纯度98%,江苏瑞邦农药厂有限公司);柱层析硅胶 (200~300目,青岛海洋化工厂);石油醚、乙酸乙酯等均为国产分析纯。
1.4 大蓟地上组织中化学成分的提取与分离取晾干的大蓟地上组织 (10 kg),粉碎,用甲醇超声提取3次。过滤,合并提取液,减压浓缩,得到甲醇浸膏。将甲醇浸膏混悬于水中,依次用石油醚和乙酸乙酯萃取,浓缩得到石油醚相 (121 g)、乙酸乙酯相 (105 g) 和水相 (351 g)。取乙酸乙酯相 (105 g) 用甲醇溶解,加入硅胶拌样,晾干研磨成粉,湿法装柱,干法上样,硅胶柱依次用石油醚、V (石油醚) : V (乙酸乙酯) = 10 : 1、8 : 1、6 : 1、4 : 1、2 : 1、1 : 1、乙酸乙酯和甲醇梯度洗脱,收集馏分,减压浓缩,经TLC (展开剂为不同比例的石油醚和乙酸乙酯) 检测后合并相同组分,分别得到F1 (9.64 g)、F2 (10.24 g)、F3 (11.21 g)、F4 (5.82 g)、F5 (1.18 g)、F6 (5.25 g)、F7 (6.37 g)、F8 (6.41 g)、F9 (7.28 g) 和F10 (28.02 g) 共10个组分。其中F4经硅胶柱梯度洗脱[洗脱剂为V (石油醚) : V (乙酸乙酯) = 10 : 1、5 : 1、3 : 1、1 : 1和乙酸乙酯],共得到F4-1 (1.06 g)、F4-2 (0.77 g)、F4-3 (0.62 g)、F4-4 (0.58 g)、F4-5 (0.46 g) 和F4-6 (0.56 g)6个部分。其中,F4-2采用LH-20葡聚糖凝胶柱层析,经反复洗脱[V (甲醇) : V (二氯甲烷) = 1 : 1]得到化合物1 (20.6 mg);F4-3、F4-4和F4-5继续经硅胶柱纯化[V (石油醚) : V (乙酸乙酯) = 5:1]得到化合物2 (15.7 mg)、3 (3.2 mg)、4 (9.9 mg)、5 (4.3 mg) 和6 (15.4 mg)。F5经硅胶柱层析 ([V (石油醚) : V (乙酸乙酯) = 4 : 1],得到化合物7 (6.5 mg)。F6经硅胶柱梯度洗脱 ([V (石油醚) : V (乙酸乙酯) = 3 : 1、1 : 1和乙酸乙酯],共得到5个部分:F6-1 (1.30 g)、F6-2 (0.74 g)、F6-3 (0.57 g)、F6-4 (0.67 g) 和F6-5 (0.72 g)。其中,F6-3和F6-4采用ODS反相柱层析,经65%~75%甲醇水溶液梯度洗脱后,第 2、5、7部分有固体析出,用甲醇重结晶分别得到化合物8 (10.8 mg)、9 (11.2 mg) 和10 (12.4 mg)。F7、F8均采用LH-20葡聚糖凝胶柱层析,反复经甲醇洗脱后,得到化合物11 (22.7 mg)、12 (20.7 mg) 和13 (40.7 mg)。
1.5 抑菌活性测定 1.5.1 萃取物和分离化合物对菌丝生长的抑制作用采用菌丝生长速率法[7]分别测定了石油醚相、乙酸乙酯相、水相及所分离化合物对5种供试病原菌的抑制活性。各萃取物用含质量分数为10%的丙酮水溶液配制成质量浓度为1.00 × 105 μg/mL的样品溶液。取1 mL该样品溶液加入到9 mL PDA培养基中,制成含药平板。所分离的化合物用含10%的丙酮水溶解并配制成系列浓度梯度药液,加入到PDA中制成质量浓度分别为600、300、150、75和37.5 μg/mL的含药平板。空白对照组均加入等量溶剂。以嘧菌酯原药为对照药剂。将供试病原菌菌饼 (直径0.5 cm) 分别接种于含药平板上,于 (25 ± 0.5) ℃培养箱中培养2~7 d,待对照皿长满菌丝,用十字交叉法测量菌落直径,计算菌丝生长抑制率,并进行数据处理。
1.5.2 化合物对真菌孢子萌发的抑制作用采用孢子萌发法[9]测定了化合物对玉米弯孢病原菌、苹果炭疽病原菌及番茄灰霉病原菌孢子萌发的抑制作用。用适量无菌水冲洗培养基中的真菌菌落,用纱布过滤去除菌丝,取上清液。用无菌水将供试病原菌孢子浓度调节至每mL 105个细胞,制备孢子悬浮液。将各化合物配制成系列浓度梯度的药液,分别与孢子悬浮液等体积混合,使药液最终质量浓度分别为0、12.5、25、50、100和200 μg/mL。混合液在25 ℃下恒温培养。当对照组孢子萌发率达到80%以上时检查结果。统计各处理组孢子萌发数,计算萌发率,并进行数据处理。
2 结果与分析 2.1 萃取物对菌丝生长的抑制作用不同溶剂萃取液对5种供试病原真菌的抑制结果 (表1) 表明:在1.00 × 104 μg/mL下,大蓟石油醚相和乙酸乙酯相对5种病原菌菌丝生长均有一定的抑制作用;水相成分无明显活性;乙酸乙酯相成分的抑制作用优于石油醚相,对其中4种病原菌菌丝生长的抑制率超过50%,对苹果腐烂病原菌菌丝生长抑制率最高,为100%。
|
|
表 1 3种溶剂萃取液对5种病原真菌菌丝生长的抑制作用(1.00×104 μg/mL) Table 1 Inhibitory effect of three extraction solvents on the mycelia growth of five plant pathogenic fungi (1.00×104 μg/mL) |
2.2 结构鉴定
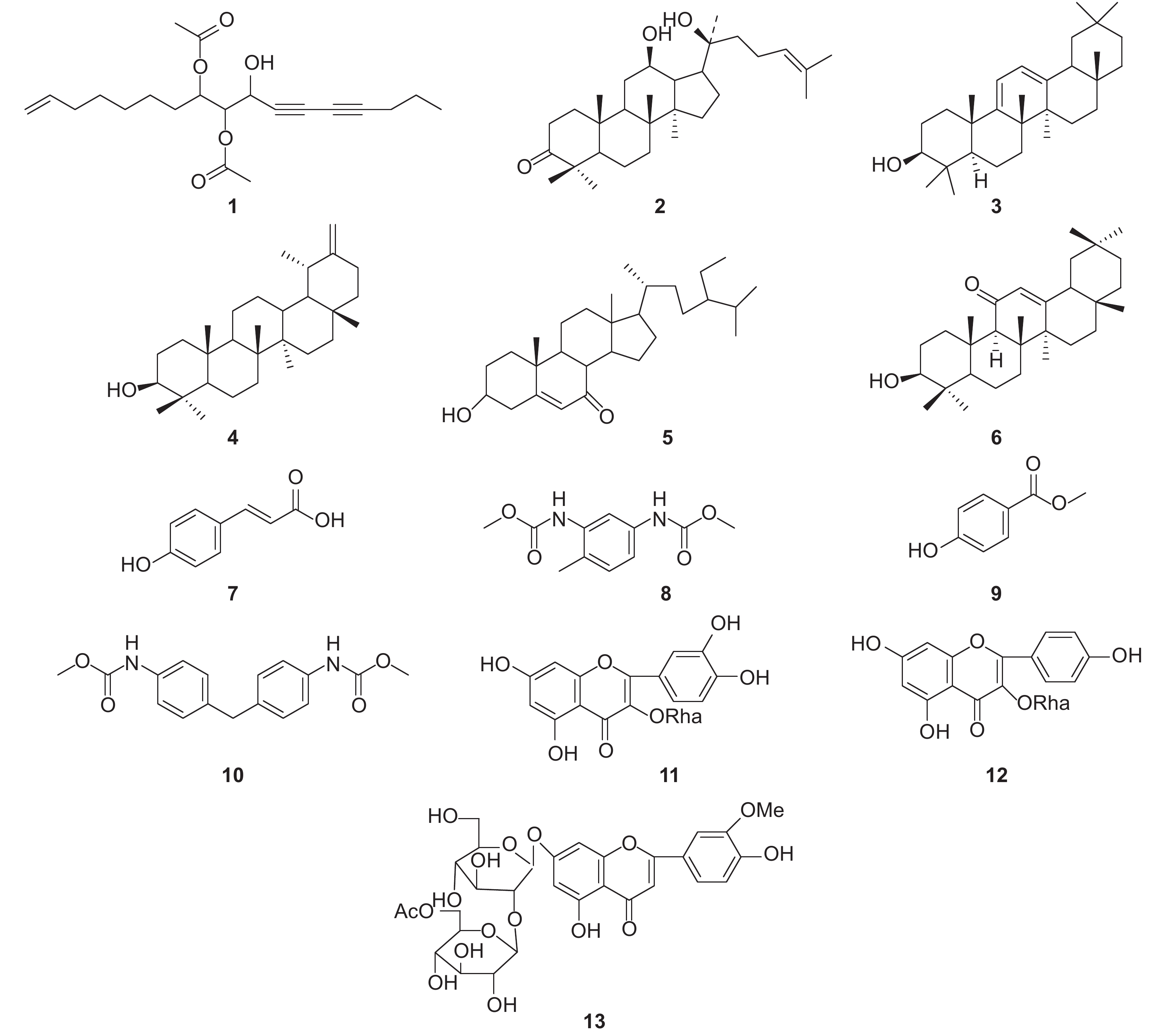
采用1H NMR、13C NMR和ESI-MS对化合物1~13的结构进行了鉴定,经与相关文献值分析比对,确定其化学结构见图式1,其中1为长链炔烃类,2、3、4、5、6为甾醇及三萜类,7、8、9、10为芳香酰胺及羧酸类,11、12、13为黄酮类及其苷类。
化合物1:黄色油状物,ESI-MS (m/z):363.22 [M+H]+,分子式为C21H30O5;其1H NMR谱和13C NMR谱数据与文献[10]报道一致,故该化合物鉴定为ciryneol D。
化合物2:无色针状晶体,m.p. 194~195 ℃ (文献值[11] 194~196 ℃);ESI-MS (m/z):459.37 [M+H]+,分子式为C30H50O3;其 1H NMR谱和 13C NMR谱数据与文献[11]报道一致,故该化合物鉴定为12β, 20 (S)-二羟基达玛烷-24-烯-3-酮 (12β, 20 (S)-dihydroxydammar-24-en-3-one)。
化合物3:白色粉末,m.p. 280~283 ℃ (文献值[12] 280~282 ℃);ESI-MS (m/z):425.36 [M+H]+,分子式为C30H48O;其 1H NMR谱和 13C NMR谱数据与文献[12]报道一致,故该化合物鉴定为3β-羟基-9 (11),12-齐墩果二烯 (9 (11),12-dieneoleana-3β-ol)。
化合物4:白色粉末,m.p. 216~219 ℃ (文献值[13] 218~219 ℃);ESI-MS (m/z):427.38 [M+H]+,分子式为C30H50O;其 1H NMR谱和 13C NMR谱数据与文献[13]报道一致,故该化合物鉴定为蒲公英甾醇 (taraxasterol)。
化合物5:无色针状晶体,m.p. 140~143 ℃ (文献值[14] 140~142 ℃);ESI-MS (m/z):429.36 [M+H]+,分子式为C29H48O2;其 1H NMR谱和 13C NMR谱数据与文献[14]报道一致,故该化合物鉴定为3β-羟基豆甾-5-烯-7-酮 (3β-hydroxystigmast-5-en-7-one)。
化合物6:白色粉末,m.p. 170~172 ℃ (文献值[15] 170~171 ℃);ESI-MS (m/z):441.38 [M+H]+,分子式为C30H48O2;其 1H NMR谱和 13C NMR谱数据与文献[15]报道一致,故该化合物鉴定为3β-羟基-12(13)-烯-齐墩果烷-11-酮 (3β-hydroxyl-12 (13)-en-olean-11-one)。
化合物7:黄色粉末,m.p. 210~212 ℃ (文献值[16] 210~212 ℃);ESI-MS (m/z):165.04[M+H]+,分子式为C9H8O3;其 1H NMR谱和 13C NMR谱数据与文献[16]报道一致,故该化合物鉴定为对香豆酸 (p-coumaric acid)。
化合物8:白色固体,m.p. 220~224 ℃ (文献值[17] 222~224 ℃);ESI-MS (m/z):239.11 [M+H]+,分子式为C11H14N2O4;其 1H NMR谱和 13C NMR谱数据与文献[17]报道一致,故该化合物鉴定为 (3-甲氧基酰氨基-4-甲基苯)-氨基甲酸甲酯 (obtucarbamate A)。
化合物9:白色固体,m.p. 124~128 ℃ (文献值[18] 125~128 ℃);ESI-MS (m/z):153.04 [M+H]+,C8H8O3;其 1H NMR谱和 13C NMR谱数据与文献[18]报道一致,故该化合物鉴定为对羟基苯甲酸酯 (methyl 4-hydroxybenzoate)。
化合物10:白色固体,m.p. 185~188 ℃ (文献值[19] 186~188 ℃);ESI-MS (m/z):315.12 [M+H]+,分子式为C17H18N2O4;其 1H NMR谱和 13C NMR谱数据与文献[19]报道一致,故该化合物鉴定为4,4′-甲氧羰基氨基二苯甲烷 (4,4′-diphenylmethane-bis(methyl) carbamate)。
化合物11:黄色针晶,m.p. 180~182 ℃ (文献值[20] 180~181 ℃);ESI-MS (m/z):448.75 [M+H]+,C21H20O11;其 1H NMR谱和 13C NMR谱数据与文献[20]报道一致,故该化合物鉴定为槲皮苷 (quercitrin)。
化合物12:黄色粉末,m.p. 210~214 ℃ (文献值[21] 210~212 ℃);ESI-MS (m/z):432.75 [M+H]+,C21H20O10;其 1H NMR谱和 13C NMR谱数据与文献[21]报道一致,故该化合物鉴定为山柰酚-3-O-α-L-鼠李糖苷 (kaempferol-3-O-α-L-rhamnoside)。
化合物13:黄色粉末,m.p. 208~212 ℃ (文献值[22] 208~210 ℃);ESI-MS (m/z):667.85 [M+H]+,C30H33O17;其 1H NMR谱和 13C NMR谱数据与文献[22]报道一致,故该化合物鉴定为柯伊利素-7-O-2′-O-6′-O-乙酰基-β-D-吡喃葡萄糖基-β-D-吡喃葡萄糖苷 (chrysoeriol-7-O-2′-O-6′-O-acetyl-β-D-glucopyranosyl-β-D-glucopyranoside)。
|
图式1 化合物1~13的化学结构式 Scheme1 Chemical structure of compounds 1-13 |
2.3 化合物的抑菌活性
菌丝生长速率法测定结果表明:所分离化合物2~13对供试植物病原真菌无明显活性;而化合物1 (ciryneol D) 对多种真菌的菌丝生长表现出明显的抑制作用,其中对苹果腐烂病菌的抑制效果最好,EC50值约为23.2 μg/mL,见表2。
|
|
表 2 Ciryneol D对5种植物病原真菌菌丝生长的抑制作用 Table 2 Inhibitory effect of ciryneol D on the mycelial growth of five plant pathogenic fungi |
孢子萌发法测定结果表明,ciryneol D对玉米弯孢病原菌、苹果炭疽病原菌及番茄灰霉病原菌的孢子萌发具有较好的抑制作用,其EC50值分别为27.5、26.4和81.9 μg/mL (表3)。
|
|
表 3 Ciryneol D对3种植物病原真菌孢子萌发的抑制作用 Table 3 Inhibitory effect of ciryneol D on conidial germination of three plant pathogenic fungi |
3 结论与讨论
笔者对大蓟地上组织的化学成分进行了系统研究,从中分离得到13个化合物,并利用质谱和核磁共振氢谱和碳谱等波谱技术鉴定了其化学结构,其中2、3、6、8、10、12和13为首次从该植物中分离得到;证实长链炔醇类化合物ciryneol D (1) 为大蓟地上组织中的抑菌活性成分,这与文献[8]中报道的大蓟根中活性成分类似。鉴于大蓟茎叶生物量大、易于采集,且具有中药药用价值的主要是大蓟根,因此从综合利用的角度考虑,大蓟地上组织是一种植物源杀菌剂的潜在资源。
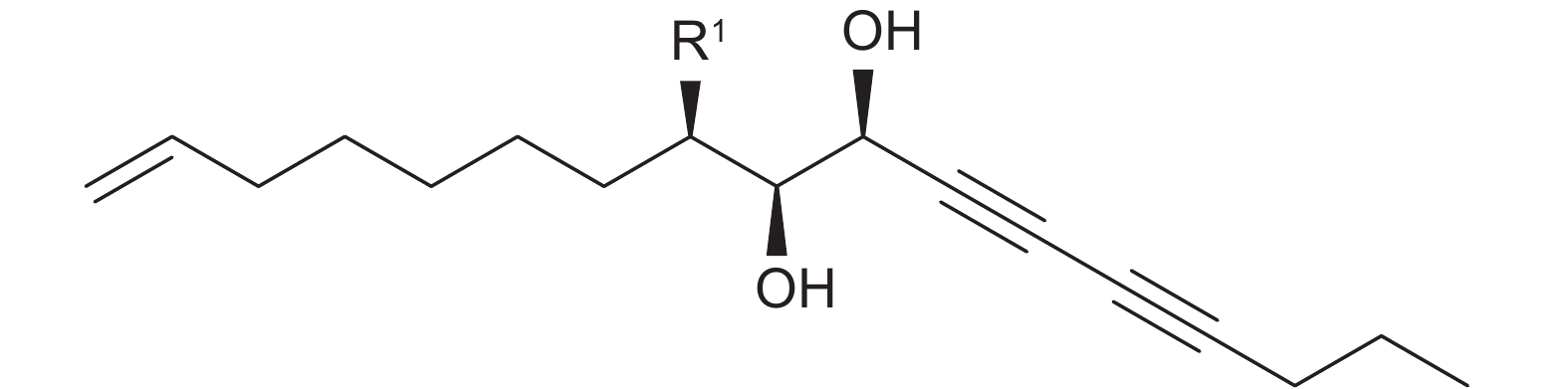
除了植物资源的直接利用外,天然产物的结构修饰也是新农药开发的重要途径[23]。大蓟中分离得到的长链炔醇类化合物其C8, C9, C10-位上均连有不同的取代基,如ciryneol A的C8-位为乙酰氧基,C9, C10-位为羟基;ciryneol C的C8-位为氯,C9, C10-位为羟基;ciryneol D的C8, C9-位为乙酰氧基,C10-位为羟基。本研究中仅分离得到1个活性化合物,不能进行构效关系分析,但从文献[8]中报道的长链炔醇类化合物抑菌活性数据可以看出,ciryneol A,ciryneol C和1-heptadecene-11, 13-diyne-8, 9, 10-triol (图式2) 表现出不同的抑菌活性,其中ciryneol C的抑菌活性最佳,说明C8-位上的羟基替换为氯原子对于抑菌活性是有利的。由此可以看出,以长链炔醇为先导化合物,通过在C8, C9, C10-位引入不同的取代基可望发现抑菌活性更为优异的化合物。
|
a. ciryneol A (R1=OAc); b. ciryneol C (R1=Cl); c. 1-heptadecene-11, 13-diyne-8, 9, 10-triol (R1=OH). 图式2 大蓟根中分离出的3个聚乙炔类化合物的化学结构式 Scheme2 Chemical structures of three polyacetylenes isolated from roots of Cirsium japonicum |
| [1] |
植飞, 孔令义, 彭司勋. 中药大蓟的化学及药理研究进展[J]. 中草药, 2001, 32(7): 664-667. ZHI F, KONG L Y, PENG S X. Progress in chemical and pharmacological studies on Cirsium japonicum [J]. Chin Tradit Herb Drugs, 2001, 32(7): 664-667. |
| [2] |
符玲, 龚千锋, 钟凌云. 大蓟的研究进展综述[J]. 江西中医药, 2003, 34(10): 42-43. FU L, GONG Q F, ZHONG L Y. Summary on recent studies of thistle[J]. Jiangxi J Tradit Chin Med, 2003, 34(10): 42-43. DOI:10.3969/j.issn.0411-9584.2003.10.037 |
| [3] |
陈泣, 龚先锋. 大蓟的化学成分综述[J]. 广州化工, 2013, 41(14): 1-2. CHEN Q, GONG X F. Summary of chemical compositions of Cirsium japonicum DC. [J]. Guangzhou Chem Ind, 2013, 41(14): 1-2. DOI:10.3969/j.issn.1001-9677.2013.14.001 |
| [4] |
BAEK N I, PARK J D, LEE Y H, et al. A novel polyacetylene from Cirsium spp.
[J]. Yakhak Hoeji, 1995, 39(3): 268-275. |
| [5] |
TAKAISHI Y, OKUYAMA T, MASUDA A, et al. Acetylenes from Cirsium japonicum
[J]. Phytochemistry, 1990, 29(12): 3849-3852. DOI:10.1016/0031-9422(90)85345-G |
| [6] |
LIM H, SON K H, CHANG H W, et al. Anti-inflammatory activity of pectolinarigenin and pectolinarin isolated from Cirsium chanroenicum
[J]. Biol Pharmaceut Bull, 2008, 31(11): 2063-2067. DOI:10.1248/bpb.31.2063 |
| [7] |
魏朝霞, 姚茹瑜, 唐嘉义. 大蓟提取物对植物病原真菌的抑菌活性成分研究[J]. 农药, 2013, 52(7): 529-532. WEI Z X, YAO R Y, TANG J Y. Anti-phytopathogenic fungi active constituent in extract from Cirsium japonicum DC. [J]. Agrochemicals, 2013, 52(7): 529-532. |
| [8] |
YOON M Y, CHOI G J, CHOI Y H, et al. Antifungal activity of polyacetylenes isolated from Cirsium japonicum roots against various phytopathogenic fungi
[J]. Ind Crops Prod, 2011, 34(1): 882-887. DOI:10.1016/j.indcrop.2011.02.013 |
| [9] |
侯颖, 徐建强, 宋宇州, 等. 三种杀菌剂对牡丹黑斑病菌菌丝生长及分生孢子萌发的影响[J]. 植物保护学报, 2014, 41(3): 367-372. HOU Y, XU J Q, SONG Y Z, et al. Effects of carbendazim, difenoconazole and azoxystrobin on mycelial growth and conidial germination of Alternaria suffruticosae [J]. Acta Phytophylacica Sinica, 2014, 41(3): 367-372. |
| [10] |
TAKAISHI Y, OKUYAMA T, NAKANO K, et al. Absolute configuration of a triolacetylene from Cirsium japonicum
[J]. Phytochemistry, 1991, 30(7): 2321-2324. DOI:10.1016/0031-9422(91)83640-7 |
| [11] |
谭钦刚, 赖春华, 张贵杰, 等. 苦楝化学成分及抗糖尿病活性研究[J]. 天然产物研究与开发, 2014, 26(2): 162-166. TAN Q G, LAI C H, ZHANG G J, et al. Chemical constituents from Melia azedarach and their anti-diabetes activities [J]. Nat Prod Res, 2014, 26(2): 162-166. |
| [12] |
杨大松, 李资磊, 魏建国, 等. 霸王鞭的化学成分研究[J]. 中草药, 2013, 44(15): 2039-2043. YANG D S, LI Z L, WEI J G, et al. Chemical constituents of Euphorbia royleana [J]. Chin Tradit Herb Drugs, 2013, 44(15): 2039-2043. |
| [13] |
薛慧清, 杨红澎, 汪汉卿, 等. 黄毛橐吾三萜类成分研究[J]. 中国中药杂志, 2008, 33(3): 272-275. XUE H Q, YANG H P, WANG H Q, et al. Study on triterpenes of Ligularia xanthotricha [J]. China J Chin Mater Med, 2008, 33(3): 272-275. |
| [14] |
何自伟, 吕长平, 吴王锁, 等. 葵花大蓟亲脂性化学成分研究[J]. 西北植物学报, 2007, 27(9): 1884-1887. HE Z W, LÜ Z P, WU W S, et al. Lipophilic chemical constituents from Cirsium souliei [J]. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(9): 1884-1887. |
| [15] |
王小雄. 菊科和木贼科三种药用植物化学成分及其生物活性[D]. 兰州: 兰州大学, 2006. WANG X X. Studies on the chemical constituents and bioactivities from three medicinal plants of compositae and equistaceae[D]. Lanzhou: Lanzhou University, 2006. |
| [16] |
植飞, 孔令义, 彭司勋. 大蓟化学成分的研究[J]. 药学学报, 2003, 38(6): 442-447. ZHI F, KONG L Y, PENG S X. Studies on the chemical constituents of Cirsium japonicum DC [J]. Acta Pharmaceutica Sinica, 2003, 38(6): 442-447. |
| [17] |
刘晓秋, 李维维, 华会明, 等. 拳参的化学成分研究[J]. 中草药, 2006, 37(10): 1476-1478. LIU X Q, LI W W, HUA H M, et al. Studies on the chemical constituents of Polygonum bistorta L.[J]. Chin Tradit Herb Drugs, 2006, 37(10): 1476-1478. DOI:10.3321/j.issn:0253-2670.2006.10.012 |
| [18] |
张雪, 宋启示. 锈毛千斤拔根的化学成分研究[J]. 中草药, 2009, 40(6): 865-868. ZHANG X, SONG Q S. Studies on the chemical constituents of Flemingia ferruginea Grah. ex Wall.[J]. Chin Tradit Herb Drugs, 2009, 40(6): 865-868. |
| [19] |
FENG L, XU Y H, WANG S S, et al. Preventative effects of 4,4′-diphenylmethane-bis(methyl) carbamate isolated from cortex mori on human umbilical vein endothelial cell dysfunction induced by advanced glycation end products[J]. Phytoth Res, 2012, 26(3): 412-419. |
| [20] |
张琳, 金媛媛, 田景奎. 田基黄的化学成分研究[J]. 中国药学杂志, 2007, 42(5): 341-344. ZHANG L, JIN Y Y, TIAN J K. Studies on chemical constituents of Hypericum japonicum [J]. Chin Pharmaceut J, 2007, 42(5): 341-344. |
| [21] |
倪付勇, 陈重, 许琼明, 等. 高山红景天化学成分研究[J]. 中草药, 2013, 44(7): 798-802. NI F Y, CHEN C, XU Q M, et al. Chemical constituents from Rhodiola sachalinensis [J]. Chin Tradit Herb Drugs, 2013, 44(7): 798-802. |
| [22] |
WEI D X, PING L L, ZHONG J J. A new flavone glycoside and other constituents from Carduus crispus
[J]. Pharmazie, 2005, 60(3): 233-236. |
| [23] |
郭宗儒. 天然产物的结构改造[J]. 药学学报, 2012, 47(2): 144-157. GUO Z R. Modification of natural products for drug discovery[J]. Acta Pharmaceutica Sinica, 2012, 47(2): 144-157. |
 2018, Vol. 20
2018, Vol. 20


