农药是重要的农业生产资料,在控制有害生物为害,保障农业生产安全等方面发挥着重要作用。常规的农药剂型如乳油、可湿性粉剂等由于不具备活性成分的控制释放能力,导致其有效成分在靶体或靶标附近环境中易被快速光解、水解或微生物代谢,因流失而导致药效降低。即使是用活性优良的农药成分加工的剂型,其有效利用率通常也只有10%~30%,流失率高达70%~90%[1],有时需反复多次喷施才能有效控制作物病虫草害,不仅提高农业生产成本,而且加剧了农药对农产品和环境的影响[2-5]。导致农药有效利用率低的原因很多,现有的常规农药剂型产品脱靶流失及使用技术落后是其中主要原因之一[1]。因此,对现有的优良农药品种进行剂型改良,发挥其控制释放作用,是降低农药流失率、提高利用率的有效途径。
目前常见的农药控释剂型如微囊、包结化合物等,由于其具有可明显提高对使用者和非靶标生物安全性,减少农药使用剂量,降低土壤淋溶和延长有效成分持效期等优点,已成为能有效减少化学农药残留、抗性和环境问题的理想农药剂型[6-7]。
环境响应性载体材料可以响应酶、氧化还原、pH值、光、温度、电场、磁场和离子强度等环境刺激的变化,实现有效成分的靶向控制释放,在药物控制释放方面显示出明显的优势,具有广阔的应用前景,目前已成为医药、食品和环境工程等领域研究的热点[8-12]。将环境响应性载体材料应用于农药领域,研究开发新型环境响应性农药控释剂,已逐渐成为新型农药制剂的重要发展方向。但目前尚未见将环境响应性载体材料应用于农药控释剂领域的相关综述报道,本文拟从环境响应性载体材料的种类及其在农药领域的研究应用进展进行综述,旨在突出环境响应性载体材料在农药控释剂领域的重要性和应用潜力。
1 环境响应性载体材料的种类环境响应性载体材料主要包括可对酶、pH值、氧化还原、光和温度等不同类型刺激作出响应的智能载体材料,在药物传递、分离纯化、临床诊断以及酶和细胞的固定化等领域应用中展现出了普通载体材料无法比拟的优越性,特别是在药物控释领域,已被认为是今后解决癌症等疑难杂症治疗的核心技术手段之一[13-15]。根据其刺激源不同,目前常见的环境响应性载体材料主要可分为以下几类。
1.1 酶响应性载体材料酶响应性载体材料包括酶响应性聚合体[16]、纳米粒子[17]和水凝胶[18]等,其研究与开发正越来越受到重视,目前在药物控释[19]、光学传感与成像[20]、生物催化[21]、组织工程[22]和临床诊断[23]等领域展示出了广阔的应用前景,尤其在医药领域已得到广泛应用,其通过利用与所患疾病相关的酶来控制药物的释放,是高效、高选择性的药物靶向控释策略,在癌症的药物治疗领域具有良好前景[24]。有害生物在对作物进行为害的过程中,同样存在多种相关联的酶,如纤维素酶[25]、果胶酶[26]和蛋白酶[27]等细胞壁降解酶,因此也可采用药物靶向控释策略,实现精准智能化控制有害生物的为害。
1.2 pH响应性载体材料pH响应性载体材料根据所含特定功能基团的不同,主要分为两类[28]:一类是酸性基团 (含有羧基、磺基等),其在碱性条件下可溶胀,如聚丙烯酸类水凝胶;另一类是碱性基团 (含有氨基等),其在酸性条件下能溶胀,如壳聚糖。近年来,pH响应性载体材料的应用已日益受到关注[29]。
1.3 氧化还原响应性载体材料氧化还原响应性载体材料可对生物体内氧化还原电位的差异作出响应,因而具有良好的生物相容性。通常含有二硫键 (S–S) 或其他具有多个氧化状态的物质 (如铁、硒和硫),其中最为常见的是含有二硫键,通过二硫键在生物体内还原型谷胱甘肽作用下发生断裂而具有氧化还原响应性。目前,氧化还原响应性载体材料也是国内外研究的热点[30]。
1.4 光响应性载体材料光响应性载体材料利用其光敏性高分子的感光现象,在吸收光能量后,通过所吸收的能量可使分子间或分子内产生物理变化 (如颜色、导电性和溶解度等) 或化学反应 (如光解、二聚、聚合和异构化等)。在高分子的主链或侧链引入光敏基团,设计制备光响应性载体材料是目前广泛应用的方法。在负载输运体系方面,光响应性载体材料显示出了使用方便、智能化和效率高等特点[31]。
1.5 温度响应性载体材料温度响应性载体材料由于能对温度刺激产生可逆的智能化响应而受到广泛关注[29]。在外界温度变化刺激下,温度响应性载体可产生相应的物理结构和化学性质变化[32]。其中较为特别的是,某些温敏聚合物水溶液在受热后其溶解度变化规律与一般物质截然相反:即当温度升至某一特定值后,聚合物溶解度反而会下降,甚至发生相分离而析出,这一特定温度被称为最低临界溶液温度 (lower critical solution temperature, LCST)[33]。具有这一性质的温敏聚合物有N-取代丙烯酰胺类聚合物、羟丙基甲基纤维素、羟丙基甲基丙烯酸甲酯、聚乙烯基甲基醚和聚乙烯醇等[34]。
2 环境响应性载体材料在农药领域应用及研究发展状况作物遭受有害生物为害时,在作物与有害生物相互作用的过程中,两者都不可避免地会伴随一系列环境刺激的变化,如酶、氧化还原、pH值、光和温度等。因此,将环境响应性载体材料应用于农药领域,研究开发新型环境响应性农药控释剂,有望成为新型农药制剂的重要发展方向,利用有害生物和作物相互作用产生的环境刺激变化调节控释载体的降解,从而智能、靶向地释放农药分子,可更有效防治有害生物。
2.1 酶响应性农药控释剂Ding等[35]以3-氨丙基三乙氧基硅烷 (APTES) 为交联剂,使春雷霉素 (kasugamycin) 的羧基和APTES的氨基键合,得到APTES改性的春雷霉素,然后通过APTES的硅氧基与正硅酸乙酯水解形成的二氧化硅相接,制备了春雷霉素二氧化硅纳米微球。该纳米微球能有效防止春雷霉素光解,在细菌侵染为害过程中产生的酰胺酶的作用下可触发而释放出春雷霉素,因而具有良好的酶刺激响应性能[35]。生物活性测定结果表明,所制备的纳米控释剂对大肠杆菌的抑菌活性比原药更好、更持久[35]。
Liu等[36]通过N-羟基琥珀酰亚胺与1-乙基-(3-二甲基氨基丙基) 碳酰二亚胺的催化作用,将春雷霉素的氨基和果胶的羧基直接键合,制备了春雷霉素-果胶控释剂。通过红外光谱、紫外光谱和热重分析手段对该控释剂进行结构表征,结果显示,所制备的控释剂在较宽范围内的pH值、温度和紫外照射条件下均稳定[36]。该控释剂可在假单胞菌分泌的果胶酶和酰胺酶作用下触发释放出春雷霉素,因而具有良好的酶刺激响应性能[36]。
Guo等[37]以正硅酸乙酯 (TEOS) 为硅源,采用乳液聚合法制备了甲氨基阿维菌素苯甲酸盐 (emamectin benzoate) 二氧化硅微囊,再经APTES改性得到氨基功能化的二氧化硅微囊,最后将氨基功能化的二氧化硅微囊与所合成的、经环氧氯丙烷改性的羧甲基纤维素 (EMC) 交联,制备得到新型酶响应性甲氨基阿维菌素苯甲酸盐微囊。该微囊具有较高的负载率,能有效保护甲氨基阿维菌素苯甲酸盐在光和热条件下的降解,在桃蚜刺吸为害过程中产生的纤维素酶 (cellulase) 作用下触发而释放出药物,显示出良好的酶刺激响应性能 (图1)[37]。生物测定表明,所制备微囊在相同浓度下对桃蚜的杀虫活性比乳油更好、更持久,而对洋葱的遗传毒性比原药低[37]。该研究提出了一种新颖、安全、可持续的作物保护策略,酶响应性控释剂的成功开发提供了一种既能有效控制农业害虫,又能降低对生态环境和人类健康危害风险的施药方法。
Kaziem等[38]通过乳液法制备了中空的介孔二氧化硅,将该介孔二氧化硅改性后负载氯虫苯甲酰胺 (chlorantraniliprole),再交联天然高分子α-环糊精以包封表面介孔,制备得到酶响应性氯虫苯甲酰胺控释剂。通过红外光谱、扫描电镜、透射电镜和热重分析对该控释剂进行表征,结果显示,该控释剂具有较高的负载率,能有效保护氯虫苯甲酰胺在光照和受热条件下的降解。该控释剂在咀嚼式口器昆虫唾液和中肠中α-淀粉酶的作用下触发而释放出药物,显示出良好的酶刺激响应性能[38]。生物活性测定结果表明,所制备的控释剂对小菜蛾的杀虫活性比悬浮剂更好、更持久[38]。
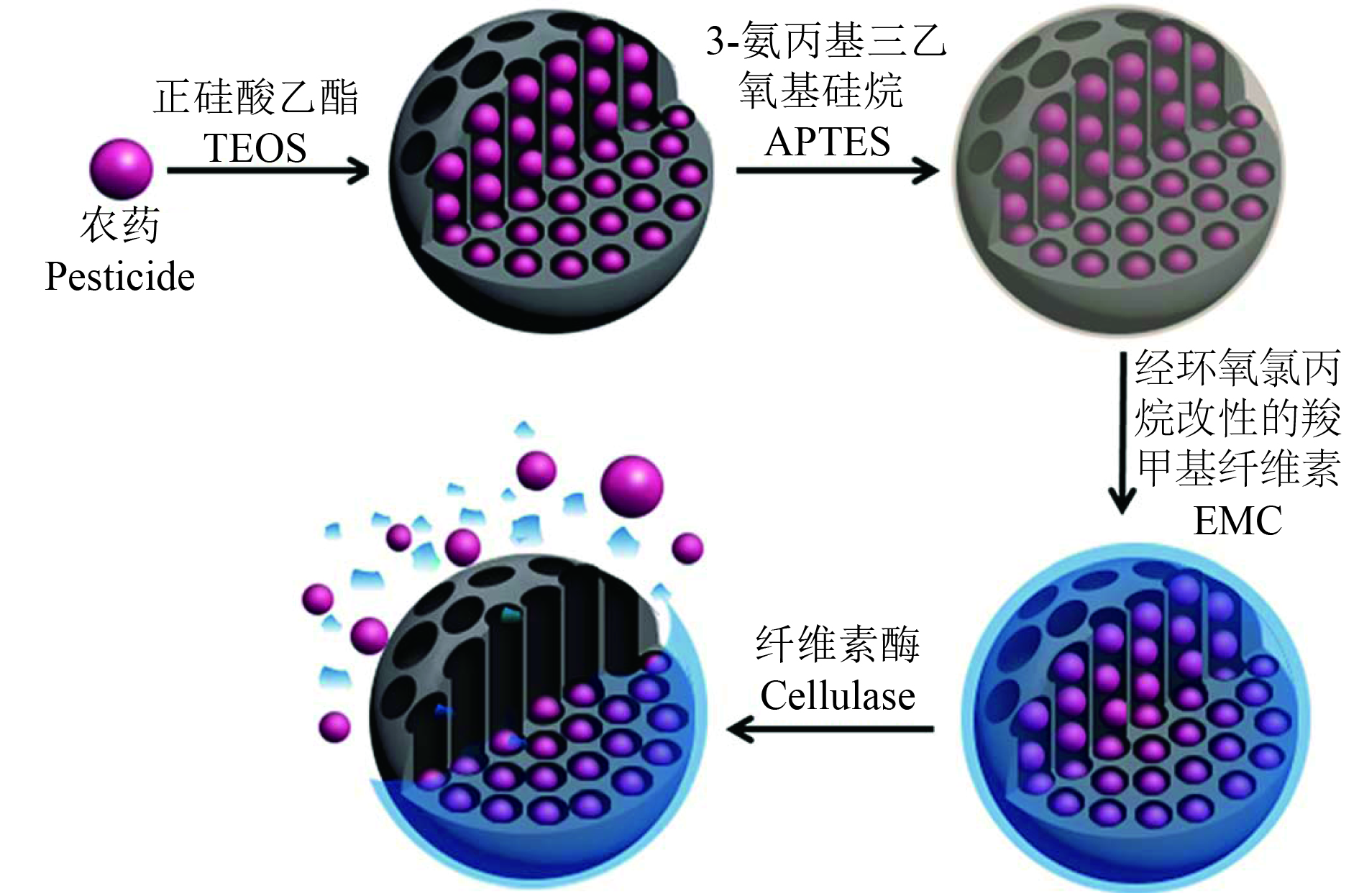
|
图 1 纤维素酶响应性甲氨基阿维菌素苯甲酸盐微囊形成机理与纤维素酶的触发释放[37] Fig. 1 The possible mechanism of the formation of the enzyme-responsive microcapsules and the triggered release by cellulase[37] |
2.2 pH响应性农药控释剂
Rudzinski等[39]以过氧化苯甲酰为引发剂、乙二醇二甲基丙烯酸酯为交联剂,采用本体和溶液聚合法制备了基于丙烯酸的共聚水凝胶,用以负载氯氰菊酯 (cypermethrin),制备得到pH响应性氯氰菊酯控释剂,采用红外光谱和差示扫描量热法对其进行表征,控释动力学考察结果表明,该控释剂具有良好的pH响应性能。该研究提供了pH响应性水凝胶在土壤中施用的新思路,即可利用土壤的碱性条件控制农药的释放。
Chen等[40]根据聚琥珀酰亚胺 (PSI) 在碱性条件下易水解为聚天冬氨酸 (PSAP),而植物韧皮部维管束pH值在8.0~8.5之间、高于周边植物组织的特性,为提高农药的运输传导性和利用率,设计制备了基于两亲性聚琥珀酰亚胺的星形聚合物纳米载体,用以负载萘乙酸 (naphthylacetic acid),通过透射电镜、动态光散射及红外光谱等手段进行表征,结果表明,该纳米控释剂在植物韧皮部的碱性条件下可快速释放出药物 (图2)。该研究表明,此类刺激响应性的、可生物降解的聚合物纳米载体,可进一步扩展用作为其他农药和肥料的控释输送系统,具有重要的潜在应用价值。
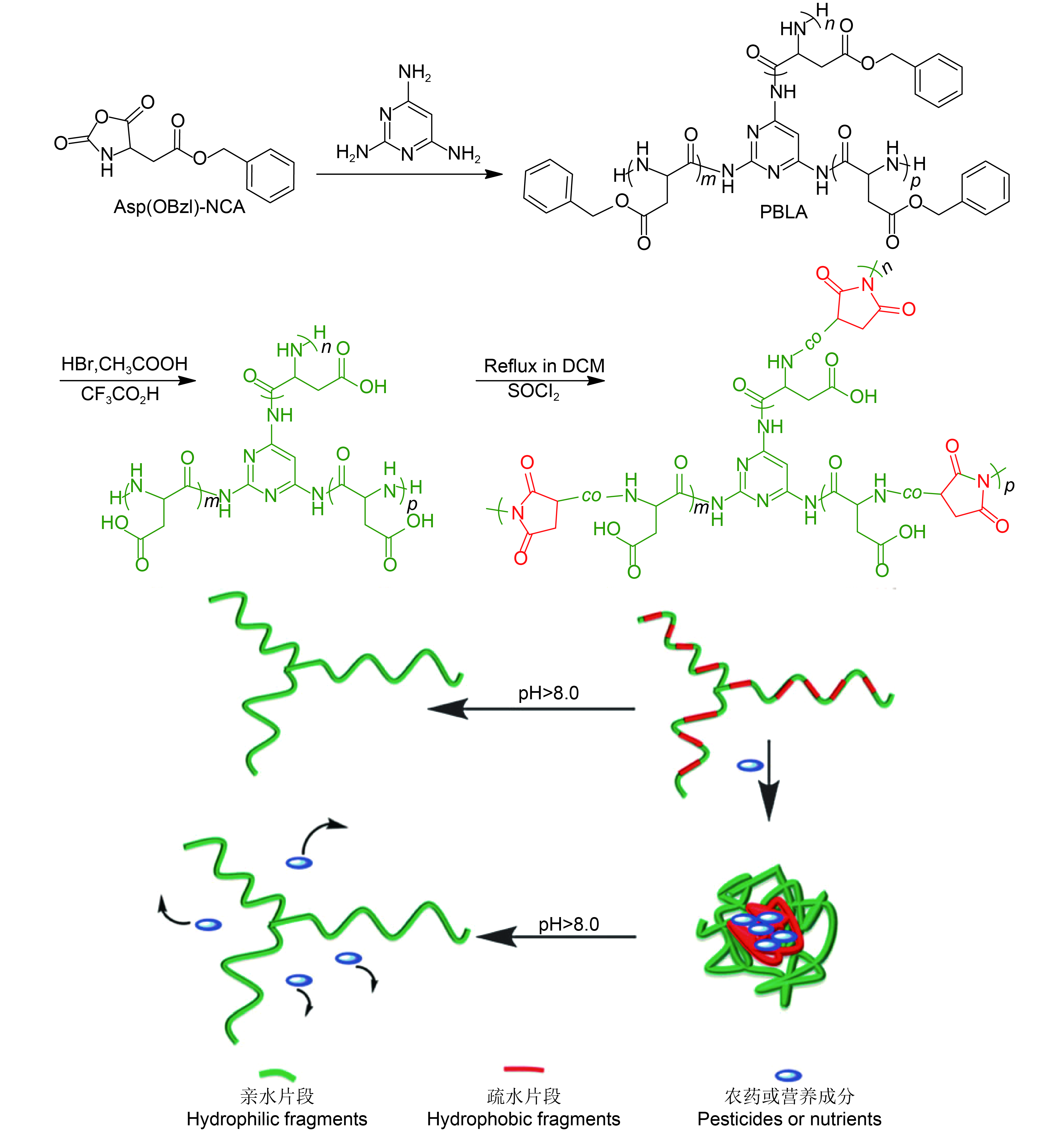
|
图 2 聚天冬氨酸-琥珀酰亚胺三臂星形共聚物的合成与pH响应性行为及其后续水解产物聚天冬氨酸[40] Fig. 2 Synthesis and pH-responsive behavior of three-arm starcopolymers of poly(aspartic acid-co-succinimide) and their subsequent hydrolysis to polyaspartate[40] |
Hill等[41]通过纳米沉淀法制备了基于聚琥珀酰亚胺的pH响应性纳米粒子,用以负载疏水性模式分子尼罗红。通过核磁共振、透射电镜及动态光散射等手段进行表征,结果表明,当pH值高于6时,聚琥珀酰亚胺纳米粒子中的疏水性琥珀酰亚胺基单元水解,释放出模式分子,且释放率随着pH值的升高而升高。此外,该聚合物材料对植物几乎没有毒性作用,所制备纳米粒子可用于负载农药、肥料等,并可根据土壤酸碱性变化而表现出不同的药物释放性能,是良好的潜在农用控释传递载体。
林粤顺等[42]通过共缩聚法制得氨基化介孔硅,用其负载毒死蜱 (chlorpyrifos),再以聚丙烯酸 (PAA) 为功能分子,通过静电吸附作用制备得到pH响应性的PAA/毒死蜱/氨基化介孔硅缓释体系。采用X射线衍射、氮气吸附-脱附、透射电镜、扫描电镜、热重分析、zeta电位和红外光谱对该体系进行表征,缓释动力学研究表明,该体系在pH ≤ 7时,pH值越低,毒死蜱释放越快,而在偏碱性条件下其释放比中性条件下稍快,表现出明显的pH响应性。
Xiang等[43]通过氢键和静电将毒死蜱吸附在纳米网状结构的聚多巴胺改性硅镁土中,再与海藻酸钙交联形成多孔的水凝胶球,制备得到pH响应性的毒死蜱控释剂。该控释剂可在碱性条件下释放出毒死蜱,表现出良好的pH响应性能,且能有效保护毒死蜱在紫外光条件下的降解,其聚多巴胺改性的硅镁土-海藻酸钙水凝胶载体材料对大肠杆菌和谷子Setaria italica具有很高的生物安全性,显示出良好的生物相容性[43]。
2.3 氧化还原响应性农药控释剂Yu等[44]将两亲性的羧甲基壳聚糖衍生物在水溶液中进行自组装,经超声处理生成二硫键,制备得到氧化还原响应性羧甲基壳聚糖纳米粒子,用以负载敌草隆 (diuron)。通过zeta电位及透射电镜等手段进行表征,结果表明,该氧化还原响应性敌草隆控释剂在植物组织中的还原型谷胱甘肽作用下触发而释放出敌草隆,对稗草Echinochloa crusgalli (L.) Beauv. 具有较好的除草活性,对作物安全。
Yi等[45]将硫代癸烷枝接至介孔二氧化硅纳米粒子外表面,制备得到功能化的氧化还原响应性介孔二氧化硅纳米粒子,用以负载水杨酸,并采用透射电镜、拉曼光谱及热重分析等手段进行表征。控释动力学研究表明,在含有谷胱甘肽的环境中,其水杨酸的释放速率显著高于不含谷胱甘肽的环境。活体试验显示,在植物细胞中谷胱甘肽的作用下,从控释剂中释放的水杨酸能诱导植物抗性基因PR-1持续性表达至处理后7 d,而对照水杨酸只能引起PR-1表达的早期高峰,处理后3 d即逐步下降。
郭明程[46]通过二硫键将二氧化硅微球与果胶交联,制备得到氧化还原响应性春雷霉素控释剂,发现该控释剂具有较高的负载率 (20%,质量分数),且能有效提高春雷霉素对光照和受热的稳定性,并可在白菜软腐病菌侵染为害过程中产生的谷胱甘肽作用下触发而释放出药物,显示出良好的氧化还原响应性能。与春雷霉素可湿性粉剂相比,该控释剂在相同浓度下的杀菌活性更好、更持久。洋葱染色体畸变试验表明,与原药相比,该控释剂对洋葱具有更低的遗传毒性[46]。
Sun等[47]合成了粒径20 nm、孔径2.87 nm的单分散介孔二氧化硅纳米粒子,并经改性,将脱落酸包覆在二氧化硅中孔内,再用硫代癸烷包封表面介孔,制备了氧化还原响应性脱落酸控释剂。体外释放动力学试验表明,在缺乏谷胱甘肽的触发作用时,该控释剂能有效负载和包封脱落酸[47]。活体试验表明,在谷胱甘肽的触发作用下,从该控释剂中释放的脱落酸可显著降低叶片气孔的开度,从而抑制植株的水分流失[47]。此外,与对照脱落酸相比,从该控释剂中释放的脱落酸明显延长了其诱导标记基因AtGALK2的表达时间,最终提高了拟南芥幼苗在干旱胁迫下的抗逆能力。
2.4 光响应性农药控释剂Atta等[48]制备了基于二萘嵌苯-3-联苯甲醇光敏有机荧光纳米粒子的光响应性2,4-D纳米控释剂,结果表明,该控释剂具有良好的荧光性、细胞吸收性和光刺激响应性能。利用光敏有机纳米粒子的荧光特性,可实时监测2,4-D在植株体内的释放与传导。生物测定试验表明,该纳米控释剂在植株体内的传导性、靶向性和除草活性显著提高。随后,Atta等[49]还以香豆素共聚物为基础,制备了光响应性2,4-D控释剂,结果表明,该控释剂的运输传导性、除草活性和热稳定性显著提高,并显示出良好的荧光性和光刺激响应性能,同时还可降低2,4-D的淋溶性。
Ye等[50]将羧甲基壳聚糖与光不稳定的2-硝基苄基侧基键合,在水溶液条件下自组装为聚合物胶束,然后逐滴加入二醛,形成交联结构,制备了光响应性壳交联胶束,用以负载敌草隆,得到了光响应性的敌草隆控释剂。采用透射电镜、核磁共振氢谱和动态光散射对其进行表征,结果表明,该交联胶束为核壳结构,平均直径为140 nm,在无光照、pH值7的水溶液条件下稳定[50]。该控释剂包封率达91.9%,黑暗条件下敌草隆不会释放,而在太阳光照射下,8 h后敌草隆释放率即可达96.8%[50]。该研究提供了光响应性聚合物胶束在农药控释中应用的新思路,即利用太阳光控释光合作用抑制剂类除草剂,可大大提高农药的利用率。
Ding等[51]将聚乙二醇与光不稳定的O-硝基苄基基团键合,再与2,4-D枝接,制备得到新型两亲性的聚合物-农药接合物,其在水溶液中自聚而形成光响应性胶束,从而实现了对2,4-D的控释。通过核磁共振氢谱和红外光谱确认了该接合物的结构,透射电镜观察显示该胶束为核壳结构,动态光散射和透射电镜测量表明,在365 nm紫外光照射后,胶束的平均直径减小了40 nm[51]。其在无光照条件下无2,4-D释放,而在太阳光照射下,8 h后2,4-D的累积释放率达99.6%[51]。
Xu等[52]将螺虫乙酯烯醇 (spirotetramat-enol) 与香豆素共价交联,制备得到光响应性的螺虫乙酯烯醇控释剂,并研究了该控释剂的光物理与光化学特性,以及其去保护光解和杀虫活性。发现该控释剂在420 nm蓝光或太阳光条件下可触发释放出螺虫乙酯烯醇,具有良好的光刺激响应性能[52]。生物测定结果表明,该控释剂在黑暗条件下对豆蚜无明显杀虫活性,而在光照条件下显示出良好的杀虫活性[52]。
2.5 温度响应性农药控释剂Sheng等[53]通过腙键键合制备了温度与pH双响应性的阿维菌素 (abamectin) 控释剂,结果表明,该控释剂具有较高的负载率 (97.4%,质量分数),并具有良好的温度与pH双刺激响应性能。
Xu等[54]以聚多巴胺 (PDA) 微球为光热剂,再包覆热敏的聚N-异丙基丙烯酰胺 (PNIPAm) 壳,制备了核壳结构的PDA@PNIPAm纳米复合材料,用以负载吡虫啉 (imidacloprid),并通过透射电镜、扫描电镜、红外光谱、动态光散射和热重分析等手段进行了表征,发现该控释剂具有较高的负载率和良好的温度响应性能。
Greene等[55]将有效成分包覆于温敏性聚合物微囊中,分别制备了温度响应性的二嗪磷 (diazinon)、氟乐灵 (trifluralin) 和甲草胺 (alachlor) 控释剂,并发现这些控释剂均可有效防止有效成分的降解,直到土壤温度或气温达到病虫草等有害生物最活跃的临界温度时,才按可预测的速率释放出药物。生物活性评价试验表明:相比常规剂型,二嗪磷控释剂延长了控制害虫的持效期;氟乐灵控释剂降低了对作物的药害,且省去了快速覆土的需求;甲草胺控释剂延长了防治杂草的持效期,并减少了甲草胺在土壤中的淋溶。
美国3M公司 (美国明尼苏达矿业及机器制造公司) 采用相分离法等工艺将药物包裹于温敏性脂质材料中,制得温度响应性农药控释剂,该控释剂在环境温度高于脂质材料熔点时释放出药物,而当温度下降后脂质材料变硬即停止药物释放[56]。
Chi等[57]以硅镁土-碳酸氢铵-草甘膦 (glyphosate) 混合物为核心,氨基硅油-聚乙烯醇为壳,制备了核壳结构的温度响应性草甘膦控释剂。由于硅镁土具有多孔的微纳米网状结构,可负载大量的草甘膦分子,而碳酸氢铵作为发泡剂,可产生二氧化碳和氨气气泡,从而在氨基硅油-聚乙烯醇壳上制造出大量微纳米孔,因而可促进草甘膦的释放;且温度变化可有效调节孔的数量,同时,聚乙烯醇壳在高温条件下易溶于水溶液中,所以草甘膦的释放易于控制[57]。该控释剂可有效减少草甘膦在模拟降雨条件下的损失,并提高对杂草的防效[57]。该研究为控制农药释放、减少有效成分损失提供了一种很有前景的方法,在提高农药利用率和降低环境污染方面具有潜在的应用价值。
3 问题与展望环境响应性载体材料制备工艺和组装技术日益成熟,且具有良好的智能响应性和生物相容性,非常适用于载药和智能控释领域。由于其在医药、食品和环境工程等众多领域均具有广阔的应用前景和潜在的应用价值,目前已成为研究的新热点。将环境响应性载体材料应用于医药领域制成药物转运系统 (drug deliver system,DDS) 的研究已非常广泛,但其在农药转运系统 (pesticide deliver system,PDS) 方面应用仍然有限。
近年来,虽然有关以环境响应性材料为载体的新型农药控释剂的研究日渐增多,开发此类环境响应性农药控释剂已成为新型农药制剂的重要发展方向。但目前对于环境响应性农药控释剂还需进行持续的系统研究,特别是在可有效响应内部生物刺激体系方面的研究还面临较大挑战。需将农药控释剂与有害生物为害过程中所产生的一系列内部生物刺激变化真正联系起来,才能设计制得精准、智能的农药转运系统,从而智能响应刺激的变化,只在“病灶”部位或组织触发后释放农药,精准靶向释药,确保有害生物得到最优控制,并减少农药对农产品与环境的负面影响。另外,目前对环境响应性农药控释剂的研究尚处于基础阶段,离商业化还有一定距离,仍受到许多因素,如制备环境响应性载体材料的成本、药物稳定性与生物活性、药物负载性能及药物控释稳定性等因素的制约。因此,要实现环境响应性农药控释剂的商业化与规模化应用,还需要进一步明确控释剂的理化性质、环境因子与生物效应之间的相互关系,深入研究开发及完善,只有解决好上述问题,才能更好地发挥环境响应性载体材料在农药控释领域的作用。
| [1] |
ZHAO X, CUI H X, WANG Y, et al. Development strategies and prospects of nano-based smart pesticide formulation[J/OL]. J Agric Food Chem, 2017 [2018-02-10]. https://doi.org/10.1021/acs.jafc.7b02004.
|
| [2] |
张一宾. 农药制剂技术的开发与最近动向[J]. 农药译丛, 1998, 20(3): 49-55. ZHANG Y B. Development and recent trend of pesticide formulation technology[J]. Translated Collection of Pesticide, 1998, 20(3): 49-55. |
| [3] |
冷阳. 我国农药制剂的动态及发展趋势[J]. 世界农药, 2010, 32(1): 19-21. LENG Y. Trends and development current of Chinese pesticide formulation[J]. World Pestic, 2010, 32(1): 19-21. |
| [4] |
华乃震. 农药微胶囊剂的加工和进展(Ⅰ)[J]. 现代农药, 2010, 9(3): 10-14. HUA N Z. Development and recent progress of pesticide microencapsulates (Ⅰ)[J]. Modern Agrochem, 2010, 9(3): 10-14. |
| [5] |
华乃震. 农药微胶囊剂的加工和进展(Ⅱ)[J]. 现代农药, 2010, 9(4): 6-10. HUA N Z. Development and recent progress of pesticide microencapsulates (Ⅱ)[J]. Modern Agrochem, 2010, 9(4): 6-10. |
| [6] |
BOEHM A L, MARTINON I, ZERROUK R, et al. Nanoprecipitation technique for the encapsulation of agrochemical active ingredients[J]. J Microencapsul, 2003, 20(4): 433-441. |
| [7] |
KNOWLES A. Recent developments of safer formulations of agrochemicals[J]. Environmentalist, 2008, 28(1): 35-44. |
| [8] |
MANATUNGA D C, DE SILVA R M, DE SILVA K M N, et al. pH responsive controlled release of anti-cancer hydrophobic drugs from sodium alginate and hydroxyapatite bi-coated iron oxide nanoparticles[J]. Eur J Pharm Biopharm, 2017, 117: 29-38. |
| [9] |
ZHANG C Y, PAN D Y, LI J, et al. Enzyme-responsive peptide dendrimer-gemcitabine conjugate as a controlled-release drug delivery vehicle with enhanced antitumor efficacy[J]. Acta Biomaterialia, 2017, 55: 153-162. |
| [10] |
ESWARAMMA S, RAO K S V K. Synthesis of dual responsive carbohydrate polymer based IPN microbeads for controlled release of anti-HIV drug[J]. Carbohydr Polym, 2017, 156: 125-134. |
| [11] |
SHAO L, HUA B, SUN J F, et al. A cucurbit[J]. Tetrahedron Lett, 2017, 58(19): 1863-1867. |
| [12] |
ZHOU Y J, JIE K C, HUANG F H. A redox-responsive selenium-containing pillar[J]. Chem Commun, 2017, 53(59): 8364-8367. |
| [13] |
SUKHORUKOV G, FERY A, MÖHWALD H. Intelligent micro-and nanocapsules[J]. Prog Polym Sci, 2005, 30(8-9): 885-897. |
| [14] |
ESSER-KAHN A P, ODOM S A, SOTTOS N R, et al. Triggered release from polymer capsules[J]. Macromolecules, 2011, 44(14): 5539-5553. |
| [15] |
KOST J, LANGER R. Responsive polymeric delivery systems[J]. Adv Drug Delivery Rev, 2012, 64(Suppl. 1): 327-341. |
| [16] |
WANG C, CHEN Q S, WANG Z Q, et al. An enzyme-responsive polymeric superamphiphile[J]. Angew Chem, 2010, 122(46): 8794-8797. |
| [17] |
NGUYEN M M, CARLINI A S, CHIEN M P, et al. Enzyme-responsive nanoparticles for targeted accumulation and prolonged retention in heart tissue after myocardial infarction[J]. Adv Mater, 2015, 27(37): 5547-5552. |
| [18] |
HU J M, ZHANG G Q, LIU S Y. Enzyme-responsive polymeric assemblies, nanoparticles and hydrogels[J]. Chem Soc Rev, 2012, 41(18): 5933-5949. |
| [19] |
LI X, BURGER S, O'CONNOR A J, et al. An enzyme-responsive controlled release system based on a dual-functional peptide[J]. Chem Commun, 2016, 52(29): 5112-5115. |
| [20] |
ZHA ZB, ZHANG S H, DENG Z J, et al. Enzyme-responsive copper sulphide nanoparticles for combined photoacoustic imaging, tumor-selective chemotherapy and photothermal therapy[J]. Chem Commun, 2013, 49(33): 3455-3457. |
| [21] |
TOKAREV I, GOPISHETTY V, ZHOU J, et al. Stimuli-responsive hydrogel membranes coupled with biocatalytic processes[J]. ACS Appl Mater Interfaces, 2009, 1(3): 532-536. |
| [22] |
TEIXEIRA L S M, FEIJEN J, VAN BLITTERSWIJK C A, et al. Enzyme-catalyzed crosslinkable hydrogels: emerging strategies for tissue engineering[J]. Biomaterials, 2012, 33(5): 1281-1290. |
| [23] |
DE LA RICA R, AILI D, STEVENS M M. Enzyme-responsive nanoparticles for drug release and diagnostics[J]. Adv Drug Delivery Rev, 2012, 64(11): 967-978. |
| [24] |
ANDRESEN T L, THOMPSON D H, KAASGAARD T. Enzyme-triggered nanomedicine: drug release strategies in cancer therapy (invited review)[J]. Mol Membr Biol, 2010, 27(7): 353-363. |
| [25] |
WATANABE H, TOKUDA G. Cellulolytic systems in insects[J]. Annu Rev Entomol, 2010, 55(1): 609-632. |
| [26] |
MAISURIA V B, PATEL V A, NERURKAR A S. Biochemical and thermal stabilization parameters of polygalacturonase from Erwinia carotovora subsp. carotovora BR1
[J]. J Microbiol Biotechnol, 2010, 20(7): 1077-1085. |
| [27] |
AGUSTÍ N, COHEN A C. Lygus hesperus and L. lineolaris (Hemiptera: Miridae), phytophages, zoophages, or omnivores: evidence of feeding adaptations suggested by the salivary and midgut digestive enzymes
[J]. J Entomol Sci, 2000, 35(2): 176-186. |
| [28] |
BAE Y, FUKUSHIMA S, HARADA A, et al. Design of environment-sensitive supramolecular assemblies for intracellular drug delivery: polymeric micelles that are responsive to intracellular pH change[J]. Angew Chem Int Ed Engl, 2003, 42(38): 4640-4643. DOI:10.1002/(ISSN)1521-3773 |
| [29] |
SCHMALJOHANN D. Thermo-and pH-responsive polymers in drug delivery[J]. Adv Drug Delivery Rev, 2006, 58(15): 1655-1670. |
| [30] |
ZHAO S, XU M M, CAO C W, et al. A redox-responsive strategy using mesoporous silica nanoparticles for co-delivery of siRNA and doxorubicin[J]. J Mater Chem B, 2017, 5(33): 6908-6919.
|
| [31] |
WANG D L, JIN Y, ZHU X Y, et al. Synthesis and applications of stimuli-responsive hyperbranched polymers[J]. Prog Polym Sci, 2017, 64: 114-153. |
| [32] |
BROMBERG L E, RON E S. Temperature-responsive gels and thermogelling polymer matrices for protein and peptide delivery[J]. Adv Drug Delivery Rev, 1998, 31(3): 197-221. |
| [33] |
CHUNG J E, YOKOYAMA M, YAMATO M, et al. Thermo-responsive drug delivery from polymeric micelles constructed using block copolymers of poly (N-isopropylacrylamide) and poly(butylmethacrylate)
[J]. J Controlled Release, 1999, 62(1/2): 115-127. |
| [34] |
GANTA S, DEVALAPALLY H, SHAHIWALA A, et al. A review of stimuli-responsive nanocarriers for drug and gene delivery[J]. J Controlled Release, 2008, 126(3): 187-204. |
| [35] |
DING G L, LI D G, LIU Y, et al. Preparation and characterization of kasuga-silica-conjugated nanospheres for sustained antimicrobial activity[J]. J Nanopart Res, 2014, 16: 2671. |
| [36] |
LIU Y, SUN Y, DING G L, et al. Synthesis, characterization, and application of microbe-triggered controlled-release kasugamycin-pectin conjugate[J]. J Agric Food Chem, 2015, 63(17): 4263-4268. |
| [37] |
GUO M C, ZHANG W B, DING G L, et al. Preparation and characterization of enzyme-responsive emamectin benzoate microcapsules based on a copolymer matrix of silica-epichlorohydrin-carboxymethylcellulose[J]. RSC Adv, 2015, 5(113): 93170-93179. |
| [38] |
KAZIEM A E, GAO Y H, HE S, et al. Synthesis and insecticidal activity of enzyme-triggered functionalized hollow mesoporous silica for controlled release[J]. J Agric Food Chem, 2017, 65(36): 7854-7864. DOI:10.1021/acs.jafc.7b02560 |
| [39] |
RUDZINSKI W E, CHIPUK T, DAVE A M, et al. pH-sensitive acrylic-based copolymeric hydrogels for the controlled release of a pesticide and a micronutrient[J]. J Appl Polym Sci, 2003, 87(3): 394-403. DOI:10.1002/(ISSN)1097-4628 |
| [40] |
CHEN M S, JENSEN S P, HILL M R, et al. Synthesis of amphiphilic polysuccinimide star copolymers for responsive delivery in plants[J]. Chem Commun, 2015, 51(47): 9694-9697. DOI:10.1039/C5CC02726H |
| [41] |
HILL M R, MACKRELL E J, FORSTHOEFEL C P, et al. Biodegradable and pH-responsive nanoparticles designed for site-specific delivery in agriculture[J]. Biomacromolecules, 2015, 16(4): 1276-1282. DOI:10.1021/acs.biomac.5b00069 |
| [42] |
林粤顺, 周红军, 周新华, 等. pH 响应性 PAA/毒死蜱/氨基化介孔硅缓释体系的制备与性能[J]. 化工学报, 2016, 67(10): 4500-4507. LIN Y S, ZHOU H J, ZHOU X H, et al. Preparation and properties of pH-responsive control release system of PAA/chlorpyrifos/amino functionalized mesoporous silica[J]. CIESC J, 2016, 67(10): 4500-4507. |
| [43] |
XIANG Y B, ZHANG G L, CHEN C W, et al. Fabrication of a pH-responsively controlled-release pesticide using an attapulgite-based hydrogel[J]. ACS Sustainable Chem Eng, 2018, 6(1): 1192-1201. DOI:10.1021/acssuschemeng.7b03469 |
| [44] |
YU Z Y, SUN X, SONG H X, et al. Glutathione-responsive carboxymethyl chitosan nanoparticles for controlled release of herbicides[J]. Mater Sci Appl, 2015, 6(6): 591-604. |
| [45] |
YI Z F, HUSSAIN H I, FENG C F, et al. Functionalized mesoporous silica nanoparticles with redox-responsive short-chain gatekeepers for agrochemical delivery[J]. ACS Appl Mater Interfaces, 2015, 7(18): 9937-9946. DOI:10.1021/acsami.5b02131 |
| [46] |
郭明程. 环境响应性农药控释剂的制备及生物效应研究[D]. 北京: 中国农业大学, 2016: 39-51. GUO M C. Preparation and biological efficacy evaluation of stimuli-responsive controlled release formulation of pesticide[D]. Beijing: China Agricultural University, 2016: 39-51. |
| [47] |
SUN D Q, HUSSAIN H I, YI Z F, et al. Delivery of abscisic acid to plants using glutathione responsive mesoporous silica nanoparticles[J]. J Nanosci Nanotechnol, 2018, 18(3): 1615-1625. DOI:10.1166/jnn.2018.14262 |
| [48] |
ATTA S, BERA M, CHATTOPADHYAY T, et al. Nano-pesticide formulation based on fluorescent organic photoresponsive nanoparticles: for controlled release of 2,4-D and real time monitoring of morphological changes induced by 2,4-D in plant systems[J]. RSC Adv, 2015, 5(106): 86990-86996. DOI:10.1039/C5RA17121K |
| [49] |
ATTA S, PAUL A, BANERJEE R, et al. Photoresponsive polymers based on a coumarin moiety for the controlled release of pesticide 2,4-D[J]. RSC Adv, 2015, 5(121): 99968-99975. DOI:10.1039/C5RA18944F |
| [50] |
YE Z, GUO J J, WU D W, et al. Photo-responsive shell cross-linked micelles based on carboxymethyl chitosan and their application in controlled release of pesticide[J]. Carbohydr Polym, 2015, 132: 520-528. DOI:10.1016/j.carbpol.2015.06.077 |
| [51] |
DING K K, SHI L Y, ZHANG L, et al. Synthesis of photoresponsive polymeric propesticide micelles based on PEG for the controlled release of a herbicide[J]. Polym Chem, 2016, 7(4): 899-904. DOI:10.1039/C5PY01690H |
| [52] |
XU Z P, GAO Z H, SHAO X S. Light-triggered release of insecticidally active spirotetramat-enol[J/OL]. Chin Chem Lett, 2018 [2018-02-10]. https://doi.org/10.1016/j.cclet.2018.01.025.
|
| [53] |
SHENG W B, MA S H, LI W, et al. A facile route to fabricate a biodegradable hydrogel for controlled pesticide release[J]. RSC Adv, 2015, 5(18): 13867-13870. DOI:10.1039/C4RA15139A |
| [54] |
XU X H, BAI B, WANG H L, et al. A near-infrared and temperature-responsive pesticide release platform through core-shell polydopamine@ PNIPAm nanocomposites[J]. ACS Appl Mater Interfaces, 2017, 9(7): 6424-6432. DOI:10.1021/acsami.6b15393 |
| [55] |
GREENE L C, MEYERS P A, SPRINGER J T, et al. Biological evaluation of pesticides released from temperature-responsive microcapsules[J]. J Agric Food Chem, 1992, 40(11): 2274-2278. DOI:10.1021/jf00023a044 |
| [56] |
THIES C, LOUIS S. Pest controlling: US 7192603[P]. 2007-03-20.
|
| [57] |
CHI Y, ZHANG G L, XIANG Y B, et al. Fabrication of a temperature-controlled-release herbicide using a nanocomposite[J]. ACS Sustainable Chem Eng, 2017, 5(6): 4969-4975. DOI:10.1021/acssuschemeng.7b00348 |
 2018, Vol. 20
2018, Vol. 20


