2. 陕西省生物农药工程技术研究中心,陕西 杨凌 712100
2. Shaanxi Research Center of Biopesticide Technology, Yangling 712100, Shaanxi Province, China
雷公藤Tripterygium wilfordii Hook.f.是卫矛科 (Celastraceae) 雷公藤属木质藤本植物,是中国传统中药材,其提取物中二萜、三萜和生物碱类物质具有一定的医药活性[1-4]。目前已报道的雷公藤的主要活性成分为雷公藤甲素 (triptolide)、雷公藤吉碱 (wilforgine) 和雷公藤次碱 (wilforine)[5],其结构式见图式 1。雷公藤甲素,又名雷公藤内酯醇,属于环氧二萜类化合物,对东方粘虫幼虫Mythimna separate有很好的杀虫活性[6]。雷公藤吉碱和次碱均为倍半萜吡啶类生物碱,吉碱对欧洲玉米螟Ostrinia nubilalis初孵幼虫有杀虫活性[7],次碱对菜青虫Pieris rapae 和东亚飞蝗 Locusta migratoria有拒食活性[8]。目前,已发表的雷公藤主要活性物质分析方法有薄层色谱法 (TLC)[9]、毛细管色谱法 (capillary chromatography)[10]、紫外分光光度法[11]、气相色谱法 (GC)[12]及高效液相色谱法 (HPLC)[13-14]等,其中,薄层色谱法需要使用Kedde试剂进行显色反应,因试剂显色不稳定,导致试验结果重现性较差;气相色谱法检测雷公藤甲素时,需要对其进行衍生化后才能检测;液相色谱-紫外检测法检测时容易受到其他杂质干扰,影响测定结果。

|
图式1 雷公藤甲素 (a)、雷公藤吉碱 (b) 和雷公藤次碱 (c) 的结构式 Scheme1 Structural formula of triptolide (a), wilforgine (b) and wilforine (c) |
高效液相色谱-电喷雾串联质谱法 (HPLC-ESI-MS/MS) 是天然产物分析中最有效的分析技术之一[15]。通过质谱及质谱联用对目标化合物进行不同的碎片扫描,可有效识别混合物中的目标化合物,显著提高信噪比[16]。鉴于此,本研究建立了高效液相色谱-电喷雾串联质谱法检测雷公藤甲素、雷公藤吉碱和次碱3种主要活性物质的检测方法,并比较了雷公藤根皮粉、茎粉、叶粉及不定根、发状根组织培养产物中3种物质的含量差异。
1 材料与方法 1.1 仪器、药剂及供试菌株LTQ XL液相色谱-质谱联用仪 (Thermo Scientific, Waltham, MA, USA),配备自动进样器、四元梯度质谱泵,LTQ离子阱质谱带电喷雾电离源,Xcalibur 2.1系统控制软件;KQ-2200型超声波清洗器 (昆山市超声仪器有限公司);Milli-Q纯水系统 (法国Millipore公司);OASIS HLB (60 mg/3 mL) 固相萃取小柱 (Waters公司);Supelclean LC-Si (500 mg/3 mL) 固相萃取小柱 (北京康林公司)。
Murashige and Skoog (MS) 培养基、2,4-二氯苯氧乙酸 (2,4-D)、激动素 (KT) 和萘乙酸 (NAA),均购自Solarbio公司。流动相甲醇、乙腈均为色谱纯,其他有机溶剂均为分析纯。试验用水均来自Milli-Q纯水系统。雷公藤甲素、吉碱和次碱标准品,纯度均为98%,均购自中国药品生物制品检定所。
供试菌株发根农杆菌A4由西北农林科技大学无公害农药研究服务中心提供;ATCC15834购自American Type Culture Collection。
1.2 供试雷公藤采样及处理雷公藤根皮、茎和叶:雷公藤采自福建省泰宁地区,扦插至陕西省咸阳市杨凌区无公害农药研究服务中心教学实习基地院内。整株植物分成根皮、茎及叶共3部分,经60 ℃烘干,粉碎,过孔径0.30 mm筛,用聚乙烯膜袋分装,置于4 ℃冰箱中保存,备用。
不定根培养:取雷公藤基地扦插的雷公藤幼根作为外植体,参照文献[17-18]方法进行愈伤组织诱导,以MS为基本培养基,其中添加1.0 mg/L的2,4-D和0.5 mg/L激动素 (KT),将雷公藤幼根在25 ℃ ± 1 ℃下培养 (16 h光照/8 h黑暗),每隔30 d继代培养一次,连续转接3次后形成愈伤组织。转移愈伤组织至MS培养基,其中添加4.0 mg/L NAA和0.5 mg/L KT,于25 ℃ ± 1 ℃下黑暗培养,每30 d继代培养一次。继代5~6代后,收集不定根作为供试材料。
发状根培养:经发根农杆菌A4和ATCC15834在MS和1/2 MS培养基上对雷公藤愈伤组织侵染得到发状根[19]。
1.3 试验方法 1.3.1 标准溶液的配制及标准曲线绘制分别准确称取雷公藤甲素、吉碱和次碱标准品适量,用甲醇溶解并定容至5 mL,分别得到100 mg/L标准品母液。根据试验需要,再用甲醇将其稀释成1、10、30、50、75和100 mg/L的系列标准溶液,备用。分别以各标准溶液进样质量浓度为横坐标、峰面积为纵坐标绘制标准曲线。
1.3.2 提取方法 1.3.2.1 回流提取参考文献[20]方法进行。称取粉碎后的雷公藤植株样品各1 g,加入20 mL V (甲醇) : V (乙腈) = 1:1混合溶液中,加热回流2 h后冷却,称其质量后用上述混合溶液补足减失的质量;过滤,将滤液旋转蒸发至近干。加入3 mL水使其溶解,上样至Supelclean LC-Si (500 mg/3 mL) 固相萃取小柱,用10 mL V (二氯甲烷) : V (甲醇) = 10:1溶液洗脱,洗脱液经氮气吹干后用甲醇定容至5 mL,过0.22 μm滤膜,待分析。
1.3.2.2 超声提取在Brinker等[13]的方法基础上进行一定修改。称取粉碎的雷公藤植株样品1 g,用9 mL乙醇超声提取3次。合并提取液,旋转蒸发至近干。加入3 mL V (二氯甲烷) : V (甲醇) = 49:1溶液超声提取10 min,过分别用3 mL甲醇及3 mL水预洗的OASIS HLB (60 mg/3 mL) 固相萃取柱,用10 mL V (二氯甲烷) : V (甲醇) = 49:1溶液洗脱,洗脱液经氮气吹干后用甲醇定容至1 mL,过0.22 μm滤膜,待分析。
1.3.3 检测方法色谱条件:Hypersil Gold C18色谱柱 (100 mm × 2.1 mm,5 μm);ZORBAX SB-C18 色谱柱 (250 mm × 4.6 mm,5 μm)。流动相A为水,流动相B为乙腈;梯度洗脱程序为:0~20 min,5%~75% (B);20~30 min,75%~75% (B);30~35 min,75%~5% (B);35~45 min,5%~5% (B)。柱温25 ℃,流速1 mL/min,上样体积20 μL。
质谱条件:电离方式为ESI+;干燥气 (N2) 流速25 L/min;辅助气 (N2) 流速0.75 L/min;离子传输管温度300 ℃;离子传输管电压7 V;电离电压4.5 kV;扫描范围,m/z 100~1 000;扫描方式为一级质谱全扫描加数据依赖的二级质谱扫描。雷公藤甲素、吉碱和次碱的质谱测定参数见表1。
|
|
表 1 雷公藤甲素、雷公藤吉碱和次碱的质谱测定参数 Table 1 MS parameters for the analysis of triptolide, wilforgine and wilforine |
1.4 添加回收试验
在雷公藤植株样品中添加雷公藤甲素、雷公藤吉碱和次碱混合标准溶液,进行添加回收试验。添加水平分别为0.01、0.5和2 mg/kg,每个水平重复5次。计算添加回收率和相对标准偏差。
2 结果与分析 2.1 固相萃取小柱及洗脱液的选择雷公藤化学成分复杂,且活性物质含量很低,因此,提取时需要进行富集。文献报道采用中性氧化铝柱、硅胶柱、佛罗里硅土柱、硅藻土吸附柱及固相萃取小柱等[21-23]。本研究比较了OASIS HLB固相萃取小柱和Supelclean LC-Si固相萃取小柱的富集和净化效果,结果发现:OASIS HLB固相萃取小柱有较好的富集和分离纯化效果。通过对洗脱方法进行优化,发现用10 mL V (二氯甲烷) : V (甲醇) = 49:1溶液可将目标化合物完全洗脱。
2.2 色谱柱的选择本研究选用了两种色谱柱进行色谱峰分离效果比较。结果表明:Hypersil Gold C18柱的分离效果不理想,待测物2和3没有得到有效分离 (图1-a);而采用ZORBAX SB-C18柱,3种待测物均得到较好的分离 (图1-b)。

|
1.雷公藤甲素 (triptolide);2. 雷公藤吉碱 (wilforgine);3. 雷公藤次碱 (wilforine) a. Hypersil Gold C18色谱柱 (100 μg/mL); b. ZORBAX SB-C18色谱柱 (100 μg/mL)a. Hypersil Gold C18 column (100 μg/mL); b. ZORBAX SB-C18 column (100 μg/mL) 图 1 雷公藤中3种活性物质在两种不同色谱柱下的分离效果比较 Fig. 1 Comparison of the separation effect of three active substances in Tripterygium wilfordiiusing two different columns |
2.3 质谱定性检测条件的选择
由图2可知,雷公藤甲素、吉碱和次碱的定性离子[M+H]+分别为361,858和868。经过调整以及对喷雾电压、气体流速、碰撞能量等参数进行优化后,在阳离子模式下,3种待测物均有良好的灵敏度及稳定的二级质谱裂解行为,其质谱断裂方式也存在共性,二级质谱碎片中易产生脱CH3COOH (m/z 60)、CO2 (m/z 44)、CO (m/z 28)、HCOOH (m/z 46) 和H2O (m/z 18) 等中性碎片离子;在雷公藤甲素的二级质谱中,能检测到由母离子 (m/z 361) 脱去1分子H2O后形成的碎片离子 [M+H–H2O]+ (m/z 343),碎片离子会继续丢失1分子H2O后形成碎片离子[M+H–2H2O]+ (m/z 325);母离子 (m/z 361) 脱去1分子H2O及2分子CO后形成碎片离子[M+H–H2O–2CO]+ (m/z 287),m/z 287继续失去H2O、CH2CHCH3及HCHO,形成碎片离子[M+H–2H2O–2CO–CH2CHCH3–HCHO]+ (m/z 197)(见图2-Ib);在雷公藤吉碱的二级质谱中,能检测到由母离子 (m/z 858) 脱去1分子呋喃甲酸 (FuOH) 后形成的碎片离子[M+H–FuOH]+ (m/z 746),碎片离子会继续丢失1分子或多分子CH3COOH而形成碎片离子m/z 686, 626和566 (见图2-IIb);在雷公藤次碱的二级质谱中,能检测到由母离子 (m/z 868) 脱去1分子苯甲酸 (BzOH) 所形成的碎片离子[M+H–BzOH]+ (m/z 746 ) (见图2-IIIb)。
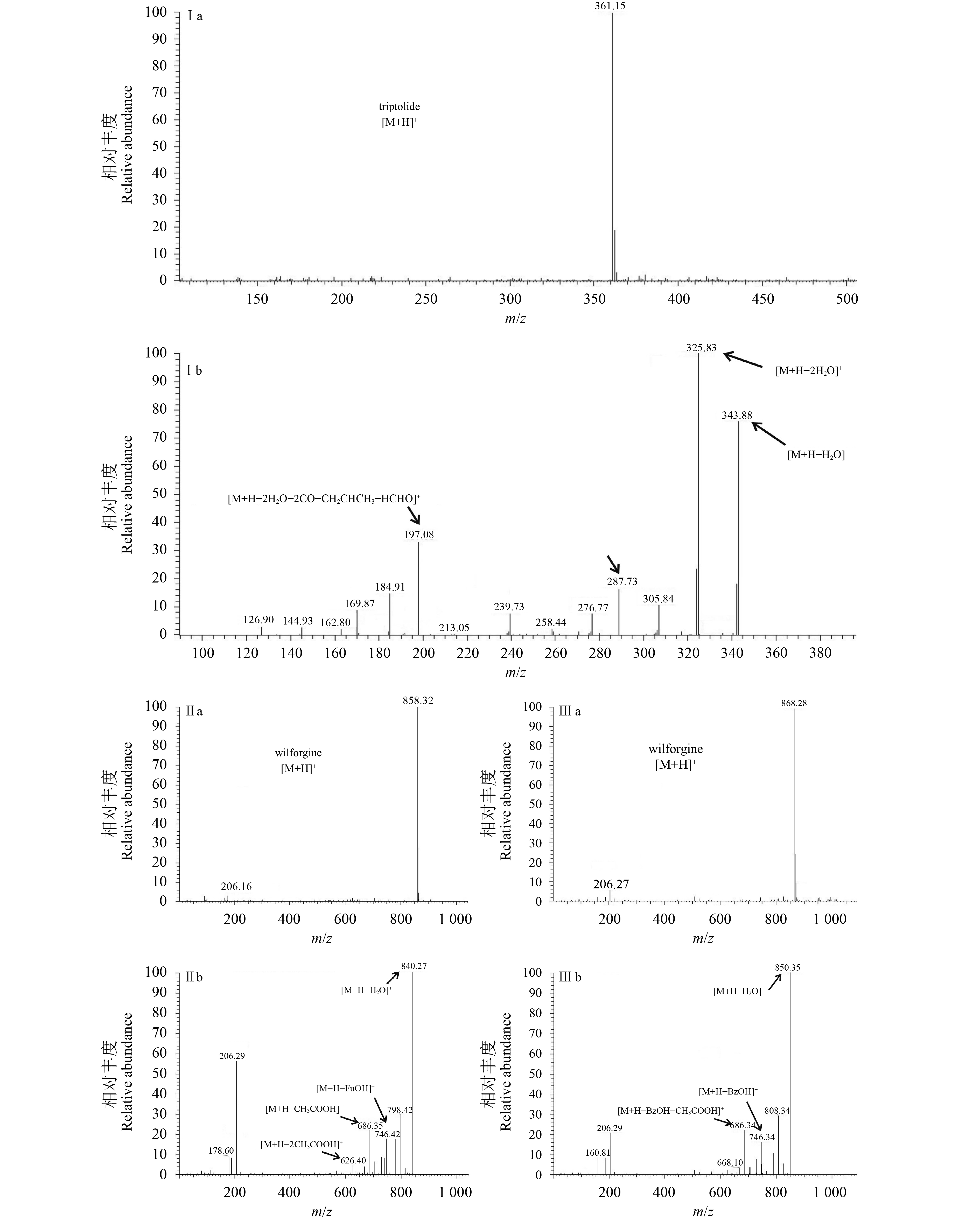
|
a. 一级质谱图 (MS spectrum);b. 二级质谱图 (MS/MS spectrum) I. 雷公藤甲素 (triptolide);II. 雷公藤吉碱 (wilforgine);III. 雷公藤次碱 (wilforine) 图 2 雷公藤甲素、雷公藤吉碱和次碱的一级、二级质谱图 Fig. 2 MS and MS/MS spectra of triptolide, wilforgine and wilforine |
2.4 方法学验证 2.4.1 标准曲线的绘制与检出限
结果 (表2) 表明:在1~100 mg/L范围内,雷公藤甲素、雷公藤吉碱和次碱的响应值与其质量浓度间线性关系良好,相关系数均大于0.995 6。以信噪比S/N ≥ 3计算各化合物的检出限 (LOD) 为0.08~0.12 mg/L。
|
|
表 2 雷公藤甲素、雷公藤吉碱和次碱的标准曲线及检出限 Table 2 Regression equation and LOD of triptolide, wilforgine and wilforine |
2.4.2 精密度
在所确定的色谱条件下,分别将10 mg/L的雷公藤甲素、雷公藤吉碱和次碱标准溶液连续进样检测3次,计算相对标准偏差 (RSD) 分别为0.103 2%、0.095 8%和0.107 5%,表明试验方法精密度高。
2.4.3 添加回收试验结果结果 (表3) 表明:在0.01、0.5和2 mg/kg 3个添加水平下,雷公藤甲素、雷公藤吉碱和次碱的添加回收率在81%~109%之间,RSD在0.4%~1.8%之间,表明本方法具有良好的准确率。
|
|
表 3 3种待测物在雷公藤植株中的添加回收率及相对标准偏差 (n = 5) Table 3 Recoveries and relative standard deviation (RSDS) of three analytes in T. wilfordii plant (n = 5) |
2.5 样品测定
采用两种不同的提取方法测定了雷公藤不同药用部位 (根、茎和叶) 以及雷公藤根不同培养方式的组培产物 (不定根和发状根) 中雷公藤甲素、雷公藤吉碱和次碱的含量。结果 (表4) 表明,不同药用部位以及不同组培产物中所含成分存在显著差异。其中,雷公藤甲素含量最高的是不定根,为43.05 μg/g,发状根中含35.97 μg/g,根皮中含量10.17 μg/g,叶中含量很少;发状根和根皮中的雷公藤吉碱含量分别为1 054.03 和1 027.46 μg/g;雷公藤次碱含量最高的是发状根,为221.79 μg/g,根皮中含204.81 μg/g,叶中未检测出。
|
|
表 4 采用不同提取方法测定的雷公藤甲素、雷公藤吉碱和次碱在不同样品中的含量 Table 4 The determined contents of triptolide, wilforgine and wilforine in different samples using different extraction method |
3 讨论
张洁等[11]建立了雷公藤多苷片和不同产地药材中总生物碱含量的检测方法,但提取时间长,步骤较为繁琐,其中使用的氧化铝柱层析虽然可以减少杂质对总生物碱含量测定的干扰,但分离效率及重现性较差;Brinker等[13]建立了雷公藤根茎中雷公藤甲素的高效液相色谱-紫外检测器分析方法,但易受到雷公藤提取物中其他杂质的干扰,影响结果的准确性。
本研究建立的HPLC-ESI-MS/MS可准确地对雷公藤主成分进行定性、定量分析,提取步骤简单,且质谱仪有较高的灵敏度,其具有离子提取功能,可以通过选择性离子扫描,对含有多种成分的复杂样品的母离子及相应的子离子同时进行检测,从而实现对每一种成分准确定性及定量。该方法具有通用性良好、灵敏度高、准确性好等特点,可以准确、快速地对雷公藤提取物及其产品进行质量监控。
雷公藤植株不同组织部位及不同组织培养体系中目标成分主要活性成分含量差异较大。本研究分析比较了雷公藤植株不同组织部位及不同组织培养中雷公藤甲素、吉碱和次碱的含量差异。结果显示:雷公藤甲素含量最高的是不定根,发状根和根皮次之,茎、叶中含量很少;雷公藤次碱含量最高的是发状根,其次是根皮,叶中未检测出;发状根和根皮中的雷公藤吉碱含量相当。这些研究结果对选用雷公藤各组织部位作为植物源农药原料及具体提取工艺有一定的指导意义。
| [1] |
QIU D M, KAO P N. Immunosuppressive and anti-inflammatory mechanisms of triptolide, the principal active diterpenoid from the Chinese medicinal herb Tripterygium wilfordii Hook. f.
[J]. Drugs R D, 2003, 4(1): 1-18. DOI:10.2165/00126839-200304010-00001 |
| [2] |
BRINKER A M, MA J, LIPSKY P E, et al. Medicinal chemistry and pharmacology of genus Tripterygium (Celastraceae)
[J]. Phytochemistry, 2007, 68(6): 732-766. DOI:10.1016/j.phytochem.2006.11.029 |
| [3] |
TAO X L, LIPSKY P E. The Chinese anti-inflammatory and immunosuppressive herbal remedy Tripterygium wilfordii Hook f
[J]. Rheum Dis Clin North Am, 2000, 26(1): 29-50. DOI:10.1016/S0889-857X(05)70118-6 |
| [4] |
SETTY A R, SIGAL L H. Herbal medications commonly used in the practice of rheumatology: mechanisms of action, efficacy, and side effects[J]. Semin Arthritis Rheum, 2005, 34(6): 773-784. DOI:10.1016/j.semarthrit.2005.01.011 |
| [5] |
ZHEN Q S, YE X, WEI Z J. Recent progress in research on Tripterygium: a male antifertility plant
[J]. Contraception, 1995, 51(2): 121-129. DOI:10.1016/0010-7824(94)00018-R |
| [6] |
LUO D Q, ZHANG Q, TIAN X, et al. Insecticidal compounds from Tripterygium wilfordii active against Mythimna separate
[J]. Z Naturforsch C, 2014, 59(5-6): 421-426. |
| [7] |
BEROZA M. Alkaloids from Tripterygium wilfordii Hook: wilforgine and wilfortrine
[J]. J Am Chem Soc, 1952, 74(6): 1585-1588. DOI:10.1021/ja01126a071 |
| [8] |
MONACHE F D, BETTOLO G B M, BERNAYS E A. Isolation of insect antifeedant alkaloids from Maytenus rigida (Celastraceae)
[J]. J Appl Entomol, 1984, 97(1-5): 406-414. |
| [9] |
马廷升, 刘志华, 兰金贵. 薄层扫描法测定雷公藤口服液中总内脂的含量[J]. 怀化学院学报, 2002, 21(2): 55-56. MANG T S, LIU Z H, LAN J G. Determination of total triptolide Tripterygium oral preparation by TLC scanning [J]. Journal of Huaihua University, 2002, 21(2): 55-56. |
| [10] |
SONG X R, YANG G L, ZHAO J X, et al. Determination of diterpenoid triepoxides in Tripterygium wilfordii by micellar electrokinetic capillary chromatography
[J]. Phytochem Anal, 2003, 14(3): 132-136. DOI:10.1002/(ISSN)1099-1565 |
| [11] |
张洁, 段宏泉. 紫外分光光度法测定雷公藤多苷片和不同产地药材中总生物碱的含量[J]. 天津医科大学学报, 2009, 15(3): 354-356. ZHANG J, DUAN H Q. Determination of total alkaloids in leigongtengduogan pian and Tripterygium wilfordii from different regions by ultraviolet spectrophotometry [J]. Journal of Tianjin Medical University, 2009, 15(3): 354-356. |
| [12] |
ZHANG L, ZHANG Z X, SHENG L S, et al. The determination of triptolide from Tripterygium hypoglaucum and T. wilfordii by high resolution gas chromatography
[J]. Phytochem Anal, 1993, 4(3): 105-108. DOI:10.1002/(ISSN)1099-1565 |
| [13] |
BRINKER A M, RASKIN I. Determination of triptolide in root extracts of Tripterygium wilfordii by solid-phase extraction and reverse-phase high-performance liquid chromatography
[J]. J Chromatogr A, 2005, 1070(1-2): 65-70. DOI:10.1016/j.chroma.2005.02.083 |
| [14] |
LI K, WANG S D. Fingerprint chromatogram analysis of extracts from the leaves of Tripterygium wilfordii Hook. f. by high performance liquid chromatography
[J]. J Sep Sci, 2005, 28(7): 653-657. DOI:10.1002/(ISSN)1615-9314 |
| [15] |
STOBIECKI M, SKIRYCZ A, KERHOAS L, et al. Profiling of phenolic glycosidic conjugates in leaves of Arabidopsis thaliana using LC/MS
[J]. Metabolomics, 2006, 2(4): 197-219. |
| [16] |
LEE M S, KERNS E H. LC/MS applications in drug development[J]. Mass Spectrom Rev, 1999, 18(3-4): 187-279. DOI:10.1002/(ISSN)1098-2787 |
| [17] |
李琰, 冯俊涛, 王永宏, 等. 雷公藤愈伤组织诱导及杀虫活性研究[J]. 西北农林科技大学学报(自然科学版), 2008, 36(5): 103-108. LI Y, FENG J T, WANG Y H, et al. Study on callus induction and insecticidal activities of Tripterygium wilfordii Hook. f. [J]. J Northwest A & F Univ: Nat Sci Ed, 2008, 36(5): 103-108. |
| [18] |
李琰, 冯俊涛, 史晓燕, 等. 雷公藤组培产物中雷公藤甲素和总生物碱含量的测定[J]. 农药学学报, 2009, 11(3): 367-372. LI Y, FENG J T, SHI X Y, et al. Study on the determination of triptolide and total alkaloids in Tripterygium wilfordii Hook. f. cultures [J]. Chin J Pestic Sci, 2009, 11(3): 367-372. |
| [19] |
MIAO G P, ZHU C S, YANG Y Q, et al. Elicitation and in situ adsorption enhanced secondary metabolites production of Tripterygium wilfordii Hook. f. adventitious root fragment liquid cultures in shake flask and a modified bubble column bioreactor
[J]. Bioprocess Biosyst Eng, 2014, 37(4): 641-650. DOI:10.1007/s00449-013-1033-0 |
| [20] |
张茹萍, 何昱, 石森林, 等. 雷公藤药材中6种有效成分以及总二萜内酯、总生物碱、总三萜的含量测定[J]. 中华中医药杂志, 2013, 28(1): 224-229. ZHANG R P, HE Y, SHI S L, et al. Determination of six effective components, total diterpenoids, total alkaloids and total triterpenes in Tripterygium wilfordii Hook. f. [J]. China J Tradit Chin Med Pharm, 2013, 28(1): 224-229. |
| [21] |
CAI M Q, CHEN X H, HE S W, et al. Determination of four pyridine alkaloids from Tripterygium wilfordii Hook. f. in human plasma by high-performance liquid chromatography coupled with mass spectrometry
[J]. J Chromatogr B, 2011, 879(30): 3516-3522. DOI:10.1016/j.jchromb.2011.09.034 |
| [22] |
LONG Z, WANG C R, GUO Z M, et al. A non-aqueous solid phase extraction method for alkaloid enrichment and its application in the determination of hyoscyamine and scopolamine[J]. Analyst, 2012, 137(6): 1451-1457. DOI:10.1039/c2an15824h |
| [23] |
DUAN H Q, TAKAISHI Y, JIA Y, et al. Sesquiterpene alkaloids from extracts of Tripterygium wilfordii
[J]. Chem Pharm Bull, 1999, 47(11): 1664-1667. DOI:10.1248/cpb.47.1664 |
 2018, Vol. 20
2018, Vol. 20


