2. 河南省粮食科学研究所有限公司,郑州 450008
2. Henan Institute of Food Science Co. Ltd, Zhengzhou 450008, China
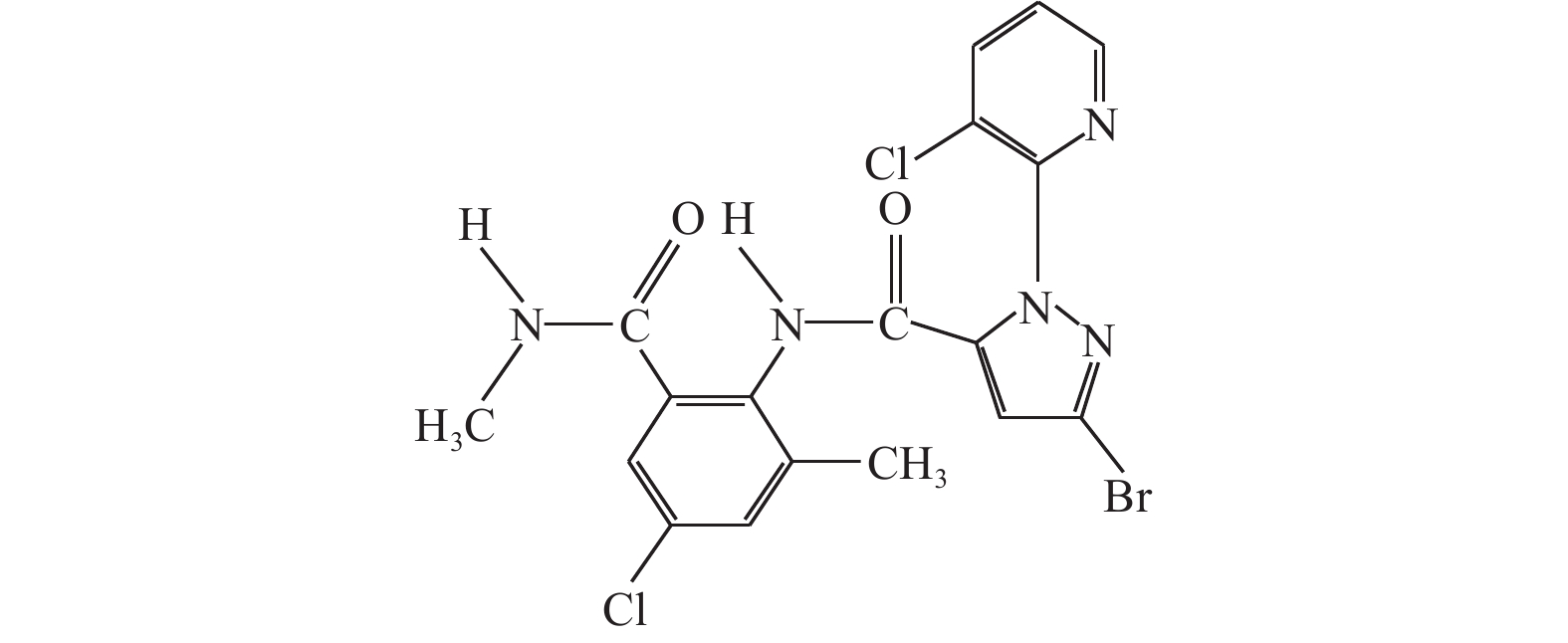
氯虫苯甲酰胺 (chlorantraniliprole,图式 1) 是由美国杜邦公司于2000年开发的第一个具有新型邻酰胺基苯甲酰胺类化学结构的广谱杀虫剂,具有高效、低毒、广谱、环境友好等特性,对危害大豆、水稻、棉花、玉米、果蔬等多种作物上的鳞翅目害虫和部分其他害虫具有较好的防治效果[1-5]。氯虫苯甲酰胺能高效激活昆虫鱼尼丁 (肌肉) 受体,释放平滑肌和横纹肌细胞内贮存的钙,引起肌肉调节衰弱、麻痹,直至害虫死亡[5]。
|
图式1 氯虫苯甲酰胺的化学结构式 Scheme1 Structural formula of chlorantraniliprole |
随着氯虫苯甲酰胺使用量及使用范围的扩大,其在作物中的残留以及对人类健康和环境造成的危害也越来越为人们所关注。鉴于此,欧盟已制定其在主要谷物和油料作物中的最大残留限量 (MRL),规定其在稻米、小麦、玉米和大豆中的MRL值分别为0.4、0.02、0.02和0.05 mg/kg;国际食品法典委员会 (CAC) 规定其在其他谷物中的MRL值为0.02 mg/kg。由于中国目前已制定的残留检测方法标准 (国标和行准) 中均未涉及氯虫苯甲酰胺在主要谷物和油料作物中的检测,因此,GB 2763—2016中已制定的氯虫苯甲酰胺的MRL值均为临时限量。中国国家标准中规定:糙米、麦类、旱粮类 (玉米除外)、玉米中的临时限量分别为0.5、0.02、0.02和0.02 mg/kg[6]。因此,尽快建立氯虫苯甲酰胺在主要谷物和油料作物中残留的检测方法成为目前亟待解决的问题。
目前,关于氯虫苯甲酰胺残留的分析方法主要有高效液相色谱法 (HPLC)[7-9]、液相色谱-质谱法 (LC-MS)[10-13]等,主要涉及到的作物样品有水果、蔬菜、稻米和土壤等,未见氯虫苯甲酰胺在小麦样品中残留的分析方法报道。在已报道文献中,常用的前处理净化方法有液-液萃取、固相萃取和基质固相分散萃取技术 (QuEChERS)。目前,采用同一种前处理方法测定主要谷物和油料作物中氯虫苯甲酰胺残留量的研究尚未见报道。基于此,本研究采用高效液相色谱-串联质谱 (HPLC-MS/MS) 法,结合QuEChERS净化技术建立了一种同时测定主要谷物和油料作物产品中氯虫苯甲酰胺残留量的分析方法。
1 材料与方法 1.1 仪器与试剂TSQ QUANTUM液相色谱-质谱联用仪 (美国Thermo公司);6202型粉碎机 (北京锟捷玉诚机械设备有限公司);L-550高速离心机 (湖南湘仪仪器有限公司);TARGIN VX-III多管涡旋振荡器 (北京踏锦科技有限公司);BSA224S电子天平 (精度0.1 mg,德国Sartorius公司);Milli-O A10超纯水系统 (美国Millipore公司)。
糙米、小麦、玉米和大豆均为试验田空白样品。
氯虫苯甲酰胺 (chlorantraniliprole) 标准品 (99.5%,德国Dr. Ehrenstorfer GmbH公司)。乙腈 (色谱纯,美国Fisher公司);甲酸 (色谱纯,德国CNW公司);氯化钠、无水硫酸镁 (分析纯,天津德恩化工有限公司);N-丙基乙二胺 (PSA)、石墨化碳黑 (GCB,38~75 μm)、C18和酸性氧化铝 (天津博纳艾杰尔科技有限公司)。
1.2 样品前处理称取已粉碎好的糙米、小麦、玉米和大豆样品各10 g (精确至0.01 g) 于100 mL离心管中,加入15 mL饱和氯化钠溶液,涡旋1 min;加入20 mL乙腈,涡旋提取20 min,于5 000 r/min下离心5 min;取4 mL上层提取液,放入装有100 mg PSA、20 mg GCB和300 mg MgSO4的10 mL离心管中,涡旋混匀1 min;取上清液2 mL,过0.22 μm针孔滤膜,待HPLC-MS/MS分析。
1.3 检测条件色谱条件:Agilent Poroshell 120 SB-C18色谱柱 (3.0 mm × 75 mm,2.7 μm);柱温30 ℃;样品室温度10 ℃;进样量10 μL;流动相为0.1%甲酸溶液 + 乙腈,洗脱梯度见表1;流速0.25 mL/min。在此条件下氯虫苯甲酰胺的保留时间为2.1 min。
|
|
表 1 梯度洗脱比例 Table 1 Gradient elution program |
质谱条件:电喷雾正离子源 (ESI+) 多反应监测模式 (MRM);电喷雾电压4 000 V;离子传输管温度 350 ℃;鞘气流速9.8 L/min,辅助气流速 1.4 L/min。在此条件下,氯虫苯甲酰胺定性离子对 (m/z) 484 > 452.9及484 > 285.9,定量离子对 ( m/z) 484 > 452.9;碰撞能量分别为20 eV和25 eV。
1.4 标准溶液配制及标准曲线绘制准确称取0.025 g (精确至0.000 1 g) 氯虫苯甲酰胺标准品,用乙腈溶解并准确定容至25 mL,配制成1 000 mg/L的氯虫苯甲酰胺标准储备液,于4 ℃避光保存。用乙腈将标准储备液逐级稀释成0.5、0.1、0.05、0.01和0.005 mg/L的系列标准工作溶液。
称取空白样品10 g,按1.2节样品前处理步骤制得各自的空白样品基质。取质量浓度为0.005、0.01、0.05、0.1和0.5 mg/L氯虫苯甲酰胺的标准工作溶液各1mL,用氮气吹至近干,准确加入空白样品基质1 mL,即得系列质量浓度的基质匹配标准溶液。外标法定量。按1.3节条件进行测定,以MS/MS定量离子色谱峰面积 (y) 对进样质量浓度 (x) 绘制标准曲线。
1.5 添加回收试验用本试验田空白样品进行基质添加回收试验。在空白样品中添加氯虫苯甲酰胺标准溶液,添加水平分别为0.02、0.05、0.1和0.5 mg/kg,每个水平重复5次。按照所建立的前处理和检测方法进行测定,计算平均回收率和相对标准偏差 (RSD)。
2 结果与讨论 2.1 提取溶剂的选择氯虫苯甲酰胺易溶于有机溶剂,本研究以小麦为分析样品,比较了乙腈、丙酮、乙酸乙酯和甲醇对样品萃取率的影响。结果表明:4种有机溶剂提取回收率均在75%以上,但以丙酮和乙酸乙酯为提取溶剂时,杂质干扰严重,容易对仪器造成污染;以甲醇为提取溶剂时虽然有较高的回收率,但不易与水分层,提取液浓缩过程繁琐;而乙腈对油脂和色素类杂质溶解度小,通过加入氯化钠经盐析作用后可与水分层,回收率稳定,因此本研究最终选用乙腈作为提取溶剂。
2.2 净化方法的选择本研究以富含油脂、淀粉和糖分的玉米为分析样品,在添加0.05 mg/kg的氯虫苯甲酰胺条件下,比较了PSA、C18、酸性氧化铝和GCB等4种常用吸附剂对样品的净化效果。结果发现:使氯虫苯甲酰胺的回收率从低到高的吸附剂依次为C18 < 酸性氧化铝 < GCB < PSA。进一步比较了使用不同用量PSA (0、25、50、100、150和200 mg) 和GCB (0、5、15、20、25和30 mg) 时的基质效应和回收率。正交试验结果表明:在PSA 100 mg、GCB 20 mg条件下,氯虫苯甲酰胺的基质效应较小,同时回收率较高。在提取上清液中加入300 mg MgSO 4,不影响氯虫苯甲酰胺的回收率。因此本研究最终选择PSA 100 mg、GCB 20 mg和MgSO4 300 mg作为吸附剂来净化样品。
2.3 质谱条件优化氯虫苯甲酰胺具有酰胺基团,在酸性条件下易被质子化,同时由于ESI源易于操作和维护,故本研究选择ESI源进行分析。将1.0 mg/L氯虫苯甲酰胺标准溶液采用流动注射直接进样,在正离子电离模式下,氯虫苯甲酰胺具有良好的电离效果,并获得稳定的准分子离子峰,[M + H]+为m/z 484;进一步对子离子、碎裂电压、碰撞能量等参数进行优化,得到碎片离子,选择相对丰度较高的离子对确定为定性、定量离子对。结果表明:氯虫苯甲酰胺定性离子对 (m/z) 484 > 452.9及484 > 285.9,定量离子对 ( m/z) 484 > 452.9;碰撞能量分别为20 eV和25 eV。
2.4 色谱条件优化采用电喷雾正离子模式 (ESI+) 分析样品时,在流动相中加入微量的甲酸可提高目标化合物离子化所需的H+。故本研究采用0.1%甲酸+乙腈作为流动相,提高了检测的灵敏度,并对流动相的比例和洗脱梯度进行优化。结果见表1。氯虫苯甲酰胺标准品的MRM色谱图见图1。

|
图 1 0.01 mg/L氯虫苯甲酰胺标准品的MRM色谱图 Fig. 1 MRM chromatograms of 0.01 mg/L chlorantraniliprole standards |
2.5 方法的线性范围、基质效应和检出限 (LOD)
基质标准曲线与溶剂标准曲线斜率的比值可以反映基质效应的强弱[14],基质效应=基质匹配标准曲线斜率/纯溶剂标准曲线斜率,若斜率比接近1,则表明基质效应较小[15]。结果显示:糙米、小麦、玉米和大豆样品基质中氯虫苯甲酰胺的基质效应结果分别为1.18、0.98、1.20和1.17,均具有一定的基质效应。故为保证方法的灵敏度和选择性,本研究采用同等基质配制的标准溶液进行定量分析。
结果 (表2) 表明:在0.005~0.5 mg/L范围内,氯虫苯甲酰胺的质量浓度与对应的峰面积间有良好的线性关系,R2均大于0.999。该方法中氯虫苯甲酰胺的LOD (S/N = 3) 为0.001 mg/L。
|
|
表 2 氯虫苯甲酰胺的线性关系、决定系数、基质效应和检出限 Table 2 Linear relationships, determination coefficients (R2), matrix effects and LODs of chlorantraniliprole |
2.6 方法的准确度和最低检测浓度 (LOQ)
结果 (表3) 表明:在0.02、0.05、0.1和0.5 mg/kg添加水平下,氯虫苯甲酰胺在糙米中的回收率为93%~114%,相对标准偏差 (RSD) 为1.3%~3.5% (n = 5);小麦中的回收率为92%~103%,RSD为2.6%~11% (n = 5);玉米中的回收率为89%~110%,RSD为3.1%~5.4% (n = 5);大豆中的回收率为91%~104%,RSD为3.7%~5.2% (n = 5)。方法的准确度符合农药残留分析要求[16]。
由最低添加水平得到氯虫苯甲酰胺在糙米、小麦、玉米和大豆中的最低检测浓度 (LOQ) 均为0.02 mg/kg。典型色谱图见图2。
|
|
表 3 不同基质中氯虫苯甲酰胺的添加回收率和相对标准偏差 (n = 5) Table 3 Average recoveries and relative standard deviations (RSDs) of chlorantraniliprole in different matrix (n = 5) |

|
图 2 糙米空白样品 (A1、A2) 与糙米样品添加0.02 mg/kg (B1、B2) 的MRM色谱图 Fig. 2 MRM chromatograms of blank brown rice (A1, A2) and 0.02 mg/kg of chlorantraniliprole in brown rice (B1, B2) |
2.7 实际样品的测定
为验证该方法在实际样品中的检测能力,采用上述方法对市场抽取和田间采集的糙米、小麦、玉米和大豆样品各10个批次进行测定,均未检出氯虫苯甲酰胺残留。
3 结论本研究通过对样品前处理方法和色谱-质谱条件的筛选和优化,建立了主要谷物和油料作物产品 (糙米、小麦、玉米和大豆) 中氯虫苯甲酰胺残留量的QuEChERS-高效液相色谱-串联质谱检测方法。样品用乙腈-水提取后进行QuEChERS净化,电喷雾正离子多反应监测模式HPLC-MS/MS检测,外标法定量。氯虫苯甲酰胺的检出限 (LOD) 为0.001 mg/L,4种样品基质中的最低检测浓度 (LOQ) 均为0.02 mg/kg;在0.02、0.05、0.1和0.5 mg/kg添加水平下,氯虫苯甲酰胺在4种基质中的回收率在89%~114%之间,相对标准偏差 (RSD) 在1.3%~11% (n = 5) 之间。该方法简单快速、准确、灵敏度高、实用性强,符合残留检测的相关要求,适用于主要谷物和油料作物产品中氯虫苯甲酰胺残留量的快速检测。
| [1] | United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances (7505P). Chlorantraniliprole[R]. Pesticide Fact Sheet, 2008. |
| [2] |
张绍明, 吴永芳, 奚本贵. 氯虫苯甲酰胺(康宽TM200SC)和茚虫威(凯恩TM150EC)防治水稻稻纵卷叶螟田间试验示范报告[M]//任璐, 李永平, 梁桂梅. 氯虫苯甲酰胺和茚虫威应用技术手册. 北京: 中国农业科学技术出版社, 2009: 47-51.
ZHANG S M, WU Y F, XI B G. The report of combating rice leafroller by chlorantraniliprole (TM200SC) and Indoxacarb (TM150EC) in field trials[M]// REN L, LI Y P, LIANG G M. Technical manual about the application of chlorantraniliprole and Indoxacarb. Beijing: China Agricultural Science and Technology Press, 2009: 47-51. |
| [3] | SAGLAM O, ATHANASSIOU C G, VASSILAKOS T N. Comparison of spinetoram, imidacloprid, thiamethoxam and chlorantraniliprole against life stages of Tribolium confusum Jacquelin du Val (Coleoptera: Tenebrionidae) on concrete [J]. Crop Protect, 2013, 53: 85–95. doi:10.1016/j.cropro.2013.05.007 |
| [4] | FENOLL J, GARRIDO I, CAVA J, et al. Photometabolic pathways of chlorantraniliprole in aqueous slurries containing binary and ternary oxides of Zn and Ti[J]. Chem Eng J, 2015, 264: 720–727. doi:10.1016/j.cej.2014.12.015 |
| [5] | LAHM G P, SELBY T P, FREUDENBERGER J H, et al. Insecticidal anthranilic diamides: a new class of potent ryanodine receptor activators[J]. Bioorg Med Chem Lett, 2005, 15(22): 4898–4906. doi:10.1016/j.bmcl.2005.08.034 |
| [6] |
食品安全国家标准 食品中农药最大残留限量: GB 2763―2016 [S]. 北京: 中国标准出版社, 2017.
National food safety standard, maximum residue limits for pesticides in food: GB 2763―2016 [S]. Beijing: Standards Press of China, 2017. |
| [7] |
占绣萍, 陈建波, 马琳, 等. 高效液相色谱法测定糙米和土壤中6种杀虫剂的残留[J]. 农药学学报, 2013, 15(5): 541–545.
ZHAN X P, CHEN J B, MA L, et al. Residues of six novel insecticides in unpolished rice and soil by high-performance liquid chromatography method[J]. Chin J Pestic Sci, 2013, 15(5): 541–545. |
| [8] | MALHAT F M. Determination of chlorantraniliprole residues in grape by high-performance liquid chromatography[J]. Food Anal Methods, 2012, 5(6): 1492–1496. doi:10.1007/s12161-012-9400-z |
| [9] | SINGH B, KAR A, MANDAL K, et al. Development and validation of QuEChERS method for estimation of chlorantraniliprole residue in vegetables[J]. J Food Sci, 2012, 77(12): T208–T215. doi:10.1111/jfds.2012.77.issue-12 |
| [10] | CABONI P, SARAIS G, ANGIONI A, et al. Liquid chromatography-tandem mass spectrometric ion-switching determination of chlorantraniliprole and flubendiamide in fruits and vegetables[J]. J Agric Food Chem, 2008, 56(17): 7696–7699. doi:10.1021/jf8014816 |
| [11] |
孟海涛, 艾连峰, 徐牛生. 在线净化液相色谱-串联质谱法测定蔬菜中噻虫嗪和氯虫苯甲酰胺的残留[J]. 环境化学, 2014, 33(2): 369–371.
MENG H T, AI L F, XU N S. Determination of thiamethoxam and chlorantraniliprole in vegetables by online cleaning-liquid chromatography tandem mass spectrometry[J]. Environ Chem, 2014, 33(2): 369–371. |
| [12] | TELÓ G M, SENSEMAN S A, MARCHESAN E, et al. Residues of thiamethoxam and chlorantraniliprole in rice grain[J]. J Agric Food Chem, 2015, 63(8): 2119–2126. doi:10.1021/jf5042504 |
| [13] |
陈国峰, 刘峰, 张晓波, 等. 氯虫苯甲酰胺在大豆和土壤中的残留及降解行为[J]. 农业环境科学学报, 2016, 35(5): 894–900.
CHEN G F, LIU F, ZHANG X B, et al. Residue analysis and degradation dynamics of chlorantraniliprole in soybean and soil[J]. J Agro-Environ Sci, 2016, 35(5): 894–900. doi:10.11654/jaes.2016.05.011 |
| [14] |
邓立刚, 陈业兵, 李增梅, 等. 超高效液相色谱-串联质谱法测定土壤中硝磺草酮及其代谢物残留[J]. 农药学学报, 2016, 18(3): 344–351.
DENG L G, CHEN Y B, LI Z M, et al. Determination of mesotrione and its metabolite residues in soils by ultra performance liquid chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2016, 18(3): 344–351. |
| [15] |
王连珠, 黄小燕, 陈泳, 等. QuEChERS前处理-液相色谱-串联质谱测定果蔬中18种弱酸性农药残留[J]. 分析测试学报, 2014, 3(10): 1102–1108.
WANG L Z, HUANG X Y, CHEN Y, et al. Determination of 18 weakly acidic pesticide residues in fruits and vegetables by liquid chromatography-tandem mass spectrometry with QuEChERS sample preparation[J]. J Instrum Anal, 2014, 3(10): 1102–1108. doi:10.3969/j.issn.1004-4957.2014.10.002 |
| [16] |
农药残留试验准则: NY/T 788—2004[S]. 北京: 中国农业出版社, 2004.
Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agriculture Press, 2004. |
 2018, Vol. 20
2018, Vol. 20


