2. 农业部 农药检定所,北京 100121
2. Institute for the Control of Agrochemicals, Ministry of Agriculture, Beijing 100121, China
玉米是中国重要的粮-经-饲三元结构作物,近年来,随着农业种植结构的调整和耕作栽培方式的转变,玉米病虫害发生一直呈加重趋势,一些次要害虫在全国范围或局部地区为害不断加重,甚至已上升为主要害虫[1]。随着新型高效药剂的开发,种子包衣技术在玉米苗期病虫害防治上得到了广泛应用。溴氰虫酰胺 (cyantraniliprole,图式 1) 是杜邦公司开发的第二代鱼尼丁受体抑制剂类杀虫剂[2],广谱、高效、低毒,对非靶标生物安全,并且内吸性强[3-5],可用于种子处理,能有效防治鳞翅目、半翅目和鞘翅目等玉米苗期害虫[6-7],应用潜力较大。
溴氰虫酰胺在田间使用后的主要降解产物为J9Z38[8](图式 1),目前尚未见关于其杀虫活性的报道。本实验室前期测定发现,J9Z38对鳞翅目害虫无致毒作用,因此溴氰虫酰胺代谢为J9Z38属于减毒代谢 (未发表)。通过检测J9Z38残留,可进一步加深对溴氰虫酰胺消解动态的了解。已有报道中主要采用高效液相色谱-串联质谱法 (HPLC-MS/MS) 检测喷雾施药后溴氰虫酰胺及其代谢物J9Z38在果蔬[8-13]和谷物[14]中的残留,尚未见有关种子处理方式下,其在玉米上残留和消解动态的研究报道。此外,由于药剂在田间施用后,剂量会随时间推移而逐渐降低,药效也相应下降。因此,本研究采用QuEChERS方法对样品进行前处理,结合超高效液相色谱-串联质谱 (UPLC-MS/MS) 建立了溴氰虫酰胺及其代谢物J9Z38在玉米植株和土壤中残留的分析方法,研究了种子包衣后两种化合物在春、夏玉米中的消解动态,以期为系统评价药剂的持效期和安全性提供理论和数据支持。
1 材料与方法 1.1 仪器及试剂ACQUITY UPLC-H-Class Xevo-TQS(Masslynx 4.1系统) 配电喷雾离子源 (ESI)(美国Waters公司);万分之一分析天平 (北京赛多利亚科学仪器有限公司);XW-80A涡旋混匀器 (上海沪西分析仪器厂有限公司);TDL-40B低速大容量离心机 (上海安亭科学仪器厂);HC-2517高速离心机 (安徽中科中佳科学仪器有限公司);T10高速均质仪 (德国IKA公司) 等。
99.2%溴氰虫酰胺 (cyantraniliprole) 和97.2% J9Z38标准品,以及19%溴氰虫酰胺悬浮剂 (SC)(美国杜邦公司);N-丙基乙二胺 (PSA,美国Agilent公司);甲醇和乙腈为色谱纯,氯化钠和无水硫酸镁为分析纯;试验用水均为双蒸水。
1.2 田间残留消解试验设计根据《农药残留试验准则》[15]方法进行。春、夏玉米分别于2016年4月25日和6月6日种植,试验地位于山东农业大学试验站,土壤质地为砂壤土 (含25.97%沙、61.88%泥和12.15%黏土),有机质含量1.41%,pH值7.13。种子包衣剂量为有效成分4 g/kg种子,同时设置空白对照组。试验小区设3个重复,每小区面积40 m2,小区间设1.2 m的隔离区。分别于玉米出苗 (第一片真叶露出地面2 cm) 后1、3、5、7、10、14、21 d采集植株和根际土壤:每小区内随机10点采集玉米完整植株;用土壤取样器 (直径8 cm, 深10 cm) 采集根际土壤,每小区随机取样5个点。每次取样量植株样品不少于2 kg,土壤样品不少于1 kg。土样过1 mm孔径筛,缩分后留样500 g,植株样品切碎后匀浆,均存放于 –20 ℃冰箱。
1.3 分析方法 1.3.1 样品前处理参照He等[16]的方法,并略做改进。准确称取10.0 g (精确至0.01 g) 充分匀浆后的玉米植株或土壤样品于50.0 mL具塞离心管中,加入20.0 mL乙腈、5.0 mL双蒸水、5.0 g氯化钠和2.0 g无水硫酸镁,涡旋振荡提取3 min,4 000 r/min离心2 min;取上清液1.5 mL转入2 mL QuEChERS离心管中 (含50.0 mg PSA,7.5 mg石墨化碳黑,150 mg无水MgSO4),涡旋振荡3 min,于12 000 r/min离心2 min;取上清液用乙腈稀释20倍后,过0.22 μm有机滤膜,待UPLC-MS/MS分析。
1.3.2 检测条件色谱条件:ACQUITY UPLCTMBEH C18色谱柱 (50 mm × 2.1 mm,1.7 μm);柱温35 ℃;流速0.35 mL/min;进样量2.0 μL;梯度洗脱程序见表1。
|
|
表 1 梯度洗脱程序 Table 1 Gradient elution procedures |
质谱条件:电喷雾正离子源模式 (ESI+);多重反应监测模式 (MRM) 扫描;毛细管电压为3.0 kV;脱溶剂气温度为400 ℃,流速800 L/h;离子采集参数见表2。
|
|
表 2 溴氰虫酰胺和J9Z38多重反应监测扫描模式采集参数 Table 2 The MRM parameters of cyantraniliprole and J9Z38 |
1.3.3 标准溶液配制及标准曲线的绘制
标准储备溶液配制:分别称取一定量的溴氰虫酰胺和J9Z38标准品,用乙腈溶解,配成100 mg/L的标准储备液,于 –20 ℃保存,备用。
基质匹配标准溶液配制:准确称取10.0 g玉米植株和土壤空白基质样品,按1.3.1节方法进行前处理,获得基质空白提取液,用基质空白提取液将溴氰虫酰胺和J9Z38标准储备液分别逐级稀释成0.1、0.5、1、5、10、50 μg/L的基质匹配标准工作溶液。按1.3.2节条件进行测定,分别以溴氰虫酰胺和J9Z38的质量浓度为横坐标、相应的峰面积为纵坐标绘制标准曲线。
1.3.4 添加回收试验分别在空白玉米植株和土壤样品中进行0.01、0.1和1 mg/kg 3个水平的添加回收试验,每个水平重复5次,按1.3.1节进行样品前处理,按1.3.2节条件进行测定,计算添加回收率和相对标准偏差。
1.3.5 基质效应基质效应 (ME) 指除目标化合物以外其他物质对目标物响应值的影响[17]。计算公式为:ME/% =[(kmatrix–ksolvent)/ksolvent] × 100,其中,ksolvent为纯溶剂标准曲线的斜率,kmatrix为基质匹配标准曲线的斜率。若|ME|的值小于10%,表明无明显基质效应;若|ME|的值大于10%,则说明具有明显的基质增强或减弱效应。本研究同时绘制了纯溶剂标准曲线和基质匹配标准曲线,考察了基质效应对检测结果的影响。
2 结果与讨论 2.1 质谱和色谱条件优化为使溴氰虫酰胺及其代谢物有很好的保留、分离和响应,本研究采用梯度洗脱程序,比较了流动相中水相分别为纯水、0.1%甲酸水溶液及0.1%甲酸 + 2 mmol/L乙酸铵溶液时的洗脱效果。结果 (图1) 显示:当流动相中水相为0.1%甲酸水溶液时,代谢物J9Z38的响应值最大;而当流动相水相为0.1%甲酸 + 2 mmol/L乙酸铵溶液时,溴氰虫酰胺的响应值最大。综合考虑,最终选择水相为0.1%甲酸水溶液的流动相,按表1进行梯度洗脱。溴氰虫酰胺和J9Z38的保留时间分别约为1.88和2.30 min。
根据文献方法[8-14],确定溴氰虫酰胺和J9Z38的离子扫描方式为电喷雾正离子源 (ESI+) 模式,母离子均为 [M + H] 形式。本研究采用500 μg/L的溴氰虫酰胺和J9Z38标准溶液,通过多重反应监测模式扫描,手动调谐获得最佳的母离子和子离子参数。最终得到溴氰虫酰胺的定性、定量离子对分别为475.1/443.9和475.1/285.8;J9Z38的定性、定量离子对分别为457.0/298.9和457.0/187.8 (表2)。
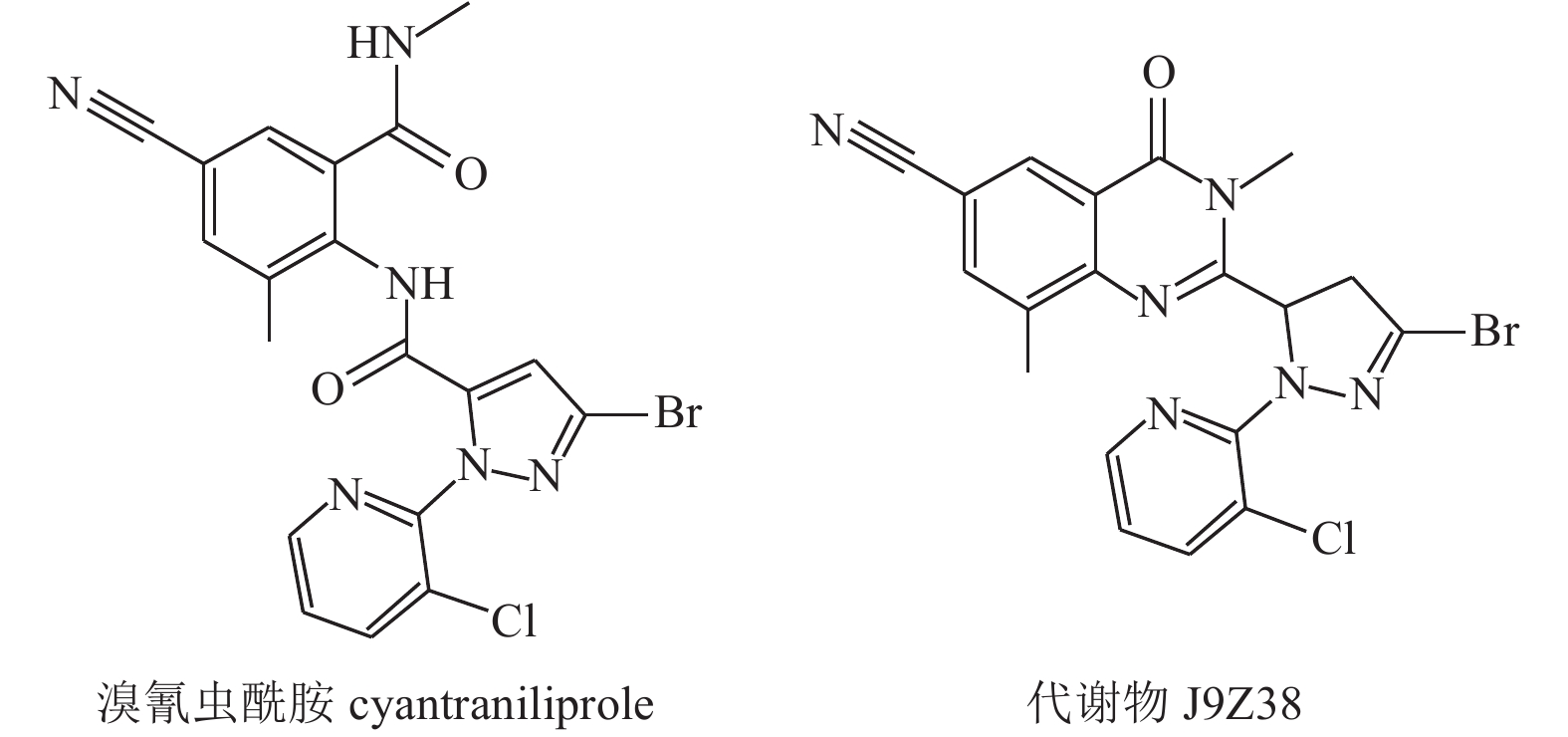
|
图式1 溴氰虫酰胺及其代谢物J9Z38的结构式 Scheme1 Structural formula of cyantraniliprole and its metabolite J9Z38 |
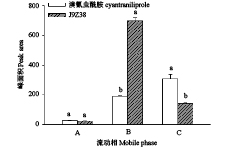
|
A:纯水;B:0.1%甲酸水溶液;C:0.1%甲酸 + 2 mmol/L乙酸铵溶液。不同小写字母表示在 P < 0.05水平差异显著。 A: water; B: 0.1% formic acid solution; C: 0.1% formic acid + 2 mmol/L ammonium acetate solution. Different small letters mean significant difference at P < 0.05 level. 图 1 溴氰虫酰胺和J9Z38的流动相优化结果 Fig. 1 Mobile phase optimization of cyantraniliprole and J9Z38 |
2.2 前处理条件优化
乙腈作为一种通用的提取溶剂,在残留检测中应用广泛,对绝大多数农药有较高的回收率[18],因此采用乙腈作为提取试剂,以最大限度地提取玉米植株基质中的残留农药,并尽可能减少干扰。QuEChERS样品前处理方法因具有操作简单、迅速和成本低廉的优点,已成为普遍使用的前处理方法。选用PSA + 石墨化碳黑 + 无水硫酸镁为净化剂,可去除玉米植株中的色素,同时保证较高的回收率,此外由于无水硫酸镁在吸水过程中会释放热量,可进一步将目标物溶解、洗脱,因此上清液经高速离心后即可过0.22 μm有机滤膜,进样检测。
2.3 基质效应、标准曲线及定量限由表3可知,样品基质对溴氰虫酰胺和J9Z38存在明显的基质增强效应,|ME|值大于10%,故采用基质匹配标准曲线进行定量。以峰面积 (y) 对农药质量浓度 (x) 作线性回归,溴氰虫酰胺和J9Z38在0.1~50 μg/L质量浓度范围内线性关系良好 (决定系数均大于0.999),线性方程见表3。以信噪比S/N = 10计算得溴氰虫酰胺和J9Z38的定量限 (LOQ) 均为0.01 mg/kg。
|
|
表 3 溴氰虫酰胺和J9Z38的线性方程及基质效应 Table 3 The linear equation and matrix effect of cyantraniliprole and J9Z38 |
2.4 方法的准确度和精密度
在0.01、0.1和1 mg/kg 3个添加水平下,溴氰虫酰胺在玉米植株和土壤中的平均回收率为82%~100%,相对标准偏差为4.7%~10.1%;J9Z38在玉米植株和土壤中的平均回收率为81%~103%,相对标准偏差为2.5%~8.0%(表4)。表明所建立的方法具有良好的准确度和精密度,符合农药残留分析的检测要求[15]。
|
|
表 4 溴氰虫酰胺和J9Z38在玉米植株及土壤中的平均回收率和相对标准偏差 (n = 5) Table 4 Average recoveries and relative standard deviations of cyantraniliprole and J9Z38 in maize plant and soil (n = 5) |
2.5 溴氰虫酰胺和J9Z38在玉米植株及土壤中的残留消解动态
溴氰虫酰胺和J9Z38在春 (夏) 玉米植株和土壤中的残留消解方程见表5,消解动态曲线见图2。结果表明,溴氰虫酰胺和J9Z38在玉米植株及土壤中的残留量均随取样时间的延长而逐渐降低。其中,溴氰虫酰胺在春玉米植株和土壤中的消解半衰期分别为8.3和8.2 d,在夏玉米植株和土壤中的消解半衰期分别为3.9 和4.5 d (表5)。溴氰虫酰胺在春玉米中的消解速率明显慢于在夏玉米中,分析其原因可能是由于春季气温和地温相对较低,溴氰虫酰胺在土壤中消解较慢,药剂由根部吸收、传导至茎基部后,代谢速率也相对缓慢所致。此外,与夏玉米相比,春玉米植株单位时间内的生长量相对较少,也在一定程度上导致了同等质量样品中药剂的含量较高。
本研究中,溴氰虫酰胺在春、夏玉米植株中的半衰期分别为8.3和3.9 d,与已有报道的溴氰虫酰胺在番茄[10]、辣椒[11]和花椰菜[19]等其他作物喷雾处理场景下获得的半衰期存在差异。分析其原因除了与作物种类、试验地的气候和土壤条件等因素有关外,与施药方式的不同关系也很大。在种子处理方式下,药剂的消解主要与土壤中微生物丰富度及植株本身生长代谢等内部环境有关[20],而喷雾方式下则药剂受风吹、雨淋、光照等外部气候条件的影响较为明显。此外,取样时间同样会影响对药剂半衰期的测定,本研究从春、夏玉米出苗后1 d开始取样,但种子出苗需要5~7 d,所以实际取样时间为施药后的6~8 d;而其他喷雾施药条件下药剂的残留与消解研究中,通常是从施药后2 h即开始取样。
|
|
表 5 溴氰虫酰胺和J9Z38在玉米植株及土壤中的消解方程和半衰期 Table 5 Dissipation equations and half-lives of cyantraniliprole and J9Z38 in maize plant and soil |
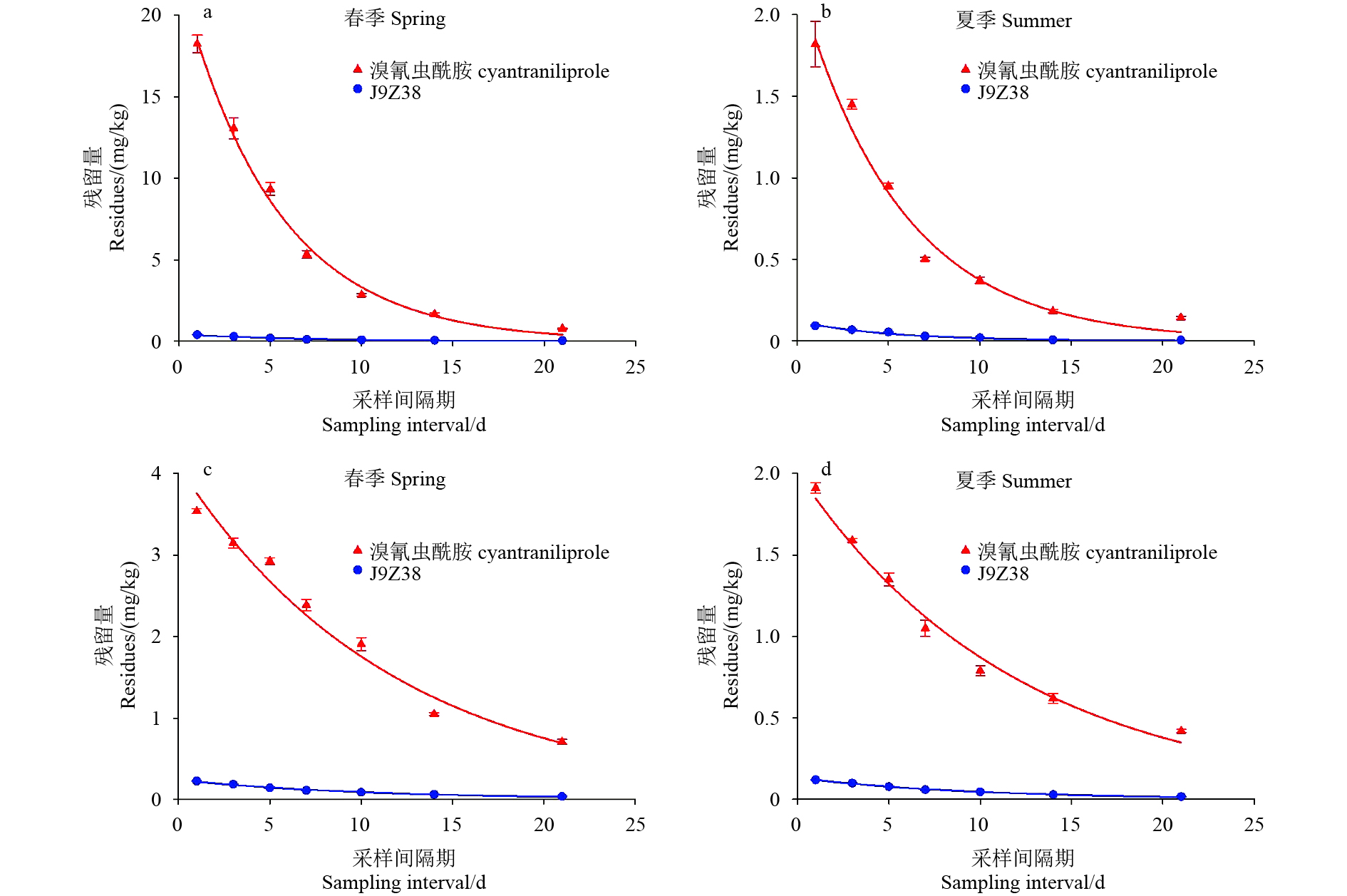
|
图 2 溴氰虫酰胺和J9Z38在玉米植株 (a-b) 和土壤 (c-d) 中的消解动态曲线 Fig. 2 Dissipation dynamics curve of cyantraniliprole and J9Z38 in maize plant (a-b) and soil (c-d) |
4 结论
本研究采用QuEChERS前处理方法,通过对色谱和质谱条件进行优化,建立了溴氰虫酰胺及其代谢物J9Z38在玉米植株和土壤中残留量的UPLC-MS/MS检测方法。该方法简单快捷,具有较高的灵敏度、准确度和精密度,实用性强。结果可为了解种子处理方式下溴氰虫酰胺控制害虫的持效期及其在玉米上残留限量 (MRL) 标准的制定提供理论依据。
| [1] |
王振营, 王晓鸣. 加强玉米有害生物发生规律与防控技术研究, 保障玉米安全生产[J]. 植物保护学报, 2015, 42(6): 865–868.
WANG Z Y, WANG X M. To strengthen researches on the occurrence of maize pests and related control techniques for ensuring the maize production security[J]. J Plant Prot, 2015, 42(6): 865–868. |
| [2] |
杨桂秋, 黄琦, 陈霖, 等. 新型杀虫剂溴氰虫酰胺研究概述[J]. 世界农药, 2012, 34(6): 19–21.
YANG G Q, HUANG Q, CHEN L, et al. Summary of a nevol pesticide cyantraniliprole[J]. World Pestic, 2012, 34(6): 19–21. |
| [3] | LAHM G P, SELBY T P, FREUDENBERGER J H, et al. Insecticidal anthranilic diamides: a new class of potent ryanodine receptor activators[J]. Bioorg Med Chem Lett, 2005, 15(22): 4898–4906. doi:10.1016/j.bmcl.2005.08.034 |
| [4] | LAHM G P, CORDOVA D, BARRY J D. New and selective ryanodine receptor activators for insect control[J]. Bioorg Med Chem, 2009, 17(12): 4127–4133. doi:10.1016/j.bmc.2009.01.018 |
| [5] |
杜军辉, 于伟丽, 王猛, 等. 三种双酰胺类杀虫剂对小地老虎和蚯蚓的选择毒性[J]. 植物保护学报, 2013, 40(3): 266–272.
DU J H, YU W L, WANG M, et al. Selective toxicity of three amide pesticides to black cutworm Agrotis ypsilon and earthworm Eisenia foetida [J]. Acta Phytophylacica Sinica, 2013, 40(3): 266–272. |
| [6] |
王猛, 王凯, 刘峰, 等. 溴氰虫酰胺和氯虫苯甲酰胺对三种鳞翅目害虫的毒力作用比较[J]. 植物保护学报, 2014, 41(3): 360–366.
WANG M, WANG K, LIU F, et al. Comparison of the bioactivity of cyantraniliprole and chlorantraniliprole against three important lepidopterous pests[J]. Acta Phytophylacica Sinica, 2014, 41(3): 360–366. |
| [7] | XU C M, DING J F, ZHAO Y H, et al. Cyantraniliprole at sublethal dosages negatively affects the development, reproduction, and nutrient utilization of Ostrinia furnacalis (Lepidoptera: Crambidae) [J]. J Econ Entomol, 2017, 110(1): 230–238. |
| [8] | DONG F S, LIU X G, XU J, et al. Determination of cyantraniliprole and its major metabolite residues in vegetable and soil using ultra-performance liquid chromatography/tandem mass spectrometry[J]. Biomed Chromatogr, 2012, 26(3): 377–383. |
| [9] | HU X Q, ZHANG C P, ZHU Y H, et al. Determination of residues of cyantraniliprole and its metabolite J9Z38 in watermelon and soil using ultra-performance liquid chromatography/mass spectrometry[J]. J AOAC Int, 2013, 96(6): 1448–1452. doi:10.5740/jaoacint.12-423 |
| [10] | PARVATAMMA B, RAO T N. A new validated HPLC method for determination of cyantraniliprole and its metabolite residues in tomato fruit[J]. Asian J Res Chem, 2015, 8(6): 383–388. doi:10.5958/0974-4150.2015.00064.4 |
| [11] |
何红梅, 张春荣, 朱亚红, 等. 溴氰虫酰胺及其代谢物在辣椒和土壤中的残留降解研究[J]. 分析化学, 2014, 42(8): 1177–1182.
HE H M, ZHANG C R, ZHU Y H, et al. Residue and degradation of cyantraniliprole and its main metabolite in pepper and soil[J]. Chin J Anal Chem, 2014, 42(8): 1177–1182. doi:10.11895/j.issn.0253-3820.140380 |
| [12] |
赵坤霞, 孙建鹏, 秦冬梅, 等. 溴氰虫酰胺及其代谢物在土壤和葱中残留行为[J]. 环境科学与技术, 2014, 37(2): 89–95.
ZHAO K X, SUN J P, QIN D M, et al. Study on residue of cyantraniliprole and its metabolites in soil and green onion[J]. Environ Sci Technol, 2014, 37(2): 89–95. |
| [13] | SUN J P, FENG N, TANG C F, et al. Determination of cyantraniliprole and its major metabolite residues in pakchoi and soil using ultra-performance liquid chromatography-tandem mass spectrometry[J]. Bull Environ Contam Toxicol, 2012, 89(4): 845–852. doi:10.1007/s00128-012-0752-2 |
| [14] | ZHANG C P, HU X Q, ZHAO H, et al. Residues of cyantraniliprole and its metabolite J9Z38 in rice field ecosystem[J]. Chemosphere, 2013, 93(1): 190–195. doi:10.1016/j.chemosphere.2013.05.033 |
| [15] |
农药残留试验准则: NY/T 788—2004[S]. 北京: 中国农业出版社, 2004.
Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agriculture Press, 2004. |
| [16] | HE M, SONG D, JIA H C, et al. Concentration and dissipation of chlorantraniliprole and thiamethoxam residues in maize straw, maize, and soil[J]. J Environ Sci Health B, 2016, 51(9): 594–601. doi:10.1080/03601234.2016.1181903 |
| [17] | KITTLAUS S, SCHIMANKE J, KEMPE G, et al. Assessment of sample cleanup and matrix effects in the pesticide residue analysis of foods using postcolumn infusion in liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2011, 1218(46): 8399–8410. doi:10.1016/j.chroma.2011.09.054 |
| [18] |
李娜, 张玉婷, 李辉, 等. 超高效液相色谱-串联质谱法测定 6 种中药材中110种农药残留[J]. 农药学学报, 2012, 14(6): 619–628.
LI N, ZHANG Y T, LI H, et al. Determination of 110 pesticide residues in six Chinese herbal medicines by ultra performance liquid chromatography-tandem mass spectrometry[J]. Chin J Pestic Sci, 2012, 14(6): 619–628. |
| [19] |
洪文英, 吴燕君, 尉吉乾, 等. 溴氰虫酰胺对小菜蛾的田间防效及其在花椰菜中的残留与消解动态[J]. 农药学学报, 2017, 19(2): 211–216.
HONG W Y, WU Y J, WEI J Q, et al. Efficiency of cyantraniliprole on Plutella xylostella (L.) and its residual dissipation dynamics in Brassica oleracea [J]. Chin J Pestic Sci, 2017, 19(2): 211–216. |
| [20] |
杨小红, 李俊, 葛诚, 等. 微生物降解农药的研究新进展[J]. 微生物学通报, 2003, 30(6): 93–96.
YANG X H, LI J, GE C, et al. Novel advances on pesticides degradation by microorganisms[J]. Microbiol China, 2003, 30(6): 93–96. |
 2018, Vol. 20
2018, Vol. 20


