丙炔氟草胺 (图式 1) 是1993年由日本住友化学工业株式会社开发的环酰亚胺类除草剂,主要用于防除小麦、大豆、花生田阔叶类杂草和禾本科杂草[1]。其作用机理是抑制原卟啉原 (PPO) 的合成,导致原卟啉原IX在植物体内积累,在日光照射下,原卟啉原IX变成单线态氧,使脂膜发生过氧化反应,导致细胞膜损伤,最终造成细胞死亡[2-4]。怀孕期大鼠口服一定剂量的丙炔氟草胺会抑制胚胎生长,导致胚胎骨骼受损[5-6]。丙炔氟草胺对非靶标生物具有严重的慢性毒性[7]。美国规定丙炔氟草胺在苹果、葡萄和大豆上的最大残留限量 (MRL) 均为0.02 mg/kg[8];日本规定其在苹果、葡萄和大豆上的MRL值分别为0.1、0.1和0.02 mg/kg [9];欧盟规定丙炔氟草胺在苹果、葡萄和大豆上的MRL值分别为0.02、0.05和0.05 mg/kg [10]。中国仅制定了丙炔氟草胺在大豆和柑橘上的MRLs值,分别为0.02和0.05 mg/kg[11]。
|
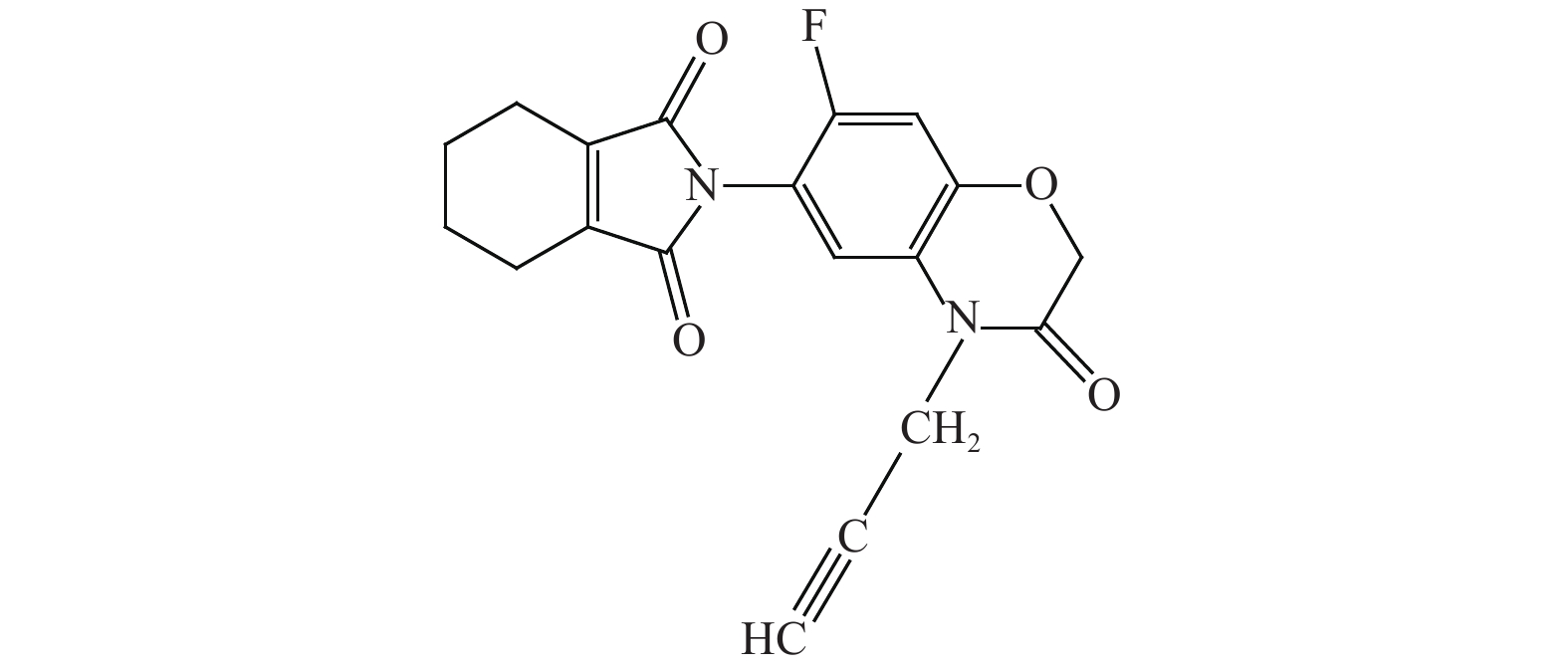
图式1 丙炔氟草胺结构式 Scheme1 Structural formula of flumioxazin |
关于丙炔氟草胺残留的检测方法主要有气相色谱-串联质谱法 (GC-MS/MS)[12-16]和高效液相色谱法 (HPLC-UV)[17-19]。其中GC-MS/MS样品前处理过程复杂耗时,水浴蒸发容易损失目标化合物,导致回收率低等问题,而HPLC-UV的检测灵敏度太低 (LOD < 0.001 mg/g) [20]。因此,有必要开发一种简单、高效的方法以满足丙炔氟草胺残留检测、安全性评价、消解模式和环境行为研究的需要。HPLC-ESI-MS/MS能够检测多种化合物,并能获得更高的灵敏度[17]。
与传统的样品前处理技术相比,QuEChERS技术具有回收率高、样品处理时间短和有机溶剂用量少等优点[21-22]。目前,中国正在扩大丙炔氟草胺防除一年生阔叶杂草及禾本科杂草的登记范围,急需提供丙炔氟草胺在食品 (水果、蔬菜和粮油) 上安全使用的技术支持。因此,建立丙炔氟草胺在不同基质中的残留检测方法,分析其在土壤中的消解趋势对于科学使用农药,减少其对环境的污染和对非靶标生物的危害均具有重要意义。鉴于此,本研究采用QuEChERS-HPLC-MS/MS建立了一种快速、高效的残留检测方法,用于检测丙炔氟草胺在食品 (苹果、葡萄、柑橘、甘蓝、小麦、大豆)、土壤和水中的残留,并分析了其在土壤中的消解动态。
1 材料与方法 1.1 仪器与试剂丙炔氟草胺 (flumioxazin,纯度为99.4%) 标准品 (德国Dr. Ehrenstorfer公司);480 g/L丙炔氟草胺悬浮剂 (一帆生物科技集团有限公司)。甲醇、乙腈和甲酸均为色谱纯;乙腈、氯化钠和无水硫酸镁均为分析纯;N-丙基乙二胺 (PSA)(40 μm)、佛罗里硅土、石墨化碳黑 (GCB)、C18 (40 μm)(天津博纳艾杰尔科技有限公司)。
Aglient 1290-6460型高效液相-串联三重四极杆质谱仪和MassHunter工作站软件 (美国安捷伦公司);BSA224S万分之一天平 (Sartorius公司,德国);IQ7000超纯水仪 (Millipore公司,美国);G560E涡旋振荡器 (Scientific Industries公司,美国);CT15RE高速冷冻离心机 (HITACHI公司,日本)。
1.2 样品前处理 1.2.1 样品采集供试苹果、葡萄、柑橘、甘蓝、小麦和大豆,来自辽宁省沈阳市某超市;供试土壤和水采自沈阳农业大学科研基地。
1.2.2 样品提取分别称取10 g匀浆后的苹果、葡萄、柑橘、甘蓝、小麦、大豆或土壤样品 (水样为10 mL) 于50 mL离心管中,加入10 mL乙腈,涡旋提取5 min;加入2 g氯化钠,于 –20 ℃下静置10 min;加入4 g无水硫酸镁,涡旋1 min,于4 000 r/min下离心5 min后待净化。
1.2.3 样品净化柑橘、苹果、葡萄和甘蓝:分别量取1.5 mL样品提取液,加入含有50 mg PSA、20 mg GCB和50 mg硫酸镁的2 mL离心管中,涡旋1 min,于5 000 r/min下离心5 min;取上清液,过0.22 μm有机滤膜,待HPLC-MS/MS分析。
小麦、大豆:分别量取1.5 mL样品提取液,加入含有50 mg PSA、30 mg C18和50 mg硫酸镁的2 mL离心管中,涡旋1 min,于5 000 r/min下离心5 min;取上清液,过0.22 μm有机滤膜,待HPLC-MS/MS分析。
土壤和水:分别量取1.5 mL样品提取液,加入含有50 mg C18和150 mg硫酸镁的2 mL离心管中,涡旋1 min,于5 000 r/min下离心5 min;取上清液,过0.22 μm有机滤膜,待HPLC-MS/MS分析。
1.3 检测条件色谱条件:Agilent Eclipse Plus C18色谱柱 (50 mm × 2.1 mm, 1.8 μm);流动相A为甲醇,流动相B为0.2%甲酸水溶液。梯度洗脱程序:0 min, 10% A; 1 min, 50%A; 3 min, 20% A; 4 min, 20% A; 5 min, 10% A。流速0.4 mL/min;柱温40 ℃;进样体积3.0 μL。
质谱条件:电喷雾离子源 (ESI),以氮气作为碰撞气和干燥气。正离子扫描多反应监测模式 (MRM),目标化合物的驻留时间为300 ms。雾化气为99.95%氮气;碰撞气为99.999%氮气;干燥气温度325 ℃,流速8.0 L/min;鞘气温度350 ℃,流速10.0 L/min;毛细管电压为4.5 kV;喷嘴电压为500 V。其他优化后的质谱条件见表1。
|
|
表 1 丙炔氟草胺的质谱检测条件参数 Table 1 MS/MS conditions and experimental parameters of flumioxazin |
1.4 标准溶液配制及标准曲线绘制
准确称取0.01 g (精确至0.000 1 g) 丙炔氟草胺标准品,用乙腈溶解并定容至100 mL,配成100 mg/L的丙炔氟草胺标准储备液。用乙腈逐级稀释储备液,配成0.01、0.05、0.1、0.5、1和5 mg/L的标准工作溶液,现用现配。用空白基质提取液稀释标准储备液,配成系列浓度的基质匹配标准工作溶液。所有溶液均于0~4 ℃下避光保存,备用。
外标法定量。以溶液质量浓度为横坐标,峰面积为纵坐标,绘制工作曲线。
1.5 添加回收试验向空白基质中添加丙炔氟草胺标准溶液,添加水平分别为0.01、0.1和1 mg/kg,每个水平5次重复。按1.2节方法进行提取和净化,按1.3节条件测定,计算日内添加平均回收率和日间添加平均回收率,其中日间添加平均回收率连续测定3 d。
1.6 土壤消解动态试验根据《农药残留试验准则》[23]要求,于2016年3月在辽宁沈阳进行丙炔氟草胺在土壤中残留消解动态试验。供试药剂为480 g/L丙炔氟草胺悬浮剂。试验前确定试验田土壤中不含丙炔氟草胺,土质为沙壤土,有机质质量分数为2.6 g/kg,pH值6.8。每小区面积30 m2,以推荐剂量的1.5倍 (有效成分90 g/hm2) 土壤喷施1次,每处理重复3次。另设空白对照小区。分别于施药后2 h及1、3、7、14、20、30、45和60 d,采集土壤样品,取土深度0~10 cm,采样量不少于1 kg,过380 μm筛,于 –20 ℃保存。
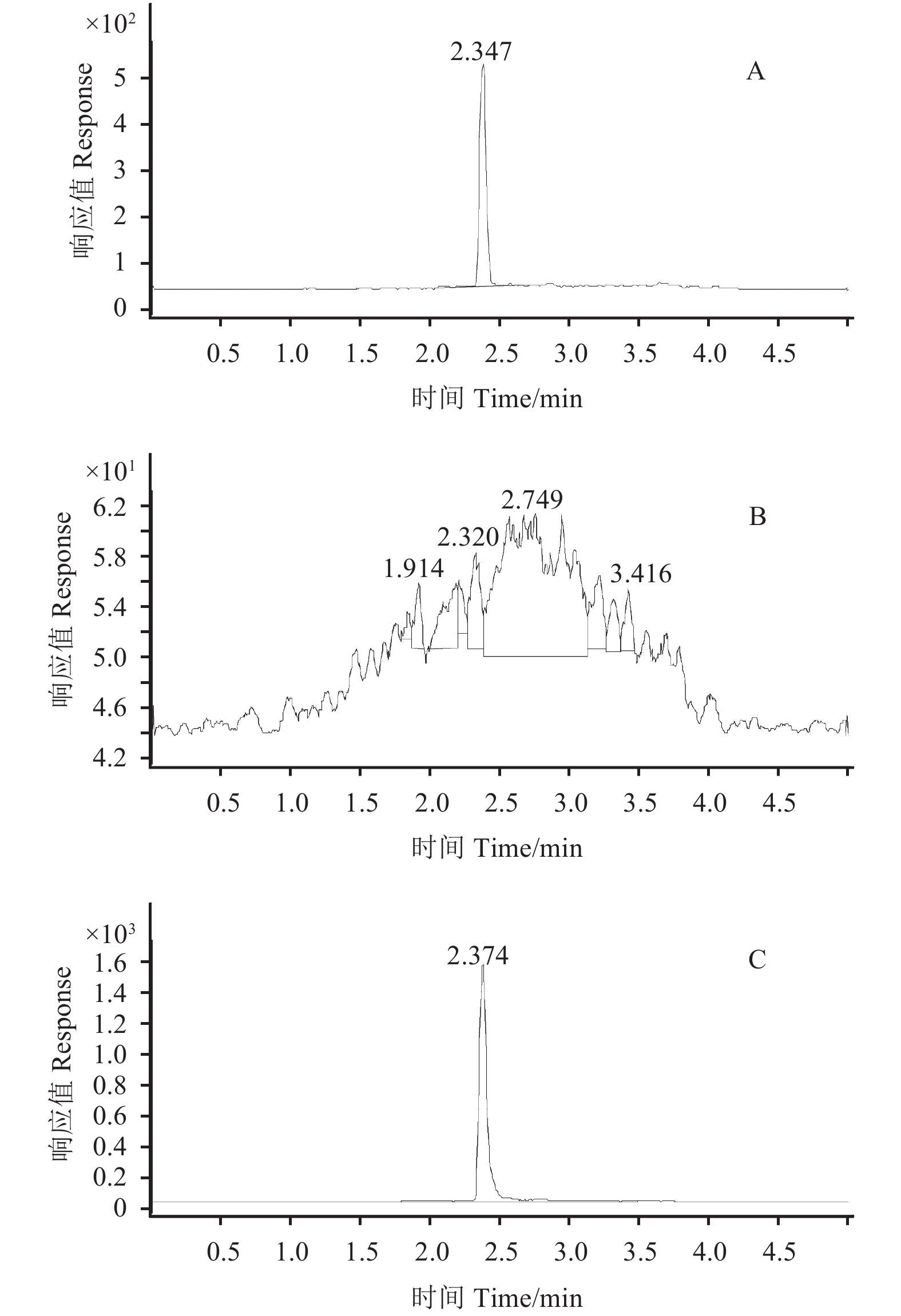
2 结果与讨论 2.1 检测条件的优化 2.1.1 液相色谱条件优化采用C18色谱柱 (50 mm × 2.1 mm, 1.8 μm),在流速为0.4 mL/min条件下,分别考察了以乙腈-水、乙腈-0.2%甲酸水溶液、甲醇-水、甲醇-0.2%甲酸水溶液为流动相对丙炔氟草胺检测结果的影响。结果 (图1) 表明:以甲醇-0.2%甲酸水溶液作为流动相时,目标化合物周围没有干扰峰,能获得更高的响应值和更好的峰形。在此条件下,丙炔氟草胺的保留时间为2.37 min,仪器的分析时间小于5 min。
|
A:丙炔氟草胺标准溶液 (0.01 mg/L);B:土壤空白;C:土壤添加 (0.1 mg/kg)。 A: 0.01 mg/L standard solution of flumioxazin; B: Blank soil sample; C: Spiked soil sample at 0.1 mg/kg. 图 1 丙炔氟草胺的HPLC-MS/MS MRM典型色谱图 Fig. 1 Typical HPLC-MS/MS MRM chromatograms of flumioxazin |
2.1.2 质谱条件优化
为了获得最佳的灵敏度和分离效果,取0.1 mg/L的丙炔氟草胺标准溶液,在以甲醇-0.2%甲酸水溶液作为流动相条件下,采用正/负离子全扫描 (m/z 100~700),丙炔氟草胺进入一级质谱后,可产生稳定的 [M+H]+ 准分子离子峰 (m/z 355.1),该离子为丙炔氟草胺的母离子。通过比较仪器响应值发现,正离子模式下母离子的响应值最高,故选用正离子模式进行扫描。在扫描离子检测 (SIM) 模式下进一步优化fragmentor值;在子离子扫描模式下向碰撞池里施加一定的碰撞能,使母离子发生断裂或重排,产生不同的离子碎片,进入二级质谱;然后在多反应监测 (MRM) 模式下进一步优化驻留时间和碰撞能,得到定性离子对m/z 355.1 > 299.1和定量离子对 m/z 355.1 > 327.1 ( 表1)。结果表明:大豆样品选择299.1 (m/z) 作为定性离子时,色谱图中出现干扰峰,而选择204.0 (m/z) 作为丙炔氟草胺的定性离子时,干扰峰消失。
2.2 样品前处理条件的优化 2.2.1 提取溶剂的选择分别考察了乙腈、甲醇、丙酮和乙酸乙酯对丙炔氟草胺提取效率的影响。结果表明:以丙酮作为提取溶剂时,提取液颜色深,色素含量较多;以甲醇为提取溶剂时,由于甲醇与基质中的水互溶,在提取高淀粉含量的样品时,样品中的淀粉会被提取出来,使样品处理过程变得复杂。以乙酸乙酯作为提取溶剂时,脂肪等非极性物质易被提取出来,容易污染仪器,干扰测定。而用乙腈作为提取溶剂时对农药有很宽的极性适用范围,且乙腈不溶解非极性的脂肪、极性的蛋白质、糖类和盐类等,能减少提取液中的干扰物质并获得较高的回收率[24],因此本研究选择乙腈作为提取溶剂。
2.2.2 氯化钠和无水硫酸镁加入顺序的优化试验中发现,将无水硫酸镁和氯化钠同时加入匀浆后的样品中时,由于无水硫酸镁遇水很容易结块,同时,其吸水会瞬间放出大量的热,影响结果的准确性。因此,本研究中采取首先加入氯化钠,使样品中的乙腈层和水层分开,于 –20 ℃下静置10 min后再加入无水硫酸镁的方式,可有效避免上述情况的发生。
2.2.3 净化条件的优化鉴于丙炔氟草胺是极性化合物且基质中含有大量的碳水化合物、脂肪酸和叶绿素等杂质,本研究考察了C18、GCB和PSA 3种类型的净化剂12种组合对丙炔氟草胺在不同基质中回收率和响应值的影响。结果 (表2和表3) 表明:单一使用C18、PSA、GCB净化剂时,丙炔氟草胺在土壤中的回收率在82%~90%之间,水中的回收率在95%~100%之间,回收率和响应值均比较理想,而在其他基质中的回收率虽符合国家标准,但响应值很低,且不同含量的C18对丙炔氟草胺的回收率和响应值有一定影响。使用PSA + C18和PSA + GCB混合吸附剂时,丙炔氟草胺的响应值较高,回收率均达到80%以上,满足农药定量分析的要求[23]。因此,在不影响农药回收率的情况下,为了尽可能最大限度除去样品中的杂质,最终选取50 mg PSA + 20 mg GCB作为甘蓝、柑橘、苹果和葡萄的净化剂,以50 mg PSA + 30 mg C18作为大豆和小麦样品的净化剂,以50 mg C18作为水和土壤样品的净化剂。
|
|
表 2 不同净化剂对丙炔氟草胺在苹果、甘蓝、葡萄、柑橘、大豆和小麦中回收率的影响 Table 2 Effect of different adsorbents on the recovery of flumioxazin in apple, cabbage, grape, orange, soybean, and wheat |
|
|
表 3 不同净化剂对丙炔氟草胺在土壤和水中回收率的影响 Table 3 Effect of different adsorbents on the recovery of flumioxazin in water and soil |
2.3 方法的确证 2.3.1 方法的线性范围及基质效应
结果 (表4) 表明:在0.01~5 mg/L范围内,丙炔氟草胺在不同基质中的质量浓度与对应的峰面积间均呈良好的线性关系,决定系数均大于0.997 6。按照信噪比 (S/N) = 10计算,丙炔氟草胺在8种基质中的定量限 (LOQ) 在0.000 3~0.003 2 mg/kg之间,均低于美国、中国、日本、欧盟等国家和地区的MRLs标准。
由于基质共提物的存在会增强或减弱目标化合物的响应值,降低检测结果的准确度和精密度[25-28]。因此,一般通过计算基质匹配标准溶液曲线和标准溶液曲线的斜率比来确定基质效应 (ME)。ME = 0为无基质效应,ME < 0为基质减弱效应,ME > 0为基质增强效应 [29]。本研究中,采用外标法基质匹配标准曲线定量以消除基质效应。结果 (表4) 表明:除水样 (ME = 11.77%) 外,丙炔氟草胺在其余基质中的ME在 –58.16%~–1.96%之间,表现为基质减弱效应。
|
|
表 4 丙炔氟草胺在不同基质中的线性范围、检出限、定量限及基质效应 (线性范围:0.01~5 mg/kg) Table 4 The linear range, detection limit, quantitative limit and matrix effect of fluioxazin in different matrices (linear range: 0.01-5 mg/kg) |
2.3.2 方法的准确度和精密度
结果 (表5) 表明:在0.01、0.1和1 mg/kg添加水平下,丙炔氟草胺在8种基质中的日内平均回收率为82%~104%,相对标准偏差 (RSD) (n = 5) 为1.1%~7.8%;日间平均回收率在77%~109%之间,RSD (n = 15) 为0.1%~9.2%,表明该方法具有较好的准确性和稳定性,可满足农药残留分析的要求[23]。
|
|
表 5 丙炔氟草胺在不同基质中的平均添加回收率和相对标准偏差 Table 5 The recovery and relative standard deviation of flumioxazin in different matrices |
2.4 丙炔氟草胺在土壤中的消解动态
丙炔氟草胺在土壤中的消解规律符合一级反应动力学方程,在土壤中消解较快,半衰期为23.90 d (表6),经推算知79 d后约90%的丙炔氟草胺被降解,属易降解类农药[30]。
|
|
表 6 丙炔氟草胺在土壤中的消解动态 (沈阳,中国) Table 6 Dissipation of flumioxazin in soil of Shenyang City, Liaoning Province, China |
3 结论
本研究通过优化样品前处理方法、色谱和质谱检测条件,建立了QuEChERS-HPLC-MS/MS法测定丙炔氟草胺在食品 (苹果、葡萄、柑橘、小麦、大豆、甘蓝)、土壤和水中残留的方法。样品前处理过程简单,方法的灵敏度、准确度和精密度均可满足农药残留检测的要求,适用于大量样品的快速检测。
| [1] | NIEKAMP J W, JOHNSON W G. Weed management with sulfentrazone and flumioxazin in no-tillage soybean (Glycine max) [J]. Crop Prot, 2001, 20(3): 215–220. doi:10.1016/S0261-2194(00)00129-0 |
| [2] | ASKEW S D, WILCUT J W, CRAMMER J R. Cotton (Gossypium hirsutum) and weed response to flumioxazin applied preplant and postemergence directed [J]. Weed Technol, 2002, 16(1): 184–190. doi:10.1614/0890-037X(2002)016[0184:CGHAWR]2.0.CO;2 |
| [3] | TAYLOR-LOVELL S, WAX L M, BOLLERO G. Preemergence flumioxazin and pendimethalin and postemergence herbicide systems for soybean (Glycine max) [J]. Weed Technol, 2002, 16(3): 502–511. doi:10.1614/0890-037X(2002)016[0502:PFAPAP]2.0.CO;2 |
| [4] | EVERMAN W J, CLEWIS S B, YORK A C, et al. Weed control and yield with flumioxazin, fomesafen, and S-metolachlor systems for glufosinate-resistant cotton residual weed management [J]. Weed Technol, 2009, 23(3): 391–397. doi:10.1614/WT-09-007.1 |
| [5] | KRIJT J. Peroxidizing herbicides: toxicology to mammals and non-target organ-isms[M]//BÖGER P, WAKABAYASHI K, eds. Peroxidizing herbicides. Berlin Heidelberg: Springer, 1999: 383-399. |
| [6] | TAKAKU T, NAGAHORI H, SOGAME Y. Metabolism and physiologically based pharmacokinetic modeling of flumioxazin in pregnant animals[J]. Toxicol Appl Pharmacol, 2014, 277(3): 242–249. doi:10.1016/j.taap.2014.03.022 |
| [7] | SALADIN G, CLÉMENT, C. Physiological side effects of pesticides on non-targer plants[M]//LIVINGSTON J V, ed. Agriculture and soil pollution: New research. New York: Nova Science Publishers, 2005. |
| [8] | Electronic Code of Federal Regulations. Tolerances and exemptions for pesticide chemical residues in food[EB/OL]. [2018-01-02]. https://www.ecfr.gov/cgibin/retrieveECFR?gp=1&SID=612dd04c97eb3a67762dd1f0f66a3584&ty=HTML&h=L&mc=true&r=SECTION&n=se40.26.180_1568. |
| [9] | The Japan Food Chemical Research Foundation. Table of MRLs for flumioxazin[DB/OL]. [2016-09-16]. http://www.m5.ws001. squarestart.ne.jp/foundation/agrdtl.php?a_inq=64000. |
| [10] | European Commission. EU Pesticides database[DB/OL]. [2016-07-04]. http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/public/?event=pesticide.residue.CurrentMRL&language=EN. |
| [11] |
农药最大残留限量数据库: 丙炔氟草胺最大残留限量[DB/OL]. [2017-11-20]. http://202.127.42.84/tbt-sps/mrlsdb/queryMrlsdb.do.
China Pesticide Information Network. Pesiticide Maximum Residue Limits data of flumioxazin[DB/OL]. [2017-11-20]. http://202.127.42.84/tbt-sps/mrlsdb/queryMrlsdb.do. |
| [12] | FEERRELL J A, VENCILL W K. Gas chromatographic/mass spectrometric determination of flumioxazin extracted from soil and water[J]. J AOAC Int, 2004, 87(1): 56–59. |
| [13] |
王红连, 张东升, 张凌裳, 等. 硒化灵芝多糖制备及免疫学相关研究[J]. 食品科学, 2009, 30(17): 316–318.
WANG H L, ZHANG D S, ZHANG L S, et al. Preparation and immunological studies of seleno-Ganoderma lucidum polysaccharide [J]. Food Sci, 2009, 30(17): 316–318. doi:10.3321/j.issn:1002-6630.2009.17.074 |
| [14] |
王连珠, 杨明智, 王瑞龙, 等. 气相色谱-质谱法测定生姜中丙炔氟草胺残留量[J]. 食品科学, 2006, 27(10): 461–463.
WANG L Z, YANG M Z, WANG R L, et al. Determination of flumioxazin residue in ginger by GC-MS[J]. Food Sci, 2006, 27(10): 461–463. doi:10.3321/j.issn:1002-6630.2006.10.115 |
| [15] |
林黎, 叶刚, 谢丽琪, 等. 气相色谱-质谱法检测食品中残留的丙炔氟草胺[J]. 色谱, 2008, 26(3): 318–321.
LIN L, YE G, XIE L Q, et al. Determination of flumioxazin residue in foods using gas chromatography-mass spectrometry[J]. Chin J Chromatogr, 2008, 26(3): 318–321. |
| [16] |
卢声宇, 徐敦明, 余孔捷, 等. 气相色谱/气质联用分析5种农产品中的苯醚甲环唑和丙炔氟草胺残留[J]. 农业环境科学学报, 2007, 26(5): 1827–1831.
LU S Y, XU D M, YU K J, et al. Determination of difenoconazole and flumioxazin in 5 agricultural products by gas chromatography (GC) with ECD and MS[J]. J Agro-Environ Sci, 2007, 26(5): 1827–1831. |
| [17] | SONDHIA S, DIXIT A. Persistence of flumioxazin residues in soybean (Glycine max) crop and soil [J]. Indian J Agric Sci, 2008, 78(8): 716–718. |
| [18] | KWON J W, ARMBRUST K L, GREY T L. Hydrolysis and photolysis of flumioxazin in aqueous buffer solutions[J]. Pest Manage Sci, 2004, 60(9): 939–943. doi:10.1002/(ISSN)1526-4998 |
| [19] | KAUR P, KAUR K, BHULLAR M S. Quantification of penoxsulam in soil and rice samples by matrix solid phase extraction and liquid-liquid extraction followed by HPLC-UV method[J]. Environ Monit Assess, 2014, 186(11): 7555–7563. doi:10.1007/s10661-014-3947-7 |
| [20] | LU L J, YANG L L, Cai H J, et al. Determination of flumioxazin residue in food samples through a sensitive fluorescent sensor based on click chemistry[J]. Food Chem, 2014, 162: 242–246. doi:10.1016/j.foodchem.2014.04.061 |
| [21] | RADIŠIĆ M, GRUJIĆ S, VASILJEVIĆ T, et al. Determination of selected pesticides in fruit juices by matrix solid-phase dispersion and liquid chromatography-tandem mass spectrometry[J]. Food Chem, 2009, 113(2): 712–719. doi:10.1016/j.foodchem.2008.07.103 |
| [22] | ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce[J]. J AOAC Int, 2003, 86(2): 412–431. |
| [23] |
农药残留试验准则: NY/T 788—2004[S]. 北京: 中国农业出版社, 2004.
Guideline on pesticide residue trials: NY/T 788—2004[S]. Beijing: China Agricultural Publishing House, 2004. |
| [24] | PECORELLI I, BIBI R, FIORONI L, et al. Validation of a confirmatory method for the determination of sulphonamides in muscle according to the European Union regulation 2002/657/EC[J]. J Chromatogr A, 2004, 1032(1-2): 23–29. doi:10.1016/j.chroma.2003.11.010 |
| [25] | XU R, WU J W, LIU Y G, et al. Analysis of pesticide residues using the quick easy cheap effective rugged and safe (QuEChERS) pesticide multiresidue method in traditional Chinese medicine by gas chromatography with electron capture detection[J]. Chemosphere, 2011, 84(7): 908–912. doi:10.1016/j.chemosphere.2011.06.013 |
| [26] | NGUYEN T D, LEE B S, LEE B R, et al. A multiresidue method for the determination of 109 pesticides in rice using the quick easy cheap effective rugged and safe (QuEChERS) sample preparation method and gas chromatography/mass spectrometry with temperature control and vacuum concentration[J]. Rapid Commun Mass Spectrom, 2007, 21(18): 3115–3122. doi:10.1002/(ISSN)1097-0231 |
| [27] | SCHRECK E, GERET F, GONTIER L, et al. Development and validation of a rapid multiresidue method for pesticide determination using gas chromatography–mass spectrometry: a realistic case in vineyard soils[J]. Talanta, 2008, 77(1): 298–303. doi:10.1016/j.talanta.2008.06.026 |
| [28] | FERNANDES V C, LEHOTAY S J, GEIS-ASTEGGIANTE L, et al. Analysis of pesticide residues in strawberries and soils by GC-MS/MS, LC-MS/MS and two-dimensional GC-time-of-flight MS comparing organic and integrated pest management farming[J]. Food Addit Contam, 2014, 31(2): 262–270. doi:10.1080/19440049.2013.865842 |
| [29] | LI M M, LIU X G, DONG F S, et al. Simultaneous determination of cyflumetofen and its main metabolite residues in samples of plant and animal origin using multi-walled carbon nanotubes in dispersive solid-phase extraction and ultrahigh performance liquid chromatography–tandem mass spectrometry[J]. J Chromatogr A, 2013, 1300: 95–103. doi:10.1016/j.chroma.2013.05.052 |
| [30] |
化学农药环境安全评价试验准则第1部分: 土壤降解试验: GB/T31270.1—2014[S]. 北京: 中国标准出版社, 2015.
Test guidelines on environmental safety assessment for chemical pesticides—part 1: transformation in soils: GB/T 31270.1—2014[S]. Beijing: Standards Press of China, 2015. |
 2018, Vol. 20
2018, Vol. 20


